È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di cellule deciduali umane primarie dalle membrane fetali del termine intempestivo della placenta
In questo articolo
Riepilogo
Questo protocollo viene illustrato un metodo per l'isolamento di cellule deciduali umane primarie raccolti da membrane fetali di placente di termine che possono essere utilizzate per una varietà di applicazioni (cioè immunocitochimica, citometria a flusso, ecc.) con l'obiettivo per studiare il ruolo delle diverse popolazioni cellulari in complicazioni di gravidanza.
Abstract
La decidua, noto anche come l'endometrio incinta, è un tessuto riproduttivo criticamente importante. Le cellule deciduali, costituite principalmente da proteina cellule stromali e le cellule immuni, sono responsabili della secrezione di fattori ormonali e infiammatorie che sono critici per l'impianto di blastocisti successo, sviluppo placenta e svolgere un ruolo inizio del lavoro a termine e pretermine. Molte complicazioni di gravidanza possono derivare da perturbazioni di un delicato equilibrio di diverse popolazioni cellulari che comprende decidua. Alterazioni nella proporzione di tipi specifici delle cellule deciduali possono interferire con questi processi cruciali e aumentare il rischio di sviluppare gravi complicazioni della gravidanza, come il mancato impianto dell'embrione, restrizione della crescita intrauterina, preeclampsia e travaglio pretermine. Il protocollo descritto qui di seguito viene illustrato un costo e tempo metodo efficace per l'isolamento di cellule deciduali umane primarie raccolti da membrane fetali di placente a termine. Combinando la digestione enzimatica e delicata rottura meccanica del tessuto deciduale, un'alta resa delle cellule deciduali è stata ottenuta con virtualmente nessuna contaminazione del corion. Cosa importante, sono state caratterizzate cellule deciduali isolate (cellule stromali (55-60%), leucociti (35%), epiteliale (% 1) o cellule del trofoblasto (0,01%)) e mantenuto alta attuabilità (80%) che è stata confermata dall'analisi di citometria a flusso imaging multicolor. Questo protocollo è specifico per il parietalis decidua e può essere adattato alle placente di primo e secondo trimestre. Una volta isolato, cellule deciduali possono essere utilizzate per una moltitudine di applicazioni sperimentali con l'obiettivo di comprendere il ruolo delle sottopopolazioni differenti delle cellule deciduali a complicazioni durante la gravidanza.
Introduzione
L'endometrio, uno dei più attivi tessuti femminili adulti, subisce drammatica che ritocca ogni ciclo mestruale in risposta alla stimolazione di ormoni ovarici, estrogeni (E2) e progesterone (P4). La decidua, noto anche come l'endometrio incinta, è un tessuto riproduttivo criticamente importante che si è formato alla fine della fase di postovulatory a seguito di P4-driven differenziazione seguendo la fase proliferativa di E2-dominante. Le cellule deciduali sono responsabili della secrezione di fattori ormonali per l'impianto della blastocisti successo e sviluppo dell'interfaccia utero-placentare per il mantenimento della tolleranza materno fetale documento non autografo.
Decidualizzazione è necessaria per l'impianto e conseguente rimodellamento delle arterie a spirale deciduale. Cellule stromali dell'endometrio subiscono decidualizzazione, sotto il controllo di P4 e cAMP, durante la fine della fase luteinica del ciclo mestruale1. Questo processo è iniziato intorno ai vasi sanguigni e si sparge durante lo stroma, suggerendo il suo ruolo nel rimodellamento vascolare e del leucocita traffico regolamento. Questa trasformazione cellulare è caratterizzata da una morfologia circolare, aumento delle dimensioni nucleare e l'espansione del reticolo endoplasmico e apparecchiatura di Golgi2. Proteina di cellule stromali sono in grado di produrre fattori paracrini che sostengono l'impianto della blastocisti e caratterizzato dalla secrezione di numerosi ormoni (cioè prolattina), fattori di crescita angiogenici, fattore di crescita insulinico binding protein-1 (IGFBP-1), della prostaglandina (pagina) E (stimolatore di cAMP intracellulare), citochine, componenti della matrice extracellulare e nutrienti essenziali per placentare l'impianto e sviluppo3,4,5,6 .
La popolazione delle cellule deciduali non è esclusivamente composto da cellule stromali proteina ma contiene anche popolazioni leucocitarie deciduali grande, gravidanza-specifiche. Decidualizzazione comporta edema localizzato transitorio e afflusso di cellule Natural killer (NK), cellule T, cellule dendritiche e macrofagi. La più grande sottopopolazione del leucocita è le cellule NK uterine, composto da circa 50-70% di tutti i leucociti materni infiltrante la decidua che sono una fonte di citochine e fattori angiogenici che possono aiutare nel processo di decidualizzazione e aumentare in numero tutta la gravidanza7. Macrofagi, essendo la seconda più grande sottopopolazione di cellule immunitarie, si trovano intorno al sito di impianto e aumentano durante la gravidanza8. Essi sono una fonte di citochine e fattori di crescita quali il fattore (CSF-1)9, fattore di necrosi tumorale α (TNFα)10 e della prostaglandina di stimolazione della Colonia (PG) E11.
Durante la gravidanza e prima del lavoro di termine, la decidua è una fonte importante di citochine e chemochine responsabile per l'attivazione del leucocita periferico materno e successiva migrazione nei tessuti uterini per avviare il lavoro. Gli studi sugli animali hanno mostrato che numerose citochine pro-infiammatorie sono up-regolate nella decidua del mouse durante il travaglio, come TNF-a, IL-6, IL-12 e IL-1b12. Nella decidua umana, citochine pro-infiammatorie IL-1b, IL-6 e IL-8 (principali chemoattractant del neutrofilo) mostrano maggiore espressione durante il travaglio rispetto ai non del lavoro13. Questi secreti citochine risultato in un'attivazione e l'afflusso dei leucociti nei tessuti deciduali14; un aumento dei macrofagi deciduali e infiltrazione di neutrofili in entrambi l'essere umano e del ratto è visto durante il travaglio a termine, con infiltrazione deciduale precede myometrial 4 volte maggiore, che indica una cascata di attivazione tra questa due-adiacente tessuti uterini 15. questi leucociti infiltranti producono in grado di attivare le contrazioni sincrone del myometrium16di PGs, metalloproteinasi della matrice (MMPs) per avviare la membrana rompersi17,18, così come citochine pro-infiammatorie per amplificare il processo di attivazione uterina ('tempesta di citochina').
A causa di molte funzioni importanti delle cellule deciduali, come giocare un ruolo critico nel mantenere la tolleranza materno-fetale nella gestazione iniziale e coinvolte nell'attivazione del lavoro a termine, il processo di impianto diverse patologie possono verificarsi durante gravidanza. Per esempio, (1) infertilità a causa di mancato impianto ricorrenti e perdita ricorrente di gravidanza possono essere causati da un guasto di decidual maturazione; (2) restrizione della crescita intrauterina (IUGR) e preeclampsia a causa di sviluppo improprio e disfunzione del decidua/placenta o trasformazione compromesso vascolare allo svincolo deciduali myometrial; così come la nascita pretermine (3) che può derivare da attivazione prematura deciduale.
Alla luce di questi disordini importanti, accoppiati con i limiti etici e pratici degli umani in vivo studi, stabilire linee di cellule deciduali umano primario è essenziale per l'analisi in vitro con lo scopo di comprendere meglio e migliorare la gestione clinica delle complicanze della gravidanza. Pertanto, l'obiettivo della nostra ricerca era di sviluppare un protocollo che permette l'isolamento di cellule deciduali primarie umane con cella ad alta resa e attuabilità raccolti da membrane fetali di placente a termine. Questo protocollo attuale chiaramente descrive un metodo di tempo e costi efficaci per isolamento di specifici sottotipi di decidual cellule che essere utilizzato per una varietà di analisi in vitro . Caratterizzazione dell'abbondanza e fenotipo di decidual sub-popolazioni a termine e confronto al primo o al secondo acetonide è cruciale per la definizione dei loro ruoli durante la gestazione umana.
Protocollo
Placente sono raccolti dal termine sano, non in donne di manodopera in fase di sezioni cesarean elettive. La raccolta, elaborazione e USA e getta di campioni umani rispettano le direttive del Consiglio di Mount Sinai Hospital etica. Un consenso scritto è ottenuto da ogni paziente. Questo studio è approvato dal comitato etico di ricerca presso il Mount Sinai Hospital.
1. preparati
Nota: Tutti i passaggi devono essere condotti sotto una cappa aspirante e tutte le attrezzature chirurgiche devono essere sterilizzate tramite autoclave prima del posizionamento della cappa fumi. Tutti gli altri materiali (bottiglie, provette da 50 mL, ecc.) devono essere sterilizzati con soluzione di etanolo 70%. Sempre indossare dispositivi di protezione individuale in qualsiasi momento quando si lavora con i rifiuti a rischio biologico (camice, guanti, capelli lunghi legati dietro, ecc.).
-
Soluzione di digestione enzimatica (soluzione finale: 200 mL)
- Pipettare 180 mL di HBSS-/ - in un becher da 500 mL, aggiungere magnete agitazione sterile e posizionare sulla piastra di agitazione a temperatura ambiente.
- Pesare e aggiungere quanto segue alla HBSS-/-soluzione lentamente e in modo sequenziale: 20 mL di FBS, 400 mg 2 collagenasi ([finale] = 2 mg/mL), 20 mg inibitore della tripsina fagiolo di soia ([finale] = 0,1 mg/mL), 30 mg 1 dnasi ([finale] = 0,15 mg/mL) e 200 mg di BSA ([finale] = 1 mg/mL)
- Impostare l'agitazione a velocità media e lasciare che la miscela sotto agitazione per 10-20 min (copertina con tin film lamina o paraffina mescolando).
- Versare la soluzione mista in un flacone di vetro 250 mL utilizzando un imbuto di plastica e mettere nella cappa.
- Filtrare la soluzione attraverso un'unità di filtrazione superiore in plastica (0.22 μm membrana filtrante, 500 mL), aliquota da 20 mL in provette da 50 mL (10 tubi totale) e conservare a-20 ° C fino all'utilizzo.
-
Media di RPMI 1640 (2% soluzione e 10% medio di crescita completa di lavaggio)
- Combinare RPMI 1640 e FBS in una bottiglia di vetro nella cappa fumi.
- Per la soluzione di 2% FBS, combinare 490 mL di RPMI 1640 e mL 10 FBS.
- Per soluzione al 10% FBS, combinare 450 mL RPMI 1640 e mL 50 FBS.
- Pipettare 500 μL di normocin nella bottiglia di vetro 500 mL dal passaggio precedente contenente RPMI media e FBS (50mg/mL stock, 0,05 mg/mL concentrazione di lavoro).
- Passare i contenuti multimediali attraverso un 0,22 μm membrana filtrante e conservare in una bottiglia di vetro da 500 mL a 4 ° C fino all'utilizzo.
- 30 min prima di iniziare l'esperimento, inserire un'aliquota di 20 mL di congelati soluzione di digestione enzimatica in un bagno di perlina di 37 ° C, inserire il 2% FBS e 10% FBS RPMI 1640 media in un bagno di perlina di 37 ° C, accendere il bagno d'acqua a dondolo e impostare a 37 ° C , 2 g e insieme una centrifuga a temperatura controllata a 4 ° C.
2. raccolta di tessuto deciduale dalle membrane placentari termine
- Posizionare le bottiglie con HBSS + / +, HBSS-/- e cinque provette da 50 mL in un rack sotto la cappa. Pipettare 25 mL di HBSS + + in una provetta.
-
Con le mani guantate, prendere la placenta di termine dal contenitore usato per il trasporto dal teatro sala operatoria. Collocare la placenta sul tappetino di pannolino (lato materno verso l'alto) e si sono diffuse le membrane fetali utilizzando forbici e pinze.
- Laici pannolone sovrapposti sulla cappa.
- Utilizzare un pannolino separato per capovolgere la placenta così il lato materno sia rivolto verso.
- Trovare il punto di rottura della membrana e fare delle incisioni per consentire la membrana spiegare e disteso sulla superficie fumehood.
Nota: Una volta che la membrana è tirata indietro dalla placenta, la decidua sarà rivolto verso l'alto che riposa sullo strato corion, con lo strato di amnion sul retro.
- Accuratamente con una spatola di plastica cellulare, raschiare il tessuto deciduale il corion e posto nel tubo 50 mL contenente 25 mL HBSS + / +.
- Raschiare la membrana con una pressione moderata. Non applicare troppa pressione come può provocare contaminazione corion. Raccogliere piccoli coaguli di sangue e, in quanto questi contengono alcune cellule deciduali.
Attenzione: Dopo la raccolta deciduale, placenta deve essere confezionato in un contenitore di plastica di biohazard e congelato in un congelatore a-20 ° C prima dello smaltimento appropriato (secondo le regole istituzionali). Sanguinosa pannolone devono essere avvolto in un sacchetto di plastica a tenuta guarnizione e smaltiti in una cassetta di sicurezza biohazard.
3. lavaggio ed enzimatica digestione del tessuto deciduale
- Lavare i tessuti raccolti delicatamente agitando a mano il tubo da 50 mL e facendolo passare attraverso un setaccio metallico (250 μm, taglia 60 maglia) di 250 μm che riposa sopra un recipiente sterile dei campioni (urina).
- Ripetere il lavaggio due volte con HBSS + / + e due volte con HBSS-/ - in tubi di freschi per ogni lavaggio. (finale lavate con HBSS-/-permette la rimozione di calcio e magnesio presente in HBSS + / +, altrimenti che interferirebbe con il seguente processo di digestione enzimatica).
NOTA. Durante le fasi di lavaggio, contaminazione del tessuto corion sarà evidente come il tessuto deciduale è rosa chiaro in colore e amorfo, mentre il corion è bianco, denso e filante. Di conseguenza, contaminazione del corion può essere rimosso facilmente con una pinza. - Facoltativamente, se il tessuto deciduale è spesso, trasferirlo in una capsula di Petri sterile 10 cm diametro e procedere per tritare del tessuto con due bisturi opposte nel piatto.
-
Posizionare il tessuto lavato in tubo sterile da 50 mL contiene 100 mg di tessuto/mL di soluzione di digestione enzimatica (vedi preparazione).
- Come punto di riferimento, accertarsi che il livello del tessuto deciduale raggiunge il 5-10 mL sul tubo 50 mL.
- Utilizzare circa 20 mL di soluzione di digestione enzimatica (preparato nel passaggio 1.1) per digerire il totale decidua raccolto da una membrana fetale di tutta la durata.
- Sigillare il tappo della provetta con il film di paraffina (sigilla ermeticamente il tubo e avvolgere la pellicola di paraffina intorno il tappo e la parte superiore del tubo) sotto la cultura del cappuccio e incubare tessuto deciduale a 37 ° C per 20 min in un bagnomaria con agitazione (145 giri/min 2 g).
- Dopo l'incubazione, rimuovere la pellicola di paraffina e sterilizzare la superficie del tubo che contiene il tessuto digerito con etanolo al 70% e portare sotto la cappa. Agitare il tubo brevemente a mano.
- Raccogliere la sospensione cellulare attraverso il setaccio di metallo (250 μm, taglia 60 mesh) in un nuovo contenitore sterile esemplare. Diluire con un volume uguale (20 mL) di RPMI + 10% FBS contenente 0,1% normocin per fermare la reazione enzimatica. Procedere direttamente al passo di centrifugazione 4.1.
- Se necessario, inserire nuovamente il tessuto restante non digerito un nuovo tubo da 50 mL con 20 mL di soluzione fresca digestione enzimatica e ripetere la digestione (20 min, 37 ° C, agitando il bagnomaria).
- Se una seconda digestione è necessaria, porre la provetta prima con sospensione cellulare su ghiaccio (copertura con film di paraffina per mantenere sterile). Ripetere i passaggi da 3.5-3.6 e combinare le sospensioni di due celle.
4. generazione di una sospensione singola cella
- Centrifugare la sospensione cellulare (420 g, 4 ° C, min 11).
- Rimuovere il supernatante e risospendere le cellule in 40 mL di RPMI + 2% FBS contenente 0,1% normocin ("tampone di lavaggio").
Nota: Pellet cellulare sarà sciolto e gelatinosa a causa della contaminazione del globulo rosso, aspirare il surnatante con cautela. Rimozione della fase superiore con una pipetta manuale può essere richiesto. - Ripetere la centrifugazione a 420 g a 4 ° C per 11 min.
- Con attenzione rimuovere il surnatante (come indicato nella nota passo 4.2) e risospendere il pellet cellulare in 5 mL di tampone di lavaggio e aggiungere 35 mL di tampone di lisi degli eritrociti nello stesso tubo.
Nota: Se il pellet è grande o molto sanguinosa, e può essere diviso in due tubi per il passaggio di lisi degli eritrociti dagli aggiungere 10 mL di tampone di lavaggio e dividere equamente in due tubi e quindi 35 mL di tampone di lisi degli eritrociti in ogni provetta. - Incubare in ghiaccio per 20 min. brevemente il vortice provette all'inizio e alla fine dell'incubazione a lisare cellule rosse del sangue.
- Centrifugare a 420 g per 11 minuti a 4 ° C.
- Con attenzione, rimuovere il supernatante e risospendere il pellet in 40 mL di tampone di lavaggio.
- Passare le cellule attraverso un filtro di nylon 70 μm per rimuovere gruppi di cellule.
- Centrifugare a 420 g per 11 min a 4 ° C.
- Rimuovere il supernatante e risospendere il pellet cellulare in 10 mL di terreno completo (RPMI 10% + FBS contenente 0,1% normocin).
-
Contare le celle utilizzando la procedura dell'emocitometro trypan blu colorante-esclusione come descritto di seguito:
- Sotto il cofano di cultura Pipettare delicatamente sospensione cellulare su e giù 3 x al fine di mescolare bene prima di combinare con trypan blu. In un 1,5 mL tubo preparare la sospensione cellulare, diluito 1:2 (combine 20 μL di soluzione di blu di trypan) e 20 μL della sospensione delle cellule deciduali. Mescolare accuratamente la soluzione di trypan blu-cella pipettando su e giù per un paio di volte (questa soluzione non è sterile).
- Posto l'emocitometro sul palco del microscopio con il vetrino coprioggetti di vetro sulla parte superiore.
Nota: Emocitometro è un vetrino da microscopio con griglie su di esso per dare nove grandi piazze divise da linee triple. Ogni grande piazza ha una superficie di 1 mm2, e la profondità del liquido nella camera di 0,1 mm. Di conseguenza, il volume di liquido che può riempire ogni grande piazza è 1 * 1 mm * 0,1 mm = 0,1 mm3= 10-4 mL. - Lentamente aggiungere 10 μL di miscela trypan blu-cellula nella scanalatura di un emocitometro, permettendo un'azione capillare disperdere la miscela delle cellule sopra l'intera diapositiva (fermata prima miscela riempie bene).
- Mostra le cellule al microscopio (a 10 ingrandimenti) e contare tutte le celle di bianco/verde che escludono trypan blu (queste sono le cellule vitali) nelle quattro grandi piazze esterne dell'emocitometro. Quando si contano le celle che toccano la linea, contano solo quelli che toccano il diritto e linee superiori ma non quelli toccando la sinistra e le linee di fondo. Non contare le celle blue scure; colore blu indica che la cella è morta come colorante trypan blu può penetrare facilmente attraverso la membrana plasmatica nel citoplasma.
- Per calcolare il numero di cellule vitali in 1 mL di sospensione cellulare (X):
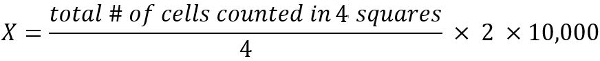
2 = fattore di diluizione
10.000 = fattore di conversione (1 mL = 1 cm3 = 10, 000 * 0.1 mm3)
- Diluire le cellule deciduali a una concentrazione finale desiderabile in RPMI + 10% FBS (crescita medio).
Nota: Per la placcatura di coltura del tessuto, pipettare 2 * 106 cellule/pozzetto in una piastra a 6 pozzetti plastica, 10 * 106 cellule in una piastra di plastica di 10 cm o 75.000 cellule per vetrino coprioggetti.
Risultati
Per convalidare l'efficienza e la vitalità delle cellule isolate, sono stati caratterizzati da due metodi: citometria a flusso e immunocitochimica (ICC). 4 popolazioni di cellule sono state mirate; cellule stromali proteina sono stati rilevati dall'anticorpo anti-vimentin, pan-leucocita marcatore CD45 era utilizzato per identificare le cellule immunitarie deciduali, cytokeratin è stato usato per rilevare le cellule epiteliali/endoteliale e infine, citocheratina 7 è stato utilizzato per...
Discussione
Il protocollo descritto qui di seguito viene illustrato un costo e tempo efficace metodo per l'isolamento primarie cellule deciduali raccolti dalle membrane fetali della placenta umana intera legislatura che è altamente accessibile e semplice. Il successo di questo protocollo dipende da due fattori critici, (1) l'efficacia di raschiatura deciduali dallo strato corion delle membrane fetali e (2) la cura con cui vengono gestite le cellule deciduali in tutto il protocollo. È importante che la contaminazione del tessuto co...
Divulgazioni
Gli autori non hanno nulla a rivelare
Riconoscimenti
Gli autori vorrei ringraziare i donatori, la Biobanca di RCWIH e il Mount Sinai Hospital/UHN dipartimento di ostetricia e ginecologia per gli esemplari umani utilizzati in questo studio. Vorremmo ringraziare i membri del laboratorio liscivia, particolarmente il Dr. Caroline Dunk per il suo aiuto con lo sviluppo del metodo. Questo lavoro è sostenuto dal fondo benvenuto Burroughs (grant #1013759).
Materiali
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salt solution with calcium and magnesium | Prepared in facility (LTRI) | ||
| Hank’s balanced salt solution without calcium and magnesium | Prepared in facility (LTRI) | ||
| Diaper pads | Sigma-Aldrich | D9542 | |
| Large surgical scissors | AL Medical | 2018-12-20. | |
| Large surgical forceps | Fine Science Tools | 11000-18 | |
| Plastic disposable cell scraper (25 cm) | Sarstedt | 83.183 | |
| 250 mm (size 60 mesh) metal sieve | Sigma-Aldrich | S1020-5EA | |
| Disposable scalpel with plastic handle (#21) | Fisher Scientific | 08-927-5D | |
| Sterile plastic petri dish (diameter 10 cm) | Sarstedt | 82.1473.001 | |
| Sterile specimen container (urine cup, 4.5 oz) | VWR | 25384-146 | |
| Nylon filter (70 mm) | VWR/Corning | 21008-952 | |
| Erythrocyte lysis buffer | Qiagen | 79217 | |
| Trypan blue, 0.4% solution | Lonza | 17-942E | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Hemocytometer | Reichert | 1490 | |
| Roswell Park Memorial Institute (RPMI) 1640 culture media | Invitrogen | 11835-055 | |
| Fetal bovine serum | Wisent | 080-150 | |
| Normocin (50mg/ mL) | Invivogen | ant-nr-1 | |
| Plastic top filtration unit (0.22 mm membrane, 500 mL) | Millipore | SCGPT05RE | |
| Collagenase 2, lyophilized powder | Sigma-Aldrich | C6885 | |
| Soy bean trypsin inhibitor, powder | Sigma-Aldrich | T9003-250mg | |
| DNase powder | Roche | 10104159001 | |
| Bovine serum albumin (BSA powder) | Fisher Scientific | BP1600-100 | |
| Spinning disc confocal microscope - Leica DMI 6000B | Leica | ||
| Imaging Flow cytometer - Image Stream MK2 | Amnis | ||
| IDEA software | Millipore Sigma | ||
| APC-conjugated Vimentin antibody | R&D Systems | IC2105A | |
| APC H7-conjugated CD45 antibody | BD | 641399 | |
| FITC-conjugated Cytokeratin antibody | MACs Miltenyi Biotec | 130-080-101 | |
| PerCP -conjugated Cytokeratin 7 antibody | Novus | NBP2-47941PCP | |
| eFluor450 Fixable Viability dye | Thermo Fisher Scientific | 65-0863-14 | |
| Vimentin primary antibody | Santa Cruz | sc-7558 | |
| CD45 primary antibody | Dako | M0701 | |
| Cytokeratin primary antibody | Dako | M0821 | |
| Cytokeratin 7 primary antibody | Dako | M7018 | |
| Mouse IgG | Santa Cruz | sc-2025 | |
| Goat IgG | Santa Cruz | sc-2028 | |
| Alexa Fluor 546 secondary antibody | Invitrogen | A10036 | |
| Alexa Fluor 594 secondary antibody | Fisher Scientific | A-11058 | |
| DAPI | Sigma-Aldrich | D9542 |
Riferimenti
- Brosens, N., Hayashi, N., White, J. O. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinology. 140, 4809-4820 (1999).
- Bell, S. C., D'Arcangues, C., Frase, I. S., Newton, J. R., Odlind, V. . Decidualization and relevance to menstruation. , 187-212 (1990).
- Kariya, M. Interleukin-1 inhibits in vitro decidualization of human endometrial stromal cells. Journal of Clinical Endocrinology and Metabolism. 73, 1170-1174 (1991).
- Dimitriadis, E., Robb, L., Salamonsen, L. A. Interleukin 11 advances progesterone-induced decidualization of human endometrial stromal cells. Molecular and Human Reproduction. 8, 636-643 (2002).
- Wu, W. -. X., Brooks, J., Glasier, A. F., McNeilly, A. S. The relationship between decidualization and prolactin mRNA and production at different stages of human pregnancy. Society for Endocrinology. 14, 255-261 (1995).
- Bell, S. C. Synthesis and secretion of protein by the endometrium and decidua. Implantation: Biology and Clinical Aspects. , 95-118 (1988).
- Croy, B. A., Chantakru, S., Esadeg, S., Ashkar, A. A., Wei, Q. Decidual natural killer cells: key regulators of placental development. Journal of Reproductive Immunology. 57, 151-168 (2002).
- Smarason, A. K., Gunnarsson, A., Alfredsson, J. H., Valdimarsson, H. Monocytosis and monocytic infiltration of decidua in early pregnancy. Journal of Clinical and Laboratory Immunology. 21, 1-5 (1986).
- Daiter, E., Pampfer, S., Yeung, Y. G., Barad, D., Stanley, E. R., Pollard, J. W. Expression of colony- stimulating factor-1 in the human uterus and placenta. Journal of Clinical Endocrinology and Metabolism. 74, 850-858 (1992).
- Casey, M. L., Cox, S. M., Beutler, B., Milewich, L., MacDonald, P. C. Cachectin/tumor necrosis factor-alpha formation in human decidua. Potential role of cytokines in infection-induced preterm labor. Journal of Clinical Investigation. 83, 430-436 (1989).
- Lala, P. K., Kennedy, T. G., Parhar, R. S. Suppression of lymphocyte alloreactivity by early gestational human decidua. II. Characterization of the suppressor mechanisms. Cellular Immunology. 127, 368-381 (1988).
- Shynlova, O., Nedd-Roderique, T., Li, Y., Dorogin, A., Nguyen, T., Lye, S. J. Infiltration of myeloid cells into decidua is a critical early event in the labour cascade and post-partum uterine remodelling. Journal of Cellular and Molecular Medicine. 17, 311-324 (2013).
- Osman, I., Young, A., Ledingham, M. A., Thomson, A. J., Jordan, F., Greer, I. A., Norman, J. E. Leukocyte density and pro-inflammatory cytokine expression in human fetal membranes, decidua, cervix and myometrium before and during labour at term. Molecular Human Reproduction. 9, 41-45 (2003).
- Farine, T., Lye, S. J., Shynlova, O. Peripheral maternal leukocytes are activated in response to cytokines secreted by uterine tissues of pregnant women. Journal of Cellular and Molecular Immunology. 14, 635-638 (2017).
- Hamilton, S., et al. Macrophages infiltrate the human and rat decidua during term and preterm labor: evidence that decidual inflammation precedes labor. Biology of Reproduction. 86, 39 (2011).
- Casey, M. L., Cox, S. M., Word, A., Macdonald, P. C. Cytokines and infection-induced preterm labour. Reprodution Fertility and Development. 2, 499-510 (1990).
- Yellon, S. M., Mackler, A. M., Kirby, M. A. The role of leukocyte traffic and activation in parturition. Journal of the Society for Gynecologic Investigation. 10, 323-338 (2003).
- Gomez-Lopez, N., StLouis, D., Lehr, M. S., Sanchez-Rodriguez, E. N., Arenas-Hernandez, M. Immune cells in term and preterm labor. Cellular & Molecular Immunology. 11, 571-581 (2014).
- Xu, Y., Plazyo, O., Romero, R., Hassan, S. S., Gomez-Lopez, N. Isolation of leukocytes from the human maternal-fetal interface. Journal of Visualized Experiments. 99, (2015).
- Trundley, T., Gardner, L., Northfield, J., Moffett, A. Methods for isolation of cells from the human fetal-maternal interface. Methods in Molecular Medicine. 122, 109-122 (2006).
- Jividen, K., Movassagh, M. J., Jazaeri, A., Li, H. Two methods for establishing primary human endometrial stromal cells from hysterectomy specimens. Journal of Visualized experiments. 87, (2014).
- Pelekanos, R. A., Sardesai, V. S., Futrega, K., Lott, W. B., Kuhn, M., Doran, M. R. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. Journal of Visualized experiments. 112, (2016).
- De Clercq, K., Hennes, A., Vrien, J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization. Journal of Visualized Experiments. 121, (2017).
- Zhang, J., Shynlova, O., Sabras, S., Bang, A., Briollais, L., Lye, S. J. Immunophenotyping and activation status of maternal and peripheral blood leukocytes during pregnancy and labour, both term and preterm. Journal of Cellular and Molecular Medicine. 10, 2386-2402 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon