Method Article
Detección de inhibidores de la quinasa en microarrays de proteínas humanas autoensamblados
En este artículo
Resumen
Se presenta un protocolo detallado para la generación de microarrays de proteínas humanas autoensamblados para el cribado de inhibidores de la quinasa.
Resumen
El cribado de inhibidores de la quinasa es crucial para una mejor comprensión de las propiedades de un medicamento y para la identificación de objetivos potencialmente nuevos con implicaciones clínicas. Se han reportado varias metodologías para llevar a cabo este tipo de pruebas. Sin embargo, cada uno tiene sus propias limitaciones (por ejemplo, el cribado de sólo análogos de ATP, restricción al uso de dominios de quinasa purificados, costos significativos asociados con las pruebas de más de unas pocas quinasas a la vez, y la falta de flexibilidad en el cribado de quinasas de proteínas con mutaciones novedosas). Aquí, se presenta un nuevo protocolo que supera algunas de estas limitaciones y se puede utilizar para el cribado imparcial de inhibidores de la quinasa. Una fuerza de este método es su capacidad para comparar la actividad de los inhibidores de la quinasa a través de múltiples proteínas, ya sea entre diferentes quinasas o diferentes variantes de la misma quinasa. Se emplean microarrays proteicos autoensamblados generados a través de la expresión de quinasas proteicas por un sistema de transcripción y traducción in vitro basado en humanos (IVTT). Las proteínas que se muestran en el microarray están activas, lo que permite medir los efectos de los inhibidores de la quinasa. El siguiente procedimiento describe los pasos del protocolo en detalle, desde la generación y el cribado de microarrays hasta el análisis de datos.
Introducción
Las quinasas proteicas son responsables de la fosforilación de sus objetivos y pueden modular vías moleculares complejas que controlan muchas funciones celulares (es decir, proliferación celular, diferenciación, muerte celular y supervivencia). La desregulación de la actividad quinasa se asocia con más de 400 enfermedades, lo que convierte a los inhibidores de la quinasa en una de las principales clases de fármacos disponibles para el tratamiento de varias enfermedades, como el cáncer, los trastornos cardiovasculares y neurológicos, así como los trastornos inflamatorios y enfermedades autoinmunes1,2,3.
Con la llegada de la medicina de precisión, la identificación de nuevas terapias, especialmente inhibidores de la quinasa, tienen un gran atractivo farmacéutico y clínico. Se pueden utilizar varios enfoques para la identificación de posibles nuevos pares de inhibidores de la quinasa/quinasa, incluido el diseño de novo de inhibidores de la quinasa y la identificación de nuevos objetivos para los medicamentos aprobados por la FDA existentes. Este último es especialmente atractivo, ya que el tiempo y el dinero necesarios para implementar estos medicamentos en las clínicas se reducen drásticamente debido a la disponibilidad de datos de ensayos clínicos anteriores. Un ejemplo canónico de la reasignación de un inhibidor de la quinasa es imatinib, inicialmente diseñado para el tratamiento de la leucemia mielógena crónica (LMC) a través de la inhibición de BCR-Abl, que también se puede utilizar con éxito para el tratamiento de la sobreexpresión de c-Kit tumores estromales gastrointestinales (GIST)4,5,6,7.
El cribado de inhibidores de la quinasa se puede realizar en ensayos de unión o ensayos basados en enzimáticos. La primera clase de ensayos se centra en las interacciones proteína-drogas y puede proporcionar información como el sitio de ligadura y la afinidad. Dado que se desconoce la actividad de la quinasa en el momento de estos ensayos, una serie de interacciones pueden perderse o identificarse falsamente debido a cambios de conformación en la proteína. Por otro lado, los ensayos a base de enzimáticos requieren que las quinasas proteicas estén activas y proporcionen información valiosa sobre el efecto del inhibidor en la actividad enzimática, sin embargo, este tipo de cribado suele ser más lento y costoso. Actualmente, ambos tipos de ensayos están disponibles comercialmente de varias fuentes. Representan una opción confiable para el cribado de inhibidores de la quinasa con algunas limitaciones, incluyendo: I) la mayoría de los métodos implican pruebas de múltiples quinasas individualmente, lo que puede hacer que el cribado de un gran conjunto de proteínas sea costoso; II) el conjunto de quinasas que se probarán se limita a una lista de quinasas preseleccionadas de tipo salvaje y varias versiones mutadas bien conocidas de algunas quinasas, lo que dificulta la prueba de muchas nuevas isoformas mutadas.
En este contexto, los microarrays proteicos son una potente plataforma capaz de superar algunas de las limitaciones que presentan las técnicas disponibles comercialmente. Es adecuado para realizar ensayos basados en enzimáticos en cribado de alto rendimiento utilizando proteínas activas de longitud completa de cualquier secuencia de interés. Los microarrays pueden ser generados por un enfoque autoensamblado como NAPPA (matriz de proteínas programables de ácido nucleico), en el que las proteínas se expresan justo a tiempo para los ensayos, aumentando la probabilidad de que los que se muestran en la matriz estén activos. Las proteínas que se muestran en NAPPA se producen utilizando ribosomas derivados del ser humano y proteínas de chaperona con el fin de mejorar la probabilidad de plegado natural y actividad.
Las proteínas se programan inicialmente imprimiendo cDNAs codificando para genes de interés fusionados con una etiqueta de captura, junto con un agente de captura, en la superficie del microarray. Las proteínas se producen en los microarrays utilizando un sistema de transcripción y traducción in vitro (IVTT), y las proteínas recién expresadas son inmovilizadas en la superficie del microarray por el agente de captura. Los arrays NAPPA expresados se pueden utilizar para el estudio de las proteínas mostradas en la matriz de una manera imparcial y de alto rendimiento8,9.
Anteriormente, se demostró que las proteínas mostradas en las matrices NAPPA se doblaban correctamente para interactuar con socios conocidos10; Además, su actividad enzimática se explotó por primera vez en 2018, cuando se demostró que las quinasas proteicas se mostraban en el autofosforilato de microarray11. Hasta la fecha, la metodología NAPPA se ha utilizado para muchas aplicaciones distintas, incluyendo el descubrimiento de biomarcadores12,13,14,15,16,17, interacciones proteína-proteína10,18, identificación de sustrato19,y detección de fármacos11. Su flexibilidad es una de las características clave de la plataforma que permite la adaptación a cada aplicación.
Aquí, se presenta un protocolo para el cribado de inhibidores de la tirosina quinasa en matrices NAPPA autoensambladas. La plataforma está optimizada para la visualización de quinasas de proteínas humanas activas y para el análisis de la actividad proteica quinasa, con bajo fondo y alto rango dinámico. Entre las modificaciones implementadas para utilizar NAPPA para el cribado de inhibidores de la quinasa se incluyen: I) cambios en la química de impresión, II) desfosforilación del microarray proteico antes del cribado del inhibidor de la quinasa, y III) optimización de la detección de la detección de la detección de proteínas fosforiladas en la matriz. Este protocolo es el primero de su tipo y proporciona información única sobre el estudio de la quinasa en microarrays NAPPA.
Protocolo
1. Búferes y soluciones comunes que se utilizarán
- Preparar medio de tuberculosis: Caldo estupendo (24 g/L extracto de levadura; 20 g/L de tripato; 4 ml/l glicerol; 0,017 M KH2PO4; y 0,072 M K2HPO4). Las soluciones 0.017 M KH2PO4 y 0.072 M K2HPO4 se pueden comprar como un búfer de fosfato de 10x (0,17 M KH2PO4 y 0,72 M K2HPO4).
- Preparar medio LB: Luria-Bertani (5 g/L extracto de levadura; 10 g/L de triptona; y 10 g/L NaCl). Ajuste el pH a 7,0 con 5 M NaOH.
- Prepara 1x TBS: Solución salina tristamponada (TBS: 50 mM Tris-Cl, pH a 7,5; 150 mM de NaCl).
- Preparar 1x TBST: TBS complementado con 0.1% Tween 20.
2. Preparación del ADN
NOTA: El ADN utilizado para las matrices NAPPA debe ser altamente puro; por lo tanto, no se recomiendan mini-preparaciones comerciales de ADN. Actualmente, se utilizan dos protocolos para la preparación del ADN: en casa mini-preparación de alto rendimiento (descrito aquí) o comercial Midi- o Maxi-prep. El rendimiento medio del protocolo de preparación mini interno es de 1.500 muestras al día por persona.
- Crecimiento bacteriano para mini-preparación interna de alto rendimiento
- Prepare la placa LB/Agar omni. Vierta 30–40 ml de agar LB (1,5 % agar bacteriológico en medios LB complementados con antibióticos para la selección de clones positivos) en cada placa de pozo individual.
- Material de glicerol puntual en la placa LB/agar. Diluir el material de glicerol en medios DE LB (1:300, por lo general 2 l en 600 l de LB). Agitar durante 10 minutos. Incubar a 37oC, boca abajo, durante la noche.
- Inocular culturas. Usando el dispositivo de 96 pines que fue esterilizado en 80% etanol y llama, inocular el cultivo de la placa de agar en un bloque de pozo profundo con 1,5 ml por pozo de medio de tuberculosis complementado con antibióticos.
- Cultivos incubados. Cubra el bloque con un sello permeable al gas e incubar durante 22–24 h a 37 oC, 300–800 rpm dependiendo del agitador.
NOTA: Los agitadores ajustados a 800 rpm son óptimos para esta incubación. El uso de un agitador de velocidad más lento puede resultar en cultivos menos densos y menores rendimientos de purificación de ADN. - Cultivos de pellets. Bloques de giro a 3.800 x g y 4 oC durante 30 min. Deseche el sobrenadante.
- Mini-preparación interna de alto rendimiento
NOTA: Los pipetadores multicanal o los dispensadores automáticos se pueden utilizar para realizar la minipreparación interna de alto rendimiento. Si utiliza un dispensador automático, asegúrese de limpiar el sistema antes de usar y entre soluciones.- Prepare todas las soluciones utilizadas durante la minipreparación:
- Solución de preparación 1: Tampón de resuspensión TE (50 mM Tris, pH a 8,0; EDTA de 10 mM, pH a 8,0; 0,1 mg/ml de ARNI). Conservar a 4oC.
- Preparar la solución 2: buffer de lisis NaOH/SDS (0,2 M NaOH; 1% SDS). Para obtener mejores resultados, se debe utilizar una solución recién hecha.
- Preparar la solución 3: búfer de neutralización KOAC (2,8 M KOAc). Ajuste el pH de la solución a 5.1 con ácido acético glacial. Conservar a 4oC.
- Preparar la solución N2: búfer de equilibrio (100 mM Tris; 900 mM KCl; 15% EtOH; 0.15% Triton X-100). Ajuste el pH de la solución a 6.3 con ácido fosfórico.
- Preparar la solución N3: búfer bash (100 mM Tris; 1.15 M KCl; 15% EtOH). Ajuste el pH de la solución a 6.3 con ácido fosfórico.
- Preparar la solución N5: búfer de elución (100 mM Tris; 1 M KCl; 15% EtOH). Ajuste el pH de la solución a 8,5 con ácido fosfórico.
NOTA: El control exitoso de la unión al ADN, el lavado y la elución durante el intercambio de aniones depende en gran medida de la concentración de KCl tampón y de los valores de pH. Las mediciones cuidadosas de los componentes del tampón y el ajuste del pH son esenciales. Las pequeñas desviaciones de las mediciones descritas pueden dar lugar a una pérdida significativa de los rendimientos.
- Vuelva a suspender el perdigón. Añadir 200 l de solución 1 y agitar a 2.000 rpm durante 5 minutos a RT. La resuspensión completa del pellet es necesaria para una lisis exitosa. Vortex el bloque si es necesario.
- Bacterias Lyse. Añadir 200 s de solución 2, sellar la placa con un sello de aluminio e invertir 5x. Tiempo cuidadosamente este paso desde el principio de la adición de la solución 2. No exceda los 5 min.
- Neutralizar la solución. Añadir 200 s de solución 3, sellar la placa con un sello de aluminio e invertir 5x. El sello puede estar suelto debido a los búferes de lisis/neutralización, así que tenga cuidado al invertir. Se recomienda una inversión parcial, en la que la solución nunca toca el sello, para evitar la contaminación cruzada entre las muestras.
- Lisado claro. Centrifugar las placas a 3.800 x g y 4oC durante 30 min.
- Preparar lodos de resina de intercambio de aniones durante el paso de centrifugación de peletización de lisado. Con una botella de 1 L, llénela con la resina de intercambio de aniones hasta que alcance la marca de 300 ml y, a continuación, añada la solución N2 hasta 900 ml.
ADVERTENCIA: Este paso debe realizarse en la campana para proteger contra la inhalación de sílice. - Preparar placas de resina de intercambio de aniones. Apilar las placas de filtro en la parte superior de un bloque de pozo profundo para actuar como un recipiente de recogida de residuos. Mezclar la suspensión de intercambio de aniones hasta que sea homogéneo, luego verter en una vaguada de vidrio. Usando puntas P1000 de gran aburra, transfiera 450 sL de la suspensión a cada pocil de las placas de filtro.
- Placas apiladas de centrífuga (placa de resina/placa de pozo profundo) a aceleración lenta durante 5 min a 130 x g y RT. Deseche el flujo a través.
- Transfiera el sobrenadante de lysato a la placa de resina/pilas de bloques de pozoprofundo profundo. Gire las placas apiladas durante 5 minutos a 30 x g con velocidad de rampa lenta.
- Lave la columna. Añadir 400 l de solución N3 (tampón de lavado) a cada poca. Transfiera la placa de resina al colector de vacío para eliminar el tampón de lavado. Repita los pasos de lavado 3x. En el último lavado, asegúrese de que todos los pozos estén correctamente vaciados. Gire las placas de pila a 150 x g durante 5 min para eliminar cualquier búfer residual.
- Elute ELADN. Coloque la placa de resina en una placa de recogida limpia de 800 ml. Añadir 300 s l de solución N5 a cada poca. Deje que se sente en RT durante 10 minutos, luego gire las placas apiladas durante 5 minutos a 20 x g con velocidad de rampa lenta. Gire las placas apiladas durante 1 min a 233 x g.
- Cuantifique el ADN y almacene las placas a -20 oC hasta su uso posterior o proceda directamente a la precipitación del ADN.
NOTA: Se hace necesario un mínimo de 30 g de ADN por muestra. Si el rendimiento del ADN es bajo, se recomienda repetir la minipreparación del ADN, o alternativamente combinar dos placas durante el paso de precipitación (sección 2.3).
- Prepare todas las soluciones utilizadas durante la minipreparación:
- Precipitaciones de ADN
- Descongelar las placas, el vórtice para homogeneizar la solución de ADN y girar a 230 x g durante 30 s para recoger toda la solución en la parte inferior del pozo.
- Añadir 40 sl de NaOAc de 3 M y 240 l de isopropanol a cada poca. Cubra la placa con un sello de aluminio y mezcle invirtiendo 3x.
- Centrifugar las placas a 30 min a 3.800 x g y 25oC. Deseche cuidadosamente el sobrenadante.
NOTA: Para combinar dos placas, transfiera el ADN de la segunda placa al pellet desde la primera placa y repita los pasos 2.3.2–2.3.3. - Lavar y precipitar el ADN. Añadir 400 l de 80% de etanol a cada poca. Sellar las placas con sello de aluminio y agitar a 1.000 rpm durante 30 min. Centrifugar a 3.800 x g durante 30 min a 25oC. Descarta el sobrenadante.
- Seque los pellets de ADN. Coloque las placas boca abajo en un ángulo sobre las toallas de papel y déjelas secar durante 1-2 h, hasta que no haya alcohol en la parte inferior del pozo. Sellar y centrifugar a 230 x g durante 2 min para bajar los pellets.
- Una vez que las placas estén secas, selle con sello de aluminio y congele a -20 oC para su uso posterior o continúe resuspendiendo el ADN (paso 4.1).
3. Recubrimiento de diapositivas Aminosilane
- Coloque los portaobjetos de vidrio en un bastidor de metal. Inspeccione visualmente cada diapositiva para asegurarse de que no haya arañazos ni imperfecciones.
- Sumerja las guías en solución de recubrimiento (2% reactivo aminosilano en acetona) durante 15 minutos mientras se balancea. La solución aminosilane se puede utilizar para recubrir dos bastidores de 30 portaobjetos cada uno antes de que necesite ser desechado.
- Enjuague el paso. Sumerja el portaobjetos en el lavado de acetona (99% acetona), agite hacia adelante y hacia atrás, luego hacia arriba y hacia abajo rápidamente 5 veces. Incline a una esquina para gotear, luego sumergirse en agua Ultrapure hacia arriba y hacia abajo rápidamente 5x. Inclina para gotear, luego coloca en servilletas.
NOTA: El lavado de acetona se puede utilizar dos veces, mientras que el agua ultrapura debe cambiarse cada vez. - Seque los portaobjetos con aire a presión, soplando sobre ellos desde todos los ángulos durante aproximadamente 3 minutos hasta que se hayan eliminado todas las gotas de agua. Guarde los portaobjetos recubiertos en RT en un estante de metal dentro de una caja herméticamente sellada.
4. Preparación de la muestra de matriz
- Resuspenda el pellet de ADN de la minipreparación interna (paso 2.3.6) en 20 l de agua ultrapura y agite a 1.000 rpm durante 2 horas. Para el ADN de preparación midi/max, diluir cada muestra a una concentración final de 1,5 g/L y transferir 20 ml a una placa de recogida de 800 ol.
- Prepare la mezcla de impresión. Para una placa de 96 pocillos, prepare 1 ml de mezcla de impresión [237,5 l de agua ultrapura; 500 ml de polilisina (0,01%); 187,5 l de BS3 (bis-sulfosuccininiminyl, 50 mg/ml en DMSO); y 75 ml de anticuerpo policlonal anti-bandera de conejo)].
NOTA: Los productos químicos deben añadirse en el orden especificado para evitar precipitaciones. - Agregue 10 ml de mezcla de impresión a cada muestra, selle las placas con papel de aluminio y agite a RT durante 90 minutos a 1.000 rpm. Almacene las placas durante la noche (16 h) a 4 oC.
- El día de la impresión, reórtice brevemente y gire las placas. Transfiera 28 l de cada muestra a una placa de matriz 384. Esta transferencia se puede realizar mediante automatización o una pipeta multicanal. Es crucial realizar un seguimiento de la posición de las muestras en la placa de matriz 384.
- Gire la placa hacia abajo brevemente para eliminar cualquier burbuja. Selle las placas con papel de aluminio.
5. Generación de arreglos NAPPA: impresión de microarrays
NOTA: Todas las condiciones de impresión se optimizaron para el instrumento que aparece en la Tabla de Equipos y Materiales. Si utiliza una matriz diferente, puede ser necesaria una optimización adicional.
- Limpieza del arreglo de discos. Antes de empezar, vacíe todos los depósitos de residuos y rellene los depósitos con agua ultrapura o 80% etanol, si es necesario. Limpie los pasadores uno por uno con toallitas sin pelusas y agua ultrapura. Seque los pasadores con toallitas libres de pelusas y colóquelos cuidadosamente en la cabeza del saqueador.
- Configuración del arrayer: especificaciones de impresión [número máximo de sellos por tinta: 1; número de sellos por punto: 1; sincronización de múltiples sellos: --; tiempo de sello (ms): 0 ms; tiempo de entrada (ms): 0 ms; ajuste de profundidad de impresión: 90 micras; número de touch-offs: 0]. protocolo de esterilización: lavado de agua ultrapuro durante 2.000 ms con 0 ms de tiempo de secado y 500 ms de tiempo de espera; repetir estos pasos 6x; seguido de lavado con 80% de etanol durante 2.000 ms con 1.200 ms de tiempo de secado y 500 ms de tiempo de espera; repetir estos pasos 6x.
- Diseño de diapositivas: configure el arrayer con el patrón de matriz deseado. El diseño debe tener en cuenta varios factores [es decir, el número de réplicas para cada muestra, ubicación y número de características de control, diseño de matriz (un bloque, varios bloques idénticos), número de matrices que se van a imprimir, longitud de la ejecución, etc.].
- Coloque los portaobjetos recubiertos de aminosilano (paso 3.4) en la cubierta del bardero. Compruebe si el vacío mantiene todas las diapositivas firmemente en su lugar. Encienda el humidificador (debe ajustarse al 60%).
- Coloque la placa de pozo 384 en la cubierta del arreglo de discos. Inicie el programa.
- Etiquete los microarrays. Cuando haya terminado de imprimir, coloque las etiquetas de diapositiva sin diapositivas en la parte inferior (no impresa) de cada diapositiva. Mantenga el orden de impresión de diapositivas en la cubierta en orden numérico.
- Almacene las matrices impresas en RT en un bastidor de metal dentro de una caja herméticamente sellada con un paquete de sílice. Las diapositivas mantenidas en un entorno seco tienen una vida útil de hasta un año.
- (Opcional): se puede imprimir un segundo lote de 90 diapositivas utilizando las mismas muestras. Para ello, retire la placa de pozo 384 de la cubierta del arrayer tan pronto como se haga la impresión de la placa. Sellar y guardar la placa a 4oC. Después de que el primer lote de matrices esté completamente hecho, retírelos de la cubierta, coloque nuevas diapositivas recubiertas de aminosilano e inicie una nueva carrera. Asegúrese de que cada placa de pozo 384 está en RT durante 30 minutos antes de su uso. Si se imprimen más de cuatro réplicas por muestra en un lote de diapositivas, se recomienda dividir las 384 placas de pozo en dos placas para disminuir la evaporación de la muestra al disminuir la cantidad de tiempo invertido en la cubierta del arreglo de discos.
NOTA: Compruebe todos los depósitos antes del comienzo de la segunda ejecución.
6. Detección de ADN en diapositivas NAPPA
- Bloquee las diapositivas. Coloque las diapositivas en una caja de pipetas y agregue 30 ml de búfer de bloqueo. Incubar a RT durante 1 h en una coctelera mecedora.
- Mancha las diapositivas. Deseche la solución de bloqueo y agregue 20 ml de tampón de bloqueo y 33 ml de tinte fluorescente intercalante de ADN. Incubar durante 15 min con agitación. Luego, enjuague rápidamente los portaobjetos con agua ultrapura y séquelos con aire a presión. Continúe con el escaneo (sección 11).
7. Expresión de diapositivas NAPPA
- Bloquee las diapositivas con tampón de bloqueo en una coctelera de balanceo a RT durante 1 h. Utilice aproximadamente 30 ml en una caja de pipetas para cuatro diapositivas.
- Enjuague los portaobjetos con agua ultrapura y séquelos con aire comprimido filtrado. Aplique la junta de sellado a cada portaobjetos según las instrucciones del fabricante.
- Añadir mezcla IVTT. Cada diapositiva requerirá 150 l de mezcla IVTT. Diluir 82,5 l de lisato de HeLa en 33 ol de agua DEPC y complementar con 16,5 ol de proteínas accesorias y 33 uL de mezcla de reacción. Agregue la mezcla IVTT del extremo no etiquetado o no espécimen. Pipetear la mezcla lentamente (es aceptable si se abaloce temporalmente en el extremo de entrada). Masajee suavemente la junta de sellado para que la mezcla IVTT se extienda y cubra toda el área de la matriz. Aplique los sellos de puerto redondo pequeño a ambos puertos.
- Coloque las diapositivas en un soporte y transfieralas a la incubadora de refrigeración programable. Incubar durante 90 min a 30oC para la expresión proteica, seguido de 30 min a 15oC para la inmovilización de la proteína de consulta.
- Lave y bloquee los portaobjetos. Retire la junta de sellado y sumerja los portaobjetos en una caja de pipeta con aproximadamente 30 ml de 1 TBST complementado con 5% de leche para la visualización de proteínas (sección 8) o 1 x TBST complementado con 3% de albúmina sérica bovina (BSA) para ensayos de quinasa o cribado de drogas (sección 9). Incubar a RT con agitación durante 20 min y repetir este paso 2x.
8. Detección de proteínas en matrices NAPPA
- Añadir anticuerpo primario. Retire las diapositivas de la solución de bloqueo (paso 7.5) y seque suavemente la parte posterior (lado no impreso) con una toalla de papel. Colocar las diapositivas sobre un soporte y aplicar 600 ml de anticuerpo primario (ratón anti-bandera) diluido 1:200 en 1 x TBST + 5% de leche. Incubar durante 1 h a RT.
- Lave los portaobjetos con 1 x TBST + 5% de leche en una coctelera mecedora (3x para 5 min cada una).
- Añadir anticuerpo secundario. Retire los portaobjetos de la solución de lavado y seque suavemente la parte posterior con una toalla de papel. Colocar las diapositivas sobre un soporte y aplicar 600 ml de anticuerpo secundario (anticuerpo antiratón con labbeled cy3) diluido 1:200 en 1 x TBST + 5% de leche. Proteja los portaobjetos de la luz e incubar durante 1 h a RT.
- Lave los portaobjetos con 1 TBST en una coctelera mecedora (3x para 5 min cada una). Enjuague rápidamente los portaobjetos con agua ultrapura y séquelos con aire a presión. Continúe con el escaneo (sección 11).
9. Examen del inhibidor de la tirosina quinasa en matrices NAPPA
NOTA: Sin embargo, se pueden procesar varias diapositivas en el mismo experimento, asegúrese de que en cada paso, una diapositiva se procesa a la vez y que no se secan entre pasos. Agregue todas las soluciones al extremo no etiquetado o no espécimen de la diapositiva.
- Prepare todas las soluciones utilizadas durante el cribado de drogas:
- Preparar la solución de fosfatasa/DNase combinando lo siguiente: 1x tampón de metalofosfasa proteica (50 mM HEPES, 100 mM NaCl, 2 mM DTT, 0.01% Brij 35 a pH a 7,5); 1 mM MnCl2; 8.000 unidades de proteína lambda fosfatasa; y 2 unidades de DNase I. Preparar 400 l de la solución para cada microarray. Añadir fosfatasa y DNase justo antes de su uso.
- Haga la dilución del medicamento. Los medicamentos se reconstituyen en DMSO a una concentración final de 10 mM. Para asegurar que todas las concentraciones de fármacos probadas en la matriz, asegúrese de que se crea el mismo volumen de DMSO (una acción de 10.000x en DMSO) para cada concentración y se mantiene en -80 oC. En el momento de su uso, los medicamentos se diluyen 1:100 en agua.
- Preparar la solución de fármaco/quinasa combinando lo siguiente: 1x tampón de quinasa (25 mM Tris-HCl de pH a 7,5); 5 mM beta-glucerofosfato; 2 mM De DTT; 0,1 mM Na3VO4; 10 mM MgCl2; 500 M de ATP; y 2 l de fármaco (diluido 1:100 en agua). Preparar 200 ml de la solución para cada microarray.
- Realice el tratamiento con fosfatasa y DNase. Retire las diapositivas de la solución de bloqueo (paso 7.5) y seque suavemente la parte posterior con una toalla de papel. Coloque las diapositivas sobre el soporte y aplique 200 ml de solución de fosfatasa/DNase. Coloque un cubreobjetos de microarray para evitar la evaporación. Incubar a 30oC durante 45 min en el horno.
- Tratamiento con fosfatasa y DNase II: retirar las matrices del horno, desechar el cubreobjetos, eliminar el exceso de solución y aplicar 200 ml de fosfatasa recién hecha y solución de DNase. Cubrir los microarrays con cubreobjetos e incubar durante otros 45 min a 30oC en el horno.
- Lave los portaobjetos con 1 TBST + 0,2 M NaCl en una coctelera mecedora (3x para 5 min cada una).
- Realizar el tratamiento farmacológico y la reacción de la quinasa. Retire los portaobjetos de la solución de lavado y seque suavemente la parte posterior con una toalla de papel. Coloque las diapositivas sobre el soporte y aplique 200 ml de solución de droga/quinasa. Coloque un cubreobjetos en la parte superior para evitar la evaporación. Incubar durante 1 h a 30oC en el horno.
- Lave los portaobjetos con 1 TBST + 0,2 M NaCl en una coctelera mecedora (3x para 5 min cada una).
- Repita los pasos 8.1–8.4 usando como anticuerpo primario anticuerpo anti-phosho-Tyr anticuerpo diluido 1:100. Reemplace 1 x TBST + 5% de leche en todos los pasos con 1 x TBST + 3% de BSA.
10. Protocolo automatizado de hibridación
NOTA: Alternativamente, una estación de hibridación se puede utilizar para automatizar todas las hibridaciones y lavados en los arreglos de discos NAPPA (secciones 7–9) y el protocolo se proporciona como Archivo Suplementario 1.
11. Adquisición de imágenes
NOTA: Las imágenes de microarray deben adquirirse con una resolución de 20 micras o superior.
- Cargue microarrays en el cargador portaobjetos con las proteínas hacia arriba. Cargue el cargador en el escáner de microarray.
- Seleccione el láser verde con un filtro de emisión de 575/30 nm para escanear la señal del anticuerpo secundario etiquetado cy-3. Si se utiliza un fluoróforo diferente, seleccione el láser/longitud de onda correcto para detectar la señal del tinte fluorescente.
- Defina el nombre de cada imagen y la ubicación en la que se guardarán.
- (Opcional): para cada nuevo fluoróforo, se recomienda optimizar las condiciones de escaneo para detectar el rango lineal de la intensidad de la señal. Para ello, escanee un microarray utilizando una gama de fotomultiplicadores (PMT) y gane hasta que se obtenga una imagen clara con señal no saturada y fondo bajo.
- Escanee todos los microarrays con los ajustes optimizados y recuerde desactivar la ganancia automática.
NOTA: Para el análisis de datos, todos los microarrays deben ser escaneados utilizando la misma configuración de escaneo. Para ensayos de quinasa que utilizan cy3 como fluoróforo, las imágenes se escanean con un 20% de PMT, una intensidad láser del 25% y 10 micras de resolución, utilizando el escáner que aparece en la Tabla de Equipos y Materiales.
12. Procesamiento y análisis de datos
NOTA: Hay varios paquetes de software disponibles para la cuantificación de datos de microarray con capacidades similares. El procedimiento descrito aquí fue diseñado para el software enumerado en la Tabla de Equipos y Materiales.
- Cargue los archivos TIFF para cuantificarlos, diseñe la cuadrícula para que coincida con el diseño del microarray y ajuste el tamaño de los puntos para incorporar toda la señal con el área mínima posible. Las manchas vecinas no deben superponerse. Inspeccione visualmente el rendimiento del software y ajuste la cuadrícula manualmente, si es necesario.
- Cuantificar la intensidad de la señal del microarray. Inspeccione visualmente las manchas en busca de cualquier anomalía (encuadernación no específica, polvo, etc.) y retírelas del análisis de datos.
- Corrija el fondo localmente utilizando la señal de las áreas vecinas en la matriz en la que no hay punto presente.
- Normalizar datos. Para comparar la señal a través de diferentes matrices, se debe normalizar la intensidad de la señal de cada microarray. Para excluir los valores atípicos, normalice los datos utilizando la media recortada del 30% de la señal del control positivo (puntos IgG) de los microarrays defosforilados.
NOTA: La señal del punto IgG no cambia durante la fosforilación y desfosforilación de los microarrays y es adecuada para la normalización. - Identificar quinasas activas. Para cada entidad mostrada en el microarray, calcule la relación entre la intensidad de la señal normalizada en las matrices autofosforiladas y desfosforiladas. Establezca un umbral de 1,5 veces el cambio para la identificación de las quinasas activas y marque todas las demás características como incapaces de someterse a la autofosforilación (N/A).
- Calcular la actividad de cada quinasa identificada en el paso 12.5 como un porcentaje de la señal ajustada (intensidad de la señal de la matriz de control positivo normalizada (DMSO) restada por la intensidad de la señal de la matriz de control negativo normalizada (desfosforilada).
Resultados
Los microarrays NAPPA autoensamblados proporcionan una plataforma sólida que se puede utilizar para muchas aplicaciones distintas, incluyendo el descubrimiento de biomarcadores, interacciones proteína-proteína, identificación de sustratos y detección de fármacos10,11 ,12,13,14,15,16,17,18,19,20.
La metodología general adoptada para el estudio de la actividad quinasa y el cribado de inhibidores de las quinasas tirosina en microarrays NAPPA se representa esquemáticamente en la Figura 1. En primer lugar, los microarrays NAPPA son generados por la inmovilización del ADNc y el agente de captura en los microarrays recubiertos. Los CDNAs se utilizan entonces como plantilla para la transcripción y traducción de proteínas, utilizando un sistema IVTT basado en humanos, y las proteínas recién sintetizadas son inmovilizadas por el agente de captura9. La calidad del microarray impreso puede ser monitoreada midiendo los niveles de ADN (confirmando la impresión consistente) o la proteína mostrada en la matriz (confirmando la expresión y captura de proteínas; Figura 1). Para disminuir la señal de fondo y aumentar el rango dinámico del experimento, los microarrays se tratan con 1) fosfatasa lambda para eliminar la fosforilación de los residuos de Ser/Thr/Tyr, luego con 2) DNase para simplificar la química en el acto y disminuir fondo(Figura 1).
El siguiente paso es la reacción de autofosforilación, en la que los microarrays se incuban con tampón de quinasa en ausencia de ATP (matriz de control negativo, denominada microarrays desfosforilados), y el búfer de quinasa se complementa con ATP (control positivo, conocidos como matrices autofosforiladas) o ATP + DMSO (control del vehículo). Cabe destacar que durante este paso, no se añade quinasa; por lo tanto, la actividad intrínseca de cada quinasa mostrada en el microarray se cuantifica mediante la medición de sus niveles de fosforilación utilizando un anticuerpo pan antifosfo-tirosina seguido de un anticuerpo secundario con cy3 labbeled(Figura 1).
El control de calidad de las matrices NAPPA-quinasa que muestran un panel de quinasas de proteínas humanas impresa en cuadruplicado se muestra en la Figura 2. Los niveles de ADN inmovilizado se midieron por tinción de ADN y mostraron una señal uniforme a través del microarray, lo que sugiere que la cantidad de ADN impreso en la matriz era uniforme. También es posible observar varias características sin ninguna tinción de ADN. Estas características corresponden a algunos controles en los que se omitió el ADN de la mezcla de impresión [es decir, puntos vacíos (no se imprimió nada), manchas de agua, punto IgG purificado (polilisina, retidóntra e IgG purificado), mezcla de impresión solamente (mezcla de impresión completa: polilisina: polilisina además de retiquete y anticuerpo anti-bandera, sin ADN)]. Los niveles de proteína mostrados en los microarrays NAPPA-quinasa se evaluaron después de la reacción IVTT utilizando anticuerpos anti-etiqueta.
Para el cribado de quinasa, Flag se utilizó como la etiqueta de elección y el nivel de proteína que se muestra en el microarray se midió utilizando un anticuerpo anti-bandera. Como se muestra, la mayoría de las manchas que contienen ADNc mostraron con éxito niveles detectables de proteína. Algunos de los puntos de control sin ADNc también revelaron señal con el anticuerpo anti-bandera: punto IgG (utilizado para detectar la actividad del anticuerpo secundario) y puntos vectoriales vacíos (códigos de ADNc para la etiqueta solamente) (Figura 2). Los microarrays NAPPA-quinasa mostraron una buena reproducibilidad entre las diapositivas, con la correlación de los niveles de visualización de proteínas entre lotes de impresión distintos superiores a 0,88 (Figura 2). Dentro del mismo lote la correlación era aún mayor, cerca de 0.92 (datos no mostrados).
A continuación, la actividad de autofosforilación quinasa de las proteínas mostradas en la matriz se midió utilizando anticuerpos antifosfo-tirosina(Figura 3). La proteína mostrada en la matriz mostró altos niveles de fosforilación proteica después de la expresión(Figura 3, izquierda), que pueden ser causadas por la actividad quinasa intrínseca de la proteína mostrada en la matriz o por quinasas activas presentes en la mezcla de IVTT. Esta fosforilación se eliminó por completo con el tratamiento de la fosfatasa lambda y estos microarrays se utilizaron para los ensayos de quinasa. Después de la defosforilación, las reacciones de autofosforilación realizadas sin ATP no mostraron niveles significativos de fosforilación, como se esperaba, mientras que los microarrays incubados con tampón de quinasa en presencia de ATP mostraron fosforilación proteica tan rápido como 15 min ( Figura 3). Para el cribado de drogas, la actividad de la quinasa se midió después de 60 minutos de reacción de autofosforilación para maximizar el número de quinasas probadas.
La comparación entre microarrays en los que los niveles de fosforilación se midieron justo después de la expresión proteica(Figura 3, izquierda) y después de 60 min de reacción de autofosforilación(Figura 3, derecha) mostró: i) proteínas fosforiladas solamente después de la expresión, lo que sugiere que pueden ser fosforilados exógenamente por proteínas presentes en la mezcla DE IVTT, pero no pueden ser autofosforilados; ii) proteína fosforilada sólo después de la reacción de autofosforilación, lo que sugiere que estas proteínas no estaban activas después de la expresión de proteínas y los cofactores requeridos presentes en el tampón de quinasa para estar activos; o iii) proteína fosforilada en ambas matrices, lo que sugiere que estaban activas en ambos ajustes(Figura 3).
Como ejemplo de los resultados obtenidos para el cribado de inhibidores de la tirosina quinasa en matrices NAPPA-quinasa se utilizaron tres inhibidores de quinasas con selectividad distinta entre las quinasas proteicas: estaurosporina, imatinib e ibrutinib. Para todos los cribados, se incubaron microarrays NAPPA defosforilados con concentraciones crecientes de TKI (que van desde 100 nM a 10 uM) durante la reacción de autofosforilación. El primer TKI probado fue la estaurosporina, un inhibidor de la proteína quinasa global, que mostró una potente inhibición de la quinasa en el microarray en prácticamente todas las quinasas probadas11.
A continuación, se probó imatinib, un inhibidor de ABL y c-Kit utilizado para el tratamiento de la leucemia mielógena crónica y tumores estromales gastrointestinales4,5,6,7. En los arrays nAPPA-quinasa imatinib mostraron una reducción significativa en la actividad de Abl1 y BCR-Abl1, mientras que otras quinasas no se vieron afectadas en sumayoría (Figura 4A). La cuantificación de datos para la actividad de la quinasa se normalizó con respecto a la matriz defosforilada y se representó como un porcentaje del microarray de control positivo (solo vehículo). Los datos de TNK2 (quinasa no relevante), Abl1 y BCR-Abl1 se muestran en la Figura 4B. Como era de esperar, imatinib mostró inhibición selectiva hacia Abl1 y BCR-ABl1. Los datos de c-Kit no eran concluyentes debido a la falta de actividad en las matrices de control positivo.
Finalmente, ibrutinib, un inhibidor covalente aprobado por la FDA de la tirosina quinasa de Bruton (BTK), fue probado. Ibrutinib se utiliza actualmente en el tratamiento de varios cánceres relacionados con la sangre con BTK hiperactivo, incluyendo la leucemia linfocítica crónica (LLC), linfoma de células del manto, y macroglobulinemia de Waldenstrom21,22. Figura 4C, es representativa de los resultados típicos obtenidos para el cribado de ibrutinib. La actividad quinasa de ABL1 (quinasa no relevante) y BTK (objetivo canónico) y ERBB4 (posible nuevo objetivo) se muestra en la Figura 4D. Los datos sugieren que ERBB4 puede ser inhibido por ibrutinib de una manera específica de dosis. Esta inhibición se confirmó in vitro y en ensayos basados en células11,demostrando el poder de esta plataforma.
En conjunto, los datos sugieren que la plataforma de microarray NAPPA-quinasa podría utilizarse para el cribado imparcial de inhibidores de los CCT. Además, el cribado es rápido y se puede personalizar fácilmente para incluir cualquier variación de las quinasas proteicas de interés.
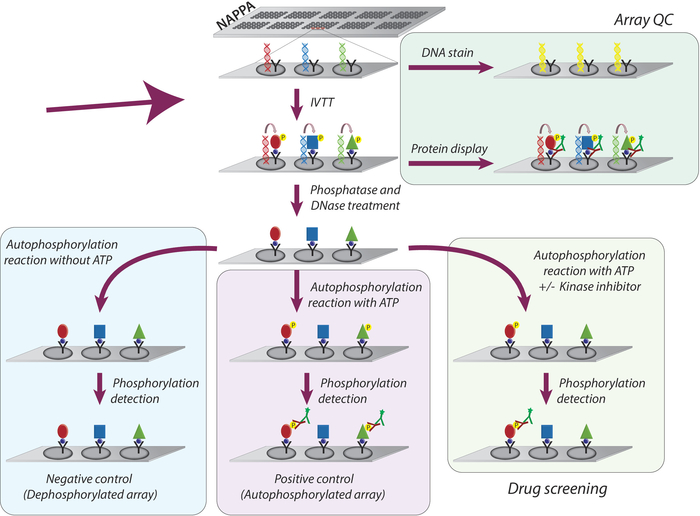
Figura 1: Representación esquemática del control de calidad y cribado de inhibidores de la tirosina quinasa en matrices NAPPA. Las matrices NAPPA se imprimen con codificación cDNA para la proteína de interés fusionada con una etiqueta y un anticuerpo de captura. Durante la transcripción in vitro y la reacción de traducción (IVTT) las proteínas sintetizadas se capturan en la superficie del microarray a través de la etiqueta por el anticuerpo de captura. El control de calidad (QC) de las matrices se realiza mediante la medición de los niveles de ADN impresos en la diapositiva, utilizando un tinte fluorescente intercalante de ADN, y los niveles de proteína que se muestran en la matriz utilizando anticuerpos específicos de la etiqueta. Para el cribado de quinasa, los microarrays se tratan con DNase y fosfatasa, después de la reacción IVTT, para eliminar el ADN impreso y toda la fosforilación que puede haber ocurrido durante la síntesis de proteínas. Las matrices defosforiladas ya están listas para ser utilizadas para la pantalla de drogas. Para cada ensayo, se utilizan rutinariamente tres conjuntos de controles: (I) matrices desfosforiladas, en las que la reacción de autofosforilación se realiza sin ATP; (II) microarrays autofosforilados, en los que la reacción de autofosforilación se realiza en presencia de ATP; y (III) Matriz tratada CON DMSO (vehículo), en la que la reacción de autofosforilación se realiza con ATP y DMSO. Las diapositivas tratadas con diferente concentración de inhibidores de la quinasa siguen exactamente el mismo protocolo utilizado para las matrices tratadas con DMSO. Haga clic aquí para ver una versión más grande de esta figura.
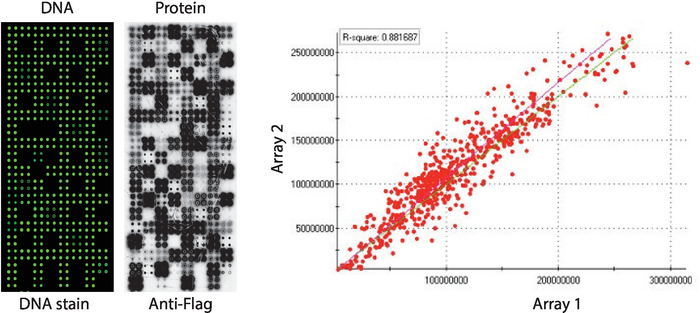
Figura 2: Resultados representativos del control de calidad para matrices NAPPA-quinasa autoensambladas. Se muestra el contenido de ADN medido por un tinte fluorescente intercalante de ADN (izquierda) y los niveles de proteína que se muestran en el microarray medido por anticuerpos anti-Flag (medio). En el lado derecho hay una gráfica de correlación de los niveles de proteína que se muestran en dos matrices NAPPA-quinasa impresas en lotes separados. Haga clic aquí para ver una versión más grande de esta figura.
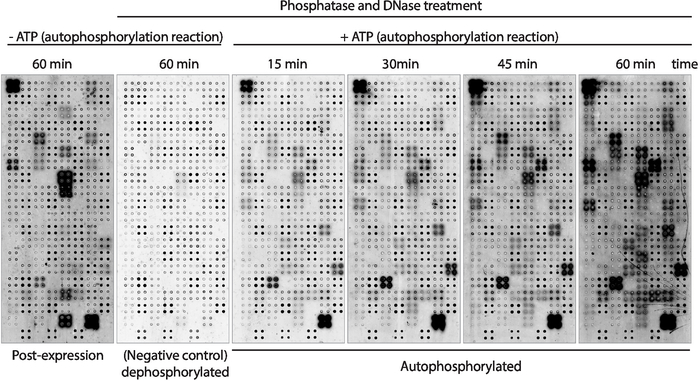
Figura 3: Resultados representativos de la actividad quinasa en matrices NAPPA-quinasa. Los microarrays que muestran quinasas de proteínas en cuadruplicado se utilizaron para estudiar la actividad de la proteína quinasa en la matriz a través de la medición de la fosforilación proteica utilizando anticuerpos anti-pTyr, seguido de anticuerpoantido con etiqueta cy3. Se utilizaron matrices de control sin tratamiento con fosfatasa/DNase y sin ATP durante la reacción de autofosforilación para medir la fosforilación de fondo después de la expresión de proteína (post-expresión). Los microarrays restantes fueron tratados con fosfatasa/ADN, y la reacción de autofosforilación se realizó sin ATP (microarray defosforilado, control negativo) o con ATP (microarrays autofosforilados). Para los microarrays autofosforilados, la reacción de autofosforilación se realizó durante 15 min, 30 min, 45 min o 60 min, como se muestra. Haga clic aquí para ver una versión más grande de esta figura.
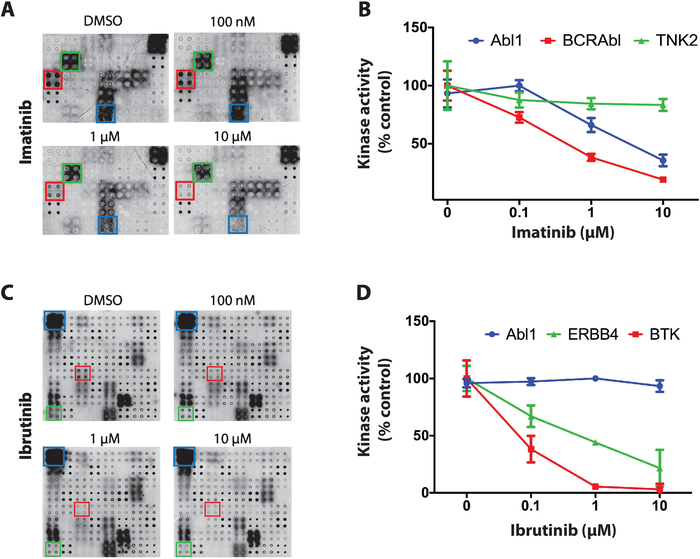
Figura 4: Datos representativos de la pantalla de tirosina quinasa en matrices NAPPA-quinasa. (A) Las matrices de NAPPA-quinasa tratadas con fosfatasa/DNasa se incubaron en concentraciones crecientes de imatinib durante la reacción de autofosforilación y la actividad de la quinasa se medió con anticuerpos antifosfofostiros. (B) Cuantificación de la actividad quinasa observada en matrices NAPPA-quinasa expuestas a imatinib. Los datos se normalizaron contra la señal de las matrices de control negativas (desfosforiladas) y se muestran como un porcentaje de las matrices de control positivas (reacción de autofosporilación realizada en presencia de DMSO). Se muestran datos similares para el cribado de ibrutinib (C,D). Esta cifra ha sido modificada de Rauf et al.11. Haga clic aquí para ver una versión más grande de esta figura.
Archivo Suplementario 1. Protocolo alternativo para el cribado de inhibidores de la tirosina quinasa en matrices NAPPA utilizando una estación de hibridación automatizada. Haga clic aquí para descargar este archivo.
Discusión
Modificaciones y solución de problemas
Durante la fase de optimización del estudio de la actividad quinasa en matrices NAPPA, una de las principales fuentes de fondo y bajo rango dinámico observado fue la BSA utilizada en la mezcla de impresión. BSA estaba proporcionando las aminas primarias necesarias para el reticulación con la superficie del aminosilano y estaba atrapando el ADN y el anticuerpo de captura en el acto. Sin embargo, BSA es altamente fosforilado, lo que dificulta la detección de la señal de autofosforilación en la matriz por encima del ruido de fondo. Para resolver este problema, se probaron varias alternativas para BSA en la mezcla de impresión, y la polilisina se identificó como un buen sustituto. La polilisina carece de cualquier sitio de fosforilación; por lo tanto, el fondo de las matrices no expresadas es muy mínimo. Además, los microarrays impresos con polilisina son reproducibles y muestran buenos niveles de proteínas(Figura 2).
La siguiente modificación crítica realizada en el ensayo estándar de NAPPA fue la adición de un paso de tratamiento de fosfatasa/DNase. El tratamiento de los microarrays con fosfatasa permite la eliminación de cualquier fosforilación que se haya producido en la mezcla de IVTT durante la síntesis y captura de proteínas(Figura 3). La fuente de esta fosforilación podría ser de la actividad intrínseca de autofosforilación o de la actividad de las quinasas presentes en la mezcla de IVTT. La eliminación de toda la fosforilación posterior a la expresión permitió una fácil identificación de las quinasas que están activas y pueden someterse a autofosforilación(Figura 3).
Pasos críticos dentro del protocolo
NAPPA es una tecnología robusta, pero como era de esperar, hay varios pasos críticos. La primera es la adquisición de ADN de alta calidad en la concentración adecuada. El uso de ADN de mala calidad o en bajas concentraciones generará microarrays de mala calidad con varias características que no se expresan y se muestran en los niveles adecuados, disminuyendo el número de proteínas analizadas en la matriz. El segundo paso crítico es la expresión de proteínas en el microarray. El uso de un sistema IVTT que expresará altos niveles de proteína funcional es vital para estudiar la actividad de la quinasa en la matriz.
El siguiente paso crítico en el cribado TKI es cómo se manejan los microarrays. Los microarrays no deben secarse durante ningún paso del protocolo, y se recomienda un manejo suave para evitar arañazos que puedan aumentar la señal de fondo. Dado que las matrices de todo el experimento se compararán entre sí, es importante asegurarse de que cada paso de incubación está incluso en todas las diapositivas. Por ejemplo, el tiempo necesario para realizar un paso en una sola matriz debe tenerse en cuenta cuando se procesa un lote de 20 matrices para evitar diferencias en la longitud de la incubación entre matrices.
Por último, el diseño del experimento y la inclusión de controles positivos y negativos son fundamentales para el control de calidad y el análisis de datos. El primer conjunto de controles son los impresos en cada matriz e incluye controles negativos [es decir, puntos vacíos (sin ningún material impreso), agua o vector vacío (expresar sólo la etiqueta)], así como un control positivo (es decir, IgG purificado, que es detectado por el anticuerpos secundarios y es inerte a la alteración en los niveles de fosforilación). Colectivamente, miden los niveles de fondo del microarray, el posible arrastre durante la impresión y la intensidad de la señal del método de detección.
El siguiente conjunto de controles son los controles de detección de drogas e incluyen los microarrays defosforilados y autofosforilados (en presencia o ausencia de DMSO). Como se mencionó anteriormente, el microarray defosforilado mide el nivel de fosforilación después del tratamiento con fosfatasa y, por lo tanto, el nivel basal para todos los demás experimentos. Cuanto menor sea el nivel de línea base, mayor será el rango dinámico de los ensayos. Las matrices autofosforiladas presentan los niveles máximos de fosforilación de todas las matrices y la señal debe ser fuerte y clara. Se utiliza para el análisis de datos, pero también como un control de que todas las reacciones se realizaron correctamente en la matriz.
Limitaciones de la técnica
A partir de ahora, una de las limitaciones del cribado de drogas presentado aquí es su capacidad para examinar sólo las quinasas proteicas que se pueden autofosforilar. Una forma posible de superar esto es imprimir una quinasa y un sustrato conocido en el mismo lugar. La coimpresión de ADN para dos proteínas distintas se logró con éxito15,lo que sugiere la viabilidad de este enfoque. Además, es posible que la proteína mostrada en la matriz no se doble correctamente, lo que resulta en una proteína inactiva. El uso del sistema de expresión basado en humanos hizo una mejora significativa en la actividad quinasa medida en la matriz; sin embargo, algunas proteínas todavía no se pueden analizar en la matriz debido a su inactividad.
Una segunda limitación es la medición de la fosforilación utilizando un anticuerpo pan anti-fosfo-tyr. A pesar de su inespecificidad con respecto al motivo del sitio de fosforilación, todas las fosforilaciones medidas ocurrieron en residuos de tirosina, dejando atrás serinas y trioninas y sus respectivas quinasas. Hasta la fecha, más de 10 anticuerpos pan fosfo-Ser/Thr han sido probados sin éxito, a pesar de varios intentos de optimizar las condiciones de incubación y lavado. Un nuevo sistema de detección que es independiente de los anticuerpos puede ser la mejor opción para ampliar el número de quinasas proteicas que se pueden analizar para la inhibición de los fármacos. En este contexto, algunas opciones están disponibles, incluyendo la radiactividad o enfoques químicos como la conjugación de clics. Se requiere una serie de optimizaciones para minimizar la señal de fondo y proporcionar un buen rango dinámico para los ensayos.
La tercera limitación es la adquisición de clones cDNA que se imprimirán en la matriz. Los clones de ADNc se pueden generar utilizando cualquier técnica de clonación, incluidos los sistemas de recombinación específicos del sitio, como Creator o Gateway23. Otra opción es comprar los clones de la biblioteca DNAsu, que se encuentran en , donde más de 17.000 clones de cDNAs, incluyendo todo el kinome humano, está fácilmente disponible para ser utilizado para la construcción de matrices NAPPA24 .
La cuarta limitación es que no todos los laboratorios están equipados con equipos adecuados para fabricar y examinar sus propios arreglos NAPPA. Este protocolo proporciona métodos alternativos para generar el ADN que se imprimirá en el microarray, sin necesidad de equipos de alto rendimiento, y protocolos para realizar manualmente todos los pasos de hibridación. Sin embargo, el acceso a un escáner de arreglos de discos y microarray sigue siendo necesario. Una opción para superar este problema es utilizar el servicio básico y la instalación de NAPPA, que se encuentra en , que distribuye microarrays NAPPA personalizados a un precio académico sin fines de lucro. Por último, a partir de cualquier metodología de cribado, los datos obtenidos en los arrays son susceptibles de ser artefactos (positivos o negativos) y por lo tanto deben ser validados mediante ensayos ortogonales.
Importancia con respecto a los métodos existentes
Varias plataformas están disponibles comercialmente para el cribado de quinasas proteicas. Un enfoque utilizado rutinariamente son los ensayos de unión, que se pueden realizar con fragmentos de proteínas, dominio de quinasa, fragmentos de proteínas más grandes con el dominio de la quinasa y algunas regiones reguladoras, e incluso proteínas de longitud completa. Las proteínas se expresan generalmente en sistemas bacterianos debido al costo y simplicidad en los protocolos de expresión y purificación. La interacción entre el fármaco de interés y la proteína se mide con algún tipo de ensayo de informe como fluorescencia o presencia de etiquetas, por ejemplo. La principal limitación de este conjunto de enfoques es el hecho de que la proteína no es necesariamente activa durante la interacción con el fármaco, lo que puede resultar en la identificación de interacciones falsas positivas y falsas negativas. Los fragmentos de proteínason son particularmente vulnerables a los cambios en la conformación y la falta de actividad y todos los datos obtenidos deben ser validados utilizando proteínas activas, preferiblemente en su forma de longitud completa. Otra limitación de algunas de las plataformas es la capacidad de examinar solo los análogos de ATP, limitando su uso general.
La mayoría de los servicios disponibles comercialmente para la detección de TKI utilizando enfoques basados en enzimáticos utilizan sólo versiones de tipo salvaje de la quinasa de interés, y a veces sólo unos pocos mutantes seleccionados. Sabiendo que la resistencia a los medicamentos es muy común en pacientes tratados con TKI, es importante poder medir la respuesta farmacológica en diferentes mutantes, para la selección del inhibidor más adecuado. Debido a la naturaleza de NAPPA, la detección de mutantes quinasa es simple y se puede lograr fácilmente, y la única herramienta necesaria es la incorporación del mutante quinasa en la colección NAPPA cDNA, que se puede hacer por mutagénesis específica del sitio, por ejemplo.
Aplicaciones futuras
Una de las formas más comunes de tratamiento que transcurren en la terapia oncológica utilizando inhibidores de la quinasa es la adquisición de mutaciones en el objetivo del fármaco durante un curso de tratamiento. El cribado de estos mutantes con respecto a su respuesta a los inhibidores de la quinasa es de vital importancia para la selección de la segunda/tercera generación de TKI para lograr un tratamiento personalizado para cada paciente. El enfoque de detección de drogas presentado aquí, proporciona una plataforma de detección imparcial en la que cualquier inhibidor de la tirosina quinasa puede ser probado contra un panel de tirosina quinasas presente en el genoma humano. Dado que las proteínas mostradas en las matrices NAPPA se expresan in vitro desde el ADNc impreso en la diapositiva, cualquier variante mutante se puede incorporar fácilmente en la colección de ADNc para mostrarse en la matriz. La instalación en la que los mutantes de la quinasa pueden ser generados y expresados en el arreglo de discos, combinado con el alto poder de alto rendimiento de la técnica NAPPA, proporciona un entorno único para el estudio de los mutantes quinasa y su respuesta a las drogas, haciendo que NAPPA sea adecuado para examen de drogas personalizado, uno de los objetivos de la medicina de precisión.
Divulgaciones
Los autores no declaran conflictos de intereses.
Agradecimientos
Los autores quieren agradecer a todos en el laboratorio de LaBaer por su ayuda y crítica durante el desarrollo del proyecto. Este proyecto fue apoyado por la subvención NIH U01CA117374, U01AI077883 y Virginia G. Piper Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 364 well plates (for arraying) | Genetix | x7020 | |
| 800 µL 96-well collection plate | Abgene | AB-0859 | |
| 96-pin device | Boekel | 140500 | |
| Acetic Acid | Millipore-Sigma | 1.00066 | |
| Acetone 99.9% | Millipore Sigma | 650501 | |
| Aluminum seal for 96 well plates | VWR | 76004-236 | |
| Aminosilane (3-aminopropyltriethoxysilane) | Pierce | 80370 | |
| ANTI-FLAG M2 antibody produced in mouse | Millipore Sigma | F3165 | |
| Anti-Flag rabbit Antibody (polyclonal) | Millipore Sigma | F7425 | |
| ATP 10 mM | Cell Signaling | 9804S | |
| β-Glycerophosphate disodium salt hydrate | Millipore-Sigma | G9422 | |
| bacteriological agar | VWR | 97064-336 | |
| Blocking Buffer | ThermoFisher/Pierce | 37535 | |
| Brij 35 | ThermoFisher/Pierce | BP345-500 | |
| BS3 (bis-sulfosuccinimidyl) | ThermoFisher/Pierce | 21580 | |
| BSA (bovine serum albumin) | Millipore Sigma | A2153 | |
| Coverslip 24 x 60 mm | VWR | 48393-106 | |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | |
| DeepWell Block, case of 50 | ThermoFisher/AbGene | AB-0661 | |
| DEPC water | Ambion | 9906 | |
| DMSO (Dimethyl Sulfoxide) | Millipore-Sigma | D8418 | |
| DNA-intercalating dye | Invitrogen | P11495 | |
| DNase I | Millipore-Sigma | AMPD1-1KT | |
| DTT | Millipore-Sigma | 43816 | |
| EDTA | Millipore-Sigma | EDS | |
| Ethanol 200 proof | Millipore-Sigma | E7023 | |
| Filter plates | Millipore-Sigma | WHA77002804 | |
| Gas Permeable Seals, box of 50 | ThermoFisher/AbGene | AB-0718 | |
| Glass box | Wheaton | 900201 | |
| Glass slides | VWR | 48300-047 | |
| Glycerol | Millipore-Sigma | G5516 | |
| HCl (Hydrochloric acid) | Millipore-Sigma | H1758 | |
| HEPES Buffer Solution | Millipore-Sigma | 83264 | |
| Human-based IVTT system | Thermo Scientific | 88882 | |
| ImmunoPure Mouse IgG whole molecule | ThermoFisher/Pierce | 31202 | |
| Isopropanol | Millipore-Sigma | I9516 | |
| KCl (Potassium chloride) | Millipore-Sigma | P9333 | |
| KH2PO4(Potassium phosphate monobasic) | Millipore-Sigma | P5655 | |
| Kinase buffer | Cell Signaling | 9802 | |
| KOAc (Potassium acetate) | Millipore-Sigma | P1190 | |
| Lambda Protein Phosphatase | new england biolabs | P0753 | |
| Lifterslips, 24 x 60 mm | ThermoFisher Scientific | 25X60I24789001LS | |
| Metal 30-slide rack with no handles | Wheaton | 900234 | |
| MgCL2 (Magnesium chloride) | Millipore-Sigma | M8266 | |
| Na3VO4 (Sodium orthovanadate) | Millipore-Sigma | S6508 | |
| NaCl (Sodium Chloride) | Millipore-Sigma | S3014 | |
| NaOAc (Sodium acetate) | Millipore-Sigma | S2889 | |
| NaOH (Sodium hydroxide) | Millipore-Sigma | S8045 | |
| NucleoBond Xtra Midi / Maxi | Macherey-Nagel | 740410.10 / 740414.10 | |
| Nucleoprep Anion II | Macherey Nagel | 740503.1 | |
| Phosphoric Acid | Millipore-Sigma | 79617 | |
| Poly-L-Lysine Solution (0.01%) | Millipore-Sigma | A-005-C | |
| Protein Phosphatase (Lambda) | New England Biolabs | P0753 | |
| RNAse | Invitrogen | 12091021 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | L6026 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | 05030 | |
| Sealing gasket | Grace Bio-Labs, Inc | 44904 | |
| Silica packets | VWR | 100489-246 | |
| Single well plate | ThermoFisher/Nalge Nunc | 242811 | |
| Sodium acetate (3M, pH 5.5) | Millipore-Sigma | 71196 | |
| TB media (Terrific Broth) | Millipore-Sigma | T0918 | |
| Tris | IBI scientific | IB70144 | |
| Triton X-100 | Millipore-Sigma | T8787 | |
| Tryptone | Millipore-Sigma | T7293 | |
| Tween 20 | Millipore-Sigma | P9416 | |
| Yeast Extract | Millipore-Sigma | Y1625 | |
| Name | Company | Catalog number | Comments |
| Equipments | Maker/model | ||
| Programmable chilling incubator | Torrey Pines IN30 Incubator with Cooling | ||
| Shaker for bacterial growth | ATR Multitron shaker | ||
| Vacuum manifold with liquid waste trap | MultiScreenVacuum Manifold 96 well | ||
| 96 well autopippetor/liquid handler | Genmate or Biomek FX | ||
| Liquid dispenser | Wellmate | ||
| DNA microarrayer | Genetix QArray2 | ||
| Automatic hybridization station | Tecan HS4800 Pro Hybridization Station | ||
| Microarray scanner | Tecan PowerScanner | ||
| Microarray data quantification | Tecan Array-ProAnalyzer 6.3 |
Referencias
- Melnikova, I., Golden, J. Targeting protein kinases. Nature Review Drug Discovery. 3 (12), 993-994 (2004).
- Patterson, H., Nibbs, R., McInnes, I., Siebert, S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. Clinical and Experimental Immunology. 176 (1), 1-10 (2014).
- Wu, P., Nielsen, T. E., Clausen, M. H. FDA-approved small-molecule kinase inhibitors. Trends Pharmacological Sciencies. 36 (7), 422-439 (2015).
- Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine. 2 (5), 561-566 (1996).
- Heinrich, M. C., et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood. 96 (3), 925-932 (2000).
- Stagno, F., et al. Imatinib mesylate in chronic myeloid leukemia: frontline treatment and long-term outcomes. Expert Review Anticancer Therapy. 16 (3), 273-278 (2016).
- Ben Ami, E., Demetri, G. D. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor. Expert Opinions in Drug Safety. 15 (4), 571-578 (2016).
- Ramachandran, N., et al. Self-assembling protein microarrays. Science. 305 (5680), 86-90 (2004).
- Festa, F., et al. Robust microarray production of freshly expressed proteins in a human milieu. Proteomics Clinical Applications. 7 (5-6), 372-377 (2013).
- Yazaki, J., et al. Mapping transcription factor interactome networks using HaloTag protein arrays. Proceedings of the National Academy of Sciences of the United States of America. 113 (29), E4238-E4247 (2016).
- Rauf, F., et al. Ibrutinib inhibition of ERBB4 reduces cell growth in a WNT5A-dependent manner. Oncogene. 37 (17), 2237-2250 (2018).
- Anderson, K. S., et al. Protein microarray signature of autoantibody biomarkers for the early detection of breast cancer. Journal of Proteome Research. 10 (1), 85-96 (2011).
- Wang, J., et al. Plasma Autoantibodies Associated with Basal-like Breast Cancers. Cancer Epidemiol Biomarkers Prevention. 24 (9), 1332-1340 (2015).
- Bian, X., et al. Tracking the Antibody Immunome in Type 1 Diabetes Using Protein Arrays. Journal of Proteome Research. 16 (1), 195-203 (2017).
- Song, L., et al. Identification of Antibody Targets for Tuberculosis Serology using High-Density Nucleic Acid Programmable Protein Arrays. Molecular and Cellular Proteomics. 16 (4 suppl 1), S277-S289 (2017).
- Wang, J., et al. Comparative Study of Autoantibody Responses between Lung Adenocarcinoma and Benign Pulmonary Nodules. Journal of Thoracic Oncology. 11 (3), 334-345 (2016).
- Montor, W. R., et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays. Infection and Immunity. 77 (11), 4877-4886 (2009).
- Tang, Y., Qiu, J., Machner, M., LaBaer, J. Discovering Protein-Protein Interactions Using Nucleic Acid Programmable Protein Arrays. Current Protocols in Cell Biology. 74, 11-15 (2017).
- Yu, X., et al. Copper-catalyzed azide-alkyne cycloaddition (click chemistry)-based detection of global pathogen-host AMPylation on self-assembled human protein microarrays. Molecular and Cellular Proteomics. 13 (11), 3164-3176 (2014).
- Anderson, K. S., et al. Autoantibody signature for the serologic detection of ovarian cancer. Journal of Proteome Research. 14 (1), 578-586 (2015).
- Woyach, J. A., Johnson, A. J., Byrd, J. C. The B-cell receptor signaling pathway as a therapeutic target in CLL. Blood. 120 (6), 1175-1184 (2012).
- Smith, M. R. Ibrutinib in B lymphoid malignancies. Expert Opinion on Pharmacotherapy. 16 (12), 1879-1887 (2015).
- Festa, F., Steel, J., Bian, X., Labaer, J. High-throughput cloning and expression library creation for functional proteomics. Proteomics. 13 (9), 1381-1399 (2013).
- Seiler, C. Y., et al. DNASU plasmid and PSI:Biology-Materials repositories: resources to accelerate biological research. Nucleic Acids Research. 42, D1253-D1260 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados