需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人类MK从人类主要来源的免疫细胞分拣或血细胞遗传基因 的体外 分化
摘要
在这里,我们提出了一个免疫嗜血策略,用于巨型胡萝卜细胞分化的特征,并展示该策略如何允许使用荧光激活细胞分拣器在不同阶段对巨型胡萝卜细胞进行排序。该方法可以应用于人体原生组织,也适用于 体外培养产生的巨型核细胞。
摘要
巨型胡萝卜素 (MK) 分化包括多个内分泌周期,导致高度多倍体(达到甚至>64N)和超大细胞 (40-60 μm)。与细胞生物学和分子水平上对巨细胞测定知识的快速增加相反,流细胞学对巨型卡罗波测定型的定性仅限于使用血统特定表面标记识别成熟的MK,而早期的MK分化阶段尚未探索。在这里,我们提出了一个免疫噬菌体策略,允许识别连续的MK分化阶段,随着策略地位的提高,在人类的主要来源或 体外培养物与 一个面板集成MK特定和非特定表面标记。尽管 MKs 的体积和脆弱性,但可以使用上述面板进行免疫型,并在压力和喷嘴直径的特定条件下通过荧光激活细胞分拣而丰富。这种方法有助于多奥米学研究,目的是更好地了解人类巨细胞和血小板生产的复杂性。更好地描述巨无霸病症可能对与血统有关的病理学和恶性肿瘤的诊断或预后构成根本。
引言
巨细胞(MKs)是按照一种称为巨细胞的复杂过程从造血干细胞(HSCs)中发育的,这个过程主要由激素血栓素(TPO)编排。巨型卡洛波伊斯的经典观点描述了从HSC到承诺祖先和前体细胞的一系列分层阶段的细胞之旅,最终导致一个成熟的MK。在成熟过程中,MKs 经历多轮内分泌,开发一个复杂的细胞内分界膜系统 (DMS),该系统为血小板生产提供足够的膜表面,并高效生产和包装成熟血小板1、2、3遗传的不同颗粒中所含的过多因子。因此,成熟的MK是大细胞(40-60微米),其特征是高度多倍体细胞核(达到甚至>64N)。最近的研究表明,HSC绕过传统的血统承诺检查站,根据某些生理病理条件,将HSC区分为MK的替代途径4、5、6、7、8、9、10、11。这些发现突出表明,对成熟MK的造血分化是一个对生物需求作出反应的连续体和自适应过程。
随着对细胞生物学和巨型细胞学12特征分子方面的了解日益增多,大部分致力于流细胞学过程研究的研究仅限于使用血统特定表面标记(即CD42A/B、CD41/CD61)识别成熟MK,而早期的MK分化阶段尚未探索。我们以前记录了在小鼠骨髓和骨髓衍生的MK培养13,14中上演巨细胞化策略,我们已经适应并应用于人类15。在本文中,我们展示了一种免疫异种策略,允许对巨型胡萝卜素进行定性, 从 HSC 到成熟的 MK,在人类主要来源(骨髓 -BM-和外周血液 -PB-)或体外培养物中使用集成 MK 特定和非特定表面标记(CD61、CD42B、CD49B、CD31、KIT 和 CD71 等)的面板。尽管MKs体积大且脆弱,但可以使用上述细胞表面标记进行免疫异种化,并通过在特定压力和喷嘴直径条件下的荧光激活细胞分类来丰富MKs,以尽量减少细胞破裂和/或损伤。这项技术促进多分子方法,目的是更好地了解巨细胞和血小板生产在人类健康和疾病中的复杂性。值得注意的是,它将构成一个有用的工具,以帮助诊断和预后在不断增长的需求的临床背景下。
在这份手稿中,我们记录了一个战略,以阶段人类巨型卡约波伊斯与面板集成MK特异性和非特定的表面标记从主要来源或产生体外。此外,我们提供一个协议来排序,与荧光激活的细胞分拣机,首选分数和成熟的MKs(图1)。这一步骤并不受欢迎,因为由于 MK 的体积大且脆弱,在技术上很难。然而,它以前在小鼠和人体骨髓样本中都使用过,由于技术的进步,每次16、17、18年都有更好的结果。可以研究MK或MK前体的人类主要来源包括骨髓、脐带血和外周血等。适当的样品处理,以隔离相关的细胞分数,对每个样本进行分析是重要的。纳入了标准程序,在研究巨型卡洛波伊斯时应考虑到一些考虑。
研究方案
根据1964年《赫尔辛基宣言》获得和处理了全血和骨髓样本。在我们的机构医学伦理委员会(阿斯图里亚斯中央大学-HUCA-)批准的一项研究中,从健康献血者那里获得了全血样本。骨髓样本是从圣卡洛斯医院血液学部管理的患者的骨髓吸附丢弃材料中获得的。
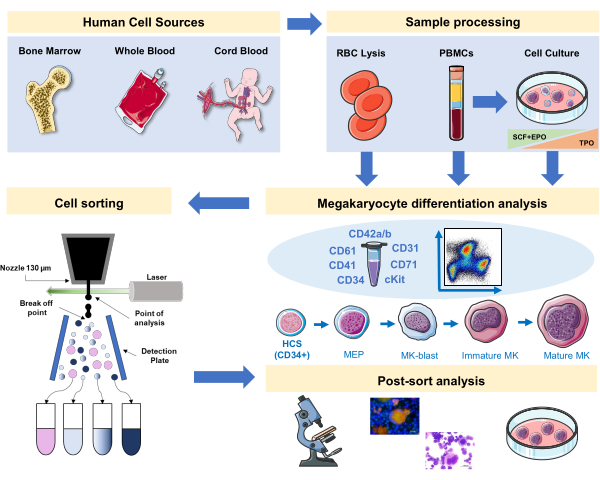
图1:本手稿中所记录的协议的示意图表示。 指出了MK分化可以通过免疫同源进行的主要人类来源或原始文化。这种免疫排他性策略可用于研究不同血统相关病理或主要来源的恶性肿瘤过程。此外,它使使用荧光激活的细胞分拣机对 MK 和前体进行细胞排序成为可能,从而进一步分析丰富分数。使用的图像是服务员医疗艺术 (SMART) 的一部分,并在 CC 3.0 下获得许可。 请单击此处查看此图的较大版本。
1. 免疫接种前的全血和骨髓处理
- 当使用捐赠中的全血 (WB) 作为主要来源时,可选地分离外周血单核细胞 (PBMC) 成分。这可以通过使用标准差分离心结合密度梯度细胞分离来实现,如前所述15。
- 简言之,离心血在室温下为193 x g,15分钟(制动器3)。丢弃上等离子体部分并收集抛光环。在 50 mL 管中的密度梯度溶液 (1.076 g/mL) 的密度梯度溶液 (1.076 g/mL) 之上小心地稀释 1:1:1 与磷酸盐缓冲盐水 (PBS) /柠檬酸三聚二甲酸酯 (38 g/L,pH 7) 缓冲器和移液器一起小心地使用 25 mL 的体积。
- 离心机20分钟,1114 x 克(加速器 3,制动器 3,室温)。丢弃等离子体部分,收集含有 PBMC 的自助环。通过添加相同体积的 PBS 进行清洗,在 435 x g 下将离心机在 5 分钟内进行清洗,然后在 PBS 中重新使用以供进一步使用。
- 或者,在对红血球(RBC)进行透水和彻底清洗后,使用WB样本(约100μL)进行免疫嗜血。
- 简言之,在冰冷的 RBC 解析缓冲区稀释 1:1 (4.15 克 NH4Cl,0.5 克 KHCO3 和 18.5 毫克 EDTA (三重 III) 至 500 毫升的 H2O, pH 7.1-7.4)。等到细胞悬架变成半透明红色(3-5分钟)。
- 离心机在 435 x g 5 分钟,在 4 °C,并恢复 PBS 中的细胞。重复程序,尽可能多次获得白细胞颗粒。
- 同样,直接处理从骨髓(渴望)中获得的样本与RBC解泡缓冲(见点1.2)和彻底清洗,以开始一个明确的单细胞悬架(图1)。
- 避免在加工过程中使用涡流混合样品, 因为它可能会通过轻弹或倒置管子来损坏脆弱的 Mks. 混合。
注意:与 RBC 解体 WB 相比,获得 PBMC 的密度梯度可能会导致更丰富、更清洁的细胞分数。然而,我们应该记住,高密度、成熟的MK可能会在"中性粒细胞"部分丢失。这将在代表结果中讨论。
- 避免在加工过程中使用涡流混合样品, 因为它可能会通过轻弹或倒置管子来损坏脆弱的 Mks. 混合。
2. 体外MK与PBMC的区别
注:MK可以在体外与早期前体(如CD34+细胞)区分开来,存在于不同的主要来源(即WB/PBMC、脐带血、骨髓)和iPSC中。为此目的应用了不同的协议。在这里,我们使用一种文化方法,允许MK区别于PBMC,而无需丰富CD34+前体15,19,20,21,22。
- 该协议由三个文化阶段组成,其中血栓素(TPO)的浓度逐渐增加,而生长因子有利于早期前体(即SCF、EPO)的增殖而逐渐减少(图2)15。
- 对于基础介质,使用茎盘SFEM补充0.4%的胆固醇富含脂质混合物和1%青霉素/链霉素。
- 对于第一阶段介质,使用基础介质补充SCF(100 ng/mL)、红细胞生成素(EPO,0.5 U/mL)和血栓素(TPO,30 ng/mL)。第二阶段介质是基础介质,辅以SCF(50 ng/mL)、EPO(0.25 U/mL)和TPO(50 ng/mL)。对于第三阶段介质,使用辅以 TPO (100 ng/mL) 的基础介质。
- 第一阶段中等文化 PBMC。在第6-8天,将PCBCs置于第二阶段介质中,在第9-12天将PCBCs置于第三阶段介质中。
- 从第一阶段到第二阶段,在室温下以435 x g的离心电池代替介质5分钟,在第二阶段至第三阶段的室温下以95 x g更换5分钟,并在新鲜介质中重新悬念。
- 培养细胞在孵化器在37 °C,5%CO2。在这些原始文化中,MK 分化持续 10-14 天,在整个文化期间,可以在不同的时间点绘制样本,以便遵循 MK 分化。
- 对于基础介质,使用茎盘SFEM补充0.4%的胆固醇富含脂质混合物和1%青霉素/链霉素。
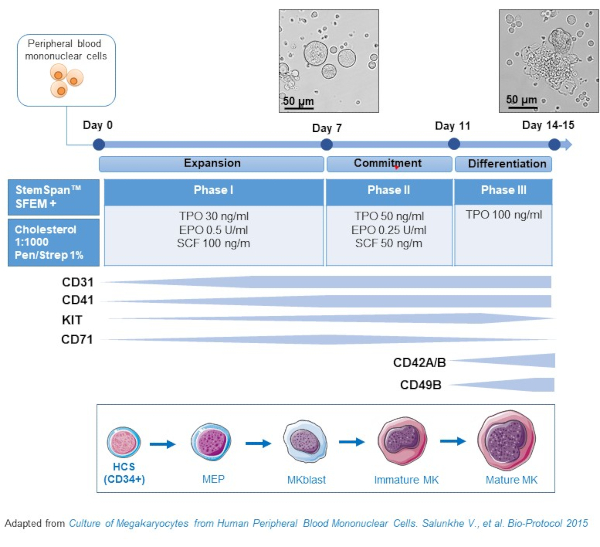
图2:PBMC衍生MK培养方法的原理图表示。 健康捐赠者的 PBMC 是根据我们开发的三阶段协议培养的,用于 生成体外 MK(根据萨伦克等人改编的方案)。15 显示在文化的第 10 天和第 13 天拍摄的图片。照片拍摄时目标为 20 倍。 请单击此处查看此图的较大版本。
- 样本收集:通过应用低速离心5分钟(95 x 克)清洗细胞,并在含有 1% 牛血清白蛋白 (BSA) 的 PBS 或 PBS 中补充它们。对于免疫细胞型,理想密度为 105-106 细胞/100 μL(参见点 3.1)。根据培养物的状态(即 存在死细胞、碎屑等),可能需要1或2次清洗。在培养期间收集您的细胞。
3. MK分化的免疫异种 - 用标记抗体面板孵育
- 按照标准程序,用一组标记抗体孵化细胞样本,在处理巨型核糖核细胞时注意低速离心机(95 x g)。我们通常在 PBS 中以 1% BSA 在 4 °C 20 分钟内以 100 μL 的体积孵育样品,范围为 105-106 个细胞。
- 必要时放大。
- 孵化后,在PBS中加入5mL的1%BSA,在低速(95 x g)下离心机,吸气超自然剂,并在PBS中以2%BSA中补充样品,以保持MK的生存能力(2 mL)。添加 1-5 m EDTA 以破坏细胞聚合物(这在 MK 培养中是自然可见的)。
- 将样品转移到 12 x 75 mm 圆形底部管 (FACS 管) 或板中,将其保持在黑暗中,直到流细胞分析或细胞排序。
- 单抗体和抗体面板混合的制备:设置流量细胞仪:
- 在抗体使用前滴定抗体以确定抗体面板的最佳浓度。抗体的最佳浓度是将明显阳性细胞与负细胞分离的最低浓度(并允许区分中间表达水平)。例如,大多数抗体用于 1:200 稀释(库存 100μg/mL),除非制造商以其他方式标注或指示。
- 一旦确定抗体滴定,准备每个抗体的10倍稀释。这些稀释用于单色控件和准备面板混合。稀释和面板混合即使在制备后一个月(存储在 4 °C,除非制造商的指示排除了这些存储条件),也可用于使用。这允许用同一面板在一段时间内对样品进行染色。
- 单色控件和面板组合均使用 10μL/100μL 的 10 倍稀释。
- 对于单色控制,使用抗体亲和力珠,在添加抗体后可直接测量。应通过每个实验测量单色控件,以便进行适当的补偿调整(并使用分析软件微调测量后)。
- 或者,使用细胞样本执行单色控制。但是,珠子允许快速测量给定数量的事件,根据抗体/表面标记,这些事件可能无法在复杂的原细胞或培养细胞源上获得。我们还建议运行沾有"荧光减去一"(FMO)面板混合的细胞样本,以设置适当的补偿设置(在运行实验之前)。这与仔细识别补偿问题有关,特别是在培养的 MK 中,以识别自流干扰(如果使用含有苯酚红色的文化介质,就会存在这种干扰)。
- 根据样品数量,准备足够的面板组合体积,其中包含设计面板的抗体。我们的大部分面板包括六种抗体(6色面板,见表1-2)。
- 对于这些面板,使用流光度计的 488-nm 和 633-nm 激光,但是,面板可以适应其他技术场景。此外,使用基于质谱的流细胞测量或具有声学聚焦技术的细胞仪时,可以避免补偿考虑。
- 用于测量可行性的染料可能会提供有关 MK 的虚假信息,尤其是在它们成熟时。MKs 是非常活跃的上升细胞, 和积极与霍奇斯特, 7 - Aad 或 Pe, 可能并不总是反映实际的细胞死亡。另一种选择(如果需要细胞死亡测量)可能是使用线粒体污渍(CMX Ros)或胺反应染料(僵尸或幽灵染料)。
表1:关于巨型细胞谱系细胞表面标记的注释请单击此处下载此表。
表2:抗体面板请点击这里下载此表。
4. 普洛伊迪分析与 6 色面板相结合
- 对于策略分析,结合 6 色抗体面板,使用抗体面板孵化后继续固定和渗透细胞。这种策略将允许保存表面标记染色,同时允许染色细胞的DNA。我们使用 Hoechst 33342 来染色 DNA,因为它可以通过可用的紫罗兰 405-nm 激光进行可视化。
- 对于 105-106个细胞,在用抗体面板孵育后,离心机细胞(95 x g 为 5 分钟),在 200 μL 的固定缓冲中重新供用,并在室温 (RT) 下孵育 10 分钟。
- 如上所述,离心细胞在200 μL固定缓冲区中第二次恢复,并在RT再孵育10分钟。
- 准备渗透缓冲区,包含 0.1% 特里顿 X-100、200 毫克/mL RNase 和 20 毫克/mL 霍奇斯特 33342(渗透霍赫斯特混合)。
- 离心细胞如上所述,在渗透霍赫斯特MIX的300μL中恢复它们,并在37°C孵育30分钟。 这一步骤非常重要,因为为了获得一个干净的策略测量,RNA必须退化。
- 孵化时间过后,用流光度计直接测量样品。否则,将样品保持在 4 °C,在黑暗中。迅速测量它们。但是,由于这些样本是固定的,测量甚至可以延迟 24-48 小时。在测量或通过细胞过滤器之前,请确保样品被彻底轻拂,以确保单个细胞悬架。
- 细胞固定后不维护前部和侧散射等形态参数。前/侧散射图将显示固定后细胞分布的收缩。然而,表面标记染色大多保存完好,门控策略几乎没有改变,因此可以分析表面标记组合定义的不同分化阶段的策略状态。
5. MK 分化分析
注:我们看到CD31/CD71的组合允许设置多个门,这些门与MK分化的不同阶段相对应。进一步背对 MK 特定标记允许将成熟和不成熟的 MK 分离。此外,在新的样品中,回封以验证使用的其他标记的存在,或将种群放置在前进/侧散射轴中,改进了对 MK 分化阶段的评估,并允许丢弃可能存在于同一群群的其他细胞类型。
- 使用包括早期前体标记(KIT,CD34)、常见前体标记(CD31、CD71)和血统标记的抗体面板,其中一些是特定的(CD42A/CD42B、CD49B、CD41/CD61、CLEC2、GPVI 等)(见 表1-2)。使用血统(林)鸡尾酒(CD3、CD14、CD16、CD19、CD20和CD56),还可以"过滤掉"成熟的造血细胞,这些细胞可能会给分析增加噪音(在选择林族 群时)。例如,我们将通过在具有代表性的结果中分析 PBMC 中的 MK、骨髓和通过 PBMC 衍生的细胞培养物。
6. MK 和 MK 前体细胞排序
注:使用FACSDiva软件,在装有488纳米和633纳米标准固态激光器的荧光激活细胞分拣机FACS Aria Iiu上对染色细胞进行了分析和排序:使用 FlowJo 软件和细胞库(viSNE 分析)对数据进行了进一步分析和呈现。通过对每个排序分数(纯度高于 85%)的流动细胞学分析确认了排序分数的纯度。
- 尽快或在抗体孵化后1小时内进行细胞分拣,以避免细胞变质。
- 使用 100μm 细胞过滤器过滤样品,以确保单细胞悬架和大型 MK 的完整性。
- 使用 130μm 陶瓷喷嘴、每平方英寸 (PSI) 的护套压力设置为 11 磅,将滴驱动频率设置为 12 kHz 以将流分解为滴。
- 在分拣之前,用青霉素/链霉素在无菌水中稀释1:5进行30分钟的采集,对喷嘴、护套和样品线进行消毒,然后用无菌水进行10分钟的采集,以去除剩余的除毒剂。
- 流稳定后,用推荐的珠子调整掉落延迟,以便以每秒 400-1200 事件的流速在微调模式下排序超过 97.5% 的反射落点。
- 在 PBS 中使用 500 μL 的 2% BSA 准备收集 FACS 管。BSA 的百分比可增加到 5-10%。
- 使用适当的补偿矩阵参数生成实验模板。
- 将FACS管加载到细胞仪中。
- 对样本进行测量,以设置目标细胞群所需的门和纯度。保持激活的记录,以便在细胞排序期间在选定的人口门中显示多达 200,000 个事件。
- FACS Aria IIu 允许同时分离多达 4 个不同的细胞群。创建新的排序布局,并选择收集设备 (4 管) 和适当的精度模式(建议使用纯度和恢复的中间面膜)。最后,将感兴趣的人口(s)添加到每个排序位置字段(图3)。

图3:荧光激活细胞分拣原理的原理图表示(FACS)。 这些粒子穿过130微米喷嘴,由于对喷嘴施用振动,被迫分解成一流的普通液滴。接下来,通过激光(分析点)对液滴进行询问,并处理信号,通过对这些液滴进行充电来做出"排序决定"。当电荷液滴穿过高压静电场(检测板)时,电滴会偏转并收集到相应的收集管中。 请单击此处查看此图的较大版本。
- 加载收集管并开始对目标人群进行排序。
- 以 95 x g 将收集管离心 5 分钟,并在 PBS 中以 2% BSA 的适当体积重新注入细胞颗粒。
- 再次测量每个排序样本的一小部分,以计算纯度。
- 适当存储单元格以供进一步使用。分拣的细胞可用于细胞学和分子分析,或可能重新培养,以研究选定细胞群的分化过程。
7. 排序后样品准备
- 准备细胞针细胞学分析与细胞中心富格
- 将分拣单元件带到易于处理的工作量 100-200 μL。考虑到细胞密度将取决于每个案例中的排序种群产量。
- 在金属支架上放置一个干净的滑梯,并放置一个过滤器顶部。请记住给幻灯片和过滤器贴上标签,以避免混合样品。
- 在滑梯的滤孔上添加 100 μL PBS,使过滤器在孔边缘加湿。
- 放置漏斗,关闭金属支架,并将其放置在离心机中。
- 在漏斗中添加样品(100-200 μL)。
- 离心机在36 x g 5分钟。细胞平滑梯可以允许在RT(适当覆盖以防止灰尘)空气干燥,并可以在RT保存1个星期之前免疫染色或组织化学。
- 用于免疫染色
- 修复在PBS中稀释的2%副甲醛(PFA)中的滑梯,并在5分钟内孵化。
- 可以使用PBS中0.5-4%PFA的范围。在我们手中,我们使用 4% 来获得组织或某些细胞类型的适当固定,PBS 中的 0.5% PFA 足以满足血小板的需求。设置此技术时,PFA 的正确百分比需要每个单元格类型/源进行优化。
- 在PBS中孵化5分钟。
- 在50%乙醇(EtOH)中孵化5分钟。
- 在 70% Etoh 中孵化 5 分钟。
- 在-20oC下存储在70%的EtOH中。
- 在进行免疫消毒、补充水分和遵循标准程序(渗透、清洗、阻塞、初级和次生抗体孵育、保存等)时。
- 修复在PBS中稀释的2%副甲醛(PFA)中的滑梯,并在5分钟内孵化。
- 对于细胞化学:
注意:幻灯片可以染上梅-格伦瓦尔德·吉姆萨染色或每个目的的方便染色。 - 立即进行形态检查
- 在细胞平的细胞包含点上添加一滴安装介质,并放置盖片。
- 除非密封,否则将幻灯片保持在 4 °C,不超过一周,即使在 RT 中安装中固定允许在 RT 进行长期存储,否则该滑梯还允许长期存储。
结果
骨髓和普洛伊迪
在 图4中, 我们展示了对BM样本(渴望)中巨型胡萝卜素的代表性免疫异种分析。在绘制针对 CD71 和 CD31 的蜂窝分数时,我们已对六个主要人群进行了限制:CD31- CD71- (红色)、CD31- CD71+ (蓝色)、CD31+ CD71- (橙色)、CD31+ CD71中 (浅绿色)、CD31+ CD71+
讨论
迄今为止,大部分以流细胞学研究巨型卡罗波西斯的研究为重点,仅限于仅使用血统特定表面标记(即CD42A/CD42B、CD41/CD61)识别MK子集,而早期的MK分化阶段则检查不力。在本文中,我们展示了一种免疫细胞学策略,以解决人类巨细胞体的综合流动细胞特征。总体而言,我们想强调将MK特定和非特定表面标记(表1和2)组合在同一流动细胞测定抗体面板中的效用,以便更详细地研究巨型细胞分...
披露声明
视听材料生产得到了BD生物科学的支持。
致谢
我们感谢马科斯·佩雷斯·巴斯特雷切亚、洛雷纳·罗德里格斯·洛伦佐和贝戈尼亚·加西亚·门德斯(胡卡)和帕洛玛·塞雷佐、阿尔穆德纳·帕耶罗和玛丽亚·德拉波韦达-科洛莫(HCSC)的技术支持。这项工作部分得到了医疗赠款(罗氏SP200221001)对A.B,RYC奖学金(RYC-2013-12587;西班牙经济部长和竞争组织)和2017年国际发展基金赠款(SAF2017-85489-P;西班牙新星大学和丰多斯联邦大学部长向L.G.提供塞韦罗·奥乔亚赠款(PA-20-PF-BP19-014):西班牙阿斯图里亚斯新星大学)至P.M-B。和2018年博士后资助(阿斯图里亚斯生物萨尼塔里亚基金会 - FINBA,西班牙奥维耶多)给A.A.-H。我们感谢雷尼尔·范德林登分享他的知识(和时间),特别是他在多色标记抗体面板组合和单色珠控制准备方面的明智建议。
材料
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. | |||
参考文献
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116 (2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342 (2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639 (2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271 (2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864 (2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。