このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単離したてのマウス肝細胞の懸濁液中の脂肪酸β酸化の測定
要約
脂肪酸β酸化は、肝細胞を含む多くの異なる細胞型においてエネルギーを生成する役割を担う必須代謝経路である。ここでは、 14C標識パルミチン酸を用いて新たに単離した初代肝細胞における脂肪酸β酸化を測定する方法について述べる。
要約
脂肪酸β酸化は、肝臓のエネルギー需要を満たすための重要な代謝経路であり、全身のグルコース恒常性を維持し、絶食状態での肝外器官機能をサポートするために不可欠なケトジェネシスおよび糖新生などの追加プロセスのための基質および補因子を提供する。脂肪酸β酸化は、ミトコンドリアおよびペルオキシソーム内で起こり、脂肪酸の取り込みおよび活性化、酵素発現レベル、補酵素AおよびNAD+などの補因子の利用可能性を含む複数のメカニズムによって調節される。肝臓ホモジネート中の脂肪酸β酸化を測定するアッセイでは、細胞溶解および補因子の超生理学的レベルの一般的な添加は、これらの調節機構の影響を隠す。さらに、ホモジネート中の細胞小器官の完全性は制御が困難であり、調製物間で大きく異なる可能性がある。無傷の初代肝細胞における脂肪酸β酸化の測定は、上記の落とし穴を克服する。このプロトコールは、 14C標識パルミチン酸と共にインキュベートされた新たに単離された初代マウス肝細胞の懸濁液中の脂肪酸β酸化の測定のための方法を記載する。数時間から数日の培養を避けることによって、この方法は、摂食マウスと比較して絶食マウスから単離された肝細胞において観察される脂肪酸β酸化の活性化を含む、元の肝臓のタンパク質発現レベルおよび代謝経路活性をよりよく保存するという利点を有する。
概要
脂肪酸β酸化は脂質代謝に不可欠なプロセスであり、脂肪酸合成と食事からの摂取のバランスをとるための異化経路を提供する。このプロセスは、心筋、腎臓皮質、絶食肝臓を含む複数の臓器にエネルギーを生成し、食事から得られる脂肪酸、脂肪組織の脂肪分解、および内部トリグリセリドストア1,2を利用します。
β酸化経路を介した脂肪酸の酸化は、アセチルCoAとして放出される一度に2つの炭素による脂肪酸アシル鎖の逐次的な短縮をもたらし、このプロセスはミトコンドリアおよびペルオキシソームの両方で起こる。ほとんどの脂肪酸はβ酸化のみを受けるが、一部はこの経路に入る前に異なる炭素で酸化される。例えば、フィタン酸などの3-メチル置換脂肪酸は、α酸化経路に入る前にペルオキシソーム中のβ酸化によって1つの炭素の除去を受ける。同様に、一部の脂肪酸は、小胞体における末端メチル基の酸化(ω-酸化)によって最初にジカルボン酸脂肪酸に変換され、その後、β酸化3によってペルオキシソーム内で優先的に酸化される。
特定の細胞小器官に関係なく、脂肪酸は、β酸化経路を介して酸化されるためには、まず補酵素A(CoA)チオエステル、またはアシルCoAに変換されなければならない。ミトコンドリアマトリックス中の長鎖アシルCoAsのβ-酸化は、カルニチンパルミトイルトランスフェラーゼ1(CPT1)がアシル-CoAsのアシルカルニチンへの変換を触媒し、このプロセス4における律速酵素であるカルニチンシャトルを必要とする。一旦ミトコンドリアマトリックスに転移すると、アシルCoAsは再形成され、ミトコンドリアβ酸化機構の基質として役立つ。絶食状態では、肝ミトコンドリアにおけるβ酸化によって産生されたアセチルCoAは、主にケトジェネシスにチャネリングされる。ペルオキシソームは、非常に長鎖、分岐鎖、およびジカルボン酸のβ酸化の一次部位として役立つ。ペルオキシソームは、脂肪酸基質を輸入するためにカルニチンシャトルを必要とせず、代わりにATP結合カセット(ABC)トランスポーターの活性を介して対応するアシル-CoAsを輸入する1-35。ペルオキシソーム内では、アシルCoAsは、ミトコンドリア脂肪酸β酸化機構とは異なる専用の酵素セットによって酸化される。ミトコンドリアとペルオキシソームの両方はまた、脂肪アシル鎖を酸化するためにNAD+ および遊離CoAの供給を必要とする。肝臓中のCoAレベルは絶食に応答して増加することが示されており、この状態で起こる脂肪酸酸化の速度の増加を支持している6。さらに、ペルオキシソームにおけるCoA分解の増加は、ペルオキシソーム脂肪酸酸化7の選択的減少をもたらす。したがって、細胞内の脂肪酸酸化のプロセスは、脂肪酸の活性化、輸送、および酸化に関与する酵素の発現レベルおよび活性、ならびに複数の細胞内区画にわたる補因子および他の代謝産物の濃度によって調節される。
脂肪酸酸化を測定するために組織ホモジネートを使用する手順は、このプロセスを調節およびサポートする細胞アーキテクチャを破壊し、in vivo代謝を正確に反映しないデータの収集につながる。播種された初代肝細胞を用いた技術はこの系を保持するが、単離された細胞を長期間培養すると、動物内にまだ生きていたときに細胞内に存在していたin vivo遺伝子発現プロファイルが失われる結果となる8,9。以下のプロトコールは、[1-14C]パルミチン酸を用いて、初代肝細胞を単離し、単離直後および懸濁液中で脂肪酸β酸化に対するそれらの能力をアッセイする方法を記載している。このアッセイは、[1-14C]パルミチン酸10,11のβ酸化によって生成されるアセチルCoAのような酸可溶性代謝産物(ASM)または生成物に関連する放射能の測定に基づいている。
プロトコル
マウス(C57BL/6J、雄、9〜11週齢)に対するすべての実験手順は、ウェストバージニア大学の施設動物ケアおよび使用委員会(IACUC)によって承認された。
1. 肝細胞の単離
- 準備
- 肝細胞単離の数日前に、 表1に記載の緩衝液及び細胞培養培地を調製した。手術が行われる場所の近くで温度を37°Cに設定したウォーターバスを設置します。
- 肝細胞単離の日に、層流フードの下で、35mLの緩衝液1を滅菌50mL遠沈管に、70mLの緩衝液2を100mLの滅菌ビーカーまたはボトルに移す。
- 抗生物質ゲンタマイシン(50μg/mL)およびペニシリン/ストレプトマイシン(1x)を両方の緩衝液に加える。
- ステップ1.1.3で調製したバッファー2の20 mLを100 mm細胞培養皿に移し、氷上に置きます。
- 残りの50 mLのバッファー2を滅菌50 mL遠沈管に移す。抗生物質添加バッファー 1 および 2 を含む 50 mL チューブを 37 °C に設定したウォーターバスに入れ、灌流を開始する前に少なくとも 15 分間ウォームアップさせます。
注:セッションで複数の肝細胞単離を実施する場合は、それに応じて準備するために、バッファー1および2の抗生物質添加アリコートの数をスケールアップしてください。 - コラゲナーゼ溶液のアリコートを解凍し、氷の上に保ちます。
注:適切に保存すれば、調製から3週間以内に3回まで凍結および解凍し、使用したコラゲナーゼ溶液において酵素活性の有意な損失はない。 - 手術器具とペリスタルティックポンプを準備します。15mLの70%エタノールを循環させ、続いて15mLの滅菌水を循環させることによって、蠕動ポンプのラインを滅菌する。
- 22Gの針を出口ラインに接続します(図1A)。カテーテルのくり抜かれたフィルターはコネクタとしてうまく機能します。ラインをバッファ 1 で満たし、ライン、コネクタ、およびニードルを調べて、気泡がトラップされていないことを確認します。
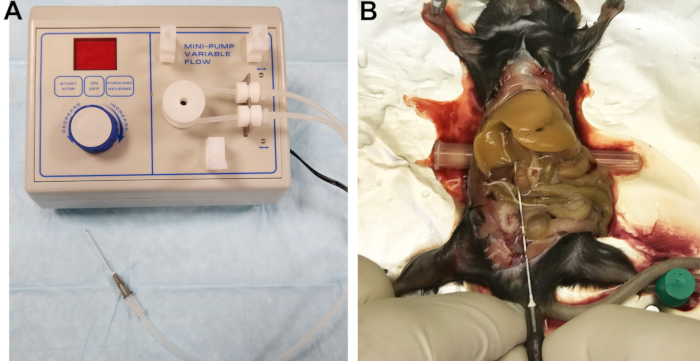
図1:灌流装置および灌流肝臓。 (A)肝臓をカニューレおよび灌流するために使用される針に接続された出口ラインを備えた蠕動ポンプ。(B)カニューレが成功したことは、肝臓の即時かつ均質なブランチングによって示される。 この図の拡大版を表示するには、ここをクリックしてください。
- 肝臓灌流と解離
- 医療グレードの空気をキャリアガスとしてイソフルラン吸入を介してマウスを麻酔し、誘導に4%イソフルランを使用し、麻酔を維持するために1.5%イソフルランを使用する。ペダル反射の損失を評価することによって麻酔の深さを確認する。
- つま先をつまんでも反応がない場合は、手術ボード上でマウスを仰臥位に置き、手足を伸ばしてピンでボードに固定します。
- マウスの腹部と胸部に70%エタノールを自由にスプレーします。
- 鉗子を使用して、腹部の基部付近の皮膚および腹壁を引き上げ、正中線の両側および横隔膜まで横方向に切断して、器官を露出させる。
- 腸を右側に動かし、肝臓の葉を静かに上にひっくり返して、下大静脈(IVC)を露出させます。ニードルキャップなどの小さな円筒形の物体をマウスの背面の下に挿入して、IVCをわずかに傾け、カニューレを容易にします(図1B)。
- ポンプを最低速度で始動し、バッファー 1 が流れている状態で、IVC に針を挿入します。
- 門脈を切断して圧力を緩和し、血液および灌流緩衝液の排液を可能にし、直ちに流量を7mL/minに増加させる。正しく行うと、肝臓は数秒以内に均一にブランチします(図1B)。
- より一貫した結果を得るには、灌流の全期間にわたって針を手で所定の位置に保持します。
- 温かいバッファー1で肝臓を灌流します。気泡の導入を避けるため、バッファー 1 を含むチューブに挿入されたラインが連続的に水没したままであることを確認してください。
- 灌流が発生している間、130 μLのコラゲナーゼ溶液をバッファー2に加え、上下にピペッティングするか、5 mLまたは10 mLの血清学的ピペットで攪拌して混合する。
- バッファー 1 を含むチューブ内の容量が約 5 mL に減少したら、チューブの側面にピペッティングしてバッファー 1 にバッファー 2 をゆっくりと加えます。目標は、バッファ 1 からバッファ 2 に変更している間にラインに気泡が導入されないようにすることです。
- 容量が再び5 mLに減少するまで待ってから、さらに5 mLのバッファー2をゆっくりと加えます。もう一度繰り返します。バッファー 2 がバッファー 1 に置き換わり、解離が始まると、肝臓が腫れ上がります。
- 残りのバッファー 2 を、最初にバッファー 1 が入っていたチューブに追加します。チューブ内に約5〜10mLのバッファー2が残っている場合は、灌流を停止します。
注:バッファ2が肝臓を灌流している間、門脈は鉗子で断続的に5秒間クランプすることができます。このステップは任意であるが、肝臓全体にわたる圧力の結果生じる増加は、その解離を改善し、したがって、最終的な肝細胞収率を改善することができる。 - 肝臓を慎重に切除し、ステップ1.1.4で確保した20mLの氷冷バッファー2を含む100mm培養皿に移す。
- 層流フードの下で、外科用はさみとピンセットを使用して肝臓を静かに分解します。
- 約20mLの氷冷M199を肝細胞懸濁液に加え、シリンジのプランジャーを用いて100μmの細胞ストレーナーを通して濾過し、より大きな肝臓片からの追加の肝細胞の放出を穏やかに促進する。
- 100 mm培養皿とセルストレーナーを追加のM199で、収集チューブがいっぱいになるまで洗浄します。
- 懸濁液を50 x g で4°Cで2分間遠心分離する。 上清を注意深く吸引し、肝細胞ペレットを渦巻いて30mLの冷たいM199に穏やかに再懸濁する。
- ステップ1.2.18で述べたように肝細胞をペレット化する。洗濯をもう一度繰り返します。
- 肝細胞を10mLの温かいM199に再懸濁し、トリパンブルー排除法および血球計数器12を用いて生存率および収量を決定する。
- 37°Cに加温したM199中の細胞を終濃度1.0 x106 生細胞/mLに希釈し、直ちにアッセイを開始する。
2. 脂肪酸β酸化測定法
注:アッセイは3連で行われ、各反応混合物は750,000細胞、1.35 mg/mLウシ血清アルブミン(BSA)、100 μMパルミチン酸、および0.4 μCi[1-14C]パルミチン酸を最終容量2mLで含む。
警告: 放射性化合物は危険です。放射性物質の購入、取り扱い、保管、廃棄は、制度、州、連邦の規制に従って行う。
- 準備
- アッセイの数日前に、パルミチン酸およびBSA溶液(表1)を調製し、それらを-20°Cで保存する。
- アッセイの日に、肝臓灌流を開始する前にステップ2.1.3〜2.1.9を完了する。
- パルミチン酸とBSA溶液を解凍する。表2に示す典型的なアッセイセットアップを用いて、20%〜30%過剰を加えた複数の反応のための基質混合物を調製 する。
- 微量遠心管内の反応ごとに13.5 μLのBSA溶液をアリコートし、41°Cに加温し、次いで1反応あたり1 μLの200 mMパルミチン酸溶液(BSA:パルミチン酸モル比= 1:5)を加える。
注:放射性および非放射性パルミチン酸溶液などの有機溶媒を使用して調製した溶液を、正の置換ピペットおよび適切なチップで分配することが好ましい。 - 渦を激しく、そして可溶性パルミチン酸の形成を促進するために41°Cでインキュベートする:BSA複合体。潜伏期間中に時折渦。
- 混合物は最初は白濁して見えるが、41°Cで20〜30分のインキュベーション後に完全に透明になる。 反応を開始する準備ができるまで41°Cに保ちます。
- 1.5 mL マイクロ遠心チューブに 133 μL の 1 M 過塩素酸をアリコートし、反応を停止しました。
警告: 過塩素酸は強酸であり、強酸化剤です。この化合物を取り扱うには適切な保護具が必要です。 - 反応ごとに485.5 μLのM199をチューブにアリコートし、37°Cに保ち、反応を開始する前にステップ2.1.4〜2.1.6で調製した放射性BSA:パルミチン酸複合体を希釈する。
- 750 μL の M199 をサンプルと同じ数の 14 mL 丸底チューブに分注します。所望により、ビヒクル対照を含む、エトモキβ、ロテノン、およびアンチマイシンなどの脂肪酸酸化の阻害剤を添加する(表2)。
- 肝細胞洗浄ステップの間、反応開始の10〜15分前に、ステップ2.1.9で調製したチューブを37°Cに設定した振とう水浴に移し、180〜200rpmで振とうした。
- 脂肪酸β酸化反応の開始、停止、分析
- 肝細胞の生存率が許容できる場合(典型的には75%、図2≥)、各反応について、0.8μLの[1-14C]パルミチン酸(0.5mCi/mL)を、清澄化されたBSA:パルミチン酸溶液を含む微量遠心管に移す(ステップ2.1.4-2.1.6)。渦を巻き込み、41°Cで水浴に戻る。
- 肝細胞を37°Cに平衡化し、阻害剤(存在する場合)と共にそれらをプレイインキュベートするために、最終的な肝細胞再懸濁液の直後に(ステップ1.2.21)、1mLピペットで750μLの肝細胞懸濁液を振とう水浴中の14mL丸底チューブのそれぞれに移し(ステップ2.1.9〜2.1.10)、低速で短時間渦を吹いて混合する。
- 各添加を30秒ずらし、15分間インキュベートする。タンパク質測定のためにサンプルを保存するには、肝細胞の別のアリコートを1.5mLの微量遠心チューブに移し、3,000 x gで5分間スピンします。
注:分注中、肝細胞懸濁液を連続的に旋回させるか、分注1 mLピペットで穏やかに攪拌して、沈降およびサンプル間での細胞数の大きな変動を防ぐ必要があります。 - 上清を取り出し、サンプル中のタンパク質の総量を測定する準備ができるまでペレットを-80°Cで保存し、結果を正規化した(図3)。
- 肝細胞が37°Cでプレイインキュベーションされている間、放射性BSA:パルミチン酸複合体を2.1.8の温培地に加え、反応を開始する準備ができるまで37°Cに保ちます。これが最終的な基質混合です。
- 反応を開始するには、肝細胞をウォーターバスから取り出し、500μLの基質混合物を加える。
- 低速で5秒間渦を巻き起こし、細胞を完全に再懸濁させ、水浴に戻す。すべてのサンプルで、30秒ずらして繰り返します。
- 15分間インキュベートする。一連の反応を開始し、直ちに停止し(ステップ2.2.10-2.2.11を参照)、バックグラウンド放射能を決定する(表2)。
- 残りの基質ミックスの重複アリコート(200〜250μL)を6mLシンチレーションバイアルに移し、カウントするために脇に置いておきます。これらのカウントを使用して、500 μLの基質混合物中の酸化に利用可能なパルミチン酸の総nmolesに対応する放射能を計算します。
- 反応を止めるには、水浴から肝細胞を取り出し、適度な速度でボルテックスすることによって肝細胞を再懸濁し、次いで400μLの肝細胞懸濁液を過塩素酸を含む微量遠心チューブに移す。
- すぐにチューブをキャップしてください。すべてのサンプルについてこのシーケンスを繰り返し、30秒ずらします。
- 1.5 mL の微量遠心チューブを激しく渦巻き、1.5 mL の微量遠心チューブを 13,000 x g で 10 分間スピンダウンします。
- 300 μLの上清を6 mLシンチレーションバイアルに移し、4 mLのシンチレーション液を加え、サンプルおよび基質混合アリコート中の放射能をシンチレーションカウンターでカウントする(ステップ2.2.9)。
警告: 遠心分離後、ヒュームフードの下でチューブを開き、脂肪酸β酸化によって生成し、酸性条件によって放出される 14 C-アセチル-CoA の完全な酸化によって生成される 14C-Co2 を呼吸しないようにします。
| バッファ/メディアコンポーネント | 量 | 最終濃度 | 指示 |
| ソリューション C | |||
| ティッカー | 1.79グラム | 480ミリアンペア月間 | 50mLに水を加える。 4°Cで保存 |
| MgSO4 七水和物 | 1.48グラム | 120ミリアンペア月間 | |
| KH2PO4 | 0.81グラム | 119ミリオンメートル | |
| クレブスヘンゼライトバッファー(KHB)、カルシウムフリー | |||
| ナクル | 7.0グラム | 120ミリアンペア月間 | 900 mLに水を加え、pHを7.4に調整し、最終容量を1 Lにします。 |
| NaHCO3 | 2.0グラム | 24ミリオン | |
| 1 M ヘップス pH 7.45 | 5キロリットル | 5ミリオン | |
| グルコース | 1 または 2 g | 5.6 または 11 mM | |
| ソリューション C | 10ミリリットル | ||
| バッファー 1 | |||
| ティッカー | 500キロリットル | 成分を混合し、フィルター滅菌します。4°Cで保存 | |
| 50 ミリグラム EGTA | 1.0キロリットル | 0.1 ミリアンペア時 | |
| バッファ 2 | |||
| ティッカー | 500キロリットル | 成分を混合し、フィルター滅菌します。4°Cで保存 | |
| 1 M CaCl2 二水和物 | 686 μL | 1.4ミリアンペア時 | |
| ゲンタマイシン溶液 | |||
| ゲンタマイシン硫酸塩 | 0.5グラム | 50 ミリグラム/ミリリットル | 10mLに水を加え、フィルター滅菌する。アリコートと-20°Cで保存 |
| コラゲナーゼ溶液 | |||
| コラゲナーゼIおよびIIブレンド | 10 ミリグラム | 7ミリグラム/mL | バイアルの全内容物を1.43mLの水に溶解する。 アリコートと-20°Cで保存 |
| M199 · | |||
| M199 · | 1ポーチ | 900mLに水を加え、pHを7.2〜7.4に調整する。最終容量を1Lにし、フィルター滅菌します。4°Cで保存 | |
| NaHCO3 | 2.2グラム | 26ミリオンメートル | |
| 1 M HEPES(細胞培養グレード) | 25ミリリットル | 25ミリオンメートル | |
| 余分なグルコース(給餌マウスのみ) | 1グラム | 11ミリオンメートル | |
| BSAソリューション | |||
| 脂肪酸フリーBSA | 400 ミリグラム | 20% (ワット/V) | 2mLの水に溶解する。 アリコートと-20°Cで保存 |
| 非放射性パルミチン酸溶液 | |||
| パルミチン酸 | 103 ミリグラム | 200ミリアンペア時 | 2mLのエタノールに溶解し、-20°Cで保存する |
| 1 M 過塩素酸 | |||
| 70% 過塩素酸 | 3.5ミリリットル | 1 M | 水で40mLに希釈する。室温で保存する |
表1:肝細胞単離および脂肪酸β酸化アッセイに必要な緩衝液、培地、およびその他の溶液
| 反応数 | M199±阻害剤 | 肝細胞懸濁液(μL) | 基質ミックス (μL) | ||||
| 容量 (μL) | エトモキシル | ||||||
| 1 | 750 | - | 37°Cで予温 | 750 | 37°Cで15分間プレインキュベート | 500 | 37°Cで15分間インキュベートする |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | すぐに停止する | |||||
| 8 | |||||||
| 9 | |||||||
表2:エトモキシルの存在下および非存在下で三連でアッセイされた肝細胞懸濁液についての実験セットアップの例。
結果
ここで説明する肝臓灌流は、トリパンブルー排除によって推定されるように、典型的には3000万〜4000万個の細胞/肝臓を生じ、平均生存率は80%である(図2)。灌流バッファー 1 および 2 の調製に使用される Krebs-Henseleit バッファー (KHB) 中のグルコースの典型的な濃度は 11 mM です。絶食マウスから単離した肝細胞における脂肪酸β酸化を測定する場合、KHB中のグルコース濃度?...
ディスカッション
肝臓灌流の間、気泡は肝臓内の微小毛細血管を遮断し、緩衝循環を防止または制限し、肝細胞の収量および生存率を全体的に低下させるので、気泡の導入を避けることが重要である20,21。IVCのカニューレ前にバッファーで満たされた入口ラインを綿密に検査し、バッファー1を含むチューブから入口ラインを持ち上げてバッファー2に切り替えること?...
開示事項
著者らは、開示する利益相反はありません。
謝辞
この研究は、国立衛生研究所がロベルタ・レオナルディに助成金R35GM119528を供与した。
資料
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
参考文献
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved