Method Article
Sul posto Visualizzazione delle dinamiche dei coni di crescita e crescita degli assoni in colture di fette di cervello embrionali ex vivo acute
In questo articolo
Riepilogo
Questo protocollo dimostra un metodo semplice e robusto per studiare la crescita degli assoni in situ e la dinamica dei coni di crescita. Descrive come preparare ex vivo fette di cervello acuto fisiologicamente rilevanti e fornisce una pipeline di analisi di facile utilizzo.
Abstract
Durante lo sviluppo neuronale, gli assoni navigano nell'ambiente corticale per raggiungere le loro destinazioni finali e stabilire connessioni sinaptiche. I coni di crescita - le strutture sensoriali situate sulle punte distali degli assoni in via di sviluppo - eseguono questo processo. Studiare la struttura e la dinamica del cono di crescita è fondamentale per comprendere lo sviluppo assonale e le interazioni con il sistema nervoso centrale circostante (SNC) che gli consentono di formare circuiti neurali. Ciò è essenziale quando si elaborano metodi per reintegrare gli assoni nei circuiti neurali a seguito di lesioni nella ricerca fondamentale e nei contesti pre-clinici. Finora, la comprensione generale della dinamica dei coni di crescita si basa principalmente su studi di neuroni coltivati in due dimensioni (2D). Sebbene indubbiamente fondamentale per l'attuale conoscenza delle dinamiche strutturali del cono di crescita e della risposta agli stimoli, gli studi 2D travisano l'ambiente fisiologico tridimensionale (3D) incontrato dai coni di crescita neuronale nel tessuto del SNC intatto. Più recentemente, i gel di collagene sono stati impiegati per superare alcune di queste limitazioni, consentendo lo studio dello sviluppo neuronale in 3D. Tuttavia, sia gli ambienti sintetici 2D che 3D mancano di segnali di segnalazione all'interno del tessuto del SNC, che dirigono l'estensione e il pathfinding degli assoni in via di sviluppo. Questo protocollo fornisce un metodo per studiare assoni e coni di crescita utilizzando fette di cervello organotipiche, in cui gli assoni in via di sviluppo incontrano segnali fisici e chimici fisiologicamente rilevanti. Combinando l'elettroporazione fine messa a punto in utero ed ex utero per fornire scarsamente reporter fluorescenti insieme alla microscopia a super-risoluzione, questo protocollo presenta una pipeline metodologica per la visualizzazione delle dinamiche degli assoni e dei coni di crescita in situ. Inoltre, è inclusa una descrizione dettagliata del toolkit dell'analisi dei dati di imaging a lungo termine e delle cellule vive.
Introduzione
I neuroni sono cellule altamente polarizzate che rappresentano l'unità computazionale di base nel sistema nervoso. Ricevono ed emettono informazioni che si basano sulla compartimentazione dei siti di input e output: dendriti e assoni, rispettivamente1. Durante lo sviluppo, gli assoni si estendono mentre navigano in un ambiente incredibilmente complesso per raggiungere la loro destinazione. La navigazione degli assoni è guidata dal cono di crescita, una struttura sensoriale situata sulla punta dell'assone in via di sviluppo. Il cono di crescita è responsabile della rilevazione dei segnali ambientali e della loro traduzione nella riorganizzazione spaziale dinamica del suo citoscheletro 2,3. Le reazioni morfo-meccaniche risultanti istruiscono il cono di crescita a estendersi o ritrarsi dal segnale scatenante, portando a specifiche manovre assonali.
L'attuale comprensione dell'estensione degli assoni e della dinamica dei coni di crescita deriva da studi che valutano la crescita degli assoni su substrati bidimensionali (2D) 2,4,5,6,7. Questi studi pionieristici hanno identificato una sofisticata interazione tra coni di crescita e substrati di crescita e hanno rivelato differenze sorprendenti dipendenti dalle caratteristiche del substrato come adesività e rigidità 8,9. Guidati da queste intuizioni, sono stati ipotizzati segnali ambientali extracellulari per dettare la crescita degli assoni, con il citoscheletro del cono di crescita che esegue questa crescita 2,10,11,12. In particolare, i neuroni possono estendere gli assoni in substrati non adesivi (ad esempio, poli-lisina, poli-ornitina)13. Inoltre, la rigidità del substrato può influenzare il tasso di crescita degli assoni indipendentemente dai complessi adesivi cellulari8. Quindi, lo studio della dinamica dei coni di crescita nei substrati 2D da solo non può modellare con precisione l'equilibrio delle forze che derivano dall'interazione dei coni di crescita assonali con ambienti tridimensionali (3D) fisiologicamente rilevanti, come quelli trovati in vivo.
Per superare i limiti dei saggi 2D, la crescita degli assoni e la dinamica dei coni di crescita sono state studiate in matrici 3D 8,9. Queste matrici pongono un contesto più fisiologico ma consentono di studiare i meccanismi intrinseci delle cellule della crescita degli assoni. Consente l'esame del cono di crescita in modo monocellulare in una varietà di condizioni e trattamenti farmacologici9. In tali ambienti 3D, gli assoni mostravano dinamiche citoscheletriche distinte e crescevano più velocemente di quelli osservati nei neuroni coltivati in 2D9. Questi eleganti studi hanno dimostrato l'influenza di una dimensione extra sulla riorganizzazione del citoscheletro del cono di crescita e, di conseguenza, sul suo comportamento.
Nonostante gli apparenti vantaggi presentati dalle matrici 3D rispetto alle superfici 2D nel supportare lo sviluppo neuronale nativo e la crescita degli assoni, rimangono un'impalcatura sintetica semplificata che non può riflettere la complessità delle dinamiche osservate nel tessuto del sistema nervoso centrale (SNC). Qui, la consegna di plasmidi reporter per elettroporazione ex utero e in utero è stata combinata con la coltura di fette organotipiche del cervello e l'imaging in situ dal vivo a super-risoluzione per analizzare le dinamiche del cono di crescita all'interno di un contesto fisiologico. Questa metodologia consente la visualizzazione degli assoni in via di sviluppo mentre si sperimenta la 3-dimensionalità degli ambienti in vivo e la complessità della sua composizione fisico-chimica. Infine, vengono descritte procedure user-friendly per misurare la crescita degli assoni e le dinamiche dei coni di crescita utilizzando software comunemente concesso in licenza e disponibile pubblicamente.
Protocollo
Gli esperimenti sugli animali devono essere conformi alle normative istituzionali e federali pertinenti. In questo protocollo sono stati utilizzati topi femmina C57BL/6JRj gravidi al giorno embrionale 15,5 e 12,5 (E15,5 ed E12,5). Gli esperimenti sono stati condotti in conformità con la legge sul benessere degli animali dell'Agenzia statale per l'ambiente della Renania settentrionale-Vestfalia (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV)).
1. Preparazione di plasmidi per iniezione
- Isolare il DNA utilizzando il kit Maxiprep privo di endotossine secondo il protocollo del produttore (vedi Tabella dei materiali).
- Mescolare il DNA selezionato alla concentrazione desiderata (Tabella 1) e la soluzione Fast Green al 10% (vedere Tabella dei materiali) per visualizzare la consegna della miscela di DNA nei ventricoli cerebrali.
NOTA: Plasmidi specifici sono stati utilizzati per l'etichettatura sparsa dei neuroni corticali (Figura 1A), delle strutture di actina filamentosa (F-actina) nel cono di crescita (Figura 1B) e della doppia etichettatura dei coni di crescita all'interno della stessa corteccia (Figura 1C). Tutti i plasmidi (Tabella 1) utilizzati in questo protocollo sono stati depositati in Addgene (vedi Tabella dei Materiali). - Preparare i capillari di vetro utilizzando un set di estrattori di elettrodi capillari secondo il seguente programma: pressione: 500, calore: 800, trazione: 30 e velocità: 40.
- Caricare 15 μL di miscela DNA/Fast Green in ogni capillare di vetro utilizzando le punte delle pipette del micro caricatore.
NOTA: assicurarsi che non si formino bolle. - Conservare i capillari pieni di DNA in un piatto di 10 cm con un pezzo di argilla modellante attraverso il diametro del piatto. I capillari possono essere caricati e conservati a 4 °C il giorno prima dell'esperimento. Sigillare l'estremità posteriore del capillare con un film flessibile per evitare l'essiccazione.
2. Preparazione delle soluzioni
- Preparare la soluzione salina tamponata di Hank-integrata con glucosio (HBSS-G).
- Aggiungere lo 0,5% di 20% di brodo di glucosio a una bottiglia di 1x HBSS. Mescolare bene e conservare a 4 °C per un massimo di 2 settimane. Per l'estrazione dell'embrione, soluzione a bolle HBSS-G con carbogeno (95% O2 e 5% CO2) utilizzando pietra gorgogliante poco prima della raccolta degli embrioni.
- Soluzione Slice Media
- Preparare una fetta fresca contenente Neurobasal 1x, siero di cavallo al 5%, siero di vitello fetale al 5%, integratore B27 1:50, integratore di L-glutamino 1:400, penicillina-streptomicina 1:200 e integratore di Neuropan-2 1:100 (a pH = 7,3), in condizioni sterili (vedi Tabella dei materiali).
- Preparare piatti da 3 cm con 1 mL di affettati ciascuno. Mettere nell'incubatore a 35 °C con il 5% di CO2 per almeno 1 ora prima dell'esperimento per equilibrare il pH del fluido attraverso lo scambio gassoso.
NOTA: l'equilibrio del pH del fluido è causato dall'acidificazione del mezzo da parte della CO2 dell'incubatore. I supporti slice possono essere conservati a 4 °C per un massimo di 1 settimana.
- Soluzione di agarosio a basso punto di fusione (3%)
- Pesare la quantità desiderata di polvere di agarosio a basso punto di fusione e sciogliere in un volume appropriato di 1x HBSS-G in una bottiglia di vetro. Sono necessari circa 7 mL di soluzione di agarosio per cervello.
- Mettere la bottiglia in un forno a microonde per 2-3 minuti, con il tappo posizionato liberamente, e agitare ogni 10-20 s.
- Una volta che la polvere si è completamente dissolta, mettere la bottiglia a bagnomaria o in un bagno di perline impostato a 37 °C almeno 1 ora prima dell'esperimento per consentire all'agarosio di raffreddarsi.
NOTA: Si consiglia di riscaldare l'agarosio due volte nell'arco di 15 minuti per assicurarsi che la polvere di agarosio sia sciolta. Questo è fondamentale per la corretta adesione dell'agarosio al tessuto cerebrale. Un termometro dovrebbe essere usato per misurare la temperatura della soluzione di agarosio mentre incorpora i cervelli, assicurandosi che sia compresa tra 37-40 °C. I cervelli di animali di età diversa hanno una rigidità diversa. Si raccomanda di testare una gamma di concentrazioni di agarosio per trovare omogeneità tra tessuto e agarosio. - Preparare soluzione salina tamponata con fosfato con 0,3% Triton X-100 (PBS-T).
- Preparare soluzione salina tamponata con fosfato con azide di sodio allo 0,2% (PBS-NaN3).
NOTA: le soluzioni descritte nei passaggi 2.4-2.5 devono essere utilizzate nella fase successiva di immunoistochimica.
3. Preparazione della stazione chirurgica
- Pulire la stazione chirurgica con etanolo al 70%-96% e posizionare il sottofondo operativo sulla superficie della stazione.
- Sterilizzare gli strumenti chirurgici risciacquando con etanolo al 70%-96%, seguito da sterilizzazione a secco in uno sterilizzatore a caldo.
- Pulire gli elettrodi della pinzetta di platino (vedere Tabella dei materiali) con etanolo al 70% -96% prima di collegarsi al generatore di impulsi.
- Inserire un capillare di vetro riempito di DNA/Fast Green nel supporto capillare. Immediatamente prima dell'uso, rompere delicatamente la punta capillare usando forbici fini e il flusso della soluzione di prova all'interno di un tubo microcentrifuga da 1,5 ml riempito con soluzione salina o acqua preriscaldata.
NOTA: La Figura 2A,B mostra la configurazione della stazione chirurgica e gli strumenti utilizzati per l'elettroporazione ex utero (EUE) e l'elettroporazione in utero (IUE). - Per IUE, riscaldare la soluzione salina a 37 °C a bagnomaria.
4. Estrazione dell'embrione
- Mettere il topo in gravidanza nella camera di induzione dell'anestesia con il 5% di isoflurano fino a quando il topo non è profondamente anestetizzato. Confermare l'anestesia dall'assenza di riflesso di astinenza del pedale.
- Trasferire il mouse in un sottofondo operativo e mantenere l'isoflurano all'1,5%-2% attraverso un cono nasale.
- Applicare un unguento su entrambi gli occhi per prevenire l'essiccazione corneale.
- Rasare l'addome del topo e quindi utilizzare una garza imbevuta di etanolo al 70% -96% per rimuovere i capelli rasati. Pulire l'area con betadine.
- Usando piccole forbici chirurgiche sterili, fai un'incisione cutanea di 2 cm lungo la linea mediana addominale, seguita da un'incisione muscolare di 1,5 cm.
NOTA: la dimensione dell'incisione dipende dalla dimensione dell'embrione. In effetti, gli embrioni più grandi richiederanno un'incisione più grande per ospitare la loro estrazione. - Tagliare un foro al centro della garza sufficientemente largo da adattarsi all'incisione cutanea (~ 2 cm di diametro), immergerlo con soluzione salina calda e posizionarlo attorno all'apertura addominale.
- Estrarre entrambe le corna uterine usando un batuffolo di cotone imbevuto di soluzione salina calda o usando una pinza, afferrando con cura gli spazi tra gli embrioni per estrarli. Posizionare gli embrioni su una garza bagnata (Figura 2C).
NOTA: Anche un piccolo danno ai vasi sanguigni e ai capillari intorno alle corna uterine probabilmente si tradurrà in un sanguinamento abbondante. Pertanto, evitare la manipolazione diretta di queste aree vascolarizzate in ogni momento. - Tagliare il sacco uterino e rimuovere ogni embrione (Figura 2D).
- Eutanasia di ogni embrione immediatamente dopo l'estrazione tramite un taglio diagonale discendente, assicurando la completa traslazione del midollo spinale (Figura 2E).
- Mettere gli embrioni in un piatto di 10 cm contenente HBSS-G sul ghiaccio.
NOTA: La decapitazione dell'embrione viene evitata per prevenire la fuoriuscita di miscela DNA/Fast Green dal cervello e facilitare il facile posizionamento dell'embrione nel supporto (vedere elettroporazione ex utero , fase 5). - Sacrificare la madre subito dopo l'estrazione degli embrioni eseguendo la lussazione cervicale.
NOTA: Qui, la madre viene sottoposta a eutanasia in anestesia per risparmiarla da ulteriori dolori o sofferenze post-procedura in conformità con il protocollo approvato dall'Animal Welfare Act dell'Agenzia ambientale statale del Nord Reno-Westfalia (LANUV).
5. Elettroporazione ex utero (EUE)
- Prendi un embrione e mettilo nel supporto.
NOTA: una punta di pipetta tagliata da 1 mL attaccata all'estremità di un raschietto cellulare viene utilizzata come porta embrioni. È essenziale tenere le braccia degli embrioni al di fuori della punta durante la procedura per evitare che scivolino nella punta (Figura 2F-I). Il diametro della punta della pipetta è facilmente regolabile per ospitare embrioni di varie dimensioni. Tagliare una seconda punta a lunghezza in cui il diametro della punta corrisponde alle dimensioni dell'embrione e utilizzarla come inserto adattatore al supporto sopra menzionato. - Inserire con attenzione il capillare di vetro riempito di DNA/Fast Green attraverso il cranio dell'embrione nel ventricolo laterale e iniettare 2-3 μL di miscela di plasmidi del DNA (Figura 1A,B; Tabella 1) in ciascun ventricolo (Figura 2F).
NOTA: Utilizzare le suture lambdoidali e sagittali come guida per la posizione dell'iniezione di DNA. Le suture lambdoidali e sagittali sono articolazioni fibrose che collegano la piastra ossea del cranio. Il primo unisce l'osso parietale con l'osso occipitale, e il secondo si unisce alle due ossa parietali. - Tenere la testa dell'embrione tra gli elettrodi della pinzetta di platino all'angolo appropriato per colpire l'area cerebrale desiderata (angolo di 60 ° in questo caso), con il catodo rivolto verso l'area in cui è previsto il trasferimento del DNA (Figura 2G-H).
- Applicare cinque impulsi a 30 mV con un intervallo di 1 s e una durata di 50 ms utilizzando un generatore di impulsi a onda quadra.
NOTA: Tieni presente che i cervelli in EUE sperimentano un campo elettrico più efficace di quelli in IUE. Pertanto, a una data concentrazione di DNA, l'EUE si traduce in una maggiore efficienza del trasferimento del DNA rispetto all'IUE e le concentrazioni di DNA devono essere regolate di conseguenza. - Se si desidera un'elettroporazione bilaterale, ripetere i passaggi 5.3-5.4 con il catodo e l'anodo che rispecchiano la posizione precedente per colpire la corteccia controlaterale.
NOTA: Poiché entrambi i ventricoli sono stati iniettati con DNA, le cortecce di entrambi gli emisferi sono state prese di mira. - Posizionare l'embrione elettroporato in un piatto di 6 cm contenente HBSS-G ghiacciato. Ripetere i passaggi 5.1-5.6 per tutti gli embrioni richiesti.
6. Elettroporazione in utero (IUE)
- Iniettare il topo in gravidanza con analgesico; 50 μL di buprenorfina (0,1 mg/kg) (vedere Tabella dei materiali) per via sottocutanea, 20 minuti prima della procedura.
- Eseguire i passaggi 4.1-4.8 dalla sezione di estrazione dell'embrione.
NOTA: Evitare di lasciare gli embrioni esposti inutilmente coprendoli con una garza sterile imbevuta di soluzione salina calda. - Usando la punta delle dita, ruotare delicatamente l'embrione all'interno dell'utero fino a quando non si trovano le suture lambdoidali e sagittali (Figura 2J). Inserire con attenzione il capillare di vetro DNA/Fast Green attraverso la parete uterina e il cranio dell'embrione nel ventricolo laterale e iniettare 2-3 μL di miscela di plasmidi del DNA (Figura 1A,C) in uno o entrambi i ventricoli come desiderato (Figura 2K-L).
NOTA: un'eccessiva pressione delle dita sulle corna uterine potrebbe portare al collasso del sacco amniotico. - Tenere la testa dell'embrione tra gli elettrodi della pinzetta di platino all'angolo appropriato per colpire l'area cerebrale desiderata (angolo di 60 ° in questo caso), con il catodo rivolto verso l'area in cui è previsto il trasferimento del DNA. Evitare di spremere l'utero poiché potrebbe causare il collasso del sacco amniotico (Figura 2M).
- Applicare cinque impulsi a 35 mV con un intervallo di 600 ms e una durata di 50 ms utilizzando un generatore di impulsi a onda quadra.
- Se sono stati iniettati entrambi i ventricoli laterali, ripetere i passaggi 6,5-6,6 con il catodo e l'anodo che rispecchiano la posizione precedente per colpire la corteccia controlaterale.
- Ripetere i passaggi 6.3-6.6 per tutti gli embrioni richiesti.
- Una volta che tutti gli embrioni richiesti sono stati elettroporati, utilizzare un batuffolo di cotone imbevuto di soluzione salina per posizionare delicatamente le corna uterine all'interno della cavità addominale.
NOTA: L'aggiunta di soluzione salina nella cavità peritoneale aiuterà le corna uterine a tornare in posizione. - Sutura di incisioni muscolari e cutanee utilizzando materiale di sutura 5-0. Utilizzare clip di sutura per fissare la ferita e disinfettare la ferita di sutura spruzzandola con betadine (Figura 2N-P).
- Iniettare il topo con 200 μL di glucosio al 5% per via sottocutanea.
- Iniettare il topo con un antibiotico; 50 μL di enrofloxacina (5 mg/kg) per via sottocutanea (vedere Tabella dei materiali).
- Riposizionare il mouse nella gabbia di recupero e mantenere il calore utilizzando una luce riscaldante a infrarossi lontani o una piastra riscaldante per almeno 20 minuti dopo la procedura (Figura 2Q).
- Monitorare il mouse ogni giorno e iniettare meloxicam dopo la procedura per alleviare il dolore seguendo le linee guida istituzionali e federali.
- Estrarre gli embrioni 2 giorni dopo la procedura (cioè E17.5) dopo la fase 4.
7. Estrazione del cervello e incorporamento nell'agarosio
NOTA: Si consiglia di eseguire i seguenti passaggi al microscopio a dissezione per una migliore precisione. Evitare danni al cervello è fondamentale per il successo della procedura.
- Installare gli strumenti di estrazione in uno spazio di lavoro sterile sotto una cappa di dissezione (Figura 3A).
- Separare la testa di un embrione dal resto del corpo usando le forbici per dissezione.
- Fissare la testa come mostrato nella Figura 3C, quindi rimuovere la pelle e il cranio tagliando lungo la linea mediana, partendo dalla base della testa verso il naso (Figura 3D).
- Sbucciare la pelle e il cranio lateralmente, creando uno spazio abbastanza grande (~ 1 cm) per l'asportazione del cervello.
- Per rimuovere il cervello, inserire la punta chiusa delle forbici da dissezione sterili, partendo da sotto il bulbo olfattivo che si muove verso il tronco cerebrale (Figura 3E).
- Tagliare il tronco cerebrale e tagliare eventuali pezzi sciolti di meningi intorno al cervello (Figura 3F).
NOTA: Le meningi sciolte spesso fanno sì che le fette rimangano attaccate al blocco di agarosio dopo il taglio, portando al distacco del tessuto dall'agarosio durante la raccolta delle fette. - Ripeti i passaggi 7.1-7.6 per tutti gli embrioni e mantieni il cervello sul ghiaccio (idealmente non più di 30 minuti) fino alla fase di incorporamento.
NOTA: I seguenti passaggi 7.7.1-7.7.4 si riferiscono all'estrazione cerebrale di cervelli E12.5.- Isolare la parte superiore della testa appena sotto l'occhio, come mostrato nella Figura 3G.
- Tagliare la pelle e il cranio sulla parte superiore del tronco cerebrale, seguendo la linea tratteggiata come mostrato nella Figura 3H, senza rimuovere il tronco cerebrale.
- Praticare un'incisione pelle-cranio di 2 mm nella parte posteriore della testa, come mostrato nella Figura 3I (vedere i disegni per chiarezza).
NOTA: Questa incisione fornisce punti di presa iniziali per staccare gli strati di pelle e cranio. In genere, si staccano come uno strato. La dimensione tipica dell'incisione è di 2 mm, corrispondente alla lunghezza del tagliente delle forbici a micro molla utilizzate. - Inizia a staccare gli strati di pelle-cranio fissando un lato dell'incisione e tirando attentamente l'altro. Con la stessa cura, finalizzare staccando la base della testa fino a liberare il cervello (Figura 3J).
NOTA: Questo deve essere fatto con grande cura, osservando che il cervello non viene tirato lungo gli strati di tessuto. Lati alternati per rimuovere il tessuto che copre il cervello.
- Versare l'agarosio tiepido (a 37-40 °C) in un piatto di 3 cm.
- Raccogli il cervello usando un cucchiaio perforato e rimuovi il liquido in eccesso tamponando il fondo del cucchiaio contro la carta velina secca. Metti il cervello in un piatto di agarosio.
NOTA: È essenziale rimuovere il più possibile il liquido da tutto il cervello per consentire una migliore adesione dell'agarosio al tessuto. - Mettere il piatto con agarosio liquido su ghiaccio. Usando un cucchiaio più piccolo, mescolare l'agarosio per 10 s per un raffreddamento uniforme. Manovra il cervello al centro del piatto. Posizionare il cervello orizzontalmente nel piatto con il lato dorsale verso l'alto, assicurandosi che sia completamente coperto di agarosio da tutte le direzioni (Figura 3K).
NOTA: I cervelli spesso affondano sul fondo del piatto una volta posti in agarosio; sollevare il cervello usando un cucchiaino fino a quando non viene stabilito uno spazio di 1-2 mm sotto il cervello. - Ripeti i passaggi 7.8-7.10 per tutti i cervelli.
- Una volta che l'agarosio ha polimerizzato, aggiungere 500 μL di HBSS-G sopra il blocco di agarosio per evitare l'essiccazione. Quindi, coprire il piatto con ghiaccio.
NOTA: Tenere il campione sul ghiaccio per 5 minuti prima del sezionamento per consentire alla temperatura cerebrale di raggiungere i 4 °C.
8. Coltura di fette organotipiche
NOTA: Pulire il vibratoma e le superfici circostanti con etanolo al 70%-96% per evitare la contaminazione delle fette. La configurazione della postazione di lavoro a vibratome (vedi Tabella dei materiali) è mostrata nella Figura 3B.
- Riempire il vassoio tampone del vibratome con HBSS-G freddo e il vassoio esterno con ghiaccio per mantenere l'HBSS-G freddo durante tutta la procedura.
- Fornire continuamente HBSS-G nel vassoio tampone con carbogen utilizzando una pietra gorgogliante.
- Usando una lama fresca, fai un taglio grande (~ 2 x 2 cm) intorno al cervello e rimuovi un blocco di agarosio contenente il cervello, con abbastanza agarosio circostante per tagliare l'agarosio in un piccolo blocco rettangolare.
NOTA: Questo passaggio consente di regolare l'angolo del blocco in modo che l'asse sagittale del cervello sia perpendicolare alla piastra vibratome e l'asse coronale si allinei parallelamente alla lama. Lasciare circa 5 mm di agarosio sul lato dorsale del cervello per una facile manipolazione delle fette. - Posizionare una piccola goccia di supercolla senza solventi adesivi rapidi al centro del portacampioni e distribuire in un'area che coprirà il fondo del blocco di agarosio.
- Raccogliere delicatamente il blocco di agarosio e asciugare il fondo tamponando la carta velina. Posizionare il blocco sull'area incollata del supporto del campione, con il lato rostrale del cervello verso l'alto. Mettere il portacampioni sul ghiaccio e lasciare asciugare la colla per 1 minuto.
- Una volta che la colla si è asciugata, posizionare il portacampioni nel vassoio tampone.
- Tagliare il cervello a fette coronali con un angolo di 15°.
NOTA: lo spessore delle fette può variare a seconda dell'applicazione. Qui, i cervelli sono stati tagliati a uno spessore di 150 μm. Impostare la velocità del vibratomo su 1,0-1,5 mm / s per tagliare l'agarosio in eccesso sulla parte superiore e tagliare le lampadine olfattive. Ridurre la velocità di taglio a 0,5 mm/s per la raccolta di fette corticali per l'analisi. La maggior parte dei vibratomi può essere messa in pausa per raccogliere ogni fetta. Se si verifica una qualità ridotta delle fette o il distacco del tessuto dall'agarosio, ridurre la velocità di taglio o sostituire la lama del vibratoma può aiutare. - Usando spatole pulite, raccogliere le fette di cervello e posizionarle sulla membrana di politetrafluoroetilene (PTFE), immobilizzate in un piatto con fondo di vetro da 35 mm usando paraffina (fino a cinque fette di cervello / membrana) (Figura 3L-M).
NOTA: Fissare la membrana in PTFE all'interno di un piatto con fondo di vetro da 35 mm con cera. Ciò stabilizzerà la membrana quando si aggiunge il terreno di coltura della fetta e anche durante l'imaging. - Utilizzando una pipetta da 200 μL, rimuovere l'eccesso di HBSS-G da intorno alle fette sulla membrana in PTFE, lasciando le fette semi-asciutte.
- Aggiungere 500 μL di slice media (preriscaldati a 35 °C) direttamente nello spazio sotto la membrana in PTFE.
NOTA: non devono formarsi bolle sotto la membrana quando si aggiunge il supporto. Ciò lascerà fette intere o parziali senza scambio di media. Sostituire 200 μL di supporti ogni 2 giorni in coltura o dopo ogni sessione di imaging. - Incubare le fette a 35 °C con il 5% di CO2.
9. Immunoistochimica
- Fissare le fette con 1 mL di paraformaldeide al 4% (PFA) - integrato con il 4% di saccarosio per piatto. Incubare a RT per 30 min.
ATTENZIONE: Quando si maneggia PFA, indossare un camice da laboratorio e guanti. Eseguire le fasi di fissaggio sotto un cappuccio chimico e smaltire i rifiuti di PFA in modo appropriato. - Lavare le fette due volte con PBS da 300 μL per 5 min. Trasferire le fette in un piatto a 24 pozzetti.
NOTA: l'esperimento può essere sospeso in questa fase. Aggiungere PBS-NaN3 alle fette e conservare a 4 °C. NaN3 è un composto tossico; quando si maneggiano soluzioni con esso, indossare un cappotto da laboratorio e guanti. I passaggi 9.3-9.10 devono essere eseguiti in uno shaker orbitale. - Spegnere le fette con 300 μL di glicina 0,1 M a 4 °C durante la notte.
- Lavare la glicina con PBS a RT 3x per 10 min.
- Permeabilizzare le fette con 300 μL di PBS-T a RT per 2 h.
- Blocco con siero di capra al 10% in PBS-T a RT per 2 ore.
- Aggiungere 300 μL di anticorpo primario (anticorpo antivimentina a una diluizione di 1:200; vedere Tabella dei materiali) diluito in siero di capra al 10% in soluzione di PBS-T a 4 °C durante la notte.
NOTA: nei passaggi 9.8-9.12, le fette sono state protette dalla luce per evitare la perdita di fluorescenza. - Lavare l'anticorpo primario con PBS a RT 3x per 20 min.
NOTA: PBS è stato utilizzato al posto di PBS-T per lavare Triton X-100. - Aggiungere 300 μL di anticorpo secondario (Alexa Fluor 488 o 647 a una diluizione di 1:400; vedere Tabella dei materiali) in PBS a RT per 2 ore.
NOTA: DAPI viene aggiunto immediatamente dopo aver rimosso l'anticorpo secondario ad una diluizione di 1:10.000 per 5 min. - Lavare l'anticorpo secondario con PBS a RT 3x per 20 min. Lavare con acqua distillata 2 volte per 1 min.
- Trasferire le fette in un vetrino con un pennello sottile, quindi asciugare a 30 °C per 20 minuti.
- Montare le fette usando un mezzo di montaggio acquoso. Mantieni le diapositive a RT durante la notte per la cura del supporto di montaggio.
10. Acquisizione di immagini
NOTA: Indipendentemente dall'approccio di consegna del DNA (IUE o EUE), le fette sono state analizzate nella stessa fascia di età evolutiva (E17.5-E18.5). IUE consente ai progenitori neuronali di dividersi e svilupparsi per altri due giorni in vivo. L'EUE, d'altra parte, consente il monitoraggio dei primi eventi di sviluppo.
- Accendere l'incubatore a camera e impostarlo a 35 °C con 5% di CO2 - idealmente 4 ore prima dell'imaging - per consentire ai componenti del microscopio di equilibrarsi a 35 ° C.
- Per l'imaging profondo delle fette, utilizzare obiettivi di immersione in acqua per ridurre la mancata corrispondenza nell'indice di rifrazione tra il tessuto e l'obiettivo.
NOTA: qui è stata utilizzata la modalità di imaging a super-risoluzione. L'imaging attraverso la membrana ptfe richiede un obiettivo con una lunga distanza di lavoro (~ 1 mm). Se un obiettivo a lunga distanza di lavoro non è disponibile, le fette possono essere trasferite in un piatto con fondo di vetro a 8 pozzetti. Per trasferire le fette, aggiungere 1 mL di slice media nella parte superiore della membrana, quindi utilizzare una spatola per sollevare una fetta e trasferirla in un pozzo contenente 200 μL di media. Rimuovere i supporti in eccesso utilizzando una punta della pipetta da 1 mL lasciando le fette semi-asciutte. - Per l'imaging della crescita degli assoni, individuare una regione della corteccia con densità cellulare da bassa a media. Per l'imaging della dinamica del cono di crescita, individuare un cono di crescita nella zona intermedia o nella zona subventricolare della corteccia.
- Definire una dimensione z-stack nel software di elaborazione delle immagini (vedere Tabella dei materiali). Per la crescita degli assoni in un grande z-stack, impostare una dimensione del passo di 2 μm. Per i coni di crescita in uno z-stack più piccolo, impostare una dimensione del passo di 1 μm.
NOTA: tenere sempre conto del movimento potenziale del cono di crescita e dell'assone attraverso i piani x, y e z. Gli assoni crescono ad un tasso molto più elevato nelle colture organotipiche rispetto alle colture in vitro . Qui, uno z-stack di circa 80 μm per la crescita degli assoni dell'immagine era sufficiente. Per la dinamica del cono di crescita, uno z-stack di ~ 6 μm era adeguato. - Per l'imaging della crescita degli assoni dei neuroni in un'area più ampia, definire una scansione delle tessere.
- Utilizzare la potenza laser più bassa possibile per ridurre al minimo le possibilità di sbiancare i coni di crescita durante l'acquisizione.
- Per l'imaging della crescita degli assoni, acquisire time-lapse per 2 ore con un intervallo di 5 minuti. Per l'imaging della dinamica del cono di crescita, acquisire time-lapse per 2-5 minuti con un intervallo di 2,5-3 s.
11. Analisi dei dati
- Misura la velocità di crescita degli assoni usando i kymografi
- Aprire il file immagine in Fiji14 tramite File > Apri e selezionare l'immagine.
- Ottenete la proiezione di massima intensità del time-lapse tramite Image > Stacks > Z-Projection > Maximum Intensity Projection.
- Passa attraverso il time-lapse e individua un assone in crescita.
- Una volta individuato, disegna una linea attraverso l'assone in crescita. Inizia dalla punta dell'assone nel primo fotogramma e segui l'assone per tutto il time-lapse.
- Genera un kymograph utilizzando il plugin KymoResliceWide.
- Impostare la scala del kymograph andando su Image > Properties. Imposta la distanza in μm in Larghezza pixel e imposta il tempo in s o min in Altezza pixel.
- Vai a Analizza > misura.
NOTA: verrà fornito un angolo relativo all'asse x. - Calcola la velocità di crescita degli assoni sostituendo l'angolo nella seguente equazione: SIN(RADIANS(θ))/COS(RADIANS(θ)) in un foglio di calcolo.
- Misurare il volume del cono di crescita utilizzando un software di analisi delle immagini (vedi Tabella dei materiali).
- Aprire il file immagine nel software di analisi delle immagini tramite File > Apri e selezionare il file di interesse.
- Selezionate la procedura guidata Aggiungi nuove superfici .
NOTA: verrà visualizzata una sezione nell'angolo in basso a sinistra con sei passaggi per la modifica manuale. - Nel passaggio 1, in Impostazioni algoritmo, selezionare Segmenta solo una regione di interesse. Nel passaggio 2, ritaglia il telaio per adattarlo all'intero cono di crescita in tutti i fotogrammi.
- Mantenere la soglia di intensità assoluta nel passaggio 3 e assicurarsi che l'intera regione del cono di crescita sia la soglia nel passaggio 4.
- Nel passaggio 5, selezionare Numero di Voxel lmg = 1 in Tipo filtro.
NOTA: nell'ultimo passaggio è possibile creare più set di misurazione. Qui, è stata creata una sola misurazione per il volume. - Selezionare il pulsante Esegui per eseguire tutti i passaggi di creazione e terminare l'Aggiunta guidata nuove superfici.
- Nella scheda Statistiche nella parte superiore della finestra della procedura guidata, selezionare Valori specifici e volume nella scheda Dettagli .
Risultati
Vengono mostrati i risultati rappresentativi ottenuti con il flusso di lavoro del metodo descritto. I topi E15.5 sono stati utilizzati nella presente dimostrazione, sebbene questo protocollo sia facilmente adattabile praticamente a tutte le età embrionali che vanno da E11 alla fine di E17. In questo protocollo, sia l'elettroporazione ex utero (EUE; Figura 2A, 2C-I) o elettroporazione in utero (IUE; Le figure 2B, C e 2J-Q) sono state utilizzate per fornire plasmidi nei neuroni progenitori che rivestono i ventricoli laterali. Questi progenitori sono la fonte dei futuri neuroni proiettati corticali (CPN)15,16. Sono state preparate miscele di plasmidi per guidare l'espressione neurone-specifica sparsa di membrana (Lyn)-mNeonGreen (Figura 1A) o LifeAct-enhanced (E)GFP (Figura 1B) per valutare rispettivamente il comportamento complessivo e le dinamiche dell'actina nei coni di crescita. Inoltre, è stato incluso un mix di plasmidi mirato a etichettare i singoli neuroni con turbo(t)-RFP o zoanthus sp. (Zs) proteina fluorescente verde (ZsGreen) (Figura 1C). Ciò facilita il monitoraggio del comportamento del cono di crescita da neuroni vicini indipendenti.
La dissezione cerebrale da embrioni elettroporati è un passaggio cruciale che deve essere eseguito con attenzione per ottenere fette di alta qualità, preservando la struttura cerebrale nativa. Gli strumenti di dissezione e il vibratoma sono stati preparati in anticipo e accuratamente sterilizzati con etanolo (Figura 3A, B). Successivamente, le teste di embrioni elettroporati sono state accuratamente sezionate e i cervelli sono stati estratti. Qui viene mostrata la dissezione rappresentativa del cervello dagli embrioni sottoposti a EUE a E15 (Figura 3C-F) ed E12.5 (Figura 3G-J). I cervelli vengono immediatamente racchiusi in una matrice di agarosio, affettati e posizionati su inserti di membrana in PTFE all'interno di un piatto di vetro inferiore per l'incubazione (Figura 3K-M).
Lo stato di salute delle fette di cervello è un punto significativo per il controllo per garantire risultati affidabili. Ogni giorno è stata eseguita un'ispezione visiva per qualsiasi contaminazione. Inoltre, una volta che la coltura è stata finalizzata, le fette di cervello vengono fissate e sottoposte a immunoistochimica. Qui,4′,6-diamidino-2-fenilindolo (DAPI) è stato utilizzato per controllare l'organizzazione cellulare complessiva e la colorazione della vimentina per rivelare l'organizzazione gliale; in particolare, impalcatura radiale glia (RG). Tipicamente, le fette di cervello coltivate con successo derivate da IUE o EUE mostrano una normale distribuzione cellulare come rivelato da DAPI e una serie in qualche modo organizzata di RG con processi di contatto piale orientati apicalmente17 (Figura 4A, B rispettivamente). Occasionalmente, si osservano marcati disturbi nell'impalcatura RG in fette di cervello in coltura, specialmente in quelli derivati dall'elettroporazione EUE (Figura 4C). Le fette di cervello con impalcatura RG estremamente disorganizzata mostrano una migrazione neuronale compromessa e una crescita assonale difettosa (non mostrata). Quindi, il controllo dell'impalcatura RG è un semplice metodo post-coltura per ordinare i dati ottenuti da fette di cervello affidabili.
Le fette di cervello derivate da IUE o EUE con mix di plasmidi che esprimono Lyn-mNeonGreen si traducono in un'etichettatura simile dei neuroni sparsi. Un CPN piramidale rappresentativo che esprime Lyn-mNeonGreen e il comportamento dinamico del suo cono di crescita è mostrato come esempio (Figura 5A e Video supplementare 1, in alto a sinistra). Inoltre, i neuroni sono stati etichettati utilizzando un plasmide che esprime una sonda di actina per analizzare la dinamica dell'actina dei coni di crescita assonale in situ (Figura 5B e Video supplementare 1, in basso a sinistra). Sono stati eseguiti anche esperimenti in situ con un plasmide a doppia espressione fluorofora Cre/Dre (Figura 1C e Video supplementare 1, a destra). I fluorofori tRFP o ZsGreen in questo plasmide potrebbero essere attivati in modo specifico e individuale da ricombinasi Dre o Cre, rispettivamente, nei neuroni vicini (Figura 5C). Questa formazione sperimentale consente l'analisi affiancata dei coni di crescita dai neuroni di controllo con neuroni modificati vicini (qualsiasi perdita o guadagno di funzione). Ciò elude la variabilità derivante dall'uso di diverse fette per testare il controllo e le condizioni sperimentali.
Sono stati analizzati i kymografi generati dal filmato registrato, dai quali è possibile ottenere facilmente parametri di crescita dinamica come l'attività protrusiva nel tempo e la lunghezza della crescita (Figura 6A). Si noti che una semplice regolazione della risoluzione temporale del time-lapse consente di misurare la velocità di allungamento degli assoni per 2 ore (Figura 6A). Inoltre, la variazione del volume del cono di crescita nel tempo - una misura dell'attività dinamica generale del cono di crescita - può essere facilmente ottenuta, in questo caso con software concesso in licenza (Figura 6B e Figura 6E, F). Questo può essere utilizzato per valutare la velocità del tapis roulant dell'actina e l'equilibrio tra filopodia / lamellipodia durante l'attività di esplorazione del cono di crescita.
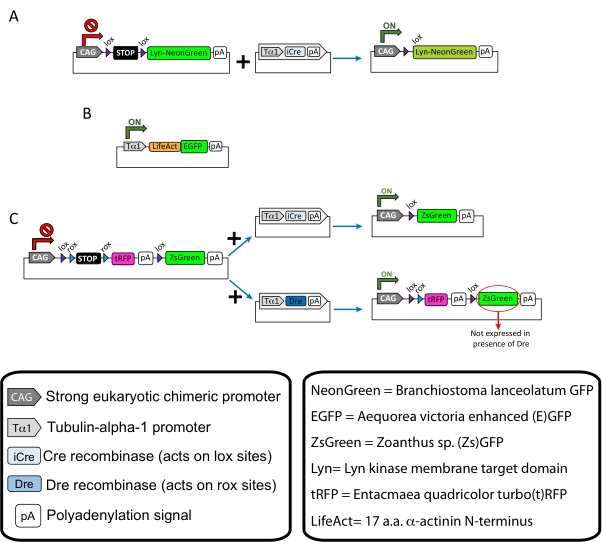
Figura 1: Schemi dei plasmidi utilizzati nel protocollo. (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alpha-1-LifeAct-GFP. (C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. Informazioni rilevanti riguardanti i componenti del plasmide e l'origine del fluoroforo si trovano nelle scatole. Fare clic qui per visualizzare una versione più grande di questa figura.
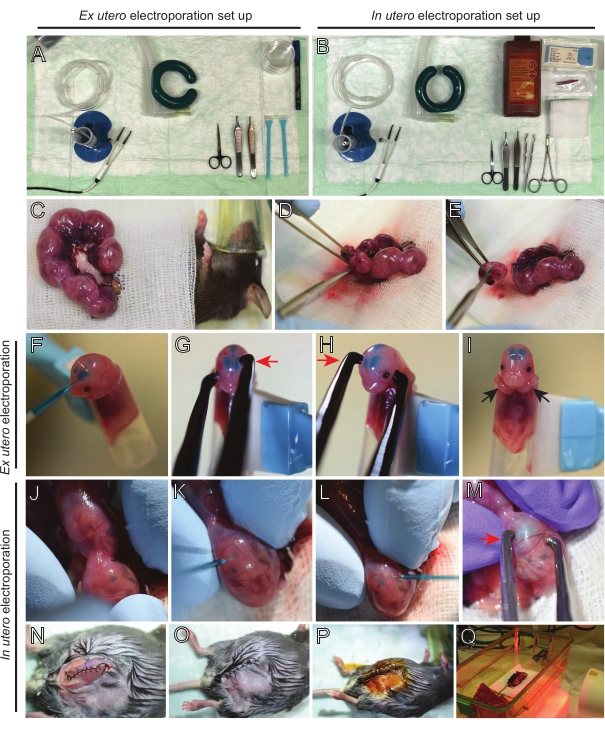
Figura 2: Flusso di lavoro dell'elettroporazione ex utero e in utero di topi E15.5. (A) Allestimento di una stazione chirurgica per l'elettroporazione ex utero. (B) Allestimento di una stazione chirurgica per l'elettroporazione in utero. (C) Corna uterine tirate fuori dalla cavità addominale del topo anestetizzato. (D) Estrazione di un embrione dal sacco uterino. (E) Sacrificio embrionale mediante completa traslazione del midollo spinale mediante incisione diagonale; si noti che la decapitazione è stata evitata. (F) Posizionamento dell'embrione nel detentore e iniettato con la miscela DNA/Fast Green nel ventricolo laterale sinistro. (G,H) Posizionare la testa dell'embrione tra gli elettrodi della pinzetta di platino con il catodo (freccia rossa) sopra la corteccia con un angolo di 60 °. (I) Posizionamento delle braccia dell'embrione (frecce nere) all'esterno del detentore per evitare lo scivolamento dell'embrione durante la procedura. (J) Rotazione dell'embrione all'interno del sacco uterino per esporre la testa. (K,L) Iniezione di miscela DNA/Fast Green nei ventricoli laterali dell'embrione attraverso la parete uterina. (M) Posizionare la testa dell'embrione tra gli elettrodi della pinzetta di platino con un catodo (freccia rossa) sopra la corteccia con un angolo di 60°. (N) Incisione muscolare suturata tramite sutura di bloccaggio in esecuzione. (O) Incisione cutanea suturata mediante sutura interrotta. (P) Fissaggio della ferita mediante clip chirurgiche per ferite e disinfezione mediante betadina. (Q) Posizionamento del mouse nella gabbia di recupero con luce di riscaldamento a infrarossi lontani. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Estrazione di cervelli E15.5 ed E12.5 e procedura di slice culture organotipica. (A) Strumenti utilizzati per la procedura di estrazione del cervello. (B) Allestimento di una stazione di coltura organotipica. (C-F) Estrazione del cervello E15.5. (G-J) Estrazione del cervello E12.5. Le linee tratteggiate evidenziano la posizione delle incisioni. Le frecce rosse indicano la direzione di tirare con una pinza. (K) Incorporare il cervello in un piatto di 3 cm contenente il 3% di agarosio a bassa fusione, lasciando uno spazio di distanza di agarosio di 1-2 mm sotto il cervello. (L) Raccolta di 150 μm di fetta di cervello. (M) Posizionamento di fette di cervello su inserti a membrana in PTFE immobilizzati in un piatto da 35 mm utilizzando pellicola di paraffina (freccia blu). La marcatura a stella rossa indica una data raccolta di fette di cervello dal vibratoma (L) e il suo trasferimento alla membrana ptfe (M). Fare clic qui per visualizzare una versione più grande di questa figura.
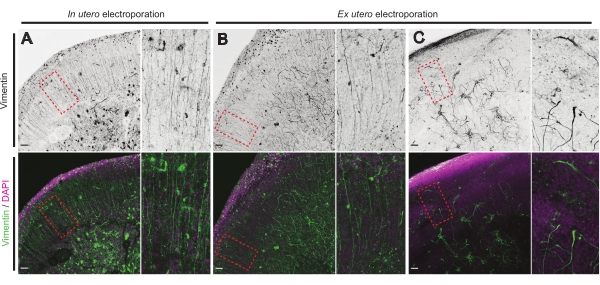
Figura 4: Struttura cellulare gliale radiale conservata in fette organotipiche sane. Immagini confocali di fette cerebrali E17.5 che rivelano array RG (vimentina; verde) e organizzazione cellulare complessiva (DAPI; magenta) dopo IUE (A) e EUE (B,C). Si notino i forti disturbi nell'array RG che possono occasionalmente derivare da EUE (C). Gli ingrandimenti corrispondono ai fotogrammi punteggiati di rosso nella figura principale: barre di scala, 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
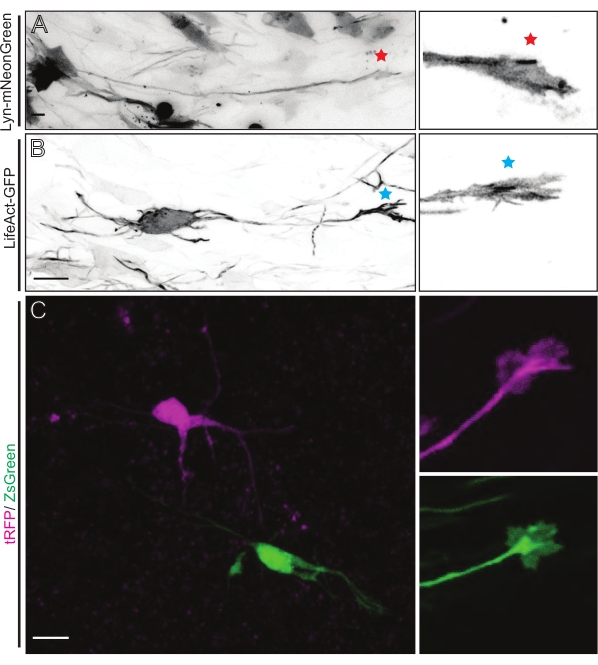
Figura 5: Visualizzazione in situ della dinamica del cono di crescita in fette organotipiche acute. (A,B) Neuroni e i loro corrispondenti coni di crescita etichettati rispettivamente con Lyn-mNeonGreen e LifeAct-GFP. Stella rossa che segna il cono di crescita del neurone che esprime Lyn-mNeonGreen. Asterisco blu che segna il cono di crescita del neurone che esprime LifeAct-GFP. (C) Neuroni vicini etichettati con il sistema a doppio plasmide contenente tRFP (magenta) e ZsGreen (verde) e i loro corrispondenti coni di crescita. I coni di crescita ripresi (a destra) erano al di fuori del fotogramma catturato (a sinistra), ottenuti poco dopo aver acquisito il time-lapse del cono di crescita; barre di scala, 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
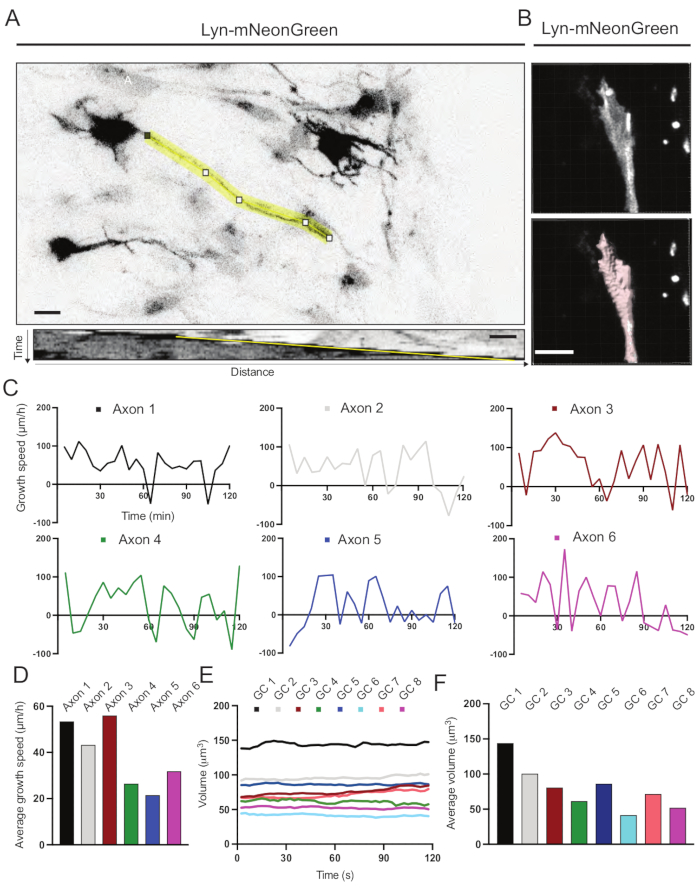
Figura 6: Analisi della velocità di crescita degli assoni e del volume del cono di crescita. (A) Tracciamento dell'assone su un neurone che esprime Lyn-mNeonGreen (in alto) e il suo corrispondente kymografo (sotto) generato utilizzando ImageJ. (B) Ricostruzione del video z-stack del cono di crescita utilizzando il software di analisi delle immagini (in alto) e lo stesso cono di crescita evidenziato utilizzando lo strumento di misurazione delle superfici (sotto). (C) Grafici che mostrano i cambiamenti nella velocità di crescita nel tempo per diversi assoni. (D) La velocità media di crescita degli assoni è quantificata in (C). (E) Grafico che mostra le variazioni del volume del cono di crescita nel tempo. F) Il volume medio dei coni di crescita è quantificato in (E); barra della scala, 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
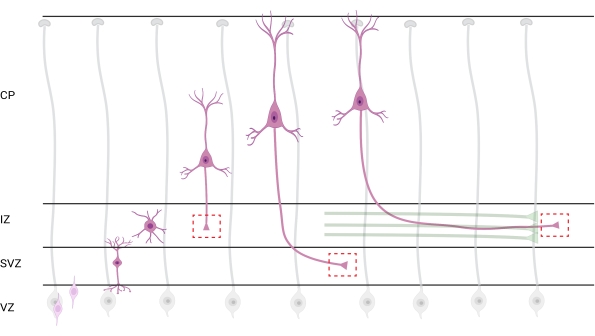
Figura 7: Migrazione radiale e polarizzazione neuronale dei neuroni corticali piramidali. Diagramma che illustra lo sviluppo di neuroni corticali piramidali (rosa) che migrano radialmente dalla zona ventricolare germinale (VZ) verso la superficie pia. Guidati da processi di glia radiale (grigio), i neuroni polarizzati migratori stabiliscono un processo principale, il dendrite futuro e il processo finale, l'assone futuro, che continuano ad estendersi verso il basso verso la zona intermedia (IZ). Le caselle rosse tratteggiate rappresentano le aree corticali in cui sono stati ripresi i coni di crescita. In particolare nell'IZ, zona subventricolare (SVZ) o unendo fasci assonali (verde). L'illustrazione è stata creata con uno strumento basato sul web, BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
| Plasmide | Concentrazione (μg/μL) | Destinazione d'uso |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | Etichettatura delle proteine bersaglio di membrana (Lyn) |
| + | + | |
| p-Tub-alfa-1-iCre | 0.08 | |
| p-Tub-alfa-1-LifeAct-GFP | 0.125 | Etichettatura dell'actina filamentosa (F-actina) nei coni di crescita |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | Etichettatura indipendente di due popolazioni di neuroni vicini |
| + | + | |
| p-Tub-alfa-1-iCre | 0.004 | |
| + | + | |
| p-Tub-alfa-1-Dre | 0.2 |
Tabella 1: Elenco dei plasmidi utilizzati nel protocollo. Nome, concentrazione e destinazione d'uso di ciascun plasmide utilizzato.
Video supplementare 1: Visualizzazione in situ della dinamica del cono di crescita in fette organotipiche acute. Dinamica dei coni di crescita etichettati con Lyn-mNeonGreen (in alto a sinistra) e LifeAct-GFP (in basso a sinistra). I coni di crescita vicini sono etichettati in modo differenziale con il sistema a doppio plasmide contenente tRFP (magenta; in alto a destra) e ZsGreen (verde; in basso a destra). Intervallo di imaging, 2,5 s. Barre di scala, 5 μm. Fare clic qui per scaricare questo file.
Discussione
Come i coni di crescita percepiscono e reagiscono al loro ambiente circostante per coordinare l'estensione e la guida simultanea degli assoni è ancora oggetto di dibattito 3,18. Studi pionieristici su substrati 2D hanno fornito uno sguardo sui meccanismi molecolari fondamentali che generano le forze che guidano la dinamica del cono di crescita durante la formazione degli assoni, la crescita e la navigazione 2,10,11,12,19. Più recentemente, studi su matrici 3D hanno rivelato quanta influenza ha una terza dimensione nel comportamento del cono di crescita e di conseguenza nella crescita degli assoni 8,9. Tuttavia, gli intricati meccanismi che istruiscono la dinamica dei coni di crescita in vivo devono ancora essere esaminati a fondo.
La preparazione di colture di fette organotipiche da cervelli IUE o EUE è ampiamente utilizzata e ben documentata. È diventato uno standard aureo che consente agli scienziati di ottenere informazioni sullo sviluppo e sul comportamento dei neuroni nel tessuto cerebrale vivente20,21. In effetti, questa tecnica è stata utilizzata con successo in combinazione con varie tecniche di imaging ad alta risoluzione per visualizzare specifici processi molecolari ed eventi morfologici in situ. Tali studi includono, ma non sono limitati alla formazione di assoni e all'estensione19,22, alla migrazione neuronale corticale 19,22,23,24, alla dinamica del centrosoma 25,26, alla dinamica dei microtubuli27, nonché alla dinamica funzionale dei compartimenti pre e postsinaptici 28,29.
Questo protocollo affronta una lacuna nella neurobiologia sperimentale, visualizzando le dinamiche del cono di crescita dello sviluppo di neuroni corticali in situ, in colture di fette di cervello acute ex vivo e gli strumenti per analizzare i dati ottenuti.
Le colture acute di fette di cervello sono state utilizzate per stabilire questo protocollo perché (1) con una certa pratica, sono facili da generare; (2) presentare un sistema accessibile per studiare i coni di crescita incorporati in un ambiente quasi completamente fisiologico, ma abbastanza trasparente da consentire l'imaging di cellule vive ad alta risoluzione; (3) può essere espanso per il suo uso con una miriade di linee di topo transgeniche; (4) combinati con IUE o EUE, forniscono un potenziale virtualmente illimitato per fornire strumenti molecolari per valutare le prestazioni dei coni di crescita e degli assoni in vivo in regimi di perdita/guadagno di funzione, insieme a reporter fluorescenti e sonde citoscheletriche.
Questa metodologia è stata descritta nel contesto sia dell'EUE che dell'IUE. Sebbene sia ancora un metodo altamente affidabile, l'EUE ha determinato un aumento dell'incidenza di fette di cervello che mostrano una rete RG disorganizzata rispetto a quelle ottenute con IUE come metodo di consegna (Figura 4C). I disturbi nell'array RG influenzano fortemente la migrazione neuronale e il modello di allungamento degli assoni30,31. Questi sono parametri chiave che prevedono dove trovare gli assoni per l'analisi in un dato momento e il tipo di ambiente in cui stanno navigando. Le fette di cervello con una rete RG significativamente interrotta in genere hanno una stratificazione dei neuroni corticali compromessa. Questo, a sua volta, produce assoni con traiettorie caotiche. Pertanto, si raccomanda vivamente di controllare l'integrità strutturale della rete RG. È interessante notare che la scarsa integrità strutturale è correlata all'aumento dell'età del cervello embrionale. In effetti, tali effetti negli embrioni più giovani di E12,5-E13,5 non sono stati osservati in genere19.
Il presente protocollo è completo e semplice. Tuttavia, ci sono alcuni passaggi critici in cui è necessario prestare particolare attenzione e attenzione per ottenere risultati ottimali. Questi sono stati espressamente annotati nel protocollo e includono (1) la messa a punto della quantità di DNA utilizzata nell'elettroporazione per ottenere un'etichettatura sparsa; (2) evitare danni durante l'estrazione del cervello; (3) controllare la temperatura dell'agarosio durante l'involucro cerebrale; (4) risoluzione dei problemi della percentuale ideale di agarosio per cervelli di una data età; e (5) selezione di fluorofori, la cui esperienza segue. Durante l'ottimizzazione del protocollo, sono state testate le prestazioni di diversi fluorofori nell'imaging in situ a cellule vive. Per questo protocollo sono state scelte varianti monomeriche GFP e NeonGreen per la preparazione dei plasmidi LifeAct- e Lyn-tagged (Figura 5A,B). Inoltre, la variante RFP mScarlet è stata testata e trovata altamente adatta per questa configurazione (dati non mostrati). Sono stati testati anche tRFP multimerico (dimero) e ZsGreen (tetramero) (Figura 5C e Video supplementare 1, a destra). Questi fluorofori super-luminosi a rapida piegatura sono raccomandati quando il metodo richiede una rapida generazione di segnali fluorescenti dopo la consegna del DNA.
Una pratica comune nell'uso di colture di fette è quella di utilizzare fette di cervelli diversi per testare il controllo e le condizioni sperimentali. Ciò rappresenta una fonte intrinseca di variabilità indesiderata. Qui è stato utilizzato un sistema di espressione che consente la modifica indipendente dei neuroni vicini e l'espressione dei giornalisti per l'identificazione. Si noti che in questa dimostrazione (Figura 5C), non c'erano differenze tra i neuroni che esprimono uno dei fluorofori. Tuttavia, ad esempio, un tale mix di plasmidi combinato con una linea di topo transgenico che ospita un gene Cre-sensibile etichetterà con neuroni tRFP (Dre-sensitive) che sono rimasti come wild type. Al contrario, ZsGreen (anche Cre-sensibile) etichetterà i neuroni ricombinati. Quindi, i coni di crescita dei due diversi genotipi, e probabilmente anche i fenotipi, potrebbero essere studiati fianco a fianco contemporaneamente nella stessa fetta di cervello.
La localizzazione di assoni e coni di crescita per l'analisi è una considerazione importante. I neuroni corticali si polarizzano mentre migrano radialmente dalla zona ventricolare (VZ) verso la piastra corticale (CP). Durante questo processo, i neuroni formano un processo principale (un futuro dendrite) e un processo finale che diventerà l'assone, unendosi infine agli assoni pionieristici nella zona intermedia (IZ), stabilendo tratti assonali32. Pertanto, per catturare i coni di crescita assonali, l'imaging è stato fatto su fibre assonali nell'IZ, compresi gli assoni che escono dal CP e gli assoni generati precocemente già associati a fasci assonali; o eventualmente, in fibre che attraversano l'IZ e si estendono al di sotto di esso (Figura 7).
Questo protocollo rende possibile eseguire l'imaging a super-risoluzione dei neuroni all'interno di fette organotipiche. Storicamente, la diffusione della luce era un problema significativo affrontato durante l'imaging di campioni spessi. Negli ultimi due decenni, gli ampi progressi nelle tecnologie ottiche hanno reso possibile l'imaging di campioni spessi. Qui, un obiettivo a lunga distanza di lavoro è stato utilizzato per visualizzare meglio le strutture più piccole, come i coni di crescita. Inevitabilmente, questo protocollo non cattura eventi più dettagliati come il flusso di actina retrograda o la dinamica dei microtubuli. L'obiettivo a lunga distanza di lavoro, che richiede un'apertura numerica (NA) inferiore, conserva le informazioni da fette spesse. Tuttavia, è stato anche possibile adattare questo protocollo per utilizzarlo con obiettivi di distanza di lavoro più breve. Ciò ha richiesto un trasferimento regolare delle fette a un piatto con fondo di vetro per preservare l'integrità strutturale. Tuttavia, l'uso di questo metodo ha comportato una sopravvivenza più breve - ~ 15 ore - a causa della perdita di scambio di gas (dati non mostrati). A differenza delle colture 2D, i coni di crescita in 3D occupano un volume maggiore e richiedono una compensazione movimento-artefatto nell'asse z. Per aumentare la capacità di visualizzare eventi dettagliati, è necessario utilizzare la moderna tecnologia confocale. Pertanto, si consiglia di utilizzare un motore z-stack a scansione rapida, come lo z-Galvo disponibile su microscopi confocali ad alta sensibilità33.
Da notare, questo protocollo presenta tre limitazioni principali. In primo luogo, è spesso difficile controllare i livelli di espressione / numero di cellule che esprimono di un dato plasmide in vivo. Ciò introduce variabilità tra tutte le fette anche quando si mantiene la stessa concentrazione di plasmidi. Pertanto, la selezione degli elementi regolatori nei vettori di espressione utilizzati deve essere predeterminata con cura. In secondo luogo, l'imaging di eventi dettagliati utilizzando inserti a membrana non è attualmente fattibile. Questa seconda limitazione potrà essere superata con gli aggiornamenti metodologici proposti nel paragrafo precedente. Infine, i coni di crescita sono altamente fotosensibili e possono diventare rapidamente fotosbiancati. Pertanto, l'imaging frequente dei coni di crescita, per un minimo di 5 minuti utilizzando microscopi a scansione laser, può spesso far collassare i coni di crescita. A questo proposito, i nuovi progressi nei dispositivi generati dalla microscopia a foglio luminoso possono essere adattati per l'imaging a lungo termine delle fette di cervello34.
Protocolli di questo tipo sono concepiti per aprire nuove strade di ricerca, consentendo una migliore comprensione di ciò che serve a un cono di crescita per leggere e reagire verso un ambiente complesso in vivo e, cosa più importante, per svelare i meccanismi di questa sofisticata interazione.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Maria Eugenia Bernis per aver fotografato le procedure. Ringraziamo anche Emily Burnside, Emily Handley, Thorben Pietralla, Max Schelski e Sina Stern per aver letto e discusso il manoscritto. Siamo grati ai nostri eccezionali assistenti tecnici, Jessica Gonyer, Blanca Randel e Anh-Tuan Pham. Riconosciamo il prezioso supporto della struttura per microscopi ottici e della struttura per animali del DZNE. Questo lavoro è stato sostenuto da Deutsche Forschungsgesellschaft (DFG), dalla International Foundation for Research in Paraplegia (IRP) e da Wings for Life (a F.B). F.B. è membro del cluster di eccellenza ImmunoSensation2, delle SFB 1089 e 1158, e ha ricevuto il Premio Roger De Spoelberch.
Materiali
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
Riferimenti
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341 (2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342 (2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203 (2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon