このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ウズラ絨毛尿膜 - 光線力学診断と治療のためのツール
要約
鳥胚の絨毛尿膜(CAM)は、さまざまな研究分野に非常に有用で適用可能なツールです。ニホンウズラCAMの特別なexovoモデルは、光線力学処理の研究に適しています。
要約
鳥胚の絨毛尿膜(CAM)は、一次呼吸器として機能する薄い胚外膜です。その特性により、血管新生、腫瘍増殖、薬物送達システム、または光線力学診断(PDD)および光線力学療法(PDT)を研究するための優れた in vivo 実験モデルになります。同時に、このモデルは、実験動物を適切な代替品に置き換えるための要件に対処します。 Ex ovo 培養胚は、物質の適用、アクセス、モニタリング、および文書化を容易にします。最も頻繁に使用されるのはひよこCAMです。ただし、この記事では、低コストで高スループットのモデルとしての日本のウズラCAMの利点について説明します。もう一つの利点は、より短い胚発生であり、それはより高い実験的代謝回転を可能にする。ここでは、癌および微生物感染のPDDおよびPDTに対するウズラCAMの適合性を探ります。一例として、送達系としてのリポタンパク質またはナノ粒子と組み合わせた光増感剤ヒペリシンの使用が記載されている。白色光の画像からの損傷スコアと紫色光(405 nm)下でのCAM組織の蛍光強度の変化を、組織学的切片の分析とともに決定しました。ウズラCAMは、血管系および組織に対するPDTの効果を明確に示しました。さらに、毛細血管出血、血栓症、小血管の溶解、大血管の出血などの変化が観察されました。日本のウズラCAMは、光線力学診断や治療研究のための有望な in vivo モデルであり、腫瘍血管新生の研究、抗血管療法、抗菌療法に応用されています。
概要
鶏絨毛尿膜(CAM)モデルはよく知られており、さまざまな研究分野で広く使用されています。それはガス交換とミネラル輸送を提供する豊かな血管新生胚外器官です1。この膜の透明性とアクセス可能性により、個々の血管とその構造変化をリアルタイムで観察できます2。利点にもかかわらず、ひよこCAMには、他の鳥類種を使用することで回避できるいくつかの制限(たとえば、より大きな繁殖施設、産卵、飼料消費など)もあります。このプロトコルでは、ニホンウズラ(Coturnix japonica)胚を用いた代替のex ovo CAMモデルが記載されている。その小さいサイズのために、それはチキンCAMよりはるかに多くの実験的個体の使用を可能にする。さらに、ウズラの胚の16日間の胚発生が短いことは別の利点です。ウズラCAMの最初の大きな血管は、胚の日(ED)7に現れます。これは、ニワトリの胚発生(ステージ4〜35)と直接比較することができます。しかし、発生の後期段階はもはや比較できず、ウズラの胚3に必要な時間は短くなります。興味深いのは、チキンCAMと同様の微小血管分岐の定期的な発生です4,5,6。急速な性的成熟、高い卵産生、および低コストの繁殖は、この実験モデル7の使用を支持する他の例です。
鳥類CAMモデルは、光線力学療法(PDT)研究でよく使用されます8。PDTは、いくつかの形態の癌(小さな限局性腫瘍)およびその他の非腫瘍性疾患の治療に使用されます。その原理は、損傷した組織への蛍光薬、光増感剤(PS)の送達と、適切な波長の光によるその活性化にあります。研究に使用される有望なPSの1つは、もともと薬用植物セントジョンズワート(Hypericum perforatum)から分離されたヒペリシンです9。この化合物の強力な光増感効果は、その光化学的および光物理的特性に基づいています。これらは、約600nmで蛍光の発光を誘発する400〜600nmの範囲の複数の蛍光励起ピークによって特徴付けられる。スペクトルバンド内のヒペリシンの吸収極大は540〜590nmの範囲にあり、蛍光極大は590〜640nmの範囲にある9。これらの光増感効果を達成するために、ヒペリシンは局所投与後に波長405nmのレーザー光によって励起される10。光の存在下では、ヒペリシンは殺ウイルス性、抗増殖性、および細胞毒性の効果を示す可能性があります11が、全身毒性はなく、生物から急速に放出されます。ヒペリシンは、水不溶性の非蛍光凝集体を形成する親油性物質であるため、ポリマーナノ粒子12,13や高密度および低密度リポタンパク質(HDL、LDL)14,15などの数種類のナノキャリアを使用して、その送達と細胞への浸透を助けます。CAMは自然に免疫不全のシステムであるため、腫瘍細胞を膜表面に直接移植することができます。このモデルは、定義されたスコア16,17に従ってPDT誘発血管損傷の程度を記録するのにも適しています。PDTに比べて低強度の光は、光線力学診断(PDD)に使用することができる。紫色励起LED光の下で組織を監視することは、蛍光灯の放出をもたらす光増感剤18,19,20の光活性化にもつながりますが、PDT反応を開始して細胞に損傷を与えるのに十分なエネルギーを提供しません。腫瘍の視覚化と診断、または使用済みPSs 14,15の薬物動態のモニタリングに適したツールになります。
この記事では、生存率が80%を超えるウズラ のex ovo CAMアッセイの準備について説明します。この 卵外 培養は、多数の実験で首尾よく適用された。
プロトコル
研究は、機関のガイドラインに準拠して実施されました。すべての機器と試薬は、70%エタノールまたはUV光でオートクレーブまたは滅菌する必要があります。
1.卵の孵化
- 受精したウズラの卵を10〜15°Cで最大4〜5日間保存してから、孵卵を開始します。清潔で損傷のない卵のみを使用してください。
- 強制ドラフトインキュベーターで卵を~53-54時間インキュベートします。卵の回転をオフにして、湿度50%〜60%、孵卵温度37.5°Cで卵を水平に置きます。
2. Ex ovo 培養の準備
注:最初の孵卵後、卵は 卵 子栽培を開始するのに適しています。
- 卵を回転させずに、70%エタノールで卵の表面を消毒します。
- 滅菌層流キャビネット内で、小型の滅菌外科用ハサミを使用して卵殻を開き、内容物を6ウェル培養プレートに移します。適切に行われれば、胚は損傷を受けていない卵黄の上に横たわるでしょう。各卵の後、はさみを70%エタノールで消毒します。
- CAMの乾燥を防ぐために湿度が不可欠であるため、6ウェルプレートの隙間に約5mLの滅菌水を追加します。
- 37°Cの温度と80%-90%の湿度を維持しながら、さらなる実験まで胚をインキュベーターに入れます。
- CAMが完全に開発されたら(ED7から)、滅菌されたシリコンリング(直径6 mm、厚さ約1.5 mm)を小さな毛細血管に沿ってCAM表面に配置します。リングを配置するときは、主要な血管を避けてください。
注意: リングはワークスペースを定義し、物質の適用場所をマークし、液体の内容物が漏れるのを防ぎます。 - 国の法律に従って胚の培養を終了します。
- 重要なのは、作業中は手袋を着用するか、70%エタノールで手を消毒しておくことです。不適切に傾いた胚または未受精卵を真空吸引器で吸引する。
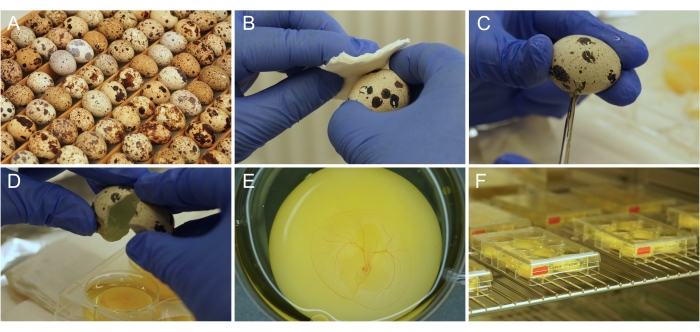
図1: Ex ovo 培養調製物。 (A)貯蔵され孵化される日本のウズラの卵。(B)エタノールによる卵表面消毒。(C)卵殻をハサミで切る。(D)卵の内容物は井戸に空になります。(E)CAM血管系を発達させ、適切に準備された3日齢の胚。(f)培養器に保存された培養プレート。 この図の拡大版を表示するには、ここをクリックしてください。
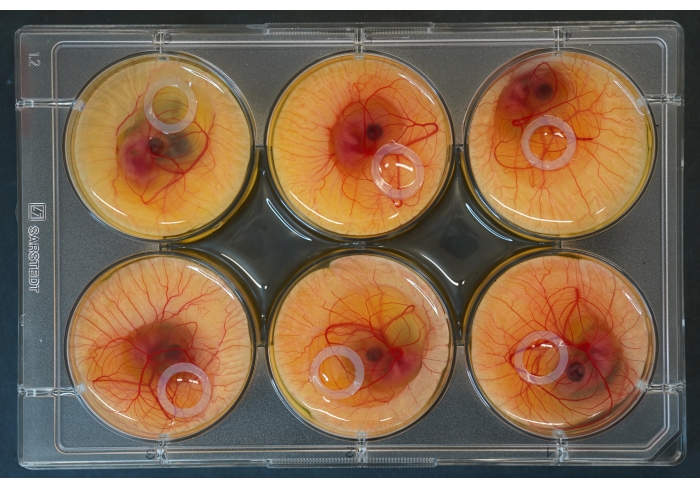
図2:胚とシリコンリングを上に配置した6ウェル培養プレート。 この図の拡大版を表示するには、ここをクリックしてください。
3.腫瘍細胞の接種
注意: すべての手順では、滅菌層流キャビネットを使用する必要があります。
- フラスコ内の異なる種類の接着細胞をそれぞれの培養プロトコールに従って培養する。
- フラスコから古い培地を取り出し、滅菌リン酸緩衝生理食塩水(PBS)で細胞層をすすぎ、培地の痕跡を取り除きます。
- トリプシン処理後、培養液を添加してトリプシンを阻害し、細胞を遠沈管に回収します。細胞を遠心分離し、細胞ペレットを新鮮な培養液に再懸濁します。細胞をカウントし、所望の濃度で細胞培養培地に再懸濁します。
注:例えばハンギングドロップ法21を用いて3D細胞培養物、すなわちスフェロイドを製造することもできる。
- 1 x 10 5-1 x 106個の腫瘍細胞または5-15個のスフェロイド(CAMあたり)を30 μLの細胞培地溶液にCAM上部のシリコンリングに移植します。
注意: 容量は、使用するシリコンリングのサイズによって異なります。より大きな直径のシリコンリングを使用する場合は、領域全体をカバーするためにより大きな体積が必要です。細胞タイプに応じて、または異なるタイプの実験のために、様々な細胞濃度が使用され得る。時々、CAMの微細な掻き取りは、埋め込まれた細胞の接着を改善するために使用される。 - 接種した細胞を含むCAMをインキュベーター(37°C、湿度80%〜90%)に戻します。

図3:腫瘍へのCAMの接種 。 (A)ピペットによるスフェロイドの吸引、および(B)CAM表面への移植。 この図の拡大版を表示するには、ここをクリックしてください。
4.光増感剤の応用
- ヒペリシンの応用
- 薄暗い照明下で、ヒペリシンの2 mMストック溶液を100%ジメチルスルホキシド(DMSO)に溶解して調製します。実験の直前に、滅菌PBSまたは生理食塩水でヒペリシンの79 μM作業溶液を調製します。すべての溶液中のDMSOの最終濃度が常に0.2%未満であることを確認し、これは胚の発生に影響を与えません。
- 無菌条件下で、適切な量のヒペリシン溶液をシリコーンリングに塗布します。直径6 mmのリングを満たすには、30 μLの容量で十分です。
- 胚を37°C、湿度80%〜90%のインキュベーターに保管してください。水溶液中のヒペリシンは、組織中でのモノマー化後、CAMへの適用後約3時間で光活性を示す。
- 輸送システムとしてのLDL、HDL、またはナノ粒子を用いたヒペリシンの応用
注:これらの輸送システムは、細胞および細胞構造へのヒペリシンの浸透を改善するために使用されます。- 感光性のため、薄暗い照明の下で溶液の調製を含むすべてのステップを実行し、溶液を暗所に保管してください。
- 参考文献15に記載のPBS中の適量のリポ蛋白およびヒペリシンストック溶液を混合することによりヒペリシン−LDLおよびヒペリシン−HDL製剤を調製する。ヒペリシンに対するLDLまたはHDLの濃度は20:115である。
- ポリマーナノ粒子を、参考文献12、13に記載のリビングカチオン開環重合によって合成する。PBSでポリマーナノ粒子中のヒペリシンの濃度を10μMに調整します12,13。
5. PDDおよびPDT
- PDDの実施
- 無菌条件下で、光増感剤(ヒペリシン、ヒペリシン装填ポリマーナノ粒子、またはリポタンパク質キャリアを含むヒペリシン)を腫瘍細胞の有無にかかわらず、CAM表面に塗布します(ED7-9)。
- 紫色励起光(波長405nmのカスタムメイド円形LEDライト)を使用してCAMを照明し、ヒペリシン投与後0、1、3、5、24、および48時間の時間間隔でデジタルカメラでCAM組織および腫瘍細胞中のヒペリシンの蛍光を記録します。
- 研究で白色光でのCAMの画像が必要な場合は、光がヒペリシンの光活性化に影響を与えるため、ヒペリシン投与前と実験終了時、組織固定直前のCAMを記録します。
- 画像処理および解析プログラム(例えば、ImageJ22)を用いて蛍光強度を評価する。
- RGB画像チャンネルを赤、緑、青の別々の画像に分割します。赤の強度画像を8ビット形式で解析します。リング内の領域から赤色の強度を評価し、それをヒペリシン蛍光として近似します。ヒペリシン投与後の異なる時間間隔(すなわち、投与直後の0時間から48時間まで)で(ImageJのプロファイルプロットプラグインを使用して)画像プロファイルプロット全体を取得します。
- PDTの実施
- ヒペリシン塗布の少なくとも3時間後にPDTを実行します。.
- レーザー光線用の光ファイバーをCAMの表面の上に置き、シリコンリング内の領域全体をカバーします。
- 405 nmのレーザー光を285 mW / cm 2のフルエンスレートで in vivo 照射(1〜2分)します。
- 光線力学処理(24時間および48時間)の前後に白色光と405 nm蛍光灯を使用してCAMを記録します。
- 白色光で撮影された画像から、PDTの24時間後および48時間後に光損傷を検出します。半定量的スコア16:1 - 破壊なしによって血管損傷を評価する。2 - 中型以上の血管(直径≥≤50μm)およびより小さな血管(直径10-50μm)の破壊のない毛細血管(直径10μm)の部分閉鎖;3-毛細血管が消失した小型船舶の部分的な閉鎖。4-小さな血管と毛細血管が消える大型船の部分的な閉鎖。5 - ほとんどの血管が消失する全写真血栓症。

図4:レーザー光によるCAMの治療。 この写真は説明のために撮影されました。PDD または PDT の場合、部屋は暗くなければなりません。 この図の拡大版を表示するには、ここをクリックしてください。
6. さらなる評価のためのCAMの準備
- パラフィン包埋
- CAM組織をPBS中の4%パラホルムアルデヒド(PFA)を含む培養プレートに最小2時間、最大一晩固定します。
- PFAを取り外し、シリコンリング内の組織の一部をCAMから慎重に切り取ります。
- 以下のように昇順アルコール系列で直ちにCAM組織を脱水する。CAM組織を70%エタノールで3分間、エオジン溶液で2分間(パラフィンブロック内の組織の位置を簡単にするため)、96%エタノールで3 x 5分間(常に新しいペトリ皿に入れ)、100%エタノールで5分間、キシレンを2 x 10分間入れます。
- ヘラまたは細いブラシを使用して、できるだけ早くサンプルをペトリ皿(59°C)に溶解したパラフィンに移します。24時間後、組織を組織型に入れ、パラフィン包埋培地で満たし、冷蔵庫で固化させます。固化したCAMを埋め込み媒体から切り取り、トレイ内で90°回転させ、再度埋め込み媒体を充填して固化させます。
- PDT誘発損傷を決定するための組織病理学的分析のために、ミクロトーム上に5〜10μmの切片を準備します。
- 組織学のための凍結CAM切片の調製
注:組織学を含むいくつかの方法論では、クライオスタットミクロトームで調製された凍結切片がより適しています。以下の手順に従って、フリーズしたCAMセクションを準備します。- ネイティブまたは4%パラホルムアルデヒド固定CAMをスライドガラスに慎重に取り付けます。
- 埋め込み型を最適な切削温度コンパウンド(OCT)で半分まで充填し、液体窒素またはドライアイスとエタノールの混合物で凍結します。
- 凍結後、CAMをスライドガラスから凍結したOCT培地の上部に慎重に傾けてスライドさせます。再び型に入れ、OCT培地で覆い、ステップ6.2.2と同様に凍結します。
- ウズラCAMのフラクタル解析
注:PDTによって引き起こされる血管系の変化は、フラクタル次元係数19を計算することによって評価できます。- 層流キャビネットで、PBS中の4%パラホルムアルデヒドと2%グルタルアルデヒドの予め温めた(37°C)固定溶液を入れた培養プレートにCAMをオーバーフローさせます。
- 48時間後に固定液を取り除きます。マイクロハサミと細かいブラシでCAMを胚から慎重に分離し、PBSで洗います。
- 洗浄したCAMをスライドガラスに取り付け、ゆっくりと乾かします。
- 均質な白色光の光源としてデジタルカメラとトランスイルミネーターを使用してスライドを撮影します。
- ImageJソフトウェア22を用いてデジタル画像を処理する。解析では、遠位動脈枝のある領域から正方形領域(512×512ピクセル)を選択します。画像を二値化およびスケルトン化し、参考文献31に記載されている手順に従ってフラクタル次元係数(Df)を計算します。
- CAM組織の分子解析
- 分子分析のために、天然CAMを注意深く分離し、液体窒素で凍結し、-80°Cで保存します。
- RNA単離23、cDNAへの逆転写、および定量的PCR24の標準プロトコルに従って遺伝子発現を決定します。
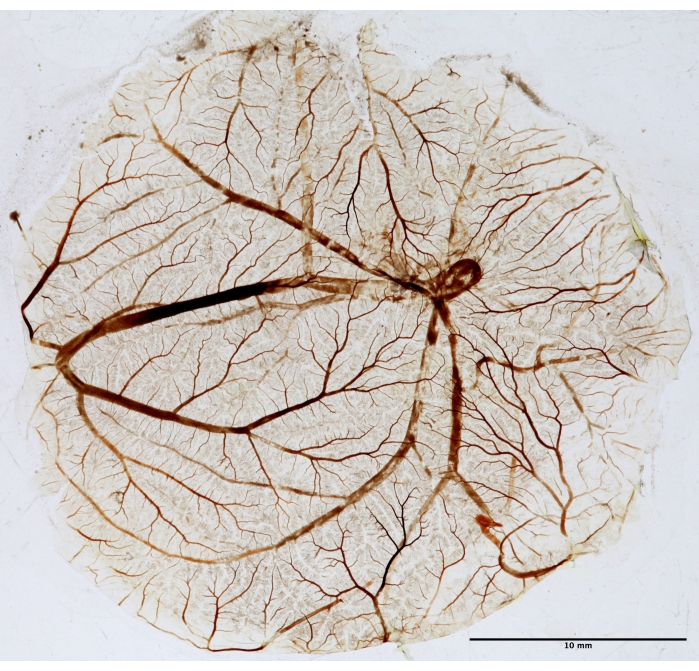
図5:フラクタル解析用のCAM組織。 PDT後、CAMを固定し、スライドに取り付け、フラクタル分析のために乾燥させます。写真はトランスイルミネーターを使用して白色光で撮影されました。 この図の拡大版を表示するには、ここをクリックしてください。
結果
CAM表面上の腫瘍の局在化は、白色光では困難である。PDDに用いられる光増感剤(ここではヒペリシン)は、腫瘍に選択的に取り込まれ、腫瘍の可視化に役立つことが期待されます。ヒペリシンの添加および蛍光光の使用(例えば、405nm)は、腫瘍(扁平上皮癌TE1)位置を非常によく示した(図6A)。組織学的分析は、健康な組織に侵入する重要な腫瘍細胞を示しました。扁平上皮癌?...
ディスカッション
卵外培養を成功させるには、上記のプロトコルに従うことが重要です。さらに、卵が十分に注意深く開かれていないか、栽培中に湿度が不十分な場合、卵黄袋は殻にくっついて破裂することがよくあります。卵の孵化の約60時間の時点での卵子培養の開始は、胚がすでに取り扱いを生き残るのに十分な大きさであるため、胚の高い生存率を保証します。発達後期には、CAMが薄く?...
開示事項
著者には利益相反はありません。
謝辞
この作業はVEGA 2/0042/21とAPVV 20-0129によってサポートされました。V. Huntošováの貢献は、プロジェクトの実施の結果です:医学における現代の学際的研究のためのオープンサイエンスコミュニティ(頭字語:OPENMED)、ITMS2014 +:ERDFによって資金提供された運用プログラム統合インフラストラクチャによってサポートされている313011V455。
資料
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
参考文献
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved