Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gelatine-Methacryloyl-Hydrogel-Gerüste: Hochdurchsatz-Mikrogelherstellung, Gefriertrocknung, chemische Assemblierung und 3D-Bioprinting
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt Protokolle für die Herstellung von Gelatine-Methacryloyl-Mikrogelen mit hohem Durchsatz unter Verwendung mikrofluidischer Geräte, die Umwandlung von Mikrogelen in resuspendierbares Pulver (Mikroaerogele), die chemische Anordnung von Mikrogelen zu körnigen Hydrogelgerüsten und die Entwicklung von körnigen Hydrogel-Biotinten mit erhaltener Mikroporosität für den 3D-Biodruck.
Zusammenfassung
Das Aufkommen von granularen Hydrogelgerüsten (GHS), die durch die Assemblierung von Hydrogel-Mikropartikeln (HMPs) hergestellt werden, hat die Bildung von mikroporösen Gerüsten in situ ermöglicht. Im Gegensatz zu herkömmlichen Bulk-Hydrogelen erleichtern miteinander verbundene mikroskalige Poren in GHS die abbauunabhängige Zellinfiltration sowie den Transfer von Sauerstoff, Nährstoffen und zellulären Nebenprodukten. Methacryloyl-modifizierte Gelatine (GelMA), ein (photo)chemisch vernetzbares, proteinbasiertes Biopolymer, das Zellklebstoff und biologisch abbaubare Einheiten enthält, wird häufig als zellresponsives/instruktives Biomaterial verwendet. Die Umwandlung von GelMA in GHS kann eine Fülle von Möglichkeiten für das Tissue Engineering und die Regeneration eröffnen. In diesem Artikel demonstrieren wir die Verfahren der Hochdurchsatz-GelMA-Mikrogelherstellung, der Umwandlung in resuspendierbare trockene Mikrogele (Mikro-Aerogele), der GHS-Bildung durch die chemische Assemblierung von Mikrogelen und der granularen Biotintenherstellung für das Extrusions-Bioprinting. Wir zeigen, wie eine sequentielle physikalisch-chemische Behandlung durch Kühlung und Photovernetzung die Bildung von mechanisch robustem GHS ermöglicht. Wenn Licht nicht zugänglich ist (z. B. während der Tiefengewebsinjektion), können individuell vernetzte GelMA-HMPs durch enzymatische Vernetzung unter Verwendung von Transglutaminasen bioorthogonal zusammengesetzt werden. Schließlich wird das dreidimensionale (3D) Bioprinting von mikroporösem GHS bei niedriger HMP-Packungsdichte über die Grenzflächen-Selbstorganisation heterogen geladener Nanopartikel demonstriert.
Einleitung
Der Zusammenbau von HMP-Bausteinen zu Tissue-Engineering-Gerüsten hat in den letzten Jahren enorme Aufmerksamkeit erregt1. GHS, die durch HMP-Assemblierung hergestellt werden, haben im Vergleich zu ihren Gegenstücken einzigartige Eigenschaften, einschließlich der Mikroporosität im Zellmaßstab, die von den Hohlräumen zwischen den diskreten Bausteinen herrührt. Zusätzliche Eigenschaften wie Injektionsfähigkeit, Modularität und entkoppelte Steifigkeit von Porosität machen GHS zu einer vielversprechenden Plattform zur Verbesserung der Gewebereparatur und -regeneration2. Für die GHS-Herstellung wurden verschiedene Biomaterialien verwendet, darunter synthetische Polymere auf PEG-Basis3,4 und Polysaccharide wie Alginat5 und Hyaluronsäure 6,7. Unter den natürlich gewonnenen Polymeren ist GelMA 8,9,10,11 das gebräuchlichste proteinbasierte Biopolymer für die GHS-Herstellung, ein vernetzbares, biokompatibles, bioadhäsives und biologisch abbaubares Biomaterial 12,13.
HMPs können durch Batch-Emulgierung8, Flow-Focusing 14,15 oder Stufen-Emulgierung9,11 Mikrofluidik-Vorrichtungen, Mischen 16 oder komplexe Koazervation17,18 hergestellt werden. In der Regel gibt es einen Kompromiss zwischen dem Herstellungsdurchsatz und der HMP-Monodispersität. Zum Beispiel liefert die Mischtechnik unregelmäßig geformte und stark polydispergierte HMPs. Die Batch-Emulgierung oder komplexe Koazervation ermöglicht die Herstellung großer Mengen von polydispergierten sphärischen HMPs. Strömungsfokussierende mikrofluidische Geräte wurden verwendet, um hochgradig monodisperse Tröpfchen mit einem Variationskoeffizienten von <5% herzustellen, der Durchsatz ist jedoch signifikant gering. In mikrofluidischen Bauelementen zur Stufenemulgierung ermöglichen die hochparallelisierten Schritte die Hochdurchsatzfertigung von monodispersen HMPs19.
HMP-Bausteine aus Methacryloyl-modifizierter Gelatine (GelMA) sind thermoresponsive und (photo-)chemisch vernetzbar, was eine einfache GHS-Herstellung ermöglicht20. Beim Abkühlen unter die obere kritische Lösungstemperatur (UCST)21 (z. B. bei 4 °C) werden Tröpfchen, die eine GelMA-Lösung enthalten, in physikalisch vernetzte HMPs umgewandelt. Diese HMP-Bausteine werden dann mit äußeren Kräften (z. B. durch Zentrifugation) gepackt, um gestaute Mikrogelsuspensionen zu erhalten. Interpartikuläre Bindungen werden zwischen benachbarten HMPs durch (photo-)chemische Vernetzung hergestellt, um mechanisch robustes GHS14 zu bilden. Eine der wichtigsten Eigenschaften von GHS ist die Mikroporosität, die eine einfache Zellpenetration in vitroermöglicht 11 und ein verstärktes Einwachsen von Gewebe in vivo22. Das dreidimensionale (3D) Bioprinting von HMPs wird herkömmlicherweise unter Verwendung dicht gepackter Mikrogelsuspensionen durchgeführt, wodurch die Mikroporosität beeinträchtigtwird 23.
Wir haben kürzlich eine neuartige Klasse von granularen Biotinten entwickelt, die auf dem Grenzflächen-Nanoengineering von GelMA-Mikrogelen über die Adsorption von heterogen geladenen Nanopartikeln basiert, gefolgt von einer reversiblen Selbstorganisation von Nanopartikeln. Diese Strategie macht lose verpackte Mikrogele scherfähig und extrusionsfähig 3D-biodruckbar, wodurch die mikroskalige Porosität von additiv hergestelltem GHS11 erhalten bleibt. In diesem Artikel werden die Methoden für die Herstellung von GelMA-Tröpfchen mit hohem Durchsatz, die Umwandlung dieser Tröpfchen in physikalisch vernetzte HMPs, die Herstellung von GelMA-HMPs unter Verwendung von resuspendierbarem Pulver, die GelMA GHS-Bildung, die Herstellung von GelMA-Nano-Granulat-Biotinte (NGB) und das 3D-Bioprinting vorgestellt.
Protokoll
HINWEIS: In der Materialtabelle finden Sie Einzelheiten zu allen Materialien, Instrumenten und Reagenzien, die in diesem Protokoll verwendet werden.
1. GelMA-Synthese
HINWEIS: Die GelMA-Synthese sollte in einem chemischen Abzug durchgeführt werden, und es sollte ständig geeignete persönliche Schutzausrüstung (PSA) verwendet werden.
- 200 ml phosphatgepufferte Kochsalzlösung (DPBS, 1x) von Dulbecco werden in einen Erlenmeyerkolben gegeben und die Lösung erhitzt, bis sie 50 °C erreicht. Decken Sie den Kolben mit Alufolie ab, um Verdunstung zu verhindern.
- 20 g Gelatinepulver werden bei 50 °C unter Rühren bei 240 U/min in die DPBS-Lösung gegeben, bis sich das Pulver vollständig aufgelöst hat.
- 16, 2,5 oder 0,5 ml Methacrylatanhydrid (MA) tropfenweise über eine Glaspasteurpipette in die Gelatinelösung geben, um GelMA mit einem hohen, mittleren bzw. niedrigen Grad an Methacryloylsubstitution zu synthetisieren.
ACHTUNG: MA ist ein Gefahrstoff. Bei der Arbeit mit MA sollte die richtige PSA verwendet werden. MA ist auch lichtempfindlich, also schützen Sie die Reaktion vor Licht, indem Sie den Kolben mit Aluminiumfolie umwickeln. - Nach 2 h 400 ml DPBS bei 50 °C zugeben, um die Reaktion zu stoppen. Das Rühren bei 50 °C 10 min weiterrühren lassen.
- Gießen Sie die Lösung in einen Dialysemembranschlauch mit einem Molekulargewichtsgrenzwert von 12-14 kDa und legen Sie den Schlauch dann in ein 5-Liter-Becherglas, das mit 40 °C Reinstwasser gefüllt ist. Rühren Sie das Wasser bei 240 U/min und 40 °C.
- Dialysieren Sie die Lösung 10 Tage lang gegen Reinstwasser und wechseln Sie das Wasser 2x täglich, um nicht umgesetztes Methacrylatanhydrid, Nebenprodukte und andere Verunreinigungen zu entfernen.
- Nach 10 Tagen 400 ml Reinstwasser bei 40 °C in die GelMA-Lösung geben. Rühren Sie die Lösung bei 240 U / min für 15 Minuten.
- Filtern Sie die Lösung zweimal mit Kaffeefiltern, gefolgt von einer Vakuumfiltration über eine 0,2-μm-Vakuumfiltrationseinheit.
- Gießen Sie 25 ml der filtrierten Lösung in 50 ml Zentrifugenröhrchen und frieren Sie sie bei -80 °C ein, wobei Sie die Röhrchen horizontal aufstellen.
- Entfernen Sie nach 2 Tagen die Kappen und bedecken Sie die Zentrifugenröhrchen mit Labortüchern. Verwenden Sie Klebeband oder ein Gummiband, um die Tücher festzuhalten.
- Lyophilisieren Sie die gefrorene GelMA-Lösung, um weißes festes GelMA zu erhalten.
- Um eine Protonen-Kernspinresonanzspektroskopie (1 H NMR) durchzuführen, werden separat 30 mg Gelatinepulver (Kontrolle) oder lyophilisiertes GelMA in 1ml Deuteriumoxid (D2O) gegeben und die Proben bei 37 °C gehalten, bis das Gelatinepulver oder GelMA vollständig aufgelöst ist.
- Erhalten Sie die 1-H-NMR-Spektren und bestimmen Sie den Grad der Methacryloylsubstitution durch Integration der aromatischen Säuren und der Lysin-Methylen-Protonen-Peaks bei chemischen Verschiebungen von ~6,5-7,5 bzw. ~3,0 ppm. Verwenden Sie den aromatischen Säurepeak als Referenz und bestimmen Sie den Substitutionsgrad (DS) unter Verwendung von Lysin-Methylen-Peaks basierend auf Gleichung (1):
DS (%) = [1 - (Fläche von Lysinmethylen in GelMA / Fläche von Lysinmethylen in Gelatine)] × 100 (1)
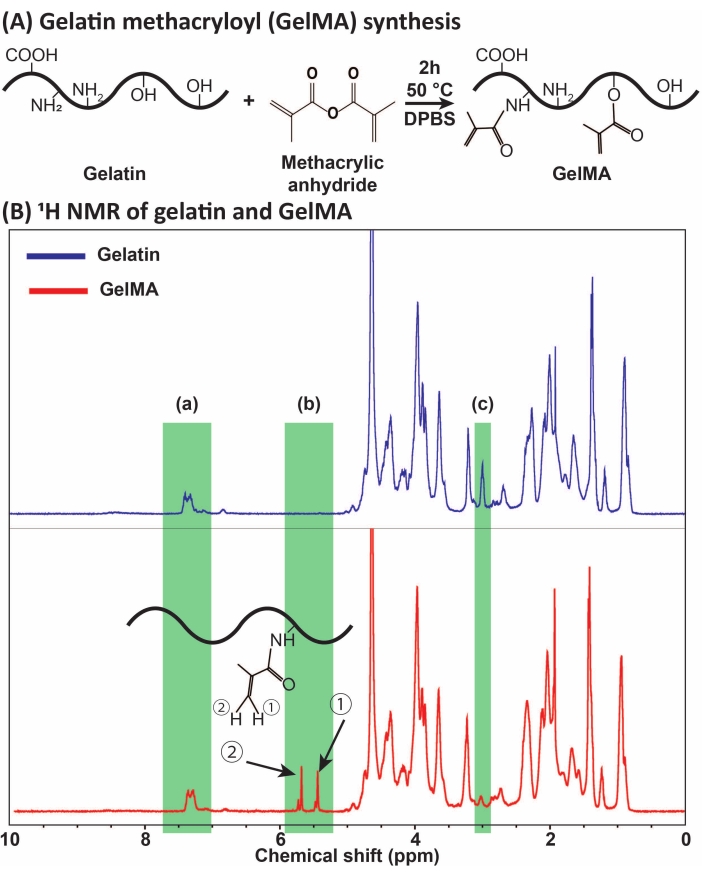
Abbildung 1: GelMA-Synthese und -Charakterisierung . (A) GelMA-Synthesereaktion. Gelatine wird mit Methacrylsäureanhydrid bei 50 °C für 2 h modifiziert. (B) Die Protonenkernspinresonanzspektren (1H NMR) von Gelatine und GelMA: (a) der Peak für aromatische Säuren, der als Referenz für die Kalibrierung ausgewählt wird, (b) Vinyl-Funktionsgruppen-Peaks nach der MA-Modifikation von Gelatine und (c) der Peak für Lysinproteine. In diesem Beispiel betrug der MA-Substitutionsgrad 71 % ± 3 % (n = 3). Diese Zahl wurde mit freundlicher Genehmigung von Ataie et al.11 Abkürzungen geändert: GelMA = Gelatinemethacryloyl; DPBS = Dulbeccos phosphatgepufferte Kochsalzlösung; MA = Methacryloyl. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Herstellung von GelMA-Mikrogelen mit hohem Durchsatz
- Mikrofabrikation von Geräte-Master-Formen
HINWEIS: Urformen können mittels Softlithografie mit dem Negativ-FotolackKMPR 1000 der Serie 19 mikrofabriziert werden.- KMPR 1025 und 1035 über Nacht auftauen. Vermeiden Sie jegliche Lichteinwirkung.
- Um die erste Schicht auf dem Wafer zu beschichten, geben Sie KMPR 1025 direkt in die Mitte des Wafers, um einen ca. 5 cm großen Fotolackkreis zu bilden. Lassen Sie den Schleudercoater 30 Sekunden lang mit 3.000 U/min laufen.
- 12 min auf einer 100 °C heißen Kochplatte weich backen. Anschließend auf der Kühlplatte 5 Minuten abkühlen lassen.
- Befestigen Sie die erste Schicht der Maske auf dem leeren Natronkalk und setzen Sie den beschichteten Wafer dann mit einem Mask Aligner für eine Dosierung von 645 mJ/cm 2 UV-Licht aus.
- Nach dem Backen 3 min auf einer 100 °C heißen Kochplatte. Auf der Kühlplatte 5 Minuten abkühlen lassen.
HINWEIS: Nach diesem Schritt nicht mehr entwickeln. Entwickeln Sie nur einmal am Ende des Prozesses. - Schleudern Sie die zweite Schicht auf dem Wafer mit dem KMPR 1035. Lassen Sie den Schleudercoater 30 Sekunden lang mit 1.000 U/min laufen.
- 30 min auf einer 100 °C heißen Kochplatte weich backen. Auf der Kühlplatte 5 Minuten abkühlen lassen.
- Befestigen Sie die zweite Schichtmaske am leeren Natronkalk und richten Sie die zweite Maske mit dem Aligner durch Standardausrichtungszeichen aus. UV-Licht mit einem Mask Aligner bis zu 2.000 mJ/cm2 aussetzen.
- Nach dem Backen 5 min auf einer 100 °C heißen Kochplatte.
- Entwickeln Sie >6 Minuten lang im SU-8-Entwickler.
HINWEIS: Wenn die Waffel milchig aussieht, sollte die Entwicklung über einen längeren Zeitraum fortgesetzt werden. Verwenden Sie jedes Mal und dazwischen einen neuen Entwickler, um ein besseres Ergebnis zu erzielen. - Mit Isopropanol besprühen. Stellen Sie sicher, dass die Waffel klar ist und keine milchigen Rückstände aufweist. Trocknen Sie den Wafer gründlich mit Stickstoffgas (N2).
- Herstellung von mikrofluidischen Geräten
- Gießen Sie 50 g Polydimethylsiloxan (PDMS) in einen transparenten Plastikbecher. Geben Sie dann 5 g des Vernetzers in den Plastikbecher. Mischen Sie die Basis und den Vernetzer mit einem Spatel kräftig, bis eine cremige Textur entsteht.
- Entgasen Sie das Gemisch mit einem Exsikkator 20 Minuten lang, bis es klar wird. Gießen Sie die Mischung auf die Urform, die hineingelegt und an eine Petrischale geklebt wird.
HINWEIS: Stellen Sie sicher, dass die Dicke (Höhe) des gegossenen PDMS ≤8 mm beträgt. - Geben Sie die Petrischale in den Exsikkator und saugen Sie die PDMS-Mischung erneut für 20 Minuten ab, bis alle Blasen entfernt sind. Stellen Sie die Petrischale für 2 h in einen 70 °C heißen Ofen, bis das PDMS vernetzt ist. Die Petrischale aus dem Ofen nehmen und abkühlen lassen.
- Schneiden Sie die Geräte mit einem Skalpell aus der Form. Lösen Sie die Geräte langsam von der Urform. Verwenden Sie den Biopsistanzen (1,5 mm Durchmesser), um Löcher durch die Einlässe und den Auslass zu schneiden.
- Entfernen Sie den Staub von den PDMS-Geräten und den Objektträgern mit Klebeband und legen Sie die Objektträger und die Geräte in eine Plasmafilterkammer. Führen Sie die Plasmabehandlung für 45 s (beginnend mit der violetten Färbung der Kammer) mit einem Luftdruck unter 400 mTorr durch. Entfernen Sie die Objektträger und Geräte aus der Kammer, setzen Sie das Gerät auf die Objektträger und üben Sie leichten Druck aus. Stellen Sie das Gerät für 30 Minuten in den 70 °C heißen Ofen, um die Verklebung zu verbessern.
- Füllen Sie die Geräte mit Trichlor(1H,1H,2H,2H-Perfluoroctyl)silan (F-Silan, 2% v/v) in der technischen Flüssigkeit, um die Kanaloberfläche fluorophil zu machen. Injizieren Sie die F-Silan-Lösung durch den Auslass und stellen Sie sicher, dass alle Geräte freigelegt sind. Warten Sie 5-10 min.
HINWEIS: F-Silan sollte frisch zubereitet werden. Darüber hinaus sollte F-Silan nicht längere Zeit der Luft ausgesetzt werden. - Saugen Sie die F-Silan-Lösung durch den wässrigen Lösungseinlass aus dem Gerät ab. Waschen Sie das Gerät zweimal mit der technischen Flüssigkeit und saugen Sie es erneut ab. Stellen Sie das Gerät für 30 Minuten in den 70 °C heißen Ofen, um das restliche Öl zu verdampfen.
- Tröpfchenbildung und GelMA-Mikrogelherstellung
- 10 mg Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP) werden zu 10 ml DPBS gegeben, um eine Photoinitiator (PI)-Lösung (0,1 % w/v) herzustellen. Schützen Sie die Lösung vor Licht, indem Sie sie in Alufolie einwickeln.
- Lösen Sie die gewünschte Menge GelMA in der PI-Lösung auf und stellen Sie sie für 1 Stunde in den 37 °C heißen Ofen, bis eine klare Lösung erhalten wird. Schützen Sie die Lösung vor Licht, indem Sie sie in Aluminiumfolie einwickeln.
- Zur Herstellung der Ölphase wird eine biokompatible Tensidlösung von 2 % v/v in der technischen Flüssigkeit hergestellt.
- Setzen Sie den Tygon-Schlauch in die Ein- und Auslässe des PDMS-Geräts ein. Führen Sie eine 25-G-Stumpfnadel in das andere Ende des Tygon-Schlauchs für Einlässe ein. Verwenden Sie die minimal mögliche Schlauchlänge.
- Stellen Sie das Gerät unter das Mikroskop. Halten Sie die Umgebung mit einem Fön und/oder einer Raumheizung warm (~40 °C).
- Laden Sie die wässrigen und öligen Lösungen in separate Spritzen, die an das Gerät angeschlossen sind. Starten Sie die Spritzenpumpen mit Durchflussraten von 160 bzw. 80 μl/min für die Öl- (kontinuierliche) bzw. wässrige (dispergierte) Phase.
HINWEIS: Beginnen Sie zuerst mit der Ölphase. Stellen Sie sicher, dass das Öl den Kanal füllt, und starten Sie dann die wässrige Phase. - Sammeln Sie die Tröpfchen in einem Behälter und werten Sie sie in der Bildgebungskammer mittels optischer Mikroskopie-Bildgebung aus.
- Platzieren Sie die Tröpfchen über Nacht bei 4 °C und schützen Sie sie vor Licht, um die physikalische Vernetzung von GelMA HMP zu initiieren und die Tröpfchen bei 4 °C in stabile Mikrogele umzuwandeln.
3. Umwandlung von Mikrogelen in resuspendierbares Pulver über die mikrotechnische Emulsion-zu-Pulver-Technologie (MEtoP)
HINWEIS: Die MEtoP-Technologie zur Umwandlung der HMPs auf Basis von Wasser-in-Öl-Emulsionen in Mikropartikelpulver (Mikro-Aerogele) mit erhaltenen Eigenschaften wie Resuspendierbarkeit, Form, Größe und Montage wurde entwickelt.
- Um den MEtoP zu implementieren, sammeln Sie die physikalisch vernetzten HMPs in der technischen Flüssigkeit mit thermisch haltbaren Mikrozentrifugenröhrchen oder Kryozellen. Öffnen Sie die Röhrchenkappen und verschließen Sie sie mit einem Labortuch und Klebeband.
- Die physikalisch vernetzten HMPs werden in flüssigem Stickstoff (-196 °C) für 10 min tiefgefroren.
- Übertragen Sie die schockgefrorenen Röhrchen auf ein Gefriertrocknergerät. Lyophilisieren Sie die Röhrchen bei niedrigem Druck (z. B. 0,06 mbar) für mindestens 6 h, um Pulver zu erhalten.
HINWEIS: Wenn der Gefriertrocknungszyklus beendet ist, brechen Sie den Druck langsam, damit das Pulver nicht verloren geht. - Fügen Sie dem Pulver 1 ml abgekühlte PI-Lösung (0,1 % w/v, 4 °C) hinzu, um Mikrogelsuspensionen herzustellen. Wirbel für 5 s, dann bei 3.000 × g für 15 s zentrifugieren. Verwerfen Sie den Überstand.
- Übertragen Sie die verpackte Mikrogelsuspension mit einer Verdrängungspipette in eine Form, gefolgt von UV-Lichtbelichtung bei 400 nm Wellenlänge mit einer Intensität von 15 mW/cm2 für 60 s, um GHS zu bilden.

Abbildung 2: GelMA-Mikropartikel-Pulverherstellung mittels MEtoP-Technologie. (A) Bilder von GelMA-Pulver, das durch die MEtoP-Technologie oder die konventionelle Gefriertrocknung von HMP erhalten wurde. Bei der MEtoP-Technologie oder der konventionellen Gefriertrocknung werden HMPs in Öltensiden bzw. wässrigen Medien suspendiert. Die technische Flüssigkeit schützt die dispergierte Phase (HMPs) vor Aggregation und bewahrt die physikalisch-chemischen Eigenschaften von GelMA-Mikropartikeln während der Gefriertrocknung. (B) Schematische Darstellung von getrockneten HMPs, die mit dem MEtoP hergestellt wurden, im Vergleich zu herkömmlich lyophilisiertem HMP in einem wässrigen Medium. (C) REM-Bilder von getrockneten GelMA-Mikropartikeln, die mit dem MEtoP hergestellt wurden, im Vergleich zur konventionellen Gefriertrocknung. Maßstabsbalken = 2 mm (links; A), 500 μm (rechts; A), 10 μm (links; C) und 200 μm (rechts; C). Diese Zahl wurde mit Genehmigung von Sheikhi et al.26 Abkürzungen geändert: GelMA = Gelatinemethacryloyl; DPBS = Dulbeccos phosphatgepufferte Kochsalzlösung; MEtoP = mikrotechnische Emulsion zu Pulver; HMP = Hydrogel-Mikropartikel; REM = Rasterelektronenmikroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. GelMA GHS-Bildung
HINWEIS: Dieses Protokoll gilt für die Herstellung von 400 μl Mikrogelsuspension. Für größere Mengen ist ein Scale-up erforderlich. Um die GelMA-HMPs physikalisch vernetzt zu halten, sollten alle Schritte bei etwa 4 °C durchgeführt werden, indem die Mikrogelbehälter in einen Eiswassereimer gestellt werden.
- 400 μl 1H,1H-Perfluor-1-Octanol (PFO)-Lösung in der technischen Flüssigkeit (20 % v/v) werden zu den physikalisch vernetzten GelMA-HMPs gegeben. Dann 5 s vorwirbeln und 15 s bei 300 × g zentrifugieren.
HINWEIS: Die PFO-Lösung in der technischen Flüssigkeit sollte frisch zubereitet und in einem geschlossenen Behälter gelagert werden, um eine Verdunstung zu verhindern. - Entfernen Sie die Ölphase aus den GelMA HMPs durch Pipettieren.
- 400 μl PI-Lösung (0,1 Gew.-%) bei 4 °C werden in die Mikrogelsuspension gegeben. Dann 5 s lang wirbeln und 15 s lang bei 300 × g zentrifugieren. Entsorgen Sie das Öl danach.
- Wiederholen Sie den vorherigen Schritt, aber zentrifugieren Sie ihn bei 3.000 × g. Entfernen Sie den Überstand der verpackten GelMA-HMPs durch Pipettieren.
- Die verpackten GelMA-HMPs werden mit einer Verdrängungspipette in eine Form gegeben, gefolgt von UV-Lichtbelichtung (Wellenlänge = 400 nm, Intensität = 15 mW/cm2, Belichtungszeit = 60 s).
5. Nanotechnologisch hergestellte granulare Biotinten (NGB) für den 3D-Bioprinting von GHS mit erhaltener Mikroporosität
- 100 mg Nanoplättchenpulver werden in 3 ml 4 °C Reinstwasser gegeben, um eine Nanopartikeldispersion (3,33 % w/v) zu bilden. Schwenken Sie die Dispersion 15 Minuten lang kräftig in einem 4 °C kalten Kühlschrank, um die ansonsten aggregierten Nanopartikel zu entfernen. Richtig gepeelte Nanopartikel ergeben eine klare Dispersion.
- 50 mg LAP werden in 5 ml 4 °C heißem Reinstwasser gelöst, um eine Stamm-PI-Lösung (1 % w/v) herzustellen.
- 333 μl PI-Lösung (1 Gew.-%) werden in die abgeblätterte Nanopartikeldispersion gegeben. Zum Schutz vor Umgebungslicht in Alufolie einwickeln. Wirbeln Sie 1 Minute lang, um die Nanopartikeldispersion und PI zu mischen. Die endgültigen Ton- und PI-Konzentrationen betragen 3 Gew.-% bzw. 0,1 Gew.-%.
- Fügen Sie PFO 20 % v/v in technischer Flüssigkeit (4 °C) zu den physikalisch vernetzten GelMA-HMPs in einem Volumenverhältnis von 1:1 hinzu. Wirbel gründlich für 5 s. Dann wird bei 300 × g für 15 s zentrifugiert und die Ölphase, die das Tensid enthält, verworfen.
- Die LAP-supplementierte Nanopartikel-Dispersion (4 °C) wird zu den gewaschenen GelMA-HMPs gegeben. 15 s vortexen, 15 s lang bei 3.000 × g zentrifugieren und das restliche Öl am Boden sowie die überstehende Dispersion verwerfen.
- Lagern Sie die Suspension 1 Tag lang bei 4 °C und schützen Sie sie mit Aluminiumfolie vor Licht. Das Produkt dieses Schrittes ist der GelMA NGB.
- Füllen Sie den NGB in eine 3-ml-Spritze, verschließen Sie die beladene Spritze mit einer Kappe und einem Parafilm und pulsieren Sie eine Impulszentrifuge mit 200 × g , um die eingeschlossene Luft zu entfernen. Übertragen Sie die Biotinte in eine 3-ml-Kartusche mit einem weiblichen Luer-Lok-Anschluss. Zentrifugieren Sie die Kartusche erneut kurz bei 200 × g , um die eingeschlossene Luft zu entfernen. Bewahren Sie den NGB vor Gebrauch bei 4 °C im Kühlschrank auf.
- Bereiten Sie vor der Herstellung von zellbeladener Biotinte eine konzentrierte Zellsuspension (z. B. NIH/3T3-murine Fibroblastenzellen) vor, die ~24 Millionen Zellen in 100 μl Zellkulturmedium enthält. Laden Sie die Zellsuspension in eine 3-ml-Spritze, koppeln Sie die NGB-geladene Spritze und die zellgeladene Spritze mit einem weiblich-weiblichen Luer-Lok-Anschluss und mischen Sie die Zellen und NGB vorsichtig, indem Sie sie 40x hin und her drücken.
- Drucken Sie den NGB oder den zellbeladenen NGB mit einem geeigneten Bioprinter mit einer konischen Standarddüse. Füllen Sie die Düse in den 3-ml-Druckkopf. Halten Sie die Druckbetttemperatur unter 10 °C. Optimieren Sie Druckparameter wie Geschwindigkeit und Gegendruck vor dem Drucken.
- Wählen Sie das Substrat und den Düsentyp (pneumatische 3-ml-Spritze mit konischer Standarddüse), kalibrieren Sie den Bioprinter anhand der Geräterichtlinien, wählen Sie den gewünschten Gcode oder die gewünschte STL-Datei aus und starten Sie den Druck.
HINWEIS: Bei der Durchführung von zellbeladenem Bioprinting sollten alle Materialien und Geräte unter der biologischen Sicherheitswerkbank aufbewahrt werden, um die Kontamination zu minimieren. - Nach dem Drucken wird das Konstrukt UV-Licht zur Photovernetzung ausgesetzt (Wellenlänge = 400 nm, Intensität = 15 mW/cm2, Belichtungszeit = 60 s).
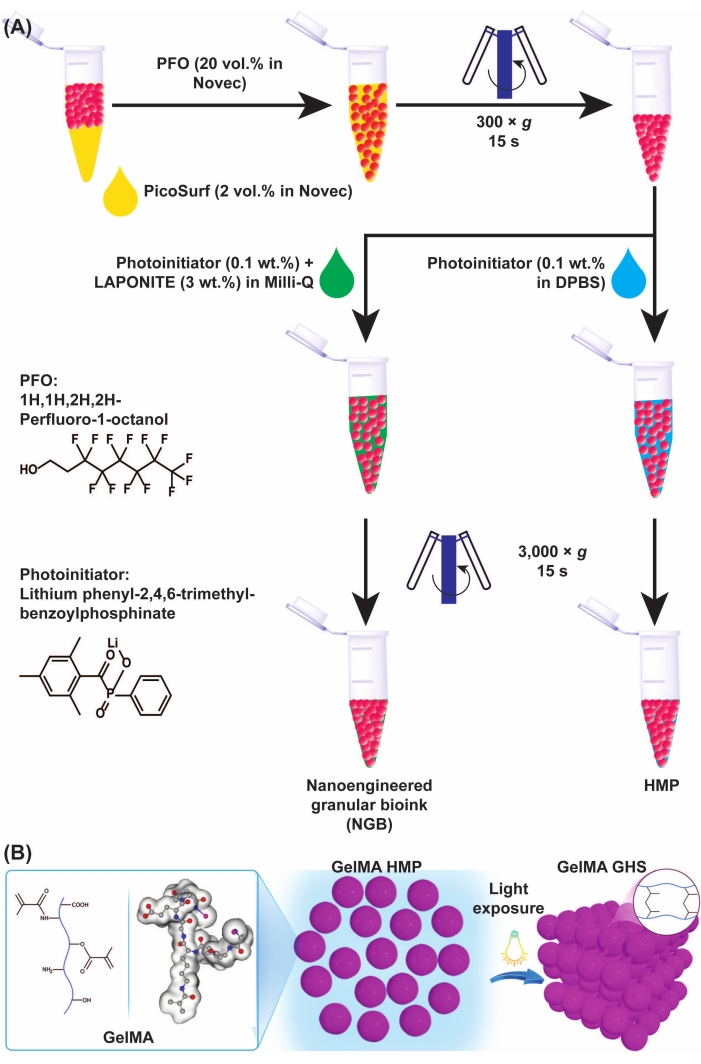
Abbildung 3: Schematische Darstellung der GelMA-Mikrogel- und GHS-Bildung. (A) Schematische Darstellung der GelMA-Mikrogeltrennung von Öl und NGB-Präparat. PFO (20 % v/v in technischer Flüssigkeit) wurde der GelMA-Mikrogel-Öl-Emulsion im Verhältnis 1:1 im Volumenverhältnis 1:1 zugesetzt, gefolgt von Vortexing und Zentrifugation bei 300 × g für 15 s. Zur Herstellung von GelMA GHS wurde die PI-Lösung (LAP 0,1 % w/v in DPBS) zu den GelMA-HMPs gegeben, gefolgt von Vortexing und Zentrifugation bei 3.000 × g für 15 s. Zur Herstellung des NGB wurden der GelMA HMP-Suspension die PI-Lösung (LAP 0,1 Gew.-% in Reinstwasser) und die Nanoplättchendispersion (3 Gew.-% in Reinstwasser) zugesetzt, gefolgt von Vortexing und Zentrifugation bei 3.000 × g für 15 s. Abbildung 3A wurde mit Genehmigung von Ataie, Z. et al.11 modifiziert (B) Die Exposition von verpackten GelMA-HMPs gegenüber Licht ergibt GHS. Abbildung 3B wurde mit Genehmigung von Sheikhi et al.15 Abkürzungen modifiziert: GelMA = Gelatinemethacryloyl; GHS = körniges Hydrogel-Gerüst; NGB = nanotechnologisch hergestellte körnige Biotinte; PFO = 1H,1H-Perfluor-1-Octanol; PI = Photoinitiator; LAP = Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat; HMP = Hydrogel-Mikropartikel; DPBS = Dulbeccos phosphatgepufferte Kochsalzlösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
GelMA wurde durch die Reaktion von Gelatine mit MA synthetisiert, wie in Abbildung 1A dargestellt. Durch Anpassung der Reaktionsbedingungen, wie z.B. der MA-Konzentration, wurden unterschiedliche Grade der MA-Substitution erhalten. Um den Grad der MA-Substitution zu quantifizieren, wurde GelMA mittels 1-H-NMR-Spektroskopie bewertet (Abbildung 1B). Vinylfunktionelle Gruppen mit repräsentativen Peaks bei den chemischen Verschiebungen von ~5-6 ...
Diskussion
Gelatine und ihre Derivate sind die am häufigsten verwendeten proteinbasierten Biomaterialien für die HMP-Herstellung. Die Herausforderung des Kompromisses zwischen Durchsatz und Partikelgröße kann mit mikrofluidischen Geräten zur Stufenemulgierung überwunden werden. Diese Geräte sind in der Lage, mehr als 40 Millionen Tröpfchen pro Stunde zu bilden, mit einem Variationskoeffizienten von weniger als 5%27. In diesem Artikel haben wir die Mikrofabrikation von Tröpfchen, die GelMA-Lösungen ...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die Autoren bedanken sich bei T. Pond, Spezialist für Forschungsunterstützung am Department of Chemical Engineering der Pennsylvania State University (Penn State), den Mitarbeitern des Nanofabrication Lab an der Penn State University und Dr. J. de Rutte von Partillion Bioscience für die Hilfe und Diskussion über Nanofabrikationsprozesse. A. Sheikhi bedankt sich für die Unterstützung des Materials Research Institute (MRI) und des College of Engineering Materials Matter at the Human Level Seed Grants, des Convergence Center for Living Multifunctional Material Systems (LiMC2) und des Exzellenzclusters Living, Adaptive and Energy-autonomous Materials Systems (livMatS) Living Multifunctional Materials Collaborative Research Seed Grant Program sowie des Startup-Fonds von Penn State. Die in dieser Publikation berichtete Forschung wurde teilweise vom National Institute of Biomedical Imaging and Bioengineering (NIBIB) der National Institutes of Health (NIH) unter der Auszeichnungsnummer R56EB032672 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Referenzen
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394 (2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115 (2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122 (2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076 (2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390 (2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644 (2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076 (2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten