È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Saggi di citotossicità con linee cellulari di zebrafish
In questo articolo
Riepilogo
Questo protocollo presenta saggi di citotossicità comunemente usati (Alamar Blue [AB], CFDA-AM, Neutral Red, e MTT assays) adattati per la valutazione della citotossicità in linee cellulari di embrioni di zebrafish (ZEM2S) e fegato (ZFL) in piastre a 96 pozzetti.
Abstract
Le linee cellulari di pesce sono diventate sempre più utilizzate negli studi di ecotossicità e sono stati proposti saggi di citotossicità come metodi per prevedere la tossicità acuta dei pesci. Pertanto, questo protocollo presenta saggi di citotossicità modificati per valutare la vitalità cellulare in linee cellulari embrionali di zebrafish (Danio rerio) (ZEM2S) e fegato (ZFL) in piastre a 96 pozzetti. Gli endpoint di citotossicità valutati sono l'integrità mitocondriale (saggi Alamar Blue [AB] e MTT), l'integrità della membrana attraverso l'attività esterasi (test CFDA-AM) e l'integrità della membrana lisosomiale (saggio Neutral Red [NR]). Dopo l'esposizione delle sostanze in esame in una piastra a 96 pozzetti, vengono eseguiti i saggi di citotossicità; qui, AB e CFDA-AM vengono eseguiti contemporaneamente, seguiti da NR sulla stessa piastra, mentre il saggio MTT viene eseguito su una piastra separata. Le letture per questi test sono prese per fluorescenza per AB e CFDA-AM e assorbanza per MTT e NR. I saggi di citotossicità eseguiti con queste linee cellulari di pesce possono essere utilizzati per studiare la tossicità acuta delle sostanze chimiche sui pesci.
Introduzione
Le sostanze chimiche devono essere testate per quanto riguarda la loro sicurezza per la salute umana e l'ambiente. I biomarcatori molecolari e cellulari sono stati sempre più considerati nelle valutazioni di sicurezza per prevedere gli effetti sugli organismi viventi da parte di agenzie e/o legislazioni regolatorie (ad esempio, REACH, OCSE, US EPA)1,2, poiché possono precedere l'esito avverso in vivo (ad esempio, interferenza endocrina, risposta immunologica, tossicità acuta, fototossicità)3,4,5,6,7 . In questo contesto, la citotossicità è stata presa come misura per prevedere la tossicità acuta dei pesci 5,8; Tuttavia, può avere molte altre applicazioni negli studi di ecotossicità, come la definizione di concentrazioni sub-citotossiche di sostanze chimiche per studiare il loro insieme più diversificato di effetti sui pesci (ad esempio, effetti di interferenza endocrina).
Nei sistemi di coltura cellulare (sistemi in vitro ), la citotossicità delle sostanze chimiche può essere determinata con metodi diversi nei tipi di endpoint. Ad esempio, un metodo di citotossicità può essere basato su un endpoint correlato alla morfologia specifica osservata durante il processo di morte cellulare, mentre un altro può determinare la citotossicità misurando la morte cellulare, la vitalità e la funzionalità, la morfologia, il metabolismo energetico e l'attaccamento e la proliferazione cellulare. Le sostanze chimiche possono influenzare la vitalità cellulare attraverso diversi meccanismi, pertanto la valutazione della citotossicità che copra diversi endpoint di vitalità cellulare è necessaria per prevedere gli effetti chimici9.
MTT e Alamar Blue (AB) sono saggi che determinano gli effetti sulla vitalità cellulare in base all'attività metabolica cellulare. Il test MTT valuta l'attività dell'enzima mitocondriale succinato deidrogenasi10. La riduzione del 3-[4,5-dimetiltiazol-2il]-2,5-difeniltetrazolio bromuro (MTT) giallastro al blu formazan si verifica solo nelle cellule vitali e la sua densità ottica è direttamente proporzionale al numero di cellule vitali10. Il saggio AB è un indicatore sensibile di ossido-riduzione, mediato da enzimi mitocondriali che fluoreggiano e cambiano colore dopo aver ridotto la resazurina a resorufin da parte delle cellule viventi11; tuttavia, anche gli enzimi citosolici e microsomiali contribuiscono alla riduzione di AB e MTT12. Questi enzimi possono includere diverse reduttasi, come alcol e aldeide ossidoreduttasi, NAD(P)H: chinone ossidoreduttasi, flavina reduttasi, NADH deidrogenasi e citocromi11.
Il test Neutral Red (NR) è un test di vitalità cellulare basato sull'incorporazione di questo colorante nei lisosomi delle cellule vitali13. L'assorbimento di NR dipende dalla capacità delle cellule di mantenere gradienti di pH. Il gradiente protonico all'interno dei lisosomi mantiene un pH inferiore al citoplasma. A pH fisiologico normale, il NR presenta una carica netta di circa zero, che gli consente di penetrare nelle membrane cellulari. Pertanto, il colorante si carica e viene trattenuto all'interno dei lisosomi. Di conseguenza, maggiore è la quantità di NR trattenuto, maggiore è il numero di cellule vitali14. Le sostanze chimiche che danneggiano la superficie cellulare o le membrane lisosomiali compromettono l'assorbimento di questo colorante.
Il test CFDA-AM è un test di vitalità cellulare fluorometrica basato sulla ritenzione di 5-carbossimetilestere diacetato di diacetato di 5-carbossimetile (CFDA-AM)15. 5-CFDA-AM, un substrato di esterasi, viene convertito in carbossifluoresceina, una sostanza fluorescente polare e non permeabile dalle membrane delle cellule viventi15; Pertanto, viene trattenuto nella parte interna di una membrana cellulare intatta, indicando cellule vitali.
Recentemente, tre saggi di citotossicità (saggi CFDA-AM, NR e AB) sono stati combinati in una linea guida ISO (International Organization for Standardization) convalidata (ISO 21115: 2019) 16 e un metodo di prova dell'OCSE (Organizzazione per la cooperazione e lo sviluppo economico) (OCSE TG 249) per valutare la tossicità acuta dei pesci utilizzando la linea cellulare RTgill-W1 (linea cellulare permanente dalla branchia della trota iridea [Oncorhynchus mykiss]) in piastre a 24 pozzetti17 . Sebbene esista un metodo basato su cellule per prevedere la tossicità acuta dei pesci, sono stati investiti sforzi nello sviluppo di metodi simili con altre specie ittiche e nell'aumento della produttività del metodo. Alcuni esempi includono lo sviluppo di linee cellulari ZFL trasfettate con geni reporter per specifiche vie di tossicità18,19, test di fototossicità nella linea cellulare RTgill-W1 20 e l'uso di linee cellulari ZFL e ZF4 (fibroblasti zebrafish derivati da embrioni di 1 giorno) per valutare la tossicità mediante diversi saggi di citotossicità21.
Danio rerio (zebrafish) è una delle principali specie ittiche utilizzate negli studi di tossicità acquatica; Pertanto, i metodi basati su cellule con linee cellulari di zebrafish per i test di tossicità dei pesci possono essere estremamente utili. La linea cellulare ZFL è una linea cellulare di epatociti epiteliali zebrafish che presenta le principali caratteristiche delle cellule parenchimali epatiche e può metabolizzare xenobiotici 7,22,23,24,25. Nel frattempo, la linea cellulare ZEM2S è una linea cellulare fibroblastica embrionale di zebrafish derivata dallo stadio di blastula che può essere utilizzata per studiare gli effetti sullo sviluppo sui pesci26,27. Pertanto, questo protocollo descrive quattro saggi di citotossicità (saggi MTT, AB, NR e CFDA-AM), con modifiche da eseguire con linee cellulari ZFL e ZEM2S in piastre a 96 pozzetti.
Protocollo
NOTA: vedere la Tabella dei materiali per l'elenco dei materiali utilizzati in questo protocollo e la Tabella 1 per la composizione delle soluzioni e dei supporti utilizzati in questo protocollo.
1. Preparazione delle celle ZFL e ZEM2S
- Iniziare con un matraccio T75 di cellule ZFL o ZEM2S con confluenza dell'80%, coltivate nel rispettivo mezzo completo a 28 °C senza CO2.
- Rimuovere il terreno di coltura dal matraccio e lavare le cellule aggiungendo 10 ml di soluzione salina tamponata con fosfato (PBS) 1x (0,01 M). Aggiungere 3 mL di 1x tripsina (0,05% v/v; 0,5 mM tripsina-EDTA) ai palloni di coltura. Incubare a 28 °C per 3 min.
- Picchiettare delicatamente il matraccio per rilasciare le cellule, quindi interrompere la digestione della tripsina aggiungendo 3 ml di terreno di coltura completo al pallone.
- Trasferire la sospensione cellulare in una provetta conica da 15 mL e centrifugare a 100 × g per 5 minuti.
- Dopo la centrifugazione, rimuovere con cautela il surnatante, aggiungere 1 mL di mezzo completo per le celle ZFL o ZEM2S e risospendere il pellet utilizzando una micropipetta.
2. Conteggio delle cellule mediante esclusione del colorante blu tripano
- Aggiungere 10 μL della sospensione cellulare e 10 μL di colorante blu tripano a un microtubo per contare le cellule e valutarne la vitalità. Mescolare la sospensione cellulare e colorare usando una pipetta.
- Quindi, trasferire 10 μL di questa miscela (sospensione cellulare + blu tripano) in una camera di Neubauer e contare le cellule nei quattro grandi quadrati (quadranti Q) posti agli angoli della camera, considerando le cellule vitali quelle che non assorbono il blu tripano. Determinare il numero di celle vitali usando l'equazione (1):
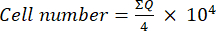 (1)
(1) - Calcolare il numero finale di celle nella sospensione cellulare moltiplicando il numero di celle determinato utilizzando l'equazione (1) per due (il fattore di diluizione dovuto all'uso del blu di tripano).
NOTA: In alternativa, è possibile utilizzare un sistema automatizzato di conteggio delle cellule (ad esempio, un citomero con funzione di conteggio delle cellule e vitalità).
3. Placcatura cellulare in piastre a 96 pozzetti
- Calcolare il volume di sospensione cellulare necessario per ottenere il numero di cellule necessarie per eseguire i saggi di citotossicità. Il numero di cellule vitali per ogni linea cellulare è indicato di seguito:
- Piastra 60.000 cellule vitali ZEM2S per pozzetto; quindi, per l'intera piastra, utilizzare sei milioni di cellule in 20 ml di mezzo completo (200 μL / pozzetto, piastra a 96 pozzetti).
- Piastra 40.000 celle ZFL vitali per pozzetto; quindi, per l'intera piastra, utilizzare quattro milioni di cellule in 20 ml di terreno completo (200 μL / pozzetto, piastra a 96 pozzetti).
- Successivamente, trasferire il rispettivo volume della sospensione cellulare in un serbatoio di reagente (sterile) e riempire con il terreno di coltura completo per ZFL o ZEM2S a 20 ml. Utilizzando una pipetta multicanale, mescolare delicatamente la soluzione su e giù.
NOTA: Fare attenzione a non formare schiuma o bolle. - Aggiungere 200 μL della sospensione cellulare a ciascun pozzetto di una piastra trasparente in polistirene a 96 pozzetti utilizzando la micropipetta multicanale. Incubare le piastre a 28 °C per 24 ore.
NOTA: La piastra deve avere almeno tre pozzetti senza celle per il controllo del bianco e solo i mezzi completi devono essere aggiunti a questi pozzetti. L'effetto bordo (causato da una maggiore evaporazione nei pozzetti di bordo) si verifica comunemente nei saggi su piastre a 96 pozzetti e può influenzare la vitalità delle cellule nei pozzetti di bordo della piastra28. Questo effetto può essere superiore o inferiore a seconda della marca e del design della piastra a 96 pozzetti28. Sebbene non abbiamo notato alcun disturbo della crescita / vitalità cellulare per ZFL e ZEM2S nei pozzetti di bordo, suggeriamo di sigillare la piastra con parafilm o pellicola sigillante adesiva per prevenire questo effetto, o coltivare le cellule solo nei 60 pozzetti interni e riempire i pozzetti di bordo con PBS.
4. Esposizione delle cellule alla sostanza chimica in esame
- Scartare con attenzione i fluidi esausti dai pozzetti utilizzando una micropipetta multicanale.
- Esporre le cellule a testare sostanze chimiche a diverse concentrazioni. Preparare le soluzioni delle concentrazioni chimiche in esame nei terreni di coltura per ZFL o ZEM2S senza siero fetale bovino (FBS) (mezzi di esposizione). Quindi, aggiungere 100 μL per pozzetto di queste soluzioni in triplice copia tecnica (cioè tre pozzetti / concentrazione chimica di prova).
- Per i controlli, posizionare i gruppi di controllo sulla stessa piastra della sostanza chimica in esame in triplicati tecnici (tre pozzetti/gruppo di controllo). Pertanto, per il controllo in bianco (B), aggiungere 100 μL dei mezzi di esposizione nei pozzetti privi di celle, per il controllo negativo (NC), aggiungere 100 μL del mezzo di esposizione ai pozzetti con celle e per il controllo positivo (PC), esporre le cellule a una soluzione di Triton X-100 all'1% preparata nei mezzi di esposizione. In alcuni casi, un controllo del solvente (SC) dovrebbe essere incluso nella piastra, considerando una concentrazione chiaramente non citotossica come concentrazione finale di solvente.
NOTA: Si consiglia di utilizzare lo 0,5% di DMSO come solvente; Il DMSO può essere utilizzato fino all'1% come solvente in queste linee cellulari senza superare la soglia di citotossicità del 10% correlata al controllo negativo. - Incubare le piastre a 28 °C per 24 ore. Sigillare le piastre con parafilm o pellicola sigillante adesiva per evitare l'evaporazione del terreno di coltura.
NOTA: Alcune sostanze chimiche possono avere assorbanza di fondo intrinseca o fluorescenza che può interferire con l'assorbanza o la fluorescenza del colorante indicatore (ad esempio, composti con colore possono influenzare l'assorbanza, albumina sierica29 e composti che interferiscono con gli enzimi di riduzione30,31). In questo caso, la piastra deve includere un controllo aggiuntivo aggiungendo soluzioni chimiche di prova nei pozzetti senza celle. Questo per verificare l'eventuale interferenza dell'autoassorbanza/autofluorescenza chimica con i coloranti. Se viene rilevata un'interferenza, si dovrebbe valutare se può essere esclusa per ottenere una corretta previsione della citotossicità.
5. Saggi di citotossicità
NOTA: preparare tutte le soluzioni secondo la Tabella 1. Tutte le fasi descritte di seguito (Figura 1) vengono eseguite in condizioni sterili. L'uso di una pipetta per scartare i supporti di esposizione non è raccomandato, perché le cellule possono facilmente staccarsi dai pozzetti dopo il trattamento chimico.
- Saggi AB e CFDA-AM
- Dopo 24 ore di esposizione alla sostanza chimica in esame, gettare con cautela il supporto di esposizione versando il contenuto in un vassoio di raccolta.
- Lavare la piastra con 200 μL di PBS. Rimuovere con cautela il PBS versandolo in un vassoio di raccolta per evitare di perdere cellule.
- Aggiungere 100 μL per pozzetto di soluzione AB/CFDA-AM. Incubare la piastra per 30 minuti al buio a 28 °C.
- Misurare la fluorescenza in un lettore di piastre a fluorescenza a 530 nm (eccitazione) e 595 nm (emissione) per AB, e a 493 nm (eccitazione) e 541 nm (emissione) per CFDA-AM.
- Saggio NR
NOTA: Le fasi per il test NR vengono eseguite immediatamente dopo i test AB e CFDA-AM (Figura 1).- Centrifugare la soluzione di lavoro NR (40 μg/ml) a 600 × g per 10 min.
NOTA: La precipitazione di NR nel tubo non deve essere trasferita alle piastre. Pertanto, dopo la centrifugazione della soluzione di lavoro NR, raccogliere il surnatante utilizzando una pipetta senza aspirare i precipitati NR. Trasferire il surnatante in un serbatoio di reagenti. - Rimuovere con cautela la soluzione AB/CFDA-AM versando il contenuto in un vassoio di raccolta.
- Aggiungere 100 μL per pozzetto della soluzione di lavoro NR utilizzando una micropipetta multicanale. Incubare la piastra a 28 °C per 3 ore.
NOTA: Dopo l'incubazione di 3 ore, osservare se si è verificata una precipitazione NR nelle piastre usando un microscopio. I precipitati NR possono interferire con la quantificazione della vitalità cellulare, quindi non dovrebbero essere presenti. - Rimuovere con cautela la soluzione NR versando il contenuto in un vassoio di raccolta. Lavare i pozzetti aggiungendo 150 μL di PBS per pozzetto.
- Aggiungere 150 μL per pozzetto della soluzione di estrazione NR e incubare la piastra su uno shaker per 10 minuti per agitare delicatamente. Misurare l'assorbanza a 540 nm in un lettore di piastre.
NOTA: è necessario effettuare una seconda lettura a 690 nm per escludere qualsiasi assorbanza delle impronte digitali di fondo nella piastra.
- Centrifugare la soluzione di lavoro NR (40 μg/ml) a 600 × g per 10 min.
- Saggio MTT
NOTA: Il test MTT deve essere eseguito separatamente dai saggi sopra descritti (in una nuova piastra) (Figura 2).- Rimuovere con cautela il supporto di esposizione versando il contenuto in un vassoio di raccolta.
- Aggiungere 100 μL di soluzione di lavoro MTT per pozzetto utilizzando una micropipetta multicanale. Incubare la piastra a 28 °C per 4 ore.
- Eliminare la soluzione MTT versando il contenuto in un vassoio di raccolta.
- Aggiungere 100 μL per pozzetto di DMSO per estrarre i cristalli di formazan, incubando la piastra su uno shaker per 10 minuti. Misurare l'assorbanza a 570 nm utilizzando un lettore di piastre.
NOTA: è necessario effettuare una seconda lettura a 690 nm per escludere qualsiasi assorbanza delle impronte digitali di fondo nella piastra. È importante notare che le sostanze chimiche in esame possono interferire con l'MTT, che deve essere valutato per garantire la qualità dei dati generati32. Per questo, devono essere esposti pozzetti privi di cellule contenenti le concentrazioni di prova e MTT (0,5 mg / ml), seguiti da incubazione per osservare qualsiasi cambiamento di colore nei pozzetti che possa aumentare l'assorbanza e portare a risultati di falsa vitalità. Le sostanze chimiche che interagiscono con MTT devono essere evitate in questo test.
6. Calcolo della vitalità/citotossicità cellulare
NOTA: L'assorbanza grezza o la fluorescenza acquisita viene utilizzata per calcolare la vitalità cellulare come percentuale correlata al controllo negativo (per le sostanze chimiche in esame preparate direttamente nei mezzi di esposizione) o al controllo del solvente (per le sostanze chimiche in esame preparate utilizzando solventi, come il DMSO). Prima di determinare la percentuale di vitalità della cella, i dati grezzi devono essere normalizzati dal controllo vuoto.
- Calcolare l'assorbanza o la fluorescenza media per ciascuna concentrazione chimica in esame e gruppo di controllo (tre pozzetti/trattamento).
- Per determinare la percentuale di vitalità cellulare relativa al controllo (negativo o solvente), utilizzare l'equazione (2):
 (2)
(2)
NOTA: Le unità di assorbanza (abs) o fluorescenza (fluo) rappresentano la media di assorbanza o fluorescenza misurata nei tre pozzetti per concentrazione; Blank rappresenta pozzi senza celle.
Risultati
La Figura 3 mostra le piastre dei saggi AB, CFDA-AM, NR e MTT. Per il saggio AB (Figura 3A), i pozzetti vuoti e i pozzetti con nessun o un numero ridotto di cellule vitali mostrano colore blu e bassa fluorescenza, mentre i pozzetti con un alto numero di cellule vitali sono rosati e presentano alti valori di fluorescenza a causa della trasformazione della resazurina (AB) in resorufin (sostanza rosata) da parte delle cellule vitali. Per il test CFDA-AM, non vi è ...
Discussione
I saggi di citotossicità sono ampiamente utilizzati per la valutazione della tossicità in vitro e questo articolo di protocollo presenta quattro saggi di citotossicità comunemente usati modificati per essere eseguiti in linee cellulari di zebrafish (cioè densità cellulare per piastra a 96 pozzetti, tempo di incubazione nel test MTT, deplezione di FBS durante la condizione di esposizione chimica e concentrazione massima accettabile per il SC). Poiché questi saggi quantificano la citotossicità in base a div...
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
In memoria del Dr. Márcio Lorencini, coautore di questo lavoro, eccellente ricercatore nel campo della cosmesi e dedito alla promozione della ricerca cosmetica in Brasile. Gli autori sono grati al Multi-user Laboratory del Dipartimento di Fisiologia (UFPR) per la disponibilità delle attrezzature e per il sostegno finanziario del Coordinamento per il miglioramento del personale dell'istruzione superiore (CAPES, Brasile) (Codice finanziario 001) e del Grupo Boticario.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-CFDA, AM (5-Carboxyfluorescein Diacetate, Acetoxymethyl Ester) | Invitrogen | C1345 | |
| Cell culture plate, 96 well plate | Sarstedt | 83.3924 | Surface: Standard, flat base |
| DMEM | Gibco | 12800-017 | Powder, high glucose, pyruvate |
| Ham's F-12 Nutrient Mix, powder | Gibco | 21700026 | Powder |
| HEPES (1 M) | Gibco | 15630080 | |
| Leibovitz's L-15 Medium | Gibco | 41300021 | Powder |
| Neutral red | Sigma-Aldrich | N4638 | Powder, BioReagent, suitable for cell culture |
| Orbital shaker | Warmnest | KLD-350-BI | 22 mm rotation diameter |
| Dulbeccos PBS (10X) with calcium and magnesium | Invitrogen | 14080055 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | Powder, BioReagent, suitable for cell culture |
| RPMI 1640 Medium | Gibco | 31800-014 | Powder |
| SFB - Fetal Bovine Serum, qualified, USDA-approved regions | Gibco | 12657-029 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Powder, bioreagent for molecular biology |
| Thiazolyl Blue Tetrazolium Bromide 98% | Sigma-Aldrich | M2128 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| ZEM2S cell line | ATCC | CRL-2147 | This cell line was kindly donated by Professor Dr. Michael J. Carvan (University of Wisconsin, Milwaukee, USA) |
| ZFL cell line | BCRJ | 256 |
Riferimenti
- ECHA. Non-Animal Approaches-Current Status of Regulatory Applicability Under the REACH, CLP and Biocidal Products Regulations. ECHA. , (2017).
- Alternative Methods Accepted by US Agencies. National Toxicology Program, and US Department of Health and Human Services Available from: https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/index.html (2022)
- Schirmer, K. Proposal to improve vertebrate cell cultures to establish them as substitutes for the regulatory testing of chemicals and effluents using fish. Toxicology. 224 (3), 163-183 (2006).
- Scholz, S., et al. Alternatives to in vivo tests to detect endocrine disrupting chemicals (EDCs) in fish and amphibians-screening for estrogen, androgen and thyroid hormone disruption. Critical Reviews in Toxicology. 43 (1), 45-72 (2013).
- Tanneberger, K., et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay. Environmental Science & Technology. 47 (2), 1110-1119 (2013).
- Roesler, R., Lorencini, M., Pastore, G. Brazilian cerrado antioxidant sources: cytotoxicity and phototoxicity in vitro. Food Science and Technology. 30, 814-821 (2010).
- Ruyra, A., et al. Zebrafish liver (ZFL) cells are able to mount an anti-viral response after stimulation with Poly (I:C). Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 182, 55-63 (2015).
- Natsch, A., Laue, H., Haupt, T., von Niederhäusen, V., Sanders, G. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay. Environmental Toxicology and Chemistry. 37 (3), 931-941 (2018).
- Freshney, R. I. Cytotoxicity. Culture of Animal Cells: A Manual of Basic Technique. , (2005).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology In Vitro. 15 (3), 257-259 (2001).
- Borenfreund, E., Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicology Letters. 24 (2-3), 119-124 (1985).
- Repetto, G., del Peso, A., Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nature Protocols. 3 (7), 1125-1131 (2008).
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglue, E. Guidelines for cell viability assays. Food Frontiers. 1 (3), 332-349 (2020).
- Water Quality-Determination of Acute Toxicity of Water Samples and Chemicals to a Fish Gill Cell Line (RTgill-W1) (ISO 21115:2019). International Organization for Standardization Available from: https://www.iso.org/standar/69933.html (2019)
- Organisation for Economic Co-operation and Development. . Test Guideline No. 249: Fish Cell Line Acute Toxicity-The RTgill-W1 Cell Line Assay. OECD Guidelines for the Testing of Chemicals, Section 2. Effects on Biotic Systems. , (2021).
- Lungu-Mitea, S., Lundqvist, J. Potentials and pitfalls of transient in vitro reporter bioassays: interference by vector geometry and cytotoxicity in recombinant zebrafish cell lines. Archives of Toxicology. 94 (8), 2769-2784 (2020).
- Lungu-Mitea, S., Han, Y., Lundqvist, J. Development, scrutiny, and modulation of transient reporter gene assays of the xenobiotic metabolism pathway in zebrafish hepatocytes. Cell Biology and Toxicology. , 1-23 (2021).
- Schirmer, K., Chan, A. G., Greenberg, B. M., Dixon, D. G., Bols, N. C. Methodology for demonstrating and measuring the photocytotoxicity of fluoranthene to fish cells in culture. Toxicology In Vitro. 11 (1-2), 107-119 (1997).
- Lungu-Mitea, S., et al. Modeling bioavailable concentrations in zebrafish cell lines and embryos increases the correlation of toxicity potencies across test systems. Environmental Science & Technology. 55 (1), 447-457 (2021).
- Cavalcante, D. G. S. M., et al. Cytotoxic, biochemical and genotoxic effects of biodiesel produced by different routes on ZFL cell line. Toxicology In Vitro. 28 (6), 1117-1125 (2014).
- Meng, Q., Yeung, K., Chan, K. M. Toxic effects of octocrylene on zebrafish larvae and liver cell line (ZFL). Aquatic Toxicology. 236, 105843 (2021).
- Kwok, M. L., Chan, K. M. Oxidative stress and apoptotic effects of copper and cadmium in the zebrafish liver cell line ZFL. Toxicology Reports. 7, 822-835 (2020).
- Yang, J., Chan, K. M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL. Aquatic Toxicology. 159, 138-147 (2015).
- Bradford, C. S., Sun, L., Collodi, P., Barnes, D. W. Cell cultures from zebrafish embryos and adult tissues. Journal of Tissue Culture Methods. 16 (2), 99-107 (1994).
- He, S., et al. Genetic and transcriptome characterization of model zebrafish cell lines. Zebrafish. 3 (4), 441-453 (2006).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochemistry and Biophysics Reports. 26, 100987 (2021).
- Funk, D., Schrenk, H. -. H., Frei, E. Serum albumin leads to false-positive results in the XTT and the MTT assay. BioTechniques. 43 (2), 178 (2007).
- Dayeh, V. R., Bols, N. C., Tanneberger, K., Schirmer, K., Lee, L. E. J. The use of fish-derived cell lines for investigation of environmental contaminants: An update following OECD's fish toxicity testing framework no. 171. Current Protocols in Toxicology. 1, (2013).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
- Ulukaya, E., Colakogullari, M., Wood, E. J. Interference by anti-cancer chemotherapeutic agents in the MTT-tumor chemosensitivity assay. Chemotherapy. 50 (1), 43-50 (2004).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10 (2), 128-134 (2011).
- Weimer, M., et al. The impact of data transformations on concentration-response modeling. Toxicology Letters. 213 (2), 292-298 (2012).
- Green, J. W., Holbech, T. A., Henrik, Chapter 4: Analysis of Continuous Data (Regression). Statistical Analysis of Ecotoxicity Studies. , (2018).
- Proença, S., et al. Effective exposure of chemicals in in vitro cell systems: A review of chemical distribution models. Toxicology In Vitro. 73, 105133 (2021).
- Guidony, N. S., et al. ABC proteins activity and cytotoxicity in zebrafish hepatocytes exposed to triclosan. Environmental Pollution. 271, 116368 (2021).
- da Silva, N. D. G., et al. Interference of goethite in the effects of glyphosate and Roundup® on ZFL cell line. Toxicology In Vitro. 65, 104755 (2020).
- Yang, Y., et al. Temperature is a key factor influencing the invasion and proliferation of Toxoplasma gondii in fish cells. Experimental Parasitology. 217, 107966 (2020).
- Lopes, F. M., Sandrini, J. Z., Souza, M. M. Toxicity induced by glyphosate and glyphosate-based herbicides in the zebrafish hepatocyte cell line (ZF-L). Ecotoxicology and Environmental Safety. 162, 201-207 (2018).
- Lachner, D., Oliveira, L. F., Martinez, C. B. R. Effects of the water soluble fraction of gasoline on ZFL cell line: Cytotoxicity, genotoxicity and oxidative stress. Toxicology In Vitro. 30, 225-230 (2015).
- Morozesk, M., et al. Effects of multiwalled carbon nanotubes co-exposure with cadmium on zebrafish cell line: Metal uptake and accumulation, oxidative stress, genotoxicity and cell cycle. Ecotoxicology and Environmental Safety. 202, 110892 (2020).
- Dognani, G., et al. Nanofibrous membranes for low-concentration Cr VI adsorption: kinetic, thermodynamic and the influence on ZFL cells viability. Materials Research. , 24 (2021).
- ZEM2S (ATCC®CRL-2147™). American Type Culture Collection Available from: https://www.atcc.org/products/crl-2147 (2023)
- Chen, Y., et al. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environmental Toxicology and Chemistry. 33 (3), 606-615 (2014).
- Pomponio, G., et al. In vitro kinetics of amiodarone and its major metabolite in two human liver cell models after acute and repeated treatments. Toxicology In Vitro. 30, 36-51 (2015).
- Mori, M., Wakabayashi, M. Cytotoxicity evaluation of chemicals using cultured fish cells. Water Science and Technology. 42 (7-8), 277-282 (2000).
- Caminada, D., Escher, C., Fent, K. Cytotoxicity of pharmaceuticals found in aquatic systems: comparison of PLHC-1 and RTG-2 fish cell lines. Aquatic Toxicology. 79 (2), 114-123 (2006).
- Giltrap, M., et al. In vitro screening of organotin compounds and sediment extracts for cytotoxicity to fish cells. Environmental Toxicology and Chemistry. 30 (1), 154-161 (2011).
- Hollert, H., Duerr, M., Erdinger, L., Braunbeck, T. Cytotoxicity of settling particulate matter and sediments of the Neckar River (Germany) during a winter flood. Environmental Toxicology and Chemistry. 19 (3), 528-534 (2000).
- Pannetier, P., et al. Toxicity assessment of pollutants sorbed on environmental sample microplastics collected on beaches: Part I-adverse effects on fish cell line. Environmental Pollution. 248, 1088-1097 (2019).
- Ternjej, I., Srček, V. G., Mihaljević, Z., Kopjar, N. Cytotoxic and genotoxic effects of water and sediment samples from gypsum mining area in channel catfish ovary (CCO) cells. Ecotoxicology and Environmental Safety. 98, 119-127 (2013).
- Hamid, R., Rotshteyn, Y., Rabadi, L., Parikh, R., Bullock, P. Comparison of alamar blue and MTT assays for high throughput screening. Toxicology In Vitro. 18 (5), 703-710 (2004).
- Vistica, D. T., et al. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production. Cancer Research. 51 (10), 2515-2520 (1991).
- Knauer, K., Lampert, C., Gonzalez-Valero, J. Comparison of in vitro and in vivo acute fish toxicity in relation to toxicant mode of action. Chemosphere. 68 (8), 1435-1441 (2007).
- Stadnicka-Michalak, J., Tanneberger, K., Schirmer, K., Ashauer, R. Measured and modeled toxicokinetics in cultured fish cells and application to in vitro-in vivo toxicity extrapolation. PLoS One. 9 (3), 92303 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon