Method Article
LipidUNet-Метод характеристики и количественной оценки липидных отложений с использованием пигментного эпителия сетчатки, полученного из iPSC
В этой статье
Резюме
Дегенеративные заболевания глаз, поражающие пигментный эпителиевый слой сетчатки глаза, имеют моногенное и полигенное происхождение. Было разработано несколько моделей заболеваний и программное обеспечение LipidUNet для изучения механизмов заболевания, а также потенциальных терапевтических вмешательств.
Аннотация
Пигментный эпителий сетчатки (RPE) представляет собой монослой гексагональных клеток, расположенных в задней части глаза. Он обеспечивает питание и поддержку фоторецепторов и хориоидальных капилляров, выполняет фагоцитоз наружных сегментов фоторецепторов (POS) и секретирует цитокины поляризованным образом для поддержания гомеостаза наружной сетчатки. Дисфункциональный RPE, вызванный мутациями, старением и факторами окружающей среды, приводит к дегенерации других слоев сетчатки и вызывает потерю зрения. Отличительной фенотипической особенностью дегенеративного РПЭ являются внутриклеточные и субклеточные отложения, богатые липидами. Эти отложения являются общим фенотипом при различных дегенеративных заболеваниях сетчатки. Для воспроизведения фенотипа липидного депонирования моногенных дегенераций сетчатки in vitro из фибробластов пациентов был получен индуцированный плюрипотентный RPE, полученный из стволовых клеток (iRPE). Клеточные линии, полученные от пациентов с болезнью Штаргардта и поздней дегенерацией сетчатки (L-ORD), получали POS в течение 7 дней для воспроизведения физиологической функции RPE, которая вызывала патологию, вызванную фагоцитозом POS при этих заболеваниях. Чтобы создать модель возрастной макулярной дегенерации (ВМД), полигенного заболевания, связанного с альтернативной активацией комплемента, iRPE был озадачен альтернативными анафилатоксинами комплемента. Внутриклеточные и субклеточные липидные отложения были охарактеризованы с использованием нильского красного, бор-дипиррометена (BODIPY) и аполипопротеина E (APOE). Для количественной оценки плотности отложений липидов было разработано программное обеспечение на основе машинного обучения LipidUNet. Программное обеспечение было обучено на проекционных изображениях iRPE максимальной интенсивности на культуральных поверхностях. В будущем он будет обучен анализировать трехмерные (3D) изображения и количественно определять объем липидных капель. Программное обеспечение LipidUNet станет ценным ресурсом для поиска лекарств, которые уменьшают накопление липидов в моделях заболеваний.
Введение
Пигментный эпителий сетчатки (RPE) представляет собой монослой клеток, расположенных в задней части глаза, рядом с фоторецепторами сетчатки. RPE играет жизненно важную роль в поддержании правильного зрения, обеспечивая метаболическую и структурную поддержку фоторецепторов. Здоровые клетки RPE характеризуются отчетливой гексагональной морфологией. Они соединены плотными соединениями, которые позволяют РПЭ действовать как барьер между хориокапилляром, расположенным на его базальной стороне, и фоторецепторами, расположенными апикально. Для поддержания экосистемы сетчатки RPE перемещает ключевые метаболиты, например, глюкозу, к фоторецепторам таким образом, чтобы свести к минимуму потребление глюкозы в RPE1. Из-за этого ограничения RPE зависит от других метаболитов для поддержания своих метаболических потребностей, включая жирные кислоты, которые RPE превращает в кетоны посредством β-окисления2. Учитывая склонность RPE использовать жирные кислоты, которые, вероятно, рециркулируются в результате пищеварения внешнего сегмента фоторецепторов (POS), в качестве источника энергии, пагубные изменения в путях обработки липидов в RPE часто приводят или связаны как с моногенными, так и с полигенными дегенеративными заболеваниями сетчатки3.
Возрастная макулярная дегенерация (ВМД), полигенное дегенеративное заболевание глаз, вызывающее дегенерацию РПЭ, также связано с аберрантной аутофагией и липидным обменом в монослое РПЭ. Неспособность дисфункционального монослоя RPE обрабатывать POS и выполнять другие критические функции приводит к внеклеточным (суб-RPE) отложениям, называемым базальными линейными отложениями (BLinD), расположенными между RPE и мембраной Бруха - отличительной чертой патологий ВМД. Основные компоненты BLinD включают липопротеины, наиболее распространенным из которых является аполипопротеин E (APOE)4. Накопление тонких слоев BLinD может привести к появлению мягких друз, которые признаются клиническим симптомомВМД 5,6.
Несколько групп показали, что модели заболеваний in vitro, полученные из стволовых клеток, которые вызывают дисфункцию RPE, характеризуются накоплением липидов sub-RPE 7,8,9. Hallam et al. (2017) получили индуцированный плюрипотентный RPE, полученный из стволовых клеток (iRPE), у пациентов с высоким риском развития ВМД из-за полиморфизма гена CFH. iRPE показал накопление друз, как отмечено APOE, а RPE с высоким риском накопил большие отложения, чем iRPE, генерируемый у пациентов с низким риском10.
Чтобы создать модель in vitro , которая повторяет клеточные признаки ВМД, такие как липидные капли и отложение друз, линии iRPE, полученные из образцов крови пациентов, были созданы с использованием ранее опубликованного протокола11, ориентированного на развитие. iRPE подвергали комплемент-компетентной сыворотке человека (CC-HS), раствору, содержащему анафилатоксины, которые имитируют одну из возможных причин ВМД: повышенную передачу сигналов альтернативного комплемента8. Результирующее клеточное и субклеточное отложение липидных отложений измеряли с использованием широко используемых липидных и липопротеиновых маркеров, APOE, Nile Red и BODIPY. С помощью этих маркеров было показано, что активированная передача сигналов комплемента через CC-HS усугубляет накопление липидов в клетках iRPE8.
Для разработки модели моногенного дегенеративного заболевания сетчатки были разработаны линии iRPE от пациентов с болезнью Штаргардта, заболеванием, вызванным мутациями гена ABCA4 в RPE. Ранее было показано, что при нокауте ABCA4 внутри RPE12 накапливается липофусцин A2E, внутриклеточное отложение, которое, как известно, содержит высокие уровни фосфолипидов и светозависимых продуктов перекисного окисления липидов. Нокаутирующие линии ABCA4 были разработаны наряду с линиями пациентов, и обе были подвергнуты POS-подаче. Stargardt iRPE продемонстрировал патологию, вызванную фагоцитозом POS, демонстрируя повышенное накопление липидов, количественно определяемое окрашиванием BODIPY. РПЭ, полученный из ИПСК ABCA4 KO, был подвергнут обработке CC-HS; количественная оценка сигнала BODIPY также показала дефект обработки липидов в модели болезни Штаргардта9.
Учитывая распространенность этих заболеваний и потребность в эффективных терапевтических средствах, наряду с соответствующими моделями заболеваний, описанными выше, необходимо разработать надежные методы количественной оценки эффективности потенциальных методов лечения. Для объективной, автоматизированной и стандартизированной количественной оценки липидных отложений было создано программное обеспечение на основе машинного обучения LipidUNet, чтобы в сочетании с инструментами анализа масок можно было быстро и эффективно идентифицировать отложение липидов с использованием общих маркеров Nile Red, BODIPY и APOE. Сводная статистика, полученная с помощью этого аналитического конвейера, затем может быть проанализирована и отображена графически, что позволяет легко сравнивать условия лечения. Схема протокола показана на рисунке 1.
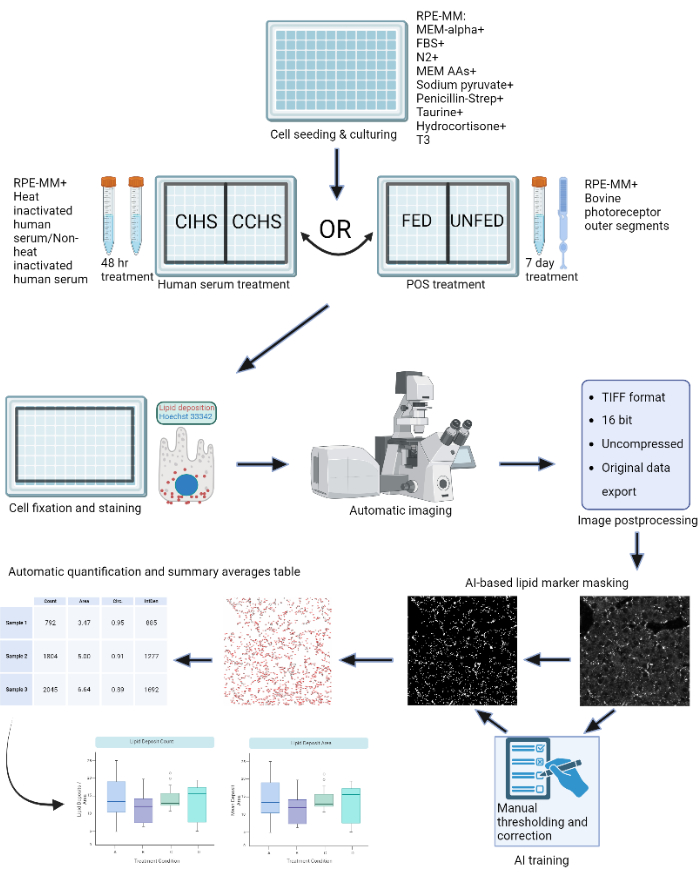
Рисунок 1: Схема протокола: клетки RPE выращивают на 96-луночном планшете и подвергают воздействию активной сыворотки человека или очищенных наружных сегментов крупного рогатого скота для моделирования различных типов дегенерации сетчатки in vitro. Клетки RPE фиксируются и окрашиваются для отложений липопротеинов с помощью Nile Red, BODIPY и APOE. Конфокальный микроскоп используется для получения Z-стеков флуоресцентно меченных липидных частиц, которые впоследствии обрабатываются в 2D-проекции максимальной интенсивности. Алгоритм машинного обучения был обучен распознавать и правильно сегментировать частицы липопротеинов. Генерируются сводные таблицы, содержащие количество частиц и различные метрики формы, которые можно использовать для последующего построения графиков и статистического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все шаги протокола соответствуют руководящим принципам, изложенным комитетом по этике исследований человека NIH. Работа со стволовыми клетками и сбор образцов пациентов были одобрены Объединенным институциональным наблюдательным советом по неврологии (CNS IRB) при Управлении по защите исследований человека (OHRP), NIH, в соответствии с руководящими принципами 45 CFR 46 правительства США. Образцы пациентов были собраны с использованием одобренной CNS формы согласия IRB в соответствии с критериями, установленными Хельсинкской декларацией под номером протокола NCT01432847 (https://clinicaltrials.gov/ct2/show/NCT01432847?cond=NCT01432847&draw=2&rank=1).
1. Генерация iRPE
- Сгенерируйте iRPE из iPSC, полученного из крови пациента, в соответствии с опубликованным протоколом Sharma et al., 202211 (рис. 2 и рис. 3).
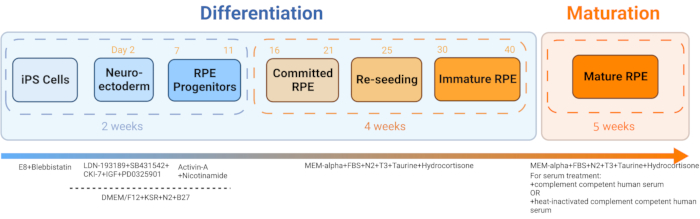
Рисунок 2: Схема дифференциации и созревания iRPE. Для генерации iRPE следовали установленному протоколу дифференцировки, и клеткам давали созревать в течение 5 недель. Полученная клеточная культура действует как модель in vitro , которой можно манипулировать с помощью различных методов лечения, чтобы имитировать дисфункцию RPE при таких заболеваниях, как ВМД и болезнь Штаргардта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
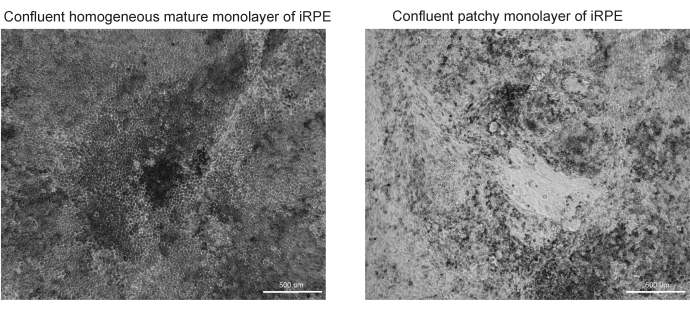
Рисунок 3: Репрезентативные образы успешной и неудачной дифференциации и созревания RPE. Два изображения светлого поля при 10-кратном увеличении TJP1 RPE показаны на 42-й день протокола iRPE. (A) Успешная дифференциация и созревание продемонстрируют слияние RPE с пигментацией и полигональной морфологией. (B) Неудачная дифференцировка и созревание покажет скопления умирающих клеток, как показано здесь. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Подготовка сред для технического обслуживания СИЗОД (СИЗОД-ММ)
- Разморозьте добавку N2 при температуре 4 °C на ночь. Разморозьте все остальные реагенты при комнатной температуре (RT).
- В стерильных условиях добавьте реагенты, перечисленные в таблице 1 , с указанными коэффициентами разбавления в соответствии с протоколом, установленным Sharma et al., 202211.
- Хорошо перемешайте материал и отфильтруйте его с помощью фильтрующего устройства 0,22 мкм.
ПРИМЕЧАНИЕ: Носитель пригоден для использования в течение 2 недель при хранении при температуре 4 °C.
3. Посев пластин на 96 лунок
- Разморозьте аликвоту витронектина при РТ в течение 3-5 минут или до полного таяния льда.
- Разбавьте витронектин фосфатно-буферным физиологическим раствором Дульбекко (DPBS) для получения желаемого рабочего раствора с использованием разведения 1:200 (витронектин: DPBS). Для 96-луночной пластины покройте каждую лунку 200 мкл рабочего раствора.
- Смешайте размороженный ингибитор ROCK (дигидрохлорид Y-27632) с RPE-MM в разведении 1:1000 для достижения конечной концентрации 10 мкМ. Это гальванический носитель для ячеек RPE.
- Разморозьте флакон iRPE с помощью автоматизированной системы размораживания клеток и перенесите клеточную суспензию iRPE в пробирку объемом 50 мл.
- Разбавьте суспензию ячейки гальваническим носителем в соотношении 1:10. Центрифугируйте пробирку при 400 x g в течение 5 мин.
- Тщательно аспирируйте надосадочную жидкость и ресуспендируйте клетки в 10 мл гальванического носителя.
- Смешайте 400 мкл гальванической среды со 100 мкл ресуспендированного раствора ячеек для подсчета клеток. Используйте эту аликвоту для определения жизнеспособной клеточной концентрации клеточной суспензии с помощью счетчика жизнеспособности клеток.
- Разбавьте клеточную суспензию гальванической средой до конечной концентрации 60 000 клеток/мл.
- Полностью аспирируйте раствор витронектинового покрытия из 96-луночной пластины и распределите 200 мкл клеточной суспензии в каждую лунку. Будет примерно 12 000 клеток / лунка или ~ 200 клеток / мм2.
- Инкубируют засеянные клеточные пластины в течение 48 ч при 37 °C и 5% CO2. Через 48 ч сменить носитель на РПЭ-ММ без добавки ингибитора РОК. Меняйте носитель каждые 2-3 дня в течение 5-недельного периода созревания.
4. Модели заболеваний in vitro
- Дополнять компетентное лечение сывороткой человека (CC-HS)
- Разморозьте сыворотку, способную дополнить человеческий продукт, при температуре 4 ° C в течение ночи.
- Приготовьте CC-HS и дополните некомпетентные среды сыворотки человека (CI-HS).
- Чтобы приготовить 5% среду CC-HS, смешайте размороженный комплемент компетентной сыворотки человека с RPE-MM в разведении 1:20. Перед использованием отфильтруйте раствор через фильтрующий фильтр 0,22 мкм.
- Чтобы приготовить среду с 5% комплементом из сыворотки крови человека (CI-HS), сначала инактивируйте CC-HS в водяной бане с температурой 57 °C в течение 30 минут, а затем смешайте с питательной средой в разведении 1:20. Перед использованием отфильтруйте раствор через фильтрующий фильтр 0,22 мкм.
- Сыворотку обрабатывают клетками 200 мкл 5% CC-HS или 5% CI-HS в течение общего времени инкубации 48 ч, обновляя среду через 24 часа.
- Промойте клетки 1x DPBS и зафиксируйте их 4% параформальдегидом в течение 20 минут при RT. Промойте еще раз 1x DPBS и храните образцы при температуре 4 °C, погруженные в 200 мкл DPBS.
- ДОПОЛНИТЕЛЬНО: При желании лизируйте клетки из пластины, чтобы показать только отложение липидов суб-RPE.
- Чтобы лизировать клетки и оставить только липидные отложения, удалите среду и добавьте в каждую лунку по 200 мкл деионизированной воды.
- Инкубировать 10-15 мин, пипеткой вверх и вниз до удаления клеток. Промойте еще раз 200 мкл деионизированной воды и немедленно зафиксируйте клетки 4% параформальдегидом.
- Подтвердите эффективность удаления клеток с помощью ядерного окрашивания с помощью Hoechst. Добавьте Hoechst в разведении 1:2000 к 1x раствору DPBS, содержащему 1% бычьего сывороточного альбумина (BSA), 0,5% Tween 20 и 0,5% Triton-X 100. Инкубировать при РТ в течение 1 ч в темноте. Затем постирайте с помощью 1x DPBS.
- Лечение наружного сегмента фоторецепторов (POS) на iRPE
- Подготовка POS
- Извлеките трубку с гранулами POS из хранилища при температуре -80 °C и разморозьте на ночь при температуре 4 °C в закрытом ведре со льдом.
- Приготовьте буфер для стирки POS, смешав 10 г сахарозы с 40 мл двойного деионизированного H 2 O(ddH2O).
- Нагрейте смесь при температуре 40-50 °C, осторожно помешивая, в течение 15 минут. Добавьте в смесь 840 мг гидрокарбоната натрия и перемешайте при нагревании в течение 10 мин.
- Отрегулируйте общий объем буфера для стирки POS до 100 мл с ddH2O и отрегулируйте pH раствора до 8,3 с 1 N HCl или 1 N NaOH по мере необходимости. Отфильтруйте моющий раствор с помощью фильтра 0,22 мкм.
ПРИМЕЧАНИЕ: Протокол можно поставить на паузу; буфер для стирки POS можно хранить при температуре 4 °C в течение ночи. - После размораживания суспендируйте гранулы в 15 мл буфера для стирки POS. Будьте осторожны во время суспензии пеллет, чтобы обеспечить целостность POS. Центрифугируйте суспензию POS при 600 x g при 4 ° C в течение 20 мин, а затем аспирируйте надосадочную жидкость.
- Ресуспендируйте гранулы POS в 10 мл буфера для стирки POS.
- Удалите аликвоту 100 мкл буфера для стирки POS + POS (раствор POS) и разбавьте 400 мкл 1x DPBS. Нанесите 50 мкл разбавленного раствора POS на пластину с кровяным агаром и агарозную пластину, чтобы проверить наличие бактериальных и грибковых загрязнений. Подготовьте положительный контроль для каждого и инкубируйте все пластины в течение 48 ч при 37 °C.
- Проведите анализ кПЦР, добавив 1 мкл раствора POS в отверстие для обнаружения для проверки на микоплазму. Чтобы амплификировать фрагменты ДНК, выполните 40 циклов денатурации (95 ° C, 15 с), а также отжига и удлинения (60 ° C, 1 мин). Прямой и обратный праймеры для обнаружения микоплазмы в образце POS следующие:
Передний праймер: GGA TTA GAT ACC CTG GTA GTC CAC G
Обратная грунтовка: CGT CAA TTC CTT TAA GTT TCA CTC TTG GC - Измерьте концентрацию POS с помощью клеточного анализатора и аликвоты в соответствии с потребностями. Для одной скважины из 96 скважин с ячейками РПЭ достаточно 3 х 106 POS. Желаемое соотношение составляет 10 ячеек POS/RPE. Храните аликвоты при температуре 80 °C для использования в будущем.
- Добавление POS в ячейки
- Разморозьте флаконы POS на ледяной бане.
- Смешайте рассчитанное количество подготовленного POS с RPE-MM и обрабатывайте клетки POS один раз в день в течение 7 дней.
ПРИМЕЧАНИЕ: Ежедневно готовьте POS-раствор свежим. - Промойте клетки 1x DPBS, а затем зафиксируйте их 4% параформальдегидом в течение 20 минут при RT. Промойте DPBS еще раз и храните образцы при температуре 4 °C, погруженные в 200 мкл DPBS.
- Подготовка POS
5. Окрашивание для отложений суб-РПЭ
- Протокол окрашивания в нильский красный цвет
- После фиксации PFA промойте образцы 3 раза с помощью 1x DPBS.
ПРИМЕЧАНИЕ: Если протокол не используется немедленно, его можно приостановить, но образцы должны храниться в 1x DPBS + 0,02% растворе азида натрия при 4 ° C. - Чтобы приготовить бульонный раствор Nile Red, растворите порошок Nile Red в ацетоне в концентрации 3 мг / мл. Инкубировать в течение 15 мин при РТ с периодическим перемешиванием. Отфильтруйте растворы фильтром 0,22 мкм один или два раза в зависимости от уровня осадка, оставшегося в растворе.
ПРИМЕЧАНИЕ: Защищайте исходный раствор от света. - Для приготовления рабочего раствора разведите исходный раствор в соотношении 1:500 в 1x DPBS. Добавьте 200 мкл рабочего раствора в образец в течение 30 мин при РТ на шейкере и защищайте его от света.
- Промойте 3 раза 1x PBS и храните образцы при температуре 4 °C, погрузив их в 200 мкл DPBS.
ПРИМЕЧАНИЕ: При проведении эксперимента на трансвеллах вместо 96-луночной пластины образцы могут быть установлены на предметное стекло с монтажными носителями, покрыты стеклянным покровным стеклом и запечатаны прозрачным лаком для ногтей. Следует соблюдать осторожность, чтобы установить образец клетками вверх.
- После фиксации PFA промойте образцы 3 раза с помощью 1x DPBS.
- Протокол окрашивания BODIPY
- Для исходного раствора растворите BODIPY в безводном диметилсульфоксиде (ДМСО) до достижения исходной концентрации 3,8 мМ.
- Для фиксированных образцов PFA разбавьте запас BODIPY в соотношении 1:300 в 1x DPBS. Добавьте 200 мкл в клетки и инкубируйте в течение ночи на коромысле при RT.
- Промойте 3 раза 1x DPBS и храните образцы при температуре 4 °C, погрузив их в 200 мкл DPBS.
ПРИМЕЧАНИЕ: При проведении эксперимента на трансвеллах вместо 96-луночной пластины образцы могут быть установлены на предметное стекло с монтажными носителями, покрыты стеклянным покровным стеклом и запечатаны прозрачным лаком для ногтей. Следует соблюдать осторожность, чтобы установить образец клетками вверх.
- Протокол иммуноокрашивания APOE
- Смешайте 1x DPBS с 1% бычьего сывороточного альбумина (BSA), 0,5% Tween 20 и 0,5% Triton-X 100 для создания буферного раствора.
- Для фиксированных образцов PFA блокируют и проникают в образец в 200 мкл буферного раствора в течение 1 ч при RT.
- Добавьте первичное антитело APOE, разведенное в соотношении 1:100, в буферный раствор и инкубируйте в течение ночи при RT.
- На следующий день промойте образцы 3 раза с помощью 1x DPBS.
- Добавьте вторичное антитело в разведении 1:1000 в буферный раствор и добавьте 200 мкл раствора в клетки в течение 1 ч при RT.
- Вымойте 3 раза 1x DPBS и храните образцы при температуре 4 °C, погруженные в 200 мкл DPBS.
ПРИМЕЧАНИЕ: При проведении эксперимента на трансвеллах вместо 96-луночной пластины образцы могут быть установлены на предметное стекло с монтажной средой (Fluoromount), покрытые стеклянным покровным стеклом и запечатанные прозрачным лаком для ногтей. Следует соблюдать осторожность, чтобы установить образец клетками вверх.
6. Автоматизация и обработка изображений
- Автоматическое сканирование изображений
ПРИМЕЧАНИЕ: В этом исследовании использовались инвертированный конфокальный сканирующий микроскоп Zeiss LSM 800 и программное обеспечение ZEN 3.2 (синяя версия). Перед визуализацией убедитесь, что 96-луночная пластина нагревается до RT в течение как минимум 60 минут, чтобы избежать дрейфа фокальной плоскости во время сканирования из-за изменения показателя преломления среды при изменении температуры.- Используя конфокальный микроскоп и 40-кратный объектив, создайте профиль сканирования с соответствующими флуоресцентными каналами для используемого липидного маркера и любых дополнительных антител.
- Установите флажок Плитки , чтобы настроить автоматизацию изображений. Чтобы откалибровать 96-луночную пластину, убедитесь, что введены и выбраны правильные измерения носителя образца. Затем нажмите кнопку «Калибровка », чтобы откалибровать пластину в соответствии с инструкциями, для чего требуется использовать объектив 10x.
- Выберите вид «Расширенные настройки », чтобы выбрать подходящие скважины и добавить 3 различные точки визуализации вблизи центра скважины с помощью функции «Позиции ». Это можно сделать вручную на вложенной вкладке « Позиция » или случайным образом, используя вкладку « Настройка положения » и выбрав «Настройка оператором». Повторите для всех лунок одно и то же окрашивание.
- Для оптимальной фокусировки и позиционирования Z-стека во время автоматизации перейдите на вкладку « Стратегия фокусировки» и выберите « Использовать значения поверхности фокусировки/Z, определенные настройкой плиток». Альтернативные методы могут использовать другие стратегии фокусировки, но рекомендуется использовать этот параметр для получения наиболее последовательных результатов.
- На вкладке «Плитки» нажмите «Проверить позиции» и вручную установите центральную плоскость Z для каждой позиции. Настройки на подвкладке «Параметры» упорядочивают получение изображений, поэтому проверьте это перед началом работы с изображениями. Чтобы получить изображения в том порядке, в котором были выбраны позиции, снимите флажки «Области/позиции плитки» и «Несущие скважины/контейнер». Выберите «Разделить сцены на отдельные файлы» для удобства обработки изображений.
- Убедитесь, что для вкладки Z-Stack установлено значение « По центру», введен диапазон в соответствии с предпочтениями пользователя, а кнопка «Оптимальный » выбрана для установки интервала фрагмента.
- После оптимизации вкладок « Режим захвата», «Каналы», «Стратегия фокусировки», «Z-стек» и «Плитки » начните эксперимент.
- Обработка изображений
- Используя метод пакетной обработки изображений, создайте максимальные проекции каждого Z-стека с помощью метода расширенной глубины резкости .
- Используя метод пакетной обработки изображений, экспортируйте максимальное количество файлов проекции в виде 16-битных изображений TIFF. Установите для сжатия значение « Нет » и убедитесь, что установлен флажок «Исходные данные ». Результирующее изображение должно представлять собой максимальную проекцию TIFF в оттенках серого только того флуоресцентного канала, на котором экспрессируется липидный маркер.
7. Сегментация и количественная оценка
ПРИМЕЧАНИЕ: Программа LipidUNet была обучена на 40-кратных изображениях с 96-луночной пластины. Настоятельно рекомендуется использовать изображения, полученные с помощью 40-кратного объектива.
- Установите LipidUNet программное обеспечение. LipidUNet можно загрузить из следующего репозитория GitHub: https://github.com/RPEGoogleMap/LipidUNet
- Определите изображения TIFF, представляющие Nile Red, Bodipy или APOE, и переместите их в папку с именем imgs в каталоге с именем Nile_Red, Bodipy или APOE, в зависимости от используемого метода.
ПРИМЕЧАНИЕ: Программа LipidUNet должна использовать точные соглашения об именах для распознавания каталогов. - Откройте программное обеспечение LipidUNet (рис. 4).
- На вкладке « Прогнозировать » программного обеспечения выберите соответствующий каталог (Nile_Red, Bodipy или APOE), щелкнув многоточие и перейдя к именованному каталогу. Убедитесь, что программа LipidUNet правильно идентифицировала изображения, проверив запись Class.
- Выберите порог вероятности для алгоритма от 0,01 до 0,99. Более высокое значение устранит больше ложноположительных результатов, но может привести к большему количеству ложноотрицательных результатов, а более низкие значения могут привести к большему количеству ложноположительных результатов, устраняя больше ложноотрицательных результатов. Значение 0,65 является значением по умолчанию и рекомендуется.
- Нажмите кнопку Предсказать.
ПРИМЕЧАНИЕ: Программное обеспечение автоматически переберет все изображения и создаст новую папку с именем predicted_masks в выбранном каталоге. - Используйте инструмент анализа масок для перебора сгенерированных масок и количественного подсчета пороговых липидных отложений из изображений масок .
- Проанализируйте сгенерированные данные подсчета для сравнения условий лечения.
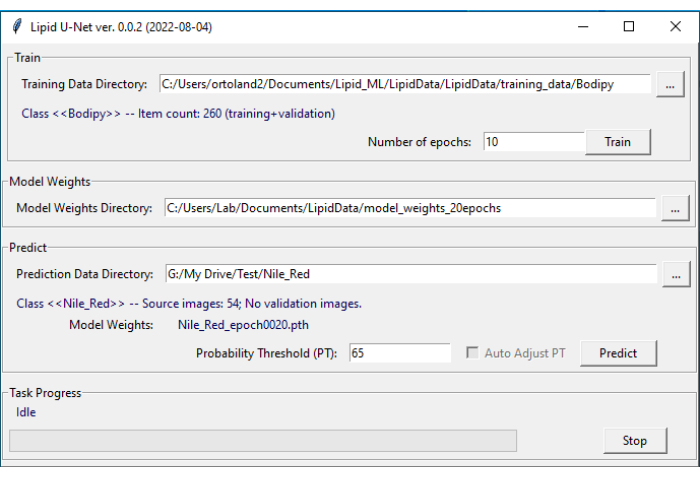
Рисунок 4: Пользовательский интерфейс LipidUNet. Программное обеспечение LipidUNet имеет различные разделы для выбора для каталога обучающих данных, где изображения липидных отложений были правильно идентифицированы; справочник весов модели, который создается на основе обучающих данных; и каталог данных прогнозирования, в который пользователь будет вводить свои изображения для сегментации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Этот протокол обеспечивает рабочий процесс для идентификации липидных отложений, окрашенных Nile Red, BODIPY и APOE. Разработанное программное обеспечение может автоматически идентифицировать и количественно определять липидные отложения и лучше всего работает при оптимизации изложенного протокола. Приведены примеры успешно дифференцированного RPE (рис. 3A) и низкодифференцированного RPE (рис. 3B), поскольку качество модели ячеек сильно влияет на качество правильной сегментации изображения.
Два из трех маркеров, описанных в протоколе, Nile Red и BODIPY, идентифицированы как небольшие круглые точки, которые отчетливо ярки на флуоресцентных изображениях (рис. 5 и рис. 6). «Позитивное» изображение из протокола было бы подходящей идентификацией этих отдельных отложений (рис. 5A-D и рис. 5E-H). «Отрицательный» результат покажет неправильную сегментацию изображения, ошибочно приняв фоновую флуоресценцию за отложение, либо из-за слабого окрашивания (рис. 6A-C и рис. 6D-F), либо из-за высокой интенсивности фона (рис. 6G-I).
Месторождения APOE имеют различные размеры и формы, выглядя более овальными или нерегулярными, чем круглые отложения Nile Red и BODIPY. Эти отложения также менее точечные, и интенсивность сигнала может различаться между отложениями из-за различий в пермеабилизации образца. Правильная идентификация позволит идентифицировать каждое месторождение, включая менее насыщенные (рис. 5I-L), в то время как неправильная сегментация не выявит эти отложения (рис. 6J-L). Поэтому важно оптимизировать методы окрашивания и визуализации, чтобы избежать резких изменений. Один из способов сделать это — обратить пристальное внимание на этапы пермеабилизации образца во время иммуноокрашивания. Для оптимизации флуоресцентного сигнала клетки могут быть лизированы перед фиксацией и иммуноокрашиванием для APOE, что приводит к равномерному насыщению и лучшей сегментации отложений APOE.
Представлены также сегментированные изображения клеток, созревших на культуральной платформе, отличной от 96-луночной пластины. Программное обеспечение LipidUNet было запущено на изображениях клеток, культивируемых на трансвелле, и, хотя липидные отложения являются пороговыми, то же самое можно сказать и о порах в трансвелл-мембране (рис. 6M-O). Из-за сходства формы и размера программное обеспечение LipidUNet в его нынешнем виде будет маскировать как липидные отложения, так и прозрачные поры.
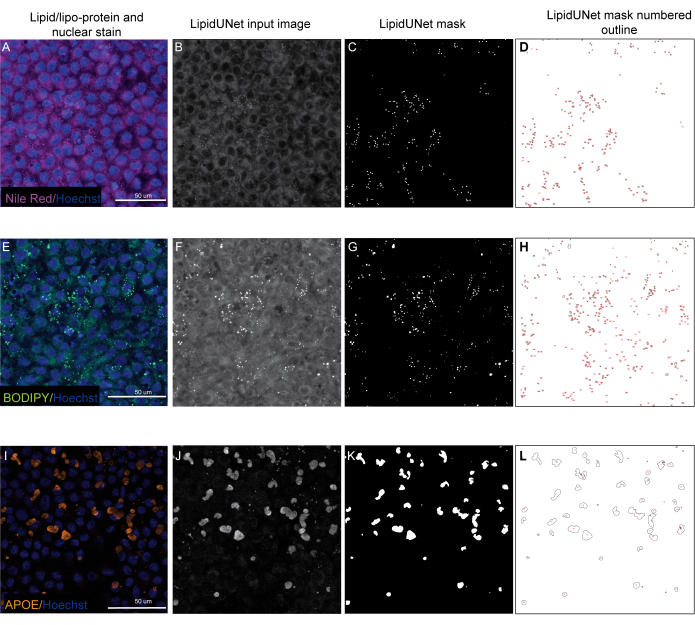
Рисунок 5: Репрезентативные результаты. (A, E, I) 96-хорошо покрытый RPE окрашивается ядерным окрашиванием Хёхста (синий) и нильским красным (пурпурный), BODIPY (зеленый) или APOE (оранжевый) и являются проекциями максимальной интенсивности Z-стека. (Б, Ф, Дж) Входные изображения в оттенках серого для программного обеспечения LipidUNet после обработки изображений. (С,Г,К) Маски, генерируемые LipidUNet, где все отложения идентифицированы правильно. (Д,Ч,Л) Контуры каждой замаскированной частицы пронумерованы. Эти метки позволяют связать каждую частицу на изображении с записью в спреде с необработанными данными. (A-D) показывает окрашивание Nile Red, и программное обеспечение способно точно распознавать отложения на фоне, несмотря на более слабый сигнал. (E-H) показывает сильный контраст между сигналом BODIPY и фоном, что является идеальным. LipidUNet правильно идентифицирует каждое отложение на изображении. (I-L) показывает сильный сигнал APOE и представляет собой вариабельность насыщения сигнала, которая часто наблюдается с этим окрашиванием. Тем не менее, сегментация изображений способна идентифицировать границы каждого месторождения APOE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
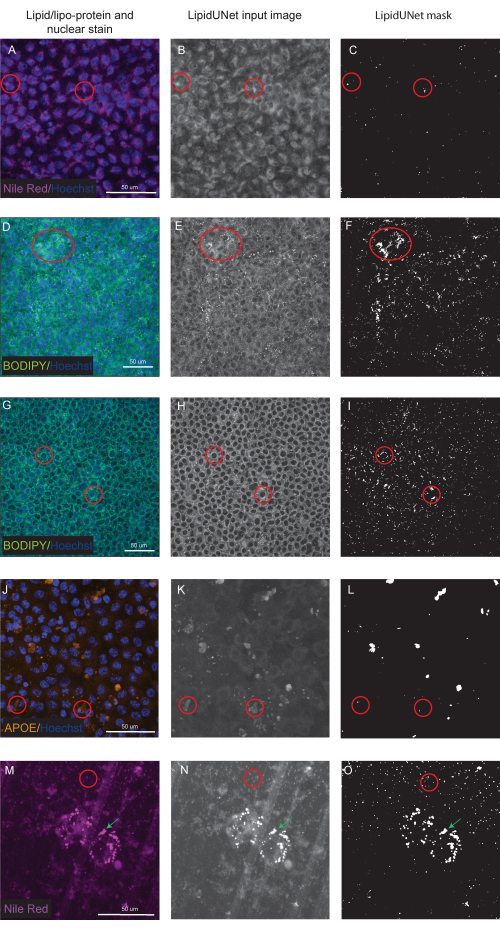
Рисунок 6: Неоптимальные результаты. (A, D, G, J, M) 96-хорошо покрытые RPE окрашиваются ядерным окрашиванием Хёхста (синий) и нильским красным (пурпурный), BODIPY (зеленый) или APOE (оранжевый) и являются проекциями максимальной интенсивности Z-стека. (Б, Э, Х, К, Н) Входные изображения в оттенках серого для программного обеспечения LipidUNet после обработки изображений. (С, Ф, И, Л, О) Неправильные маски, сгенерированные LipidUNet. Красные круги указывают, где программное обеспечение неправильно идентифицировало липидное отложение. (А-С) Обработка Nile Red неверна, потому что программное обеспечение определило фоновое окрашивание как отложение. Это может происходить чаще, когда на изображении высокий фон, но мало липидных отложений. Показаны два примера окрашивания BODIPY: некачественное изображение из-за (D-F) слабого окрашивания BODIPY и (G - I) сильный сигнал BODIPY с высоким фоном. В обоих случаях программное обеспечение не может отличить небольшие круглые липидные отложения от фонового кольцевого кольца, окружающего ядро. Хотя окрашивание и визуализация должны быть оптимизированы, чтобы избежать этих ошибок, самая последняя версия LipidUNet в значительной степени улучшена для этих изображений. (Ж-Л) Некорректная сегментация APOE. Поскольку депозиты более изменчивы по размеру и насыщенности сигнала, программное обеспечение испытывает трудности с распознаванием некоторых депозитов. (М-О) РПЭ посеян на трансвелл и окрашен нильским красным цветом. Здесь показан срез Z-стека как с отложениями липидов Nile Red, так и с трансвеллированными порами. Программное обеспечение не может различить их, о чем свидетельствует красный круг, содержащий поперечные поры, и зеленая стрелка, указывающая на отложения Nile Red. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Сравнение инструментов маски. (А, В, В) 96-хорошо покрытые РПЭ с переменным количеством осаждения липидов идентифицируются с красным нильским (красным). Изображения маскируются с использованием трех различных распространенных методов маскировки: Find Maxima, Max Entropy и Renyi Entropy, и сравниваются с маской, сгенерированной LipidUNet. Исходное изображение сопровождается ручным подсчетом липидных отложений, в то время как маски отображают прогнозируемые подсчеты по каждому методу сегментации. Средняя частота ошибок была рассчитана для каждого метода сегментации по следующей формуле: среднее[(|Прогнозируемый подсчет - ручной подсчет|/ручной подсчет) x 100]. Маска, сгенерированная LipidUNet, более точно идентифицирует липидные отложения на изображениях с переменным осаждением по сравнению с другими методами маскирования (средняя частота ошибок: 23% LipidUnet, 1164% Find Maxima, 851% Max Entropy, 203% Renyi Entropy). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Компонент | Номер кошки | Биржевой конс. | Заключительный конс. | мл |
| МЕМ альфа | 12571-063 | Н.А. | 500 | |
| Дополнение N2 | 17502-048 | Н.А. | 1% | 5 |
| Инактивированный теплом FBS | Ш30071.03 | Н.А. | 5% | 25 |
| НМЭМ, НЕАА | 11140-050 | 10мМ | 0,01 мМ | 5 |
| Пируват натрия | 11360-070 | 100 мМ | 1 мМ | 5 |
| Пенициллин-стрептомицин | 15140-122 | 10000 ед/мл | 100 Ед / мл | 5 |
| Таурин | Т4571 | 50 мг/мл | 250 мкг/мл | 2.5 |
| Гидрокортизон | Н6909 | 18,1 мг/л | 20 мкг/л | 0.553 |
| Т3 | Т5516 | 20 мкг/л | 0,013 мкг/л | 0.33 |
| Общий объем, мл | 548.383 | |||
Таблица 1: Состав реагентов РПЭ-ММ. Перечень реагентов и оптимальных концентраций для РПЭ-ММ.
Обсуждение
Этот протокол обеспечивает метод эффективной маркировки, изображения и количественного определения липидных отложений в моногенных и полигенных моделях заболеваний in vitro для дегенеративных заболеваний глаз. Программное обеспечение на основе искусственного интеллекта LipidUNet может быть применено к трем распространенным липидным маркерам, APOE, Nile Red и BODIPY, и обеспечивает быстрый автоматический метод анализа, который позволяет количественной оценке быть стандартной и объективной.
Основным ограничением LipidUNet является тот факт, что набор обучающих данных для ИИ был ограничен изображениями клеток с 40-кратным увеличением, культивируемых в 96-луночном планшете. В результате набора обучающих изображений LipidUNet в его нынешнем виде ограничен анализом изображений с 40-кратным увеличением. Программное обеспечение может быть использовано для анализа 40-кратных изображений клеток, культивируемых на других культуральных поверхностях, помимо 96-луночной пластины, но следует позаботиться о проверке сгенерированных выходных масок для проверки точного порогового значения программным обеспечением. Потребуется больше наборов изображений (с разным увеличением), чтобы расширить область применения образцов/изображений, которые он может анализировать.
Протокол состоит из нескольких важных этапов. На этапе липидного маркера пользователь должен подтвердить, что выбранное им маркировочное соединение (BODIPY, APOE, Nile Red) эффективно маркировало его образец. Зрелые клетки RPE часто сильно пигментированы, что может ухудшить флуоресцентный сигнал иммуноокрашивания антителами. Когда сигнал флуоресценции слабый или когда слишком много фонового окрашивания, LipidUNet не может точно различать липидные капли. По той же причине необходимо использовать правильно выбранные параметры сбора данных для этапа автоматической визуализации протокола. Если полученные изображения имеют низкое качество, LipidUNet будет изо всех сил пытаться правильно маскировать изображения, и, следовательно, количественная оценка будет неточной (рис. 6A-L). Наконец, постобработка изображений является важным шагом, поскольку LipidUNet предъявляет особые требования к программному обеспечению для работы.
По сравнению с рабочими процессами для анализа липидов, в которых используется ручная пороговая оценка, или методами, включающими автоматическое пороговое значение в программном обеспечении, таком как Fiji, LipidUNet предлагает непредвзятую и надежную сегментацию по изображениям с переменным отложением липидов, что отражается в небольшой частоте ошибок при идентификации липидных частиц (рис. 7). Программное обеспечение позволяет пользователю вводить дополнительные обучающие изображения, что позволяет анализировать наборы изображений, выходящие за рамки тех, которые используют объектив 40-кратного увеличения, или даже тех, которые используют другой липидный маркер, как указано в протоколе. В будущем программное обеспечение будет обучено анализировать 3D-изображения, чтобы можно было количественно оценить объем липидных отложений. Дегенеративные заболевания глаз, которые связаны с отложением липидов в качестве основного фактора патологии, широко распространены, и, по прогнозам, случаи будут увеличиваться по мере увеличения пожилого населения13. Точные модели заболеваний и эффективные инструменты анализа, как мы изложили в этом протоколе, позволят разработать новые терапевтические вмешательства.
Раскрытие информации
Никаких разглашений.
Благодарности
Мы благодарим гистологическое ядро Национального института глаз (NEI) за использование конфокальной системы Zeiss. Эта работа была поддержана фондами NEI IRP (номер гранта ZIA EY000533-04).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm Steriflip filter system | EMD Millipore | SCGP00525 | |
| 1x Dulbecco's Phosphate Buffered Saline | Gibco | 14190-144 | |
| 3,3',5-Triiodo-L-thyronine | Sigma | T5516 | |
| Albumin Bovine, Fraction V | MP Biomedical | 160069 | |
| Alexa Fluor 555 rabbit anti-goat IgG (H+L) | Invitrogen | A21431 | APOE secondary antibody |
| APOE primary antibody | Millipore Sigma | AB947 | |
| BODIPY 493/503 | Invitrogen | D3922 | Protect from light |
| Complement competent human serum | Millipore Sigma | S1-LITER | |
| CTS N2 Supplement | Life Technologies | A13707-01 | |
| Fetal Bovine Serum | Hyclone | SH30071.03 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Slide mounting media |
| Glass Cover Slips #1 1/2 22 mm x 22 mm | Electron Microscopy Sciences | 72204-01 | |
| Glass Microscope Slide 25 mm x 75 mm- 1.2 mm Thick | Electron Microscopy Sciences | 71870-01 | |
| Hydrocortisone | Sigma | H0396 | |
| MEM Alpha | Life Technologies | 12571-063 | |
| MEM non-essential Amino Acids | Life Technologies | 11140 | |
| Nile Red | Sigma | 72485-100MG | Protect from light |
| Paraformaldehyde 16% Solution, EM Grade | Electron Microscopy Sciences | 15710 | |
| Penicillin-Strep | Life Technologies | 15140-148 | |
| Phosphate Buffered Saline 10x | Gibco | 70011-044 | |
| Rod Outer Segments (OS) | InVision Bioresources | 98740 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium Pyruvate | Life Technologies | 11360-070 | |
| Sucrose | Sigma Aldrich | S1888 | |
| SYBR Green Master Mix | Bio-Rad | 1725274 | |
| Taurine | Sigma | T0625 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| Tween 20 Ultrapure | Affymetrix | 9005-64-5 | |
| Vitronectin | Life Technologies | A14701SA | |
| Y-27632 dihydrochloride | R&D Systems | 1254 |
Ссылки
- Kanow, M. A., et al. Biochemical adaptations of the retina and retinal pigment epithelium support a metabolic ecosystem in the vertebrate eye. eLife. 6, e28899 (2017).
- Adijanto, J., et al. The retinal pigment epithelium utilizes fatty acids for ketogenesis. The Journal of Biological Chemistry. 289 (30), 20570-20582 (2014).
- Farnoodian, M., et al. Cell-autonomous lipid-handling defects in Stargardt iPSC-derived retinal pigment epithelium cells. Stem Cell Reports. 17 (11), 2438-2450 (2022).
- Curcio, C. A. Soft drusen in age-related macular degeneration: Biology and targeting via the oil spill strategies. Investigative Ophthalmology & Visual Science. 59 (4), AMD160-AMD181 (2018).
- Cankova, Z., Huang, J. D., Kruth, H. S., Johnson, M. Passage of low-density lipoproteins through Bruch's membrane and choroid. Experimental Eye Research. 93 (6), 947-955 (2011).
- Curcio, C. A., et al. Esterified and unesterified cholesterol in drusen and basal deposits of eyes with age-related maculopathy. Experimental Eye Research. 81 (6), 731-741 (2005).
- Miyagishima, K. J., et al. AMPK modulation ameliorates dominant disease phenotypes of CTRP5 variant in retinal degeneration. Communications Biology. 4 (1), 1360 (2021).
- Sharma, R., et al. Epithelial phenotype restoring drugs suppress macular degeneration phenotypes in an iPSC model. Nature Communications. 12 (1), 7293 (2021).
- Farnoodian, M., et al. Cell-autonomous lipid-handling defects in Stargardt iPSC-derived retinal pigment epithelium cells. Stem Cell Reports. 17 (11), 2438-2450 (2022).
- Hallam, D., et al. An induced pluripotent stem cell patient specific model of complement factor H (Y402H) polymorphism displays characteristic features of age-related macular degeneration and indicates a beneficial role for UV light exposure. Stem Cells (Dayton, Ohio). 35 (11), 2305-2320 (2017).
- Sharma, R., Bose, D., Montford, J., Ortolan, D., Bharti, K. Triphasic developmentally guided protocol to generate retinal pigment epithelium from induced pluripotent stem cells. STAR Protocols. 3 (3), 101582 (2022).
- Issa, P. C., Barnard, A. R., Herrmann, P., Washington, I., MacLaren, R. E. Rescue of the Stargardt phenotype in Abca4 knockout mice through inhibition of vitamin A dimerization. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8415-8420 (2015).
- GBD 2019 Blindness and Vision Impairment Collaborators. Blindness and Vision Impairment Collaborators. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Global Health. 9 (2), e144-e160 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены