このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ゼブラフィッシュ成魚の行動性における前脳活動の2光子カルシウムイメージング
要約
ここでは、成体のゼブラフィッシュの背側前脳で2光子カルシウムイメージングを行うためのプロトコルを紹介します。
要約
成魚のゼブラフィッシュ(Danio rerio)は、認知機能を研究するための豊富な行動レパートリーを示します。また、光学イメージング法によって脳領域全体の活動を測定するために使用できるミニチュア脳も備えています。しかし、ゼブラフィッシュの成体における脳活動の記録に関する報告は少ない。本研究では、成体のゼブラフィッシュの背側前脳に2光子カルシウムイメージングを行う手順について記載する。ゼブラフィッシュの成体が頭部を動かすのを抑制する手順に着目し、脳活動のレーザースキャニングイメージングを可能にする安定性を提供します。頭を拘束された動物は、補助具なしで体の部分を自由に動かし、呼吸することができます。この手術は、頭部拘束手術の時間を短縮し、脳の動きを最小限に抑え、記録されるニューロンの数を最大化することを目的としています。カルシウムイメージング中に没入型の視覚環境を提示するためのセットアップもここで説明されており、視覚的に誘発される行動の根底にある神経相関を研究するために使用できます。
概要
遺伝子コードされたインジケーターまたは合成色素を用いたカルシウム蛍光イメージングは、ヒト以外の霊長類、げっ歯類、鳥類、昆虫などの行動動物の神経活動を測定する強力な方法です1。脳表面から約800μm下までの数百の細胞の活動は、多光子イメージングを用いて同時に測定することができます2,3。特定の細胞タイプの活性は、遺伝的に定義された神経集団でカルシウム指標を発現することによっても測定できます。小型脊椎動物モデルへのイメージング法の適用は、脳領域を横断する神経細胞計算の分野に新たな可能性を開きます。
ゼブラフィッシュは、神経科学研究で広く使用されているモデルシステムです。受精後約6日目のゼブラフィッシュ仔魚は、脳が小さく、体が透明であるため、カルシウムイメージングに使用されています4。ゼブラフィッシュの稚魚(生後3〜4週間)は、感覚運動経路の根底にある神経メカニズムの研究にも使用されます5,6。しかし、連想学習や社会的行動を含む複雑な行動の最大パフォーマンスレベルは、7,8歳以上で到達します。したがって、イメージング法を用いて成体のゼブラフィッシュの脳内の複数の認知機能を研究するには、信頼性の高いプロトコルが必要です。ゼブラフィッシュの幼生やゼブラフィッシュ稚魚はアガロースに包埋してin vivoイメージングを行うことができますが、生後2ヶ月以上の成魚は低酸素状態になり、体力が強すぎてアガロースで拘束できません。したがって、脳を安定させ、動物が鰓を通して自由に呼吸できるようにするには、外科的処置が必要です。
ここでは、単一のヘッドバーの斬新な設計を含むヘッドレストプロトコルについて説明します。手術時間が25分に短縮され、以前の方法9の2倍の速さです。また、記録室(半六角形のタンク)、ヘッドステージ、および2つの部品を組み合わせるためのクイックロック機構の設計についても説明します9。最後に、視覚的に誘発される脳の活動と行動を研究するための没入型の視覚刺激を提示するためのセットアップについても説明します。全体として、ここで説明する手順は、頭部を拘束された成体のゼブラフィッシュの遺伝的に定義された細胞集団で2光子カルシウムイメージングを実行するために使用でき、さまざまな行動パラダイムにおける脳活動の調査を可能にします。
プロトコル
すべての動物処置は、中央研究院の動物実験委員会のガイドラインに従って承認され、実施されました。研究ツールの詳細については、 資料表をご覧ください。
1. 記録室の準備
- 半六角形のタンク、ベースプレート、ヘッドステージを準備します(図1A;補足ファイル1-3)。ヘッドステージは、円形のプレートに取り付けられた2本の金属製の支柱で構成されています。円形プレートには、ベースプレートにロックできる溝が含まれています。一緒にロックされた後、ヘッドステージとベースプレートは半六角形のタンクの底に置かれます。
- 半六角形のタンクを顕微鏡の実験台に置きます。プラットフォームは、平行移動ステージの限界に達することなく、X方向とY方向に移動できる必要があります。
- 810nmの赤外線(IR)ライトとカメラをヘッドステージに向け、行動を記録します。カメラの視野が大人のゼブラフィッシュが収まるのに十分な大きさであることを確認してください。
- 2光子レーザーと視覚刺激が行動記録に干渉しないように、カメラの前にそれぞれ875nmのショートパスフィルターと700nmのロングパスフィルターを設置します。
- 視覚刺激を与えるために、半六角形の水槽の3つの壁の内側にバックプロジェクションフィルムを貼り付けます(図1A)。
- 3 台のプロジェクターをタンクの 3 つの表面に向けます。3 つの画像は、連続した視覚シーンを形成するように位置合わせする必要があります。プロジェクターの光がカルシウムの蛍光信号を汚染するのを防ぐため、各プロジェクターの手前に減光フィルターと赤色フィルター(600nm、ロングパス)を配置し、光電子増倍管(PMT)の前にバンドパスフィルター(510/80nm)を配置します。
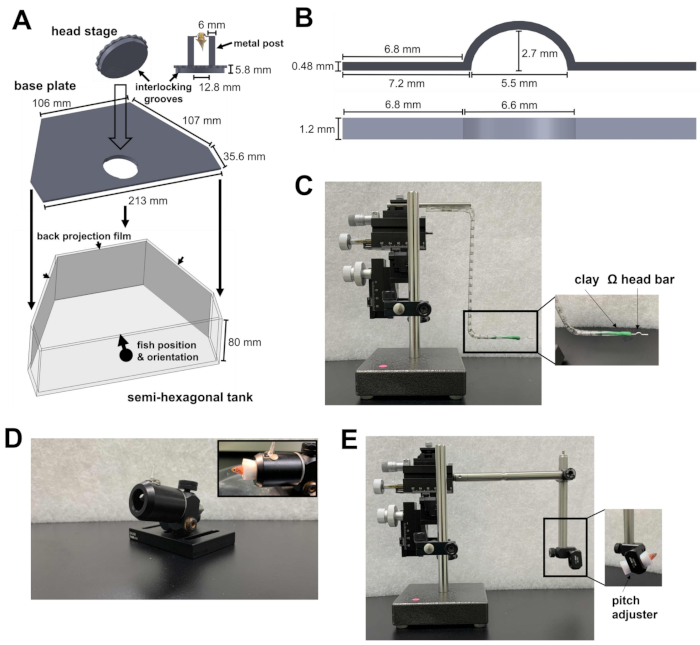
図1:頭部拘束手術に必要な器具 。 (A)ヘッドステージの円形プレートと半六角タンク内のベースプレートの間のクイックロック機構。カスタムメイド部品のコンピューター支援設計(CAD)ファイルは、 補足ファイル1〜4にあります。(B)頭部拘束用のΩ字型ヘッドバー。(C)ヘッドバーを取り付け部位に配置するために使用される3軸マイクロマニピュレーター。インセット:粘土の中のヘッドバーの向き。(D)手術中に魚を保持するための大砲。インセット:大砲内の魚の向き。(E)魚のローディングモジュールと、ヘッドステージに魚をロードするために使用されるマイクロマニピュレーター。挿入図:モジュール内の魚の向き。 この図の拡大版をご覧になるには、ここをクリックしてください。
2.頭部拘束手術
- Ω型のヘッドバーを準備します(図1B; 補足ファイル4)ゼブラフィッシュのヘッドレスト用。これを行うには、油性モデリングクレイを3軸マイクロマニピュレーターに取り付けます。粘土がヘッドバーを保持するのに十分な固さであるが、ヘッドレスト後にヘッドバーから取り外すのに十分な柔らかさであることを確認してください。
- ヘッドバーのアームを粘土に挿入し、ヘッドバーを水平に向けます(図1C)。これにより、後でヘッドバーをゼブラフィッシュに取り付けても水平になります。
注:ヘッドバーはチタン(24 mg)またはステンレス鋼(43 mg)でできており、複数の実験に再利用できます。ヘッドバーの素材は、ヘッドレスト下でのゼブラフィッシュの成魚(体重300〜1,000mgの範囲)の行動に影響を与えません。 - 手術中に魚体を所定の位置に保持するための中空のチューブである大砲を準備します(図1D)。
- 水槽の水に0.03%および0.01%のトリカインメタンスルホン酸(TMS; 材料表を参照)を調製します。これは、麻酔をかけ、手術中に魚を鎮静状態に維持するために使用されます。
- 頭蓋骨の付着部位から余分な皮膚と水分を取り除くために、4本の組織スワブを準備します。各綿棒を準備するには、ペーパータオルを3cmの正方形にカットし、その対角線に沿って折りたたんでチューブ状の構造を作ります。チューブの端を細かくねじります。取り付け部位が非常に小さいため、細かい点により綿棒をより細かく制御できます。
- マイクロマニピュレーター用の魚のローディングモジュールを準備します(図1E)。
注:モジュールは、直角の支柱クランプで固定された2本のスチール支柱で構成されています。1本の支柱はマイクロマニピュレーターに取り付けられ、もう1本の支柱は魚を運ぶ回転式支柱クランプを保持します。このモジュールは、魚をヘッドステージに細かく制御して配置するために使用されます。回転するポストクランプは、魚のピッチ角度を変更するためのピッチアジャスターとして機能します。 - 水槽の水に0.03%TMSで魚を麻酔します。以下のステップでは、シリンジを使用して、水槽の水に溶けた 0.01% TMS を 90 秒ごとに短いパルスで口に送達します。灌流からの水流は鰓の動きを誘発するはずです。これにより、手術中に魚は40分以上生き残ることができます。
注:Tg[neuroD:GCaMP6f]は、幼虫期と成虫期の両方で前脳のカルシウム指示薬が広く発現するために使用される10。
注意: オプションで、重力灌流を使用して、両手がふさがっている手術中に口に一定の水流を供給します。 - 魚をカプセル(図2A)に包み、大砲の中に魚を入れます。
- 麻酔をかけた魚を、尾の先端から鰓まで約1mmの尾部まで湿らせた紙で包みます。魚が組織から滑り落ちないように、ラッピングがきつくなっていることを確認してください。
- 縦方向のスリットが入った柔らかいプラスチックチューブ(例えば、中型の熱収縮チューブを切り開いたもの)を紙ティッシュに巻き付けて、尾の端から鰓までの尾側約2mmまで魚を覆います。チューブは、手術中、魚の体をまっすぐに保つことを保証します。
- ペーパータオルをチューブに巻き付けて、大砲の直径とほぼ同じ直径にします。
- プラスチック製トランスファーピペットのバルブから切り取った柔らかいプラスチックチューブをペーパータオルに巻き付けます。これにより、カプセルを大砲にスムーズに装填できます。
- 魚を大砲に装填します。
- メスを使用して、付着部位、小脳の吻側と鰓の上にある頭蓋骨の2つの三角形の領域(図2B)を覆っている皮膚を取り除き、次に付着部位の間の領域を覆っている皮膚を取り除きます。組織スワブを使用して付着部位を乾かし、残っている皮膚を取り除きます。
- 皮膚の除去中に頭を支えるために調整可能なプラットフォームを使用しますが、手術中の目の怪我を避けるために、プラットフォームが目に接触してはなりません。
注:付着部位の皮膚を完全に除去することは、イメージング中のモーションアーチファクトを減らすために重要です。
- 皮膚の除去中に頭を支えるために調整可能なプラットフォームを使用しますが、手術中の目の怪我を避けるために、プラットフォームが目に接触してはなりません。
- 10 μLのピペットチップを使用して、各取り付け部位の中央に組織接着剤( 材料表を参照)を一滴塗布します。
注意: ティッシュ接着剤は取り付け部位を覆い、すぐに乾きます。組織接着剤は、頭蓋骨とヘッドバーの接着に使用される歯科用セメントとの間の接着界面を提供し、鰓からの水が付着部位に到達するのを防ぎます。 - 魚体を直立させ、ヘッドバーを取り付け部位より少し上、尾側に置き、ヘッドバーの接着に備えます。
- 歯科用セメントを準備し( 材料表を参照)、すぐにそれを使用してヘッドバーを頭蓋骨に接着します(図2C)。この手順は時間的制約があり、45秒以内に行う必要があります。
- 小さじ1杯のポリマーを4滴のクイックモノマーと1滴の触媒Vと混合し、混合物を15秒間均一に攪拌します。
- マイクロピペットと10 μLのピペットチップを使用して、混合物を接着部位と部位間の領域に塗布します。鰓や目を覆うことは避けてください。
- マイクロマニピュレーターを使用して、ヘッドバーをセメントにそっと押し付けます。ヘッドバーを残りのセメントで覆います。
- 歯科用セメントが硬化するまで12分待ちます。セメントとの水の接触を避けてください。
- カルシウムイメージングのための前脳への光アクセスを改善するには、終脳の上の皮膚を取り除きます。皮膚の除去は、メスを使用して5回切断し、3分で行うことができます(図2D)。頭蓋骨の表面に付着した脂質滴が取り除かれていることを確認してください。
- 硬化後、ヘッドバーから粘土を取り除きます。
- カプセル全体を大砲からマイクロマニピュレーターの魚装填モジュールのピッチアジャスターに移します。
- マイクロマニピュレーターを使用して魚を配置します。ヘッドバーは、ヘッドステージの金属製の支柱の上に配置する必要があります。魚のピッチ角をわずかに大きくして、2光子イメージング中に前脳の表面を光学面に合わせやすくします。
- ヘッドバーを紫外線(UV)硬化型接着剤で金属製の支柱に接着します。硬化には15秒のUV曝露で十分です。
- カプセルから魚を引き出し、ヘッドステージを半六角形の水槽内のベースプレートにロックします。
- 動物を水槽の水に浸します。魚は呼吸を開始し、1〜2分以内に麻酔から回復するはずです。
注意: 必要に応じて、シリンジ灌流を使用して真水を口に送ります。
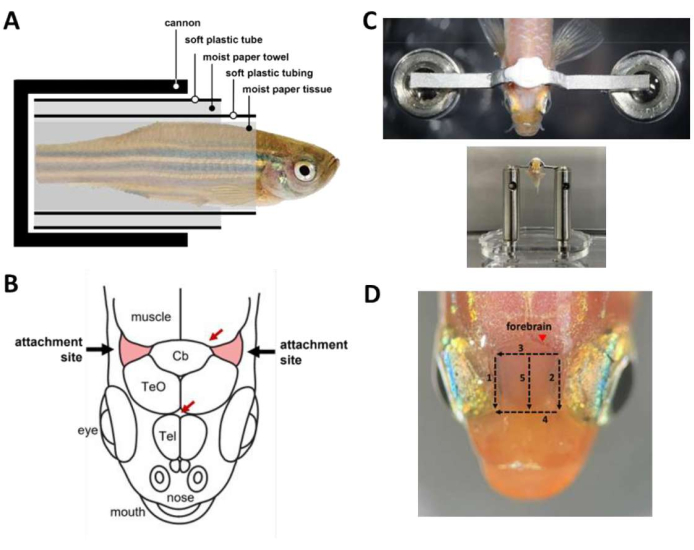
図2:頭部拘束手術中の主な手順 。 (A)大砲内部のカプセルの構成。(B)頭蓋骨の付着部位(赤)。赤い矢印は血管部位を示します。(C)トップ:魚の頭蓋骨に取り付けられたヘッドバー。下:ヘッドステージに載せられた魚。(D)前脳の上の皮膚を切除するために必要な切り傷。数字は切断順序を示します。動物の出血を防ぐために、マークされた部位(矢じり)の皮膚の除去は避けてください。 この図の拡大版をご覧になるには、ここをクリックしてください。
3. 2光子イメージング
- レーザーをオンにし、出力が安定するまで30分間待ちます。サンプルの波長を 920 nm、出力を約 50 mW に設定します。
注意: レゾナントスキャナーによって制御されるレーザービームは、スキャンパスの折り返し点でゆっくりと移動します。組織の損傷を防ぐために、ポッケルスセルを使用して、ターンアラウンドポイントでのレーザー出力を低減します。 - 頭部を拘束したゼブラフィッシュを収容した記録チャンバーを実験プラットフォームに置きます(図3A)。プラットフォームは、平行移動ステージの限界に達することなく、X方向とY方向に移動できる必要があります。
- 対物レンズを前脳表面にできるだけ近づけて置きます。対物レンズは瞳孔の前端に向ける必要があります(図3B)。
- レーザーシャッターを開き、PMTを有効にします。 蛍光画像に背側前脳が現れるまで、対物レンズを徐々に上昇させます(~1mm)。
- 記録されるニューロンの数を増やすには、ピエゾアクチュエータを使用して、複数の深さ(15 μm離れた6つの画像面)で画像を取得します。これにより、フレームレートを犠牲にしてデータの歩留まりが向上します。ピエゾアクチュエータを制御するために、高速Z軸スキャンを有効にします(均一モード、スライス数 = 6、ステップサイズ = 15 μm、波形 = のこぎり波、フライバック時間 = 4 ms、アクチュエータラグ = 8 ms)。
- 行動を記録するには、タンクの両側にある 810 nm 赤外線 (IR) ライトをオンにします。カメラではっきりと見えるはずの全身を照らすように角度を調整します。
- プロジェクタの電源を入れます。
- データの記録を開始します。
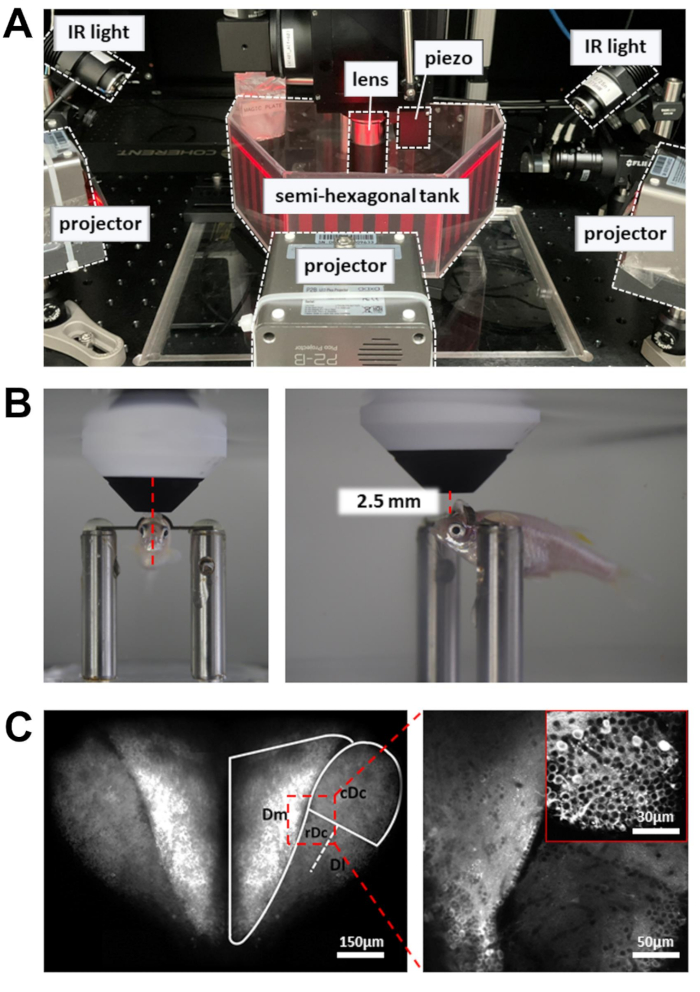
図3:カルシウムイメージング、行動記録、視覚刺激表示を行うためのセットアップ 。 (A)3台のプロジェクターが半六角形の水槽の壁に視覚刺激を映し出す。側面のIRライトは、ゼブラフィッシュの体を照らすために使用されます。(B)対物レンズの位置決め。左:正面図。右:側面図。16倍の対物レンズと標的の脳領域の間の距離は約2.5mmです。 (C)2光子画像の例。左:背側前脳全体のTg[neuroD:GCaMP6f]の最大投射。右:複数の脳領域にわたるニューロンを明らかにするためのズームイン画像。挿入図:異なる脳領域からのより高い倍率。画像は、5Hzで記録された10秒間のデータの平均値です。 この 図の拡大版を表示するには、ここをクリックしてください。
結果
プロトコルは2部から成っている:頭部拘束の外科および前脳のニューロン活動の2光子カルシウムイメージ投射。手術の成功は、動物の生存とヘッドレストの安定性によって定義されます。手術中に口から0.01%TMS溶液を頻繁に灌流することで、生存率を大幅に向上させることができます。魚は麻酔から回復し、水槽の水に浸された後1〜2分以内に活発に呼吸する必要があります。2光子カルシウ?...
ディスカッション
ここでは、ゼブラフィッシュの成体であるゼブラフィッシュの頭部を拘束し、2光子カルシウムイメージングを行うための詳細なプロトコルについて説明します。レーザースキャニングイメージングに十分な安定性を備えたヘッドレストを実現するには、2つの重要なステップがあります。まず、ヘッドバーを頭蓋骨の特定の取り付け部位に接着する必要があります。頭蓋骨の他の部分は、機?...
開示事項
著者らは、競合する金銭的利害関係はないと宣言しています。
謝辞
この研究は、中央研究院分子生物学研究所と台湾の国家科学技術評議会の支援を受けました。中央研究院物理研究所の機械工場は、カスタム設計の部品の製造を支援しました。また、P. Argast 氏 (Friedrich Miescher Institute for Biomedical Research, Basel, Switzerland) には、ヘッドステージのクイックロック機構の設計をお願いいたします。
資料
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
参考文献
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved