Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikroakışkan çip bazlı döngü aracılı izotermal amplifikasyon yoluyla alt solunum yolu enfeksiyonlarına neden olan bakteriyel patojenlerin hızlı tespiti
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Çeşitli bakteriyel patojenler, doğru bir şekilde tespit edilmez ve derhal tedavi edilmezse solunum yolu enfeksiyonlarına neden olabilir ve ciddi sağlık sorunlarına yol açabilir. Döngü aracılı izotermal amplifikasyon yoluyla bu patojenlerin hızlı ve doğru tespiti, klinik ortamlarda solunum yolu enfeksiyonlarının etkili bir şekilde yönetilmesini ve kontrol edilmesini sağlar.
Özet
Solunum yolu enfeksiyonları (RTI) klinik ortamlarda en sık görülen problemler arasındadır. Bakteriyel patojenlerin hızlı ve doğru bir şekilde tanımlanması, RTI'lerin yönetimi ve tedavisi için pratik kılavuzlar sağlayacaktır. Bu çalışma, çok kanallı döngü aracılı izotermal amplifikasyon (LAMP) yoluyla solunum yolu enfeksiyonlarına neden olan bakteriyel patojenleri hızlı bir şekilde tespit etmek için bir yöntemi açıklamaktadır. LAMP, bakteriyel nükleik asitleri yüksek doğruluk ve güvenilirlikle hızlı bir şekilde tespit eden hassas ve spesifik bir tanı aracıdır. Önerilen yöntem, zaman alıcı olan ve genellikle düşük bakteriyel nükleik asit seviyelerini tespit etmek için daha fazla hassasiyet gerektiren geleneksel bakteri kültürleme yöntemlerine göre önemli bir avantaj sunmaktadır. Bu makale, alt solunum yolundan örnekleri (balgam, bronşiyal lavaj sıvısı ve alveoler lavaj sıvısı) tespit etmek için LAMP kullanılarak K. pneumoniae enfeksiyonu ve çoklu ko-enfeksiyonlarının temsili sonuçlarını sunmaktadır. Özetle, çok kanallı LAMP yöntemi, klinik numunelerde tekli ve çoklu bakteriyel patojenleri tanımlamak için hızlı ve verimli bir yol sağlar, bu da bakteriyel patojenlerin yayılmasını önlemeye ve RTI'lerin uygun tedavisine yardımcı olabilir.
Giriş
Bakteriyel patojenlerin neden olduğu solunum yolu enfeksiyonları (RTI'ler) öncelikle dünya çapında morbidite ve mortaliteye katkıda bulunur1. 2-3 gün süren ateşin eşlik ettiği herhangi bir üst veya alt solunum yolu belirtisi olarak tanımlanır. Üst solunum yolu enfeksiyonu, alt solunum yolu enfeksiyonuna göre daha sık görülürken, kronik ve tekrarlayan solunum yolu enfeksiyonları da sık görülen, bireyler için büyük riskler oluşturan ve sağlık sistemleri üzerinde önemli bir yük oluşturan klinik durumlardır2. RTI'lerin yaygın bakteriyel patojenleri arasında Streptococcus pneumoniae3, Haemophilus influenzae4, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Stenotrophomonas maltophilia ve diğerleri bulunur. Bu patojenik bakteriler genellikle konakçının nazofarenks ve üst solunum yollarının mukozal yüzeylerini kolonize ederek boğaz ağrısı ve bronşit gibi RTI'lerin tipik semptomlarına neden olur. Üst solunum yollarından alt solunum yollarının steril bölgelerine yayıldıklarında pnömoniye neden olurlar ve solunum yolu ile kişiden kişiye yayılabilirler5. Ciddi vakalarda, dünya çapında tüm yaş gruplarındaki insanlarda morbidite ve mortalitenin önde gelen nedenleri olan bakteriyemik pnömoni, menenjit ve sepsis başta olmak üzere invaziv bakteriyel hastalıklara da yol açabilirler.
RTI'ler için geleneksel testler, boğaz sürüntüleri ve balgam solunum örnekleri kullanılarak yapılan mikrobiyolojik kültürü içerir6. Ek olarak, enzime bağlı immünosorbent testi (ELISA) gibi serolojik testler serumdaki antikorları veya antijenleri tespit ederken, aglütinasyon testleri enfeksiyonu tespit etmek için antikorların ve antijenlerin aglütinasyon reaksiyonunu gözlemler7. Mikrobiyal kültür, RTI'leri teşhis etmek için altın standart olarak kabul edilir, ancak düşük kültür pozitiflik oranı, düşük güvenilirliği ve uzun tespit döngüsü tanısal verimliliği sınırlar8. Gerçekte, RTI'lerin hızlı ve doğru teşhisi, bakteriyel patojenin kesin olarak ortadan kaldırılması için çok önemlidir. Hızlı ve etkili tespit yöntemleri, patojenlerin bulaşma hızını azaltmaya, enfeksiyon süresini kısaltmaya ve gereksiz antibiyotik kullanımını azaltmaya yardımcı olabilir 9,10. Moleküler biyoloji tabanlı yöntemler, patojenleri tespit etmek için bir hedef genin DNA dizisini çoğaltan polimeraz zincir reaksiyonu (PCR) gibi tespiti önemli ölçüde hızlandırır. Bununla birlikte, geleneksel PCR, hantal ve zaman alıcı olan karmaşık sıcaklık döngüsü ekipmanı gerektirir. Ayrıca, PCR kullanılarak yapılan her DNA amplifikasyonu (gerçek zamanlı PCR hariç), ürünün elektroforetik olarak ayrılmasıyla sonuçlanır ve bu da zaman alır. Ürünün görselleştirilmesi, çoğu mutajenik veya kanserojen olan boyalar gerektirir. Bu nedenle, RTI bakteriyel patojenlerini teşhis etmek için sürekli olarak yeni yöntemler ve teknolojiler geliştirmek zorunludur.
Döngü Aracılı İzotermal Amplifikasyon (LAMP), ilk olarak Notomi ve ark. 2000yılında 11. LAMP, karmaşık sıcaklık döngüsü ekipmanı olmadan kararlı izotermal koşullar altında DNA'yı çoğaltabilir, bu da onu hızlı algılama için uygun hale getirir ve ekipman karmaşıklığını ve maliyetiniazaltır 12. LAMP, düşük konsantrasyonlarda hedef DNA'yı yüksek hassasiyetletespit edebilir 13. Hedef diziler için seçiciliği artırmak ve yanlış pozitifler14 olasılığını azaltmak için birden fazla spesifik primer kullanır. LAMP, RTI'leri tespit etmek için bile kolaylığı, hızı ve sezgisel kullanımı nedeniyle klinik laboratuvarlarda giderek yaygın olarak kullanılmaktadır. Bu çalışmada, Şekil 1'de gösterildiği gibi klinik örneklerde (balgam, bronşiyal lavaj sıvısı ve alveoler lavaj sıvısı) düşük RTI'leri tespit etmede LAMP'nin etkinliğini araştırdık. LAMP'in daha düşük RTI tespitinde geleneksel testlere göre hız, hassasiyet ve kullanım kolaylığı gibi avantajlar sunduğu ve bu da onu umut verici bir uygulama haline getirdiği açıktır.
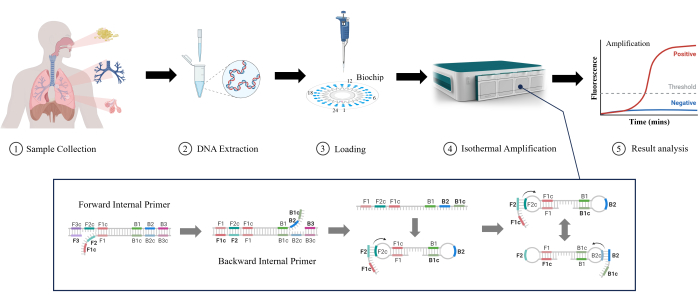
Şekil 1: LAMP algılama yönteminin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Bu çalışma için tüm örnekler Guangdong İl Halk Hastanesi Etik İnceleme Komitesi tarafından değerlendirilmiş ve onaylanmıştır (Onay Numarası: KY2023-1114-01). Tüm katılımcılar deneylerden önce yazılı bilgilendirilmiş onam imzaladılar. Çalışma için kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir. Protokolde kullanılan kısaltmalar Ek Tablo 1'de listelenmiştir.
1. Alt solunum yollarından klinik örneklerin toplanması
- Balgam toplama
- Ağız boşluğunu ve dişleri temiz suyla temizleyin ve varsa protezin çıkarılmasını sağlayın. Derin solunum balgamını bir balgam kabına (en az 0.6 mL) atmak için kuvvetlice öksürük.
- Tükürük veya burun akıntısı ile kontaminasyondan kaçının. Öksürük zorsa, balgam söktürmeyi kolaylaştırmak için 45 ° C'de 100 g / L NaCl solüsyonunun solunmasını sağlayın. Numuneyi steril, sızdırmaz bir kaba aktarın.
NOT: Balgam örneklerinin sabahları ve herhangi bir antibakteriyel ilaç kullanımından önce alındığından emin olun.
- Bronşiyal lavaj sıvısı (BLF)
- Kollektör kafasını burun deliğinden veya trakeostomi bölgesinden (yaklaşık 30 cm derinlikte) trakeaya yerleştirin. 5 mL salin enjekte edin, negatif basınç oluşturun, kolektör kafasını döndürün ve yavaşça geri çekin.
- Ekstrakte edilen mukusu toplayın ve toplayıcıyı bir kez örnekleme solüsyonu (fizyolojik tuzlu su veya enjeksiyon için steril su) ile durulayın. Alternatif olarak, toplama yerine bir pediatrik idrar kateterini 50 mL'lik bir şırıngaya bağlayın.
- Alveoler lavaj sıvısı (ALF)
- Göğüs görüntüleme muayeneleri ile lezyonun yerini belirleyin. Lavaj için en önemli veya hızla ilerleyen alanı seçin.
- Lavaj sırasında biyopsi kanalı yoluyla bronş segmentine 1-2 mL% 2 lidokain enjekte edin ve lavajlanmış akciğer segmenti15 için lokal anestezi sağlayın. İntravenöz genel anestezi altında hala güçlü hava yolu reaksiyonları sergileyen hastalar için 1-2 mL% 2 lidokain enjekte edin.
- Lokal anesteziden sonra, farenksten sağ orta lobun bronşuna veya sol akciğerin lingual segmentine geçerek ağız veya burundan bir fiberoptik bronkoskop yerleştirin. Ucunu bronş dalının girişine yerleştirin ve yavaşça steril fizyolojik salin ekleyin.
- Seans başına 100-250 mL hacimde (maks. 300 mL) 30-50 mL salin uygulayın. Ekstrakte edilen mukusu kapalı steril bir kapta toplayın.
2. DNA ekstraksiyonu
- Alt solunum yolu numunelerinin viskozitesine bağlı olarak, uygun miktarda %10 NaOH ekleyin. Düşük viskoziteli numuneler için, sıvılaştırma çözeltisi numunesinin hacminin 2-3 katı ekleyin. Orta viskoziteye sahip numuneler için, sıvılaştırma çözeltisi numunesinin hacminin 5-6 katı ekleyin. Yüksek viskoziteli numuneler için, sıvılaştırma çözeltisi numunesinin hacminin 8-10 katı ekleyin.
- %10 NaOH hacmini numune viskozitesine göre ayarlayın. Numuneleri 15 saniye boyunca bir vorteks karıştırıcı kullanarak mümkün olduğunca eşit bir şekilde dağıtın ve sıvılaştırma için 37 ° C'de 30 dakika inkübe edin.
NOT: Daha kalın numuneler için NaOH hacmini artırın veya sıvılaştırma süresini uzatın. Numunelerin sıvılaştırma kalitesi, sonraki ekstraksiyon verimliliğini doğrudan etkiler. İdeal olarak, sıvılaştırılmış numuneler tutarlı, yapışkan olmayan bir kıvam göstermelidir.
- %10 NaOH hacmini numune viskozitesine göre ayarlayın. Numuneleri 15 saniye boyunca bir vorteks karıştırıcı kullanarak mümkün olduğunca eşit bir şekilde dağıtın ve sıvılaştırma için 37 ° C'de 30 dakika inkübe edin.
- Sıvılaştırılmış numunenin 1 mL'sini 1,5 mL'lik bir santrifüj tüpüne pipetleyin. 2-6 °C'de 5 dakika boyunca 15.777 × g hızında santrifüjleyin, ardından süpernatanı çıkarmak ve atmak için bir pipet kullanın.
NOT: Numuneyi aspire ederken, tüpün altından yabancı maddeler çekmekten kaçının; Çok sayıda safsızlık varsa, numune aspirasyondan önce 1 dakika boyunca 1.753-2.739 × g'da santrifüjlenebilir. - Santrifüj tüpüne 1 mL yıkama solüsyonu ekleyin ve çökeltiyi tüpün altından kaldırmak için girdap yapın. Tamamen dağıtmaya gerek yoktur.
- Çözeltiyi 15.777 × g'da 5 dakika santrifüjleyin, süpernatanı atın ve çökeltiye dokunmamaya çalışın.
NOT: Sonraki amplifikasyonu etkilememek için yıkama solüsyonunun tamamen çıkarıldığından emin olun.
- Çözeltiyi 15.777 × g'da 5 dakika santrifüjleyin, süpernatanı atın ve çökeltiye dokunmamaya çalışın.
- Santrifüj tüpüne 100 μL nükleik asit ekstraksiyon çözeltisi ekleyin. Çökeltiyi iyice aspire etmek ve karıştırmak için bir pipet kullanın. Sıvıyı aktarın ve birlikte bir nükleik asit ekstraksiyon tüpüne çökeltin. Nükleik asit ekstraksiyon çözeltisinin bileşimi Tablo 1'de sunulmuştur.
- Nükleik asit ekstraksiyon tüplerini bir girdap karıştırıcısına yerleştirin ve en az 5 dakika orta hızda girdaplayın. Girdaplamadan sonra, nükleik asit ekstraksiyon tüplerini sabit bir sıcaklıkta metal bir banyoya aktarın ve 5 dakika boyunca 100 ° C'de ısıtın.
- 15.777 × g'da 2-6 °C'de 5 dakika santrifüjleyin ve bir kenara koyun.
NOT: PCR amplifikasyon reaksiyonu 24 saat içinde gerçekleştirilirse, nükleik asit 4 °C'de saklanabilir. Amplifikasyondan sonra nükleik asidi -20 °C'de saklayın. Uzun süreli depolama için (24 saatten fazla), nükleik asidi -20 °C'de saklayın. Tekrar kullanıma hazır olduğunda, numuneyi doğal olarak çözdürün, karıştırmak için girdaplayın, 95 ° C'lik bir su banyosunda 5 dakika ısıtın, 1 dakika boyunca 10.956 × g'da santrifüjleyin ve PCR amplifikasyonu için süpernatanı kullanın.
| Çözüm | Bileşen | Sayı | Şartname |
| Yıkama Solüsyonu | 10 mM EDTA | 1 şişe | 24 mL/şişe |
| Nükleik Asit Ekstraksiyon Reaktifi | 10mM Tris-HCl, 1mM EDTA, Nükleik asit koruyucular | 2 tüp | 1.2 mL/şişe |
| Nükleik Asit Ekstraksiyon Tüpü | Cam boncuklar | 1 çanta | 24 şişe / torba |
Tablo 1: Nükleik asit ekstraksiyon reaktifinin bileşimi.
3. Döngü aracılı izotermal amplifikasyon ve mikroakışkan çip
- Reaktif ve mikroakışkan çip
- Mikroakışkan disk şeklindeki bir çip üzerinde izotermal amplifikasyon reaksiyonları gerçekleştirin (bkz. Malzeme Tablosu). Sabit sıcaklık amplifikasyonunu 65 °C'de gerçekleştirin.
- Sabit sıcaklık amplifikasyonu mikroakışkan çip nükleik asit analizörü üzerinde bir floresan boya birleştirme yöntemi14 kullanarak gerçek zamanlı floresan analizi gerçekleştirin. İplik yer değiştirme işlevine sahip bir polimeraz kullanarak pozitif numuneler için S-şekilli bir amplifikasyon eğrisi gözlemleyin.
- Döngü aracılı izotermal amplifikasyon
- İki iç astar ve iki dış astar (LAMP kiti ile birlikte verilir) dahil olmak üzere dört özel astar ile altı dizi bölgesini hedefleyin.
NOT: DNA, iplik yer değiştirme işlevine sahip bir DNA polimeraz kullanılarak sabit bir sıcaklıkta sürekli olarak kopyalanır ve amplifiye edilir. Reaksiyon süreci, dambıl şeklindeki şablon sentez aşamasını, döngü amplifikasyon aşamasını, uzamayı ve geri dönüşüm aşamasını içerir ve sonuçta kök halka ve karnabahar benzeri yapılara sahip DNA parçalarının bir karışımını oluşturur. Ayrıntılı bilgi için kit talimatlarına bakın (Ek Dosya 1). - Kök döngü yapılarına bağlanan, iplik yer değiştirme sentezini ve döngüsel replikasyonu başlatan reaksiyon verimliliğini artırmak için reaksiyon sistemine iki döngülü primerler ekleyin. Solunum yolu patojenleri için nükleik asit tespit kitinin bileşimi Tablo 2'de sunulmaktadır.
NOT: Reaktif kiti LAMP yöntemini kullanır. Prensip, DNA'nın yaklaşık 65 °C'deki dinamik dengesine dayanır, burada çift sarmallı DNA'nın tamamlayıcı bölgesinde baz eşleşmesi yoluyla uzanan herhangi bir primer, diğer zincirin ayrışmasına ve tek bir iplik oluşturmasına neden olur.
- İki iç astar ve iki dış astar (LAMP kiti ile birlikte verilir) dahil olmak üzere dört özel astar ile altı dizi bölgesini hedefleyin.
- Mikroakışkan çip
NOT: Her bir mikroakışkan çip (Malzeme Tablosuna bakınız), saat yönünün tersine numaralandırılmış 24 reaksiyon kuyusu ile donatılmıştır ve kuyu 1'in giriş ve çıkışı reaksiyon kuyusu 1'e karşılık gelir (Şekil 2). Belirli bir nükleik asit hedef dizisinin amplifikasyonu ve tespiti için özel bir primer seti, her reaksiyon kuyusuna gömülür ve sabitlenir.- Örnek DNA'yı amplifikasyon reaktifi ile karıştırın. Karışımı çipe enjekte edin ve oda sıcaklığında 30 saniye boyunca 1.000 × g'da her bir reaksiyon kuyusu santrifüjüne dağıtın.
NOT: Bağımsız izotermal amplifikasyon reaksiyonları ve gerçek zamanlı floresan algılama, çip üzerindeki her reaksiyon kuyusunda birlikte meydana gelir. Belirli bir reaksiyon kuyusunda S-şekilli bir amplifikasyon eğrisi tespit edilirse, o kuyu için karşılık gelen algılama indeksi pozitiftir.
- Örnek DNA'yı amplifikasyon reaktifi ile karıştırın. Karışımı çipe enjekte edin ve oda sıcaklığında 30 saniye boyunca 1.000 × g'da her bir reaksiyon kuyusu santrifüjüne dağıtın.
| Bileşen | Kompozisyon | Sayı |
| Yonga | Astar | 12 yer |
| Sızdırmazlık Filmi | / | 1 yaprak |
| İzotermal Amplifikasyon Reaktifi | Floresan boya, Enzim | 270 μL/tüp |
| Pozitif Kontrol | Escherichia coli Genomik DNA | 160 μL/tüp |
Tablo 2: Solunum yolu patojenleri için nükleik asit tespit kitinin bileşimi.
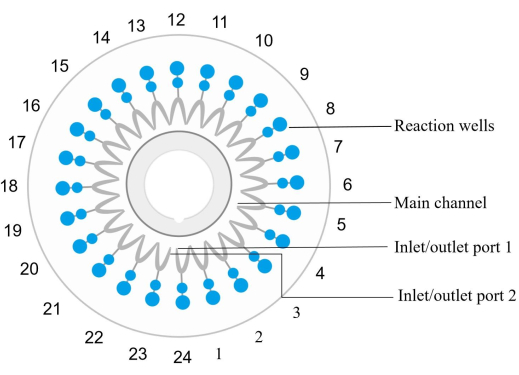
Şekil 2: Disk çip yapı şeması. Reaksiyon kuyuları saat yönünün tersine sıralı olarak numaralandırılır, burada giriş/çıkış portu 1, 1 numaralı reaksiyon kuyusuna karşılık gelir. Reaksiyon kuyuları 1, 4, 7, 10, 13, 16, 19, 22 ve 24 negatif kontrollerdir. Reaksiyon kuyusu 6 pozitif bir kontroldür (E. coli). Reaksiyon kuyusu 12 dahili bir pozitif kontroldür ve reaksiyon kuyusu 23 harici bir pozitif kontroldür. Reaksiyon kuyusu 2 spn'yi algılar. Reaksiyon kuyusu 3 sau'yu algılar. Reaksiyon kuyusu 5 MRSA'yı tespit eder. Reaksiyon kuyusu 8 kpn'yi algılar. Reaksiyon kuyusu 9 pae'yi algılar. Reaksiyon kuyusu 11 aba'yı algılar. Reaksiyon kuyusu 14 sma'yı tespit eder. Reaksiyon kuyusu 15 hin'i tespit eder. Örnek ayrıntılar için lütfen Tablo 5'e bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Numune hazırlama ve bakteri tespiti
- İzotermal amplifikasyon reaksiyon sistemini hazırlayın
- İzotermal amplifikasyon reaktifini kitten alın ve oda sıcaklığında tamamen çözülmesine izin verin. İyice karıştırmak için hafifçe çalkalayın ve tüpün dibinde toplamak için kısa bir süre santrifüjleyin.
- Reaktif saklama ve hazırlama alanında, 20 μL izotermal amplifikasyon reaktifini hazırlanmış 200 μL'lik bir santrifüj tüpüne pipetleyin. Tüpün üzerini kapatın ve numune başına bir santrifüj tüpü ile numune hazırlama alanına taşıyın.
- Numune hazırlama alanına 34,5 μL hedef nükleik asit numunesi ekleyin. İyice karıştırmak için hafifçe çalkalayın ve tüpün dibinde toplamak için kısa bir süre santrifüjleyin. Her bir nükleik asit amplifikasyon reaksiyon sisteminin toplam hacmi 54.5 μL'dir (Tablo 3).
- Talaş yükleme prosedürü
- Çip ambalajının üzerinde numune numarasını etiketleyin. Mikroakışkan çipi, ambalaj etiketi yukarı bakacak şekilde açın.
- Çipi giriş ve çıkış portları yukarı bakacak şekilde yerleştirin. Bir pipet kullanarak, hazırlanan amplifikasyon reaksiyon sisteminden 50 μL çekin ve giriş portundan çipin ana kanalına ekleyin. Ana kanal dolduğunda eklemeyi bırakın ve giriş ve çıkış portlarının etrafındaki fazla sıvıyı tüy bırakmayan mendille hızlıca silin.
- Bir sızdırmazlık filmi almak için cımbız kullanın ve giriş ve çıkış portlarının üzerine kapatın. Temiz bir pipet ucunu sızdırmazlık filminin üzerine bir yönde bastırın. Sıkı bir sızdırmazlık sağlayın.
- qPCR reaksiyonu
- Nükleik asit analizörünün ışık kaynağı ön ısıtmayı tamamladıktan sonra, Tepsiyi Aç düğmesine tıklayın. Çipi ön tarafı yukarı bakacak şekilde tepsiye yerleştirin ve sabitlemek için yerleştirme küçük silindirinin çipin orta boşluğundan çıktığından emin olun. Tepsideki merkez konumlandırma cihazını çipteki büyük merkezi delikle hizalayın.
- Çipi nükleik asit analizörüne yerleştirmek için Tepsiyi Kapat düğmesine tıklayın.
- Algılama arabirimindeki Örnek Bilgileri alanına, örneği test etmek için bilgileri girin. Numune numarası, çip numarası ve numune tipi zorunludur; diğerleri isteğe bağlıdır.
- Numune algılamayı başlatmak için işlem alanındaki Algılamayı Başlat düğmesine tıklayın. Cihaz, önceden ayarlanmış programa göre numune testi yapacaktır.
NOT: Algılama tamamlandıktan sonra, cihazın beraberindeki yazılım otomatik olarak veri analizi yapacaktır. Eşzamanlı olarak, nükleik asit analizörü otomatik bir soğutma işlemi başlatacaktır. Sıcaklık 37 °C'ye düştüğünde, cihaz tepsiyi otomatik olarak açar ve çipi almak için çıkarır. Sonuçlar sistem tarafından otomatik olarak yorumlanacaktır (Tablo 4).
- Kalite kontrol standartları
- Bu reaktif kitindeki her çipte bir pozitif kalite kontrolü ve dokuz negatif kalite kontrolü bulunur. Pozitif kalite kontrolü için tespit sonuçlarının pozitif olduğundan ve aynı zamanda dokuz negatif kalite kontrolünün tümünün sonuçlarının negatif olduğundan emin olun.
NOT: Sonuçlar, görüntünün sağ tarafında, test sonuçlarının geçerli olduğunu gösteren "Kalite Kontrol Sonuçları: Deney Normal (Pozitif Normal, Negatif Normal)" ifadesi görüntülenir. Herhangi bir sonucun yanlış olması ve numune test sonucunun geçersiz sayılması durumunda tekrar test yapılması gerekir. İnsana özgü primerleri kullanan bir pozitif dahili kontrol, çip içine yerleştirilmiştir, bunun sonucu klinik numune testi için pozitiftir, numunenin düşük bir insan genomik DNA içeriğine sahip olması durumunda negatiftir, bu da daha düşük bir hücre sayısını gösterir. Bu gibi durumlarda numuneleri toplayın ve yeniden test edin.
- Bu reaktif kitindeki her çipte bir pozitif kalite kontrolü ve dokuz negatif kalite kontrolü bulunur. Pozitif kalite kontrolü için tespit sonuçlarının pozitif olduğundan ve aynı zamanda dokuz negatif kalite kontrolünün tümünün sonuçlarının negatif olduğundan emin olun.
- Sonuç analizi
- Algılamanın tamamlanmasından sonra, hızlı amplifikasyon aşaması sırasında S-şekilli amplifikasyon eğrisinin ilk bükülme noktasını hesaplamak için yazılımda ticari olarak korunan algoritmalarla birleştirilmiş ikinci türev maksimum yöntemini kullanın. Ayrıntılar, Solunum Patojenleri Nükleik Asit Tespit Kiti Talimatlarının (Ek Dosya 1) "Testin Prensipleri" bölümünde açıklanmıştır.
NOT: TP değeri, bükülme noktası ile orijin arasındaki zaman farkıdır. Sonuç, TP ve olumlu yargı değerlerine göre yorumlanır. Bir algılama indeksi için TP değeri, o indeks için pozitif yargı değerinden küçük veya ona eşitse, pozitif olarak yorumlanır. TP değeri pozitif karar değerini aşarsa, talimatlarda yer alan "pozitif karar değeri" kriterine göre negatif olarak yorumlanır. "Floresan Eğrisi Alanı" normalleştirilmiş eğriyi gösterir ve "Algılama Sonucu" alanı her parametre için kalite kontrol ve algılama sonuçlarını gösterir (Tablo 5).
- Algılamanın tamamlanmasından sonra, hızlı amplifikasyon aşaması sırasında S-şekilli amplifikasyon eğrisinin ilk bükülme noktasını hesaplamak için yazılımda ticari olarak korunan algoritmalarla birleştirilmiş ikinci türev maksimum yöntemini kullanın. Ayrıntılar, Solunum Patojenleri Nükleik Asit Tespit Kiti Talimatlarının (Ek Dosya 1) "Testin Prensipleri" bölümünde açıklanmıştır.
| Reaktan | Hacim (μl) |
| İzotermal Amplifikasyon Reaktifi | 20 |
| Şablon DNA | 34.5 |
Tablo 3: İzotermal amplifikasyon reaksiyon sistemi.
| Adım | Bir | İki |
| Sıcaklık (°C) | 37 | 65 |
| Zaman (dk) | 3 | 47 |
Tablo 4: Nükleik asit amplifikasyon reaksiyon programı.
| Gösterge Adı | Pozitif Kontrol Değeri |
| Streptococcus pneumoniae (sp) | 30 |
| Staphylococcus aureus (sau) | 34 |
| Metisiline dirençli Staphylococcus aureus (mrsa) | 22 |
| Klebsiella pneumoniae (kpn) | 29 |
| Pseudomonas aeruginosa (pae) | 36 |
| Acinetobacter baumannii (aba) | 36 |
| Stenotrophomonas maltophilia (sma) | 27 |
| Haemophilus influenzae (hin) | 36 |
Tablo 5: Enfeksiyon göstergesi için pozitif kontrol değeri.
Sonuçlar
Bu deney, bir mikroakışkan disk çipi üzerinde reaksiyonlar yürüten izotermal amplifikasyon teknolojisini kullanır. Reaksiyon, bir floresan boya yerleştirme yöntemi kullanan bir mikroakışkan çip nükleik asit analizörü üzerinde gerçekleşir. İzotermal reaksiyon, 65 °C'lik sabit bir sıcaklıkta gerçekleştirilir ve gerçek zamanlı floresan analizi aynı anda gerçekleştirilir. Pozitif numuneler, zincir yer değiştirme işlevine sahip polimerazın etkisi altında amplifikasyona tabi tutulur ve bu da S...
Tartışmalar
Solunum yolu enfeksiyonları, hastaneyle ilişkili yaygın enfeksiyonlardır ve hastalar üzerinde ciddi sonuçlar doğurur ve ölüm oranlarını artırır16. Potansiyel patojenlerin zamanında ve doğru bir şekilde tanımlanması ve ardından etkili antibiyotikler, özellikle geleneksel kültür yöntemlerinin doğasında bulunan sınırlamalar göz önüne alındığında, başarılı tedavinin ve prognozun iyileştirilmesinin anahtarıdır17. Bu çalışmada, RTI'lerin...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Guangdong Temel ve Uygulamalı Temel Araştırma Vakfı (Hibe No. 2022A1515220023) ve Guandong Eyalet Halk Hastanesi İleri Yetenekler Araştırma Vakfı (Hibe No. KY012023293).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bath Incubator(MK2000-2) | ALLSHENG | Provide a constant temperature environment | |
| Bronchial lavage fluid collector head | TIANPINGHUACHANG | SEDA 20172081375 | Collecting bronchoalveolar lavage fluid |
| Fiberoptic bronchoscope | OLYMPUS | SEDA 20153062703 | A flexible bronchoscope equipped with a fiberoptic light source and camera, to visually examine the airways and structures within the lungs. Assist in collecting bronchoalveolar lavage |
HR1500- B2 B2 | Haier | SEDA 20183541642 | Biosafety cabinet |
| NAOH | MACKLIN | S817977 | Liquefy viscous lower respiratory tract sample |
| Nucleic acid detection kit for respiratory tract pathogens | Capitalbio Technology | SEDA 20173401346 | Testing for bacteria infection |
| Nucleic acid extraction reagent | Capitalbio Technology | SEDA 20160034 | For DNA extraction |
| RTisochip-W | Capitalbio Technology | SEDA 20193220539 | Loop-mediated Isothermal Amplification |
| THERMO ST16R | Thermo Fisher Scientific | SEDA 20180585 | Centrifuge the residual liquid off the wall of the tube. |
| Vortex mixer VM-5005 | JOANLAB | For mixing reagent |
Referanslar
- GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: A systematic analysis for the global burden of disease study 2016. Lancet Infect Dis. 18 (11), 1191-1210 (2018).
- Niederman, M. S., Torres, A. Respiratory infections. Eur Respir Rev. 31 (166), 220150 (2022).
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: Transmission, colonization and invasion. Nat Rev Microbiol. 16 (6), 355-367 (2018).
- Watt, J. P., et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years_ global estimates. Lancet. 374 (9693), 903-911 (2009).
- Kadioglu, A., Weiser, J. N., Paton, J. C., Andrew, P. W. The role of streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat Rev Microbiol. 6 (4), 288-301 (2008).
- Popova, G., Boskovska, K., Arnaudova-Danevska, I., Smilevska-Spasova, O., Jakovska, T. Sputum quality assessment regarding sputum culture for diagnosing lower respiratory tract infections in children. Open Access Maced J Med Sci. 7 (12), 1926-1930 (2019).
- Nuyttens, H., Cyncynatus, C., Renaudin, H., Pereyre, S., Identification Bébéar, C. expression and serological evaluation of the recombinant ATP synthase beta subunit of mycoplasma pneumoniae. BMC Microbiol. 10 (1), 216 (2010).
- Noviello, S., Huang, D. B. The basics and the advancements in diagnosis of bacterial lower respiratory tract infections. Diagnostics (Basel). 9 (2), 37 (2019).
- Hanson, K. E., et al. Molecular testing for acute respiratory tract infections: Clinical and diagnostic recommendations from the IDSA's diagnostics committee. Clin Infect Dis. 71 (10), 2744-2751 (2020).
- Daniel Reynolds, J. P. B., et al. The threat of multidrug-resistant/extensively drug-resistant gram-negative respiratory infections: Another pandemic. Eur Respir Rev. 31 (166), 220068 (2022).
- T Notomi, H. O., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28 (12), 63 (2000).
- Soroka, M., Wasowicz, B., Rymaszewska, A. Loop-mediated isothermal amplification (LAMP): The better sibling of PCR. Cells. 10 (8), 1931 (2021).
- Mori, Y., Kitao, M., Tomita, N., Notomi, T. Real-time turbidimetry of lamp reaction for quantifying template DNA. Biophys J. 59 (2), 145-157 (2004).
- Parida, M., Sannarangaiah, S., Dash, P. K., Rao, P. V., Morita, K. Loop mediated isothermal amplification (LAMP): A new generation of innovative gene amplification technique: Perspectives in clinical diagnosis of infectious diseases. Rev Med Virol. 18 (6), 407-421 (2008).
- Chinese Medical Association Respiratory Branch Critical Care Medicine Group, Working Committee on Critical Care Medicine of the Chinese Physicians Association Respiratory Physicians Branch. Standardization of collection, submission, testing, and interpretation of bronchoalveolar lavage fluid in ICU patients. Chin J Tubere Respir Dis. 43 (9), 744-756 (2020).
- Koch, A. M., Nilsen, R. M., Eriksen, H. M., Cox, R. J., Harthug, S. Mortality related to hospital-associated infections in a tertiary hospital: Repeated cross-sectional studies between 2004-2011. Antimicrob Resist Infect Control. 4 (1), 57 (2015).
- Seymour, C. W. F. G., et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 376 (23), 2235-2244 (2017).
- Choi, C. W., Hyun, J. W., Hwang, R. Y., Powell, C. A. Loop-mediated isothermal amplification assay for detection of candidatus Liberibacter asiaticus: A causal agent of citrus huanglongbing. Plant Pathol. 34 (6), 499-505 (2018).
- Büscher, P., Njiru, Z. K. Loop-mediated isothermal amplification technology: Towards point of care diagnostics. PLoS Negl Trop Dis. 6 (6), e1572 (2012).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): Principle, features, and future prospects. J Microbiol. 53 (1), 1-5 (2015).
- Ajibola, O., Gulumbe, B., Eze, A., Obishakin, E. Tools for detection of schistosomiasis in resource limited settings. Medical Sciences. 6 (2), 39 (2018).
- Kumar, Y. S. B., et al. Loop-mediated isothermal amplification (LAMP): A rapid and sensitive tool for quality assessment of meat products. Compr Rev Food Sci Food SAF. 16 (6), 1359-1378 (2017).
- Hongling Ou, Y. W., et al. Rapid detection of multiple pathogens by the combined loop-mediated isothermal amplification technology and microfluidic chip technology. Ann Palliat Med. 10 (10), 11053-11066 (2021).
- Liang Wang, J. -. X. L., et al. Quantitative polymerase chain reaction (qPCR)-based rapid diagnosis of helicobacter pylori infection and antibiotic resistance. J Vis Exp. (197), e65689 (2023).
- Jing-Wen Lyu, B. X., et al. Rapid prediction of multidrug-resistant klebsiella pneumoniae through deep learning analysis of SERS spectra. Microbiol Spectr. 11 (2), e0412622 (2023).
- Wei Liu, J. -. W. T., et al. Discrimination between carbapenem-resistant and carbapenem-sensitive klebsiella pneumoniae strains through computational analysis of surface-enhanced Raman spectra a pilot study. Microbiol Spectr. 10 (1), e0240921 (2022).
- Zhang, L. Y., et al. Classification and prediction of klebsiella pneumoniae strains with different MLST allelic profiles via SERS spectral analysis. Peer J. 11, e16161 (2023).
- Zhi Liu, Q. Z., et al. Rapid and sensitive detection of salmonella in chickens using loop-mediated isothermal amplification combined with a lateral flow dipstick. J Microbiol Biotechnol. 29 (3), 454-464 (2019).
- Chen, F., et al. Fully Integrated microfluidic platform for multiplexed detection of hunov by a dynamic confined-space-implemented one-pot RPA-LAMP system. Adv Sci (Weinh). 21, e2306612 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır