Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Methods Article
Kanser Araştırmaları için Fizyolojik İnsan Vaskülarize Mikro-Tümör Modelinin Oluşturulması
Bu Makalede
Özet
Bu protokol, yükleme, bakım ve değerlendirme prosedürlerinin bir açıklamasıyla birlikte yüksek verimli temel ve translasyonel insan kanseri araştırmaları, gelişmiş ilaç taraması, hastalık modellemesi ve kişiselleştirilmiş tıp yaklaşımları gerçekleştirmek için fizyolojik olarak ilgili bir çip üzerinde tümör modeli sunar.
Özet
Solid kanserlerin tümör mikroçevresini in vitro olarak özetleyen doğrulanmış kanser modellerinin eksikliği, klinik öncesi kanser araştırmaları ve terapötik geliştirme için önemli bir darboğaz olmaya devam etmektedir. Bu sorunun üstesinden gelmek için, karmaşık insan tümör mikroçevresini gerçekçi bir şekilde modelleyen mikrofizyolojik bir sistem olan vaskülarize mikrotümörü (VMT) veya tümör çipini geliştirdik. VMT, dinamik, fizyolojik akış koşulları altında birden fazla insan hücresi tipinin birlikte kültürlenmesiyle mikroakışkan bir platform içinde de novo oluşturur. Bu doku mühendisliği mikro-tümör yapısı, tıpkı yeni oluşan damarların in vivo olarak yaptığı gibi, büyüyen tümör kitlesini destekleyen canlı bir perfüze vasküler ağ içerir. Daha da önemlisi, ilaçlar ve bağışıklık hücreleri, tümöre ulaşmak için endotel tabakasını geçmeli, terapötik uygulama ve etkinlik için in vivo fizyolojik engelleri modellemelidir. VMT platformu optik olarak şeffaf olduğundan, doku içindeki floresan etiketli hücrelerin doğrudan görüntülenmesi ile immün hücre ekstravazasyonu ve metastaz gibi dinamik süreçlerin yüksek çözünürlüklü görüntülenmesi sağlanabilir. Ayrıca, VMT in vivo tümör heterojenliğini, gen ekspresyon imzalarını ve ilaç yanıtlarını korur. Hemen hemen her tümör tipi platforma uyarlanabilir ve taze cerrahi dokulardan elde edilen birincil hücreler büyür ve VMT'de ilaç tedavisine yanıt vererek gerçekten kişiselleştirilmiş tıbbın yolunu açar. Burada, VMT'yi kurma ve onkoloji araştırmaları için kullanma yöntemleri özetlenmiştir. Bu yenilikçi yaklaşım, tümörleri ve ilaç yanıtlarını incelemek için yeni olanaklar sunarak araştırmacılara kanser araştırmalarını ilerletmek için güçlü bir araç sağlar.
Giriş
Kanser dünya çapında önemli bir sağlık sorunu olmaya devam etmektedir ve Amerika Birleşik Devletleri'nde ikinci önde gelen ölüm nedenidir. Ulusal Sağlık İstatistikleri Merkezi, yalnızca 2023 yılı için ABD'de 1,9 milyondan fazla yeni kanser vakası ve 600.000'den fazla kanser ölümünün meydana gelmesini öngörüyor1 ve etkili tedavi yaklaşımlarına olan acil ihtiyacı vurguluyor. Bununla birlikte, şu anda, klinik araştırmalara giren anti-kanser terapötiklerinin yalnızca% 5.1'i nihayetinde FDA onayı almaktadır. Gelecek vaat eden adayların klinik çalışmalarda başarılı bir şekilde ilerleyememesi, kısmen klinik öncesi ilaç geliştirme sırasında 2D ve sferoid kültürler gibi fizyolojik olmayan model sistemlerinin kullanılmasına bağlanabilir2. Bu klasik kanser modelleri, terapötik direnç ve hastalık ilerlemesinin temel belirleyicileri olan stromal niş, ilişkili bağışıklık hücreleri ve perfüze damar sistemi gibi tümör mikroçevresinin temel bileşenlerinden yoksundur. Bu nedenle, klinik öncesi bulguların klinik translasyonunu iyileştirmek için insan in vivo tümör mikroçevresini daha iyi taklit eden yeni bir model sistem gereklidir.
Doku mühendisliği alanı hızla ilerlemekte ve laboratuvar ortamlarında insan hastalıklarını incelemek için gelişmiş yöntemler sunmaktadır. Önemli bir gelişme, sağlıklı veya hastalıklı koşulları kopyalayabilen işlevsel, minyatür insan organları olan organ çipleri veya doku çipleri olarak da bilinen mikrofizyolojik sistemlerin (MPS) ortaya çıkmasıdır 3,4,5. Bu kapsamda, onkoloji araştırmaları için üç boyutlu mikroakışkan tabanlı in vitro insan tümör modelleri olan tümör çipleri geliştirilmiştir 2,3,4,5,6,7,8,9,10,11,12,13 . Bu gelişmiş modeller, dinamik bir tümör mikro ortamı içinde biyokimyasal ve biyofiziksel ipuçlarını bir araya getirerek, araştırmacıların tümör davranışını ve tedavilere verilen yanıtları fizyolojik olarak daha ilgili bir bağlamda incelemelerine olanak tanır. Bununla birlikte, bu gelişmelere rağmen, çok az sayıda grup, özellikle fizyolojik akışa yanıt olarak kendi kendine patern oluşturan canlı, fonksiyonel bir damar sistemini başarılı bir şekilde dahil etmiştir 3,4,5,6. İşlevsel bir vasküler ağın dahil edilmesi, ilaç veya hücre dağıtımını etkileyen fiziksel engellerin modellenmesine, farklı mikro ortamlara hücre hedeflemesine ve tümör, stromal ve immün hücrelerin transendotelyal göçüne izin verdiği için çok önemlidir. Bu özelliği dahil ederek, tümör çipi, in vivo tümör mikroçevresinde gözlemlenen karmaşıklıkları daha iyi temsil edebilir.
Bu karşılanmamış ihtiyacı karşılamak için, mikro damar ağlarının bir mikroakışkan cihaz içinde oluşmasını sağlayan yeni bir ilaç tarama platformu geliştirdik 8,9,10,11,12,13,14,15,16. Vaskülarize mikro organ (VMO) olarak adlandırılan bu temel organ çipi platformu, hastalık modellemesi, ilaç taraması ve kişiselleştirilmiş tıp uygulamaları için orijinal doku fizyolojisini çoğaltmak için hemen hemen her organ sistemine uyarlanabilir. VMO'lar, endotelyal koloni oluşturan hücre kaynaklı endotel hücreleri (ECFC-EC), HUVEC veya iPSC-EC (bundan sonra EC olarak anılacaktır) ve matrisi yeniden şekillendiren normal insan akciğer fibroblastları (NHLF) ve damarları saran ve stabilize eden perisitler dahil olmak üzere odadaki çoklu stromal hücrelerin birlikte kültürlenmesiyle oluşturulur. VMO, vaskülarize bir mikro tümör (VMT)8,9,10,11,12,13 veya tümör çipi modeli oluşturmak için tümör hücrelerini ilişkili stroma ile birlikte kültürleyerek bir kanser modeli sistemi olarak da kurulabilir. Dinamik bir akış ortamında çoklu hücre tiplerinin birlikte kültürü yoluyla, perfüze mikrovasküler ağlar, vaskülogenezin interstisyel akış hızları14,15 tarafından yakından düzenlendiği cihazın doku odalarında de novo oluşturur. Ortam, kılcal damarlar için görülene benzer şekilde, 1.2 x 10-7 cm/s'lik bir geçirgenlik katsayısına sahip, doku odasının çevresindeki hücrelere yalnızca mikro damarlar aracılığıyla besin sağlayan bir hidrostatik basınç başlığı tarafından cihazın mikroakışkan kanallarından geçirilir in vivo8.
Kendi kendini organize eden mikro damarların VMT modeline dahil edilmesi önemli bir atılımı temsil eder, çünkü: 1) vaskülarize tümör kitlelerinin yapısını ve işlevini in vivo olarak taklit eder; 2) tümör-endotelyal ve stromal hücre etkileşimleri dahil olmak üzere metastazın temel basamaklarını modelleyebilir; 3) Besin ve ilaç dağıtımı için fizyolojik olarak seçici engeller oluşturur, farmasötik taramayı iyileştirir; ve 4) anti-anjiyojenik ve anti-metastatik yeteneklere sahip ilaçların doğrudan değerlendirilmesine izin verir. VMO/VMT platformu, karmaşık bir 3D mikro ortamda besinlerin, ilaçların ve bağışıklık hücrelerinin in vivo dağıtımını çoğaltarak, ilaç taraması yapmak ve kanser, vasküler veya organa özgü biyolojiyi incelemek için kullanılabilecek fizyolojik olarak ilgili bir modeldir. Daha da önemlisi, VMT, kolon kanseri, melanom, meme kanseri, glioblastom, akciğer kanseri, periton karsinomatozu, yumurtalık kanseri ve pankreas kanseri dahil olmak üzere çeşitli tümör türlerinin büyümesini destekler 8,9,10,11,12,13. Düşük maliyetli, kolay kurulabilen ve yüksek verimli deneyler için dizilebilen mikroakışkan platform, tümör-stromal etkileşimlerin gerçek zamanlı görüntü analizi ve uyaranlara veya terapötiklere yanıt için tamamen optik olarak uyumludur. Sistemdeki her hücre tipi, tüm deney boyunca hücre davranışının doğrudan görselleştirilmesine ve izlenmesine izin vermek için farklı bir floresan işaretleyici ile etiketlenir ve dinamik tümör mikro ortamına bir pencere oluşturur. VMT'nin in vivo tümör büyümesini, mimarisini, heterojenliğini, gen ekspresyon imzalarını ve ilaç yanıtlarını standart kültür modalitelerinden daha sadık bir şekilde modellediğini daha önce göstermiştik10. Daha da önemlisi, VMT, ana tümörlerin patolojisini standart sferoid kültürlerden daha iyi modelleyen ve kişiselleştirilmiş tıp çabalarını daha da ilerleten kanser hücreleri de dahil olmak üzere hasta kaynaklı hücrelerin büyümesini ve çalışmasını destekler11. Bu el yazması, VMT'yi kurma yöntemlerini özetlemekte ve insan kanserlerini incelemek için faydasını göstermektedir.
Protokol
1. Tasarım ve imalat
- Cihaz tasarımı
- Mikroakışkan cihaz üretimi için, bir Si-gofret (RCA-8 temizlenmiş ve% 200 hidrojen florür (HF) ile muamele edilmiş) üzerine 2 μm spin kaplı SU-1 tabakası kullanarak bir SU-2 kalıbı oluşturun,ardından daha önce açıklandığı gibi tek bir maske fotolitografi adımı 8,9.
- Sonraki imalat adımları için dayanıklı bir poliüretan kalıp oluşturmak için SU-8 kalıbından 4 mm kalınlığında bir polidimetilsiloksan (PDMS) replikası dökün. Çeşitli tasarım yinelemelerikullanılabilir 8,9,10,11,12,13,14,15.
- Mevcut yinelemede, mikroakışkan cihazı, standart bir 96 oyuklu plaka formatına özel olarak takılacak ve altta ince (1/16 inç) şeffaf bir polimer membran tabakası ile çevrelenmiş 12 mikroakışkan cihaz ünitesine sahip 2 mm kalınlığında bir PDMS özellik katmanından oluşacak şekilde tasarlayın (Şekil 1A).
- Bireysel doku ünitelerinin, jel yükleme girişi (L1) ve çıkışı (L2) ile çevrili bir doku odasından, bir basınç regülatöründen (PR)16 ve her iki taraftaki 2 ortam giriş ve çıkışına bağlı ayrılmış mikroakışkan kanallardan (M1-M2, M3-M4; Şekil 1B).
- Her bir giriş ve çıkışı, mikroakışkan kanal boyunca hidrostatik basınç (10 mmH2O) oluşturmak için orta rezervuar görevi gören tek bir kuyu içine yerleştirin. Dış kanallarla vasküler ağ anastomozlarına izin vermek için, mikroakışkan kanalları 50 μm genişliğinde iletişim gözenekleri (6 üstte, 6 altta) aracılığıyla doku odasına bağlayın.
NOT: Mikroakışkan dirençler, vasküler ağ tamamen oluştuğunda intraluminal hale gelen doku odası boyunca 5 mmH2Ointerstisyel basınç gradyanı oluşturur 8,10. Sonraki prosedürler, tamamen monte edilmiş yüksek verimli bir plaka ile başlar.
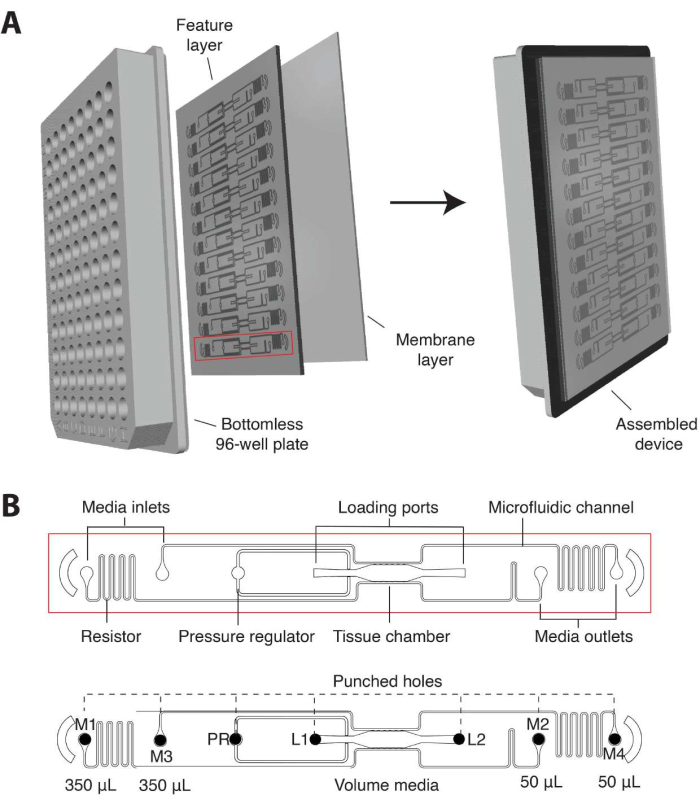
Şekil 1. Mikroakışkan platform tasarımı. (A) Platform düzeneğinin şeması, dipsiz 96 oyuklu bir plakaya bağlanmış ve ince şeffaf bir polimer membran ile kapatılmış 12 cihaz ünitesine sahip PDMS özellik katmanını gösterir. Her cihaz ünitesi, plaka üzerinde bir kuyu sütunu kaplar. Kırmızı ile özetlenen tek cihaz birimi, (B)'deki ayrıntılarla birlikte gösterilmiştir. (B) Bir cihaz ünitesinin şeması, 96 oyuklu plakanın bir kuyucuğuna yerleştirilmiş tek bir doku odasını ve hücre-matris karışımının sokulmasına izin vermek için delinmiş giriş ve çıkış (L1-L2) deliğine sahip iki yükleme portunu gösterir. Ortam girişleri ve çıkışları (M1-M2, M3-M4) delinir ve ortam rezervuarı görevi gören kuyuların içine yerleştirilir. Farklı hacimlerde ortam, ayrıştırılmış mikroakışkan kanallar aracılığıyla doku odası boyunca hidrostatik bir basınç gradyanı oluşturur. Basınç regülatörü (PR) ünitesi, yükleme kolaylığını artırmak için bir jel patlama valfi görevi görür. Cihazın 200 μm derinliğinde ve doku odasının 2 mm x 6 mm olduğuna dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Yükleme öncesi hazırlıklar
- Hücre kültürü
- Hücreleri, nemlendirilmiş 37 °C ve %5CO2 inkübatörde üreticinin tavsiyelerine göre koruyun.
- Yüklemeden 3-4 gün önce üretici ve kullanıcı protokolleri tarafından bildirilen bir yoğunlukta transdüksiyona tabi EC, NHLF veya diğer fibroblast/stromal hücre ve istenen kanser hücrelerinin plaka T75 şişeleri. Bu protokol için, her hücre tipi için şişe başına 1 x 106 hücre plaka. Endotelyal Büyüme Ortamı 2 (EGM2) tam ortamında kültür EC, %10 FBS ile Dulbecco'nun Modifiye Kartal Ortamında (DMEM) NHLF ve hücre tipine bağlı olarak uygun ortamda kanser hücreleri.
- Her 2-3 günde bir ilgili ortamla besleyerek hücreleri koruyun ve hücreleri bir floresan mikroskobu altında görselleştirerek iletim veya etiketleme verimliliğini yeniden doğrulayın. Yükleme gününde, EC'nin %80-100 birleşik, NHLF'nin ise %70-80'de alt birleşimli olduğundan emin olun.
- Fibrinojen hazırlanması
- Fibrinojen çözeltisini istenen konsantrasyona hazırlayın (tipik olarak, 5-8 mg / mL, fibrinojenin pıhtılaşma yüzdesini hesaba katarak sağlam vasküler ağ oluşumunu destekler). İhtiyaç duyulan fibrinojen miktarını aşağıdaki denklemle hesaplayın:
Fibrinojen (mg) = (hacim (mL)) x (konsantrasyon (mg/mL))/ (pıhtılaşma %) - Fibrinojeni, tüpü hafifçe vurarak (girdap yapmayın) 37 ° C'ye ısıtılmış uygun bir hacimde endotelyal bazal ortam 2 (EBM2) içinde çözün. Fibrinojeni 37 °C'lik bir su banyosunda inkübe ederek tamamen çözeltiye girmesini sağlayın. Daha da önemlisi, tam bir ortam kullanmayın.
- 0.22 μm filtreli steril filtre fibrinojen çözeltisi ve istenen hacme alikot, tipik olarak mikrosantrifüj tüpü başına 400 μL.
NOT: Diğer matriks proteinleri (örneğin, kollajenler, fibronektin veya laminin) fibrinojen karışımına eklenebilir.
- Fibrinojen çözeltisini istenen konsantrasyona hazırlayın (tipik olarak, 5-8 mg / mL, fibrinojenin pıhtılaşma yüzdesini hesaba katarak sağlam vasküler ağ oluşumunu destekler). İhtiyaç duyulan fibrinojen miktarını aşağıdaki denklemle hesaplayın:
3. Numunelerin yüklenmesi
NOT: Yükleme zamana duyarlıdır ve en iyi sonuçları elde etmek için başlangıçtan (hücre kaldırma) bitişe (cihazlara ortam eklenmesi) kadar yaklaşık 1.5-1.75 saat içinde tamamlanmalıdır. Her adım, kullanıcının yolda kalmasına yardımcı olmak için önerilen bir zamanlayıcı ile not edilir.
- Malzemelerin hazırlanması (Yükleme günü)
- Aşağıdakileri 37 °C'lik bir su banyosuna 10-15 dakika koyun: Hücreleri yıkamak için Hank'in dengeli tuz çözeltisi (HBSS) veya fosfat tamponlu salin (PBS), hücre ayrışma reaktifi, ortam (örneğin, EGM2, DMEM)
- Aşağıdaki reaktifleri kullanıma hazır olana kadar 4 °C'lik bir buzdolabında saklayın: trombin, laminin (gece boyunca 4 °C'de çözülür).
- Fibrinojen alikotunu oda sıcaklığında çözdürün. Cihaz ünitesi başına bir tüp olacak şekilde 500 μL'lik mikrosantrifüj tüplerine 1.5 μL trombin alikotları hazırlayın. Yüklemeyi kolaylaştırmak için trombin alikotunun her tüpün altında olduğundan emin olun.
- Mikroakışkanlarda sıkışan havayı çıkarmak için UV ile sterilize edilmiş yüksek verimli plakaları yüklemeden önce en az 30 dakika boyunca bir desikatöre yerleştirin.
- Hücre hazırlığı (Zamanlayıcı başlangıcı = 0 dakikada başlar)
- Birleşme ve transdüksiyon verimliliğini doğrulamak için hücreleri mikroskop altında 4x büyütmede kontrol edin.
- Her bir T75 hücre şişesini 2x 5 mL HBSS ile yıkayın ve tamamen aspire edin. Her şişeye 1 mL ayrışma reaktifi ekleyin ve 37 °C'de, %5CO2'de 1-2 dakika inkübe edin.
- Avucunuzun içini kullanarak plakaya hafifçe vurun ve tüm hücrelerin kaldırıldığını kontrol edin.
- Şişedeki hücreleri 9 mL uygun ortamla yıkayın ve 15 mL'lik bir konik halinde toplayın. Hücre sayımı için hemen küçük bir alikotu çıkarın.
- Hücreleri 300 ° C'de 3-5 dakika boyunca 4 x g'da santrifüjleyin. Hücreleri santrifüjlerken, hücreleri sayın. EC veya NHLF'nin birleşik bir T75 şişesi en az 2 x 106 hücre vermelidir.
- Santrifüjlemeden sonra, ortamı aspire edin ve peleti 1 x 106 hücre/mL konsantrasyonda uygun ortamda yeniden süspanse edin. Hücreleri buz üzerinde tutun.
- Hücre ve fibrinojen karışımının hazırlanması (Zamanlayıcı = 20 dakikada başlar)
- Pipetleme kaybını hesaba katmak için 1-2 ekleyerek kaç cihazın yükleneceğini belirleyin ve cihaz başına gereken hücre/fibrinojen karışımı hacmiyle çarpın. Bu, cihaz yapılandırmasına bağlı olacaktır, ancak bu makalede sunulan cihaz tasarımı için cihaz başına 6 μL gereklidir.
- Her hücre tipinin konsantrasyonu deneysel olarak belirlenmelidir. Bir başlangıç noktası için, EC'yi yaklaşık 7 x 106 hücre/mL konsantrasyonda ve NHLF'yi 3,5 x 106 hücre/mL konsantrasyonda yükleyin. Kanser hücrelerinin konsantrasyonu, büyüme hızlarına bağlı olarak önemli ölçüde değişebilir, ancak tipik olarak 0.5-2 x 106 hücre / mL aralığındadır. Gerekli hücre sayısını hesaplamak için bu denklemi kullanın:
İhtiyaç duyulan hücre sayısı = (fibrin hacmi (μL))/1000 μL x (hücre konsantrasyonu) - Hücreleri 1 x 106 hücre / mL konsantrasyonda yeniden süspanse edin ve gerekli hücre hacmini belirlemek için aşağıdaki denklemi kullanın:
Gerekli hücre hacmi (μL) = (gerekli hücre sayısı)/1000 - İlgili hacimlerde EC, NHLF ve kanser hücrelerini (yalnızca VMT için) konik bir tüpte karıştırın ve 4 ° C'de 3-5 dakika boyunca 300 x g'da santrifüjleyin.
- Döndürdükten sonra, ortamı dikkatlice aspire edin ve peletin yakınında kalan ortamları pipetleyin. Pelet, hava kabarcıkları oluşturmamaya ekstra özen göstererek, hesaplanan fibrinojen hacmine nazikçe ama iyice yeniden süspanse edin. Buzda kal.
- Sterilize edilmiş plakları ve trombin alikotlarını doku kültürü başlığına getirin.
- Yükleme cihazları (Zamanlayıcı = 30-35 dakikada başlar)
- Bir P20 pipeti kullanarak, hücre/fibrin karışımından 6 μL hacim pipetleyin. Homojen hücre süspansiyonu sağlamak için karışımı en az 5 kez yukarı ve aşağı pipetlediğinizden emin olun. Pıhtılaşmayı yavaşlatmak için karışımı buz üzerinde tutun.
- Pipet ucunu doğrudan tüpün altındaki trombin alikotuna koyarak hücreyi/fibrini bir trombin tüpüne yavaşça karıştırın. Hava kabarcığı oluşturmamaya dikkat ederek hemen en az 2 kez yukarı ve aşağı pipetleyin. Fibrin, trombin ile karıştığında pıhtılaşmaya başlayacaktır, bu nedenle hızlı ama kasıtlı olarak 3.4.3 adımlarını tamamlayın. ve 3.4.4. pipet ucundaki fibrin jelleşmeden önce (~3 s).
- Yüksek verimli plakayı belirli bir açıyla kaldırın ve pipet ucunu cihaz yükleme portlarından birine (L1 veya L2) hızlı bir şekilde yerleştirin. Şematik için Şekil 2A'ya bakın.
- Hücre/fibrin karışımını doku odasına enjekte etmek için pipet pistonunu pürüzsüz, akıcı bir hareketle ilk durağa kadar itin. Jelin hazneden tamamen geçmesini izleyin.
NOT: Bu adım sırasında çok fazla basınç uygulamak, jelin doku odalarının üstündeki ve/veya altındaki mikroakışkan kanallara patlamasına neden olabilir. - Pipet ucunu çıkarmadan, pipet pistonunu serbest bırakmadan veya pipeti bozmadan plakayı nazikçe kağıt mendil kültürü başlığına düz bir şekilde yerleştirin. Pipet ucunu P20'den döndürmek ve çıkarmak için elinizi kullanın ve yükleme portu deliğinde bırakın. Çok fazla basınca neden olacağından ucu çıkarmak için ejektör düğmesini kullanmayın.
- Kalan cihazlar için 3.4.1-3.4.5 adımlarıyla devam edin.
- Yükleme tamamlandığında, plakanın doku kültürü başlığında rahatsız edilmeden 2 dakika oturmasına izin verin.
- Pipet uçlarını hafifçe döndürerek ve yükleme portlarından çekerek çıkarın. Plakadaki kapağı değiştirin.
- Jelin tamamen polimerize olmasını sağlamak için tüm plakayı 37 ° C'lik bir inkübatörde 15-20 dakika inkübe edin.
- İnkübe ettikten sonra, her bir cihaz birimini mikroskop altında kontrol edin. Hücrelerin herhangi bir hava kabarcığı olmadan oda boyunca eşit olarak dağıldığını ve Şekil 2B-C'deki gibi doku odası ile mikroakışkan kanallar arasında açıkça görülebilen bir jel arayüzü olduğunu kontrol edin.
- Lamininli kanal kaplaması (Zamanlayıcı = 45-50 dakikada başlar)
- Jeller tamamen katılaştıktan sonra, vasküler anastomozu teşvik etmek için mikroakışkan kanallara laminin ekleyin.
- Bir P20 kullanarak, cihazın her bir mikroakışkan kanalına (üst ve alt) 4 μL laminin ekleyin. Pipet ucunu M1 veya M3'e yerleştirin ve lamininin tüm üst kanalı kapladığından emin olmak için laminini yavaşça dışarı atın ve ardından tüm alt kanalı kaplamak için M2 veya M4 için tekrarlayın.
- Yeterli basıncın itilmesine izin vermek için basınç regülatörünün karşısındaki taraftan laminin pipetleyerek yönü belirleyin. Bununla birlikte, laminin bir taraftan kolayca hareket etmiyorsa, ucu bir taraftan çıkarın ve laminini diğer taraftan itin. Laminini tüm kanal boyunca itmek için yeterli basıncı oluşturmak için pipetin ikinci durağına gitmek (yani pistonu tamamen aşağı itmek) gerekebilir.
- Ucu yavaşça ortam giriş/çıkışından çıkarın. P20 üzerindeki ejektör düğmesini kullanmayın.
- Her cihaz için 3.5.1-3.5.4 adımlarını tekrarlayın ve plakayı 37 °C, %5CO2'de 10 dakika inkübe edin.
- Medya ekleme (Zamanlayıcı = yaklaşık 1 saat 10 dakikada başlar)
- A ve B veya G ve H sıralarındaki kuyucukların bağlanmamış ortam rezervuarlarına 275 μL EGM2 tam ortam ekleyin. Bu yüksek taraf olacaktır ve yön basınç regülatörünün karşısındaki taraftaki kuyuların başlaması için yüksek hacim yapılarak belirlenmelidir. Medya, yerçekimi tarafından yüksek taraftan itilecek.
- Bir P200 pipeti kullanarak, 275 μL EGM2 içeren kuyucukların ortam giriş/çıkışlarına 75 μL ortam verin. Ucu medya giriş deliğine sokun ve medyanın kanaldan geçtiğini ve diğer tarafta kabarcıklar oluşturduğunu izleyerek ortamı yavaşça dışarı atın.
- Pipet ucunu çıkarın ve yüksek taraftaki toplam hacim 350 μL olacak şekilde uçtan kalan ortamı ortam haznesine itin.
- Her cihaz birimi, üst ve alt kanallar için 3.6.1-3.6.3 adımlarını tekrarlayın.
- Yukarıda açıklanan oryantasyona bağlı olarak, alt tarafı, A ve B veya G ve H sıralarındaki kuyucukları tamamen kaplamak için 50 μL ortam ekleyin. Kuyu tabanını kaplayan eşit bir ortam tabakası olduğundan emin olun. Rezervuarlardaki ortam hacimlerini gösteren bir şema için Şekil 2D'ye bakın.
- Hava kabarcıklarının giderilmesi (yükleme sonrası)
NOT: Kabarcıkları çıkarmak, her cihazda uygun akışı sağlamak için kritik bir adımdır. 2. günde, endotel hücreleri ve fibroblastlar akışa yanıt olarak gerilmeye başlayacaktır (Şekil 2E).- Tüm ortamlar eklendikten sonra, kanallarda veya ortam giriş/çıkışlarında hava kabarcıkları olup olmadığını kontrol etmeden önce plakaları 37 °C, %5CO2 inkübatörde 1-2 saat inkübe edin.
- Mikroskoptaki medya kanallarındaki kabarcıkları görselleştirin ve kabarcıkları dışarı itmek için kanallara 75 μL ortamı yeniden vererek dışarı atın.
- Ortam giriş/çıkışlarındaki kabarcıkları gözle görselleştirin. Pistonu aşağı iterek, ucu deliğe sokarak ve negatif basınç uygulamak ve balonu emmek için pistonu kaldırarak balonu dışarı çekerek ortam giriş ve çıkışlarında sıkışan hava kabarcıklarını çıkarmak için bir P200 pipeti kullanın.
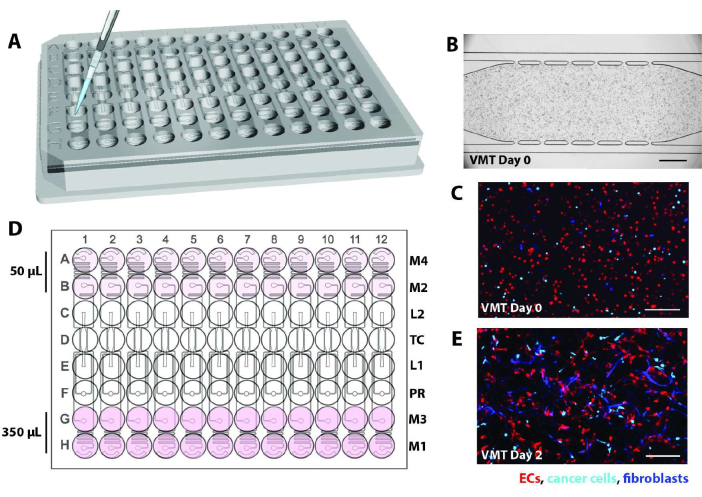
Şekil 2. Cihaz yükleme şeması. (A) Bir P20 pipeti kullanılarak, hücre/fibrin karışımı, yükleme portlarından biri aracılığıyla her bir cihaz ünitesinin doku odasına verilir. (B) Brightfield mikrografı, bir VMT oluşturmak için EC, fibroblastlar ve kanser hücrelerini yükleyen bir mikroakışkan cihazı gösterir. Ölçek çubuğu = 500 μm. (C) EC'yi kırmızı, tümörü camgöbeği ve fibroblastları mavi gösteren B'deki cihazın floresan mikrografı. (D) Şematik, hidrostatik basınç yüksekliğini oluşturmak için yüksek tarafta 350 μL ve düşük tarafta 50 μL olmak üzere rezervuarlara ortam ilavesini gösterir. (E) VMT kültürünün 2. günü, fibroblastların ve EC'nin vasküler ağı oluşturmak için gerilmeye başladığını gösterir. Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Cihaz bakımı ve deneysel uygulamalar
- Bakım ve ilaç tedavisi
NOT: Sistemdeki akışı korumak için, yüksek taraftaki toplam hacmin 350 μL'de kalması sağlanacak şekilde, ortam hacmi alçak taraftan yüksek tarafa veya tam tersi şekilde pipetlenerek hidrostatik basınç günlük olarak yeniden oluşturulmalıdır. VMO veya VMT kuruluşunun 2. gününden sonra her gün akış yönü değiştirilir. Ek bakım ve tedavi detayları aşağıda verilmiştir.- Damar sistemi tamamen yerleşene kadar (5-6. gün) EGM2 ile her gün medyayı değiştirin. Eski ortamı tamamen aspire edin ve yüksek basınçlı kuyuları (350 μL) ve düşük basınçlı kuyuları (50 μL) değiştirin.
NOT: Optimize edilmiş ortam formülasyonlarının deneysel olarak belirlenmesi, genellikle 50:50 karışımını veya EGM2'ye belirli bileşenlerin eklenmesini içeren diğer hücre tipleri için gerçekleştirilebilir. - Vasküler ağ oluştuktan ve doku tamamen geliştikten sonra (4-7. gün), cihazları deneyler için kullanmadan önce bir dekstran perfüzyon testi yapın (adım 4.2.1.). Sadece doku odasına yeterli perfüzyonu olan cihazları kullanın.
- Terapötiklerin kullanıldığı deneyler için, tedavinin başladığı gün, her cihaz için tüm floresan kanallarında görüntü alın. Bu bir temel olarak hizmet edecektir.
- Ortamı, istenen konsantrasyonda seyreltilmiş ilacı içeren taze ortamla değiştirerek cihazları istenen terapötik ile tedavi edin. İlaçların üreticinin tavsiyesine bağlı olarak uygun araçlarda seyreltildiğinden emin olun, ancak ortamda %0,01 DMSO'yu geçmemelidir.
- Cihazları istenen süre boyunca ilaca maruz bırakın (tipik olarak 48 saat, ancak farmakokinetik tarafından bilgilendirilebilir).
- Tedavi yanıtını izlemek için her cihazın her kanalını istenen zaman aralığında görüntüleyin. Deney süresince plakaları adım 4.1.1'de belirtildiği gibi koruyun.
- Deneyin tamamlanmasından sonra, ağartma plakaları ve biyolojik tehlike kabına koyun, immünofloresan boyama için %4 PFA ile sabitleyin (adım 4.3.) veya canlı hücre veya RNA izolasyonu için hasat edin (adım 4.4.).
- Damar sistemi tamamen yerleşene kadar (5-6. gün) EGM2 ile her gün medyayı değiştirin. Eski ortamı tamamen aspire edin ve yüksek basınçlı kuyuları (350 μL) ve düşük basınçlı kuyuları (50 μL) değiştirin.
- Perfüzyon tahlilleri
- Dekstran perfüzyonu
NOT: Vasküler geçirgenlik/açıklık, vasküler ağın değişen moleküler ağırlıklarda (40 kD, 70 kD veya 150 kD) floresan etiketli dekstran ile perfüze edilmesiyle belirlenebilir. EC'nin floresan etiketine bağlı olarak FITC veya rodamin-dekstran kullanılabilir.- Perfüzyondan önce, boş bir cihazın akışkan kanalına veya odasına birkaç μL dekstran ekleyerek FITC veya rodamin kanalının uygun maruziyetini belirleyin. Piksel yoğunluklarının histogramını görüntülemek için mikroskop yazılımı kullanarak pozlama süresini doygunluk seviyesinin hemen altına ayarlayın ve kayda değer herhangi bir yüksek yoğunluklu değer konsantrasyonu olmadan düzgün dağılmış piksellerle karakterize edilen dinamik bir aralık sağlayın.
- Arka plana göre kalibre etmek için floresan dekstran kanalındaki tüm cihazların arka plan görüntüsü de dahil olmak üzere ilgili kanallardaki tüm cihazların mikrograflarını alın. Yukarıda belirtilenle aynı pozlamayı kullanın ve niceleme için tutarlı görüntüler sağlamak için doku odasını görüntü çerçevesinin ortasına hizalayın.
- 1x DPBS'de 5 mg / mL konsantrasyonda bir ana FITC-dekstran veya rodamin-dekstran stoğu hazırlayın. Bu stok 4 °C'de tutulabilir.
- Bir çalışma stoğu hazırlamak için, 5 mg/mL stoğu EGM2'de 50 μg/mL'lik bir nihai konsantrasyona seyreltin.
- Rezervuarlardaki ortamı, seyreltilmiş dekstran çözeltisi ile yarı maksimum hacim olarak değiştirin (175 μL, doku odasının üst veya alt kanalındaki yüksek tarafa bir kuyuya). Diğer kuyucuklardaki ortamı değiştirin, böylece bağlanmamış yüksek taraf dekstran olmadan 175 μL taze EGM2 alır ve düşük taraftaki kuyucukların her birinde yalnızca 50 μL olur.
NOT: Dekstran, yüksek basınç tarafından, vasküler yatağa ve düşük basınç tarafından dışarı çıkan boyanın görselleştirilmesine izin vermek için mikroakışkan kanalların (üst veya alt) yalnızca bir tarafına eklenmelidir. - Mikroskop altında, floresan dekstranın vasküler ağdan akmasını izleyin. Bu genellikle boyayı ortam haznesine ekledikten sonra yaklaşık 2 dakika içinde gerçekleşir.
- Floresan dekstran kanalını (ve istenirse diğer kanalları) görüntülemeye başlayın. Bu T = 0 zaman noktasıdır. Birden fazla zaman noktasında (genellikle her 10 dakikada bir) veya tek bir bitiş noktası görüntüsünde ek görüntüler çekin.
- Hücrelerin perfüzyonu
NOT: Kanser immünolojisi çalışmaları için lenfositler veya makrofajlar ve metastaz çalışmaları için kanser hücreleri dahil olmak üzere, çalışma tasarımına bağlı olarak çeşitli hücre tipleri damar sistemi yoluyla perfüze edilebilir. Zaman içinde izlemeyi kolaylaştırmak için hücreler floresan olarak etiketlenmelidir.- Hücreleri perfüze etmeden en az 2 saat önce, yukarıda belirtildiği gibi tüm cihazlarda dekstran perfüzyonu gerçekleştirin. Bu adım, hücre eklemeden önce vasküler açıklığı belirlemek için önemlidir.
- Perfüze edilecek hücreler için uygun kamera pozlamasını belirleyin. Mikroskop altında görüntülemek için küçük bir hücre örneği alın ve bu floresan işaretleyici için pozlama süresini ayarlayın. Pozlama süresini doygunluk seviyesinin hemen altına ayarlayın.
- Arka plana göre kalibre etmek için floresan dekstran kanalındaki tüm cihazların arka plan görüntüsü de dahil olmak üzere ilgili kanallardaki tüm cihazların mikrograflarını alın. Adım 4.2.2.1'de belirlenenle aynı pozlamayı kullanın.
- Perfüzyon için hücreleri toplamadan önce dekstranın doku odalarından tamamen yayıldığını doğrulayın. İlgilenilen hücreleri toplayın ve sayın.
- Hücreleri uygun yoğunlukta EGM2'ye yeniden süspanse edin. Örneğin, T hücreleri tipik olarak kandaki konsantrasyonu taklit etmek için yaklaşık 1 x 106 hücre / mL'de eklenir.
NOT: EC, ortam bileşimine duyarlıdır ancak diğer ortamların çoğuyla %50'ye kadar karışımı tolere edebilir. Önceden test edin. - Her cihazın yüksek tarafındaki bir oyuğa 175 μL hücre süspansiyonu ekleyin ve diğer kuyucuğa 175 μL EGM2 ekleyin. Düşük tarafta, her iki kuyucuğa da 50 μL EGM2 tam ortam ekleyin.
- Mikroskop altında, floresan hücrelerin vasküler ağdan akmasını izleyin. Bu, genellikle hücreleri ortam rezervuarına ekledikten sonra yaklaşık 2 dakika içinde gerçekleşir.
- Hücre akışı sağlandıktan sonra, floresan hücre kanalını (ve istenirse diğer kanalları) görüntülemeye başlayın. Bu T = 0 zaman noktasıdır. Etüt tasarımına bağlı olarak birden fazla zaman noktasında veya tek bir uç nokta görüntüsünde ek görüntüler çekin. Örneğin, her 10 dakikada bir görüntüleme, periyodik hücre hareketlerini izlemek için yüksek çözünürlüklü zaman kurslarına veya her 6-12 saatte bir sonuçlanacaktır.
- Dekstran perfüzyonu
- İmmünofloresan (IF) boyama
- Kuyulardan ortamı aspire edin. Her bir cihaz ünitesinin yüksek tarafındaki her iki kuyucuğa 200 μL %4 PFA ve düşük tarafa 50 μL ekleyin. PFA'nın oda sıcaklığında 15 dakika veya 30°C'de 4 dakika odalardan akmasına izin verin.
- İnkübasyon sırasında, oyuk başına 500 μL 1x PBS içeren 24 oyuklu bir plaka hazırlayın. Her cihazı boyamak için kaç kuyuya ihtiyaç duyulduğunu hesaplayın.
- PFA'yı kuyulardan tamamen çıkarın. Plakayı ters çevirin ve membran üzerindeki plastik desteği dikkatlice çıkarın.
NOT: IF boyama, membran ve cihaz çıkarılmadan yerinde de yapılabilir. Bunu yapmak için, reaktifleri VMO/VMT aracılığıyla perfüze ederek boyama adımlarını gerçekleştirin ve her inkübasyon adımının süresini yaklaşık 6 kat artırın. - Her iki köşeyi kavrayarak ve yavaş ve yumuşak bir hareketle aşağı çekerek doku odalarını ortaya çıkarmak için alt membran tabakasını cihazın özellik tabakasından çok nazik ve dikkatli bir şekilde soyun. Dokunun çoğu doku odasında kalmalıdır. Lütfen Şekil 3A'ya bakın.
- Özellik katmanını tamamen kesmek için yeterli kuvvet uygulamak için bir tıraş bıçağı veya neşter kullanın ve Şekil 3B'de gösterildiği gibi her bir cihaz biriminin etrafında küçük bir dikdörtgen kesin.
- Özellik katmanı ile kuyu plakası arasına bir spatula sıkıştırın. Doku odasını içeren tüm özellik katmanını kuyu plakasından dikkatlice çıkarmak için özellik katmanının altına hafif bir basınç uygulayın.
- Dokuyu içeren her bir dikdörtgen PDMS özellik katmanı parçasını, yüzü aşağı bakacak şekilde PBS içeren tek bir kuyucuğa yerleştirin.
- Tüm üniteler kuyucuklara girdikten sonra, plakayı 5 dakika boyunca yumuşak bir külbütöre yerleştirerek, PBS'yi kuyudan aspire ederek ve 500 μL taze PBS ile değiştirerek PBS ile yıkayın. Toplam 3 yıkama için tekrarlayın.
- Her bir kuyucuktan PBS'yi aspire edin ve PBS'de 500 μL% 0.5 Triton-X ile dokuları geçirgenleştirin, her biri 10 dakika boyunca 2x, yumuşak bir külbütör üzerinde. Geçirgenlik çözeltisini çıkarın.
- Cihaz başına% 0.1 Triton-X içinde 500 μL% 10 serumu oda sıcaklığında 1 saat boyunca hafifçe sallayarak bloke edin.
- Primer antikorları% 3 serumda% 0.1 Triton-X içinde istenen konsantrasyon ve hacme seyreltin. Bloke edici solüsyonu çıkarın ve her bir oyuğun tabanını tamamen kaplayacak ve cihaz dokularının (~ 200 μL) serbest hareketine izin verecek kadar birincil antikor solüsyonu ekleyin. Plakayı şeffaf bir filmle örtün.
- Gece boyunca sallanan plakayı 4 °C'de inkübe edin. Ertesi gün, cihaz mendillerini içeren plakayı oda sıcaklığına (~15 dakika) getirin.
- Her bir kuyucuktan birincil antikor solüsyonunu aspire edin ve odaları 500 μL PBS ile, her biri 5 dakika boyunca 3x ile hafif bir külbütörde yıkayın.
- İstenilen konsantrasyonda% 0.1 Triton-X içinde% 3 serumda 200 μL ikincil antikor ekleyin. Plakayı karanlıkta oda sıcaklığında 1 saat hafifçe sallayarak inkübe edin.
- İkincil antikor solüsyonunu aspire edin ve PBS ile 3x, her biri 5 dakika boyunca hafifçe sallayarak yıkayın. Karanlıkta sallanırken 10 dakika boyunca %0,1 Triton-X içinde 1x DAPI çözeltisi ekleyin.
- Lekeli dokular içeren dikdörtgen cihaz kesiklerini cımbız kullanarak plakadan çıkarın ve doku tarafı yukarı bakacak şekilde bir kağıt havlu üzerine yerleştirin.
- Birkaç μL (~10 μL) antifade solüsyonunu doğrudan her hazneye ve lamel üzerine pipetleyin ve kabarcık oluşturmamaya dikkat edin. Antifadenin gece boyunca karanlıkta oda sıcaklığında odalarda kürlenmesine izin verin ve ardından görüntülemeye devam edin.
- Moleküler tahliller için doku ve hücre izolasyonu
NOT: Her yüksek verimli plaka, hasat zaman noktasına bağlı olarak yaklaşık 1-2 x 105 hücre içerecektir. Toplam hücrelerin yanı sıra hasat sırasındaki olası kaybı hesaba katmak için deneysel kopyaların sayısını ölçeklendirin.- Tek hücreli analizler
- Her kuyucuktan ortamı aspire edin ve yüksek verimli plakayı, cihaz katmanı yukarı bakacak şekilde ters çevirin.
- Membran üzerindeki plastik desteği çıkarın. Her iki köşeyi kavrayarak ve yavaş ve yumuşak bir hareketle aşağı çekerek doku odalarını ortaya çıkarmak için PDMS alt membranını cihazın özellik katmanından çok nazik ve dikkatli bir şekilde soyun.
- Membran, uygun yapıştırma ile bile çıkarılabilir. Zar çıkarıldıktan sonra dokunun çoğu doku odasında kalmalıdır; Bununla birlikte, membrana herhangi bir kısım yapışmışsa, membranın kendisinde aşağıdaki adımları izleyin.
- Her cihaz ünitesini 500 μL HBSS veya PBS ile yıkayın. Her cihaz ünitesine 100 μL ayrışma reaktifi ekleyin ve cihazın üzerine bir damlacık olarak oturmasına izin verin. Plakayı 37 °C'lik inkübatöre 5 dakika geri koyun.
- Sindirimden sonra, doku odaları boyunca yukarı ve aşağı pipetlemek ve dokuları ayrışma reaktifinde toplamak için bir P200 pipeti kullanın. Dokunun tamamen çıkarılmasını sağlamak için pipet ucunu her cihaz arasında ileri geri hareket ettirin ve ayrışma reaktifini nötralize etmek için 500 μL EGM2 ile 15 mL'lik bir konik halinde toplayın.
- Kalan hücrelerin doku odasından tamamen çıkarılması için, her cihaz ünitesine 500 μL EGM2 ekleyin ve bir P200 pipeti ile yıkayın.
- Tek hücreleri ve tüm dokuları peletlemek için yerinden çıkmış dokuları içeren sindirim solüsyonunu 300 x g'da 4 ° C'de 5 dakika santrifüjleyin.
- Ortamı dikkatlice aspire edin ve dokulara HBSS'de 500 μL 1 mg / mL (200 U / mL) kollajenaz tip IV, 0.1 mg / mL hyaluronidaz tip V ve 200 U / mL DNAse tip IV ekleyin.
- Nazikçe yeniden süspanse edildikten sonra, jeli ayırmak için tekrar hafifçe pipetlemeden önce çözeltiyi oda sıcaklığında 2 dakika bekletin.
- Çürütme karışımını 10 mL EGM2 ile yıkayın ve 300 x g'da 4 °C'de 5 dakika santrifüjleyin. Hücreleri %1 BSA veya HSA ile 1x DPBS'de yeniden süspanse edin ve 1 dakika boyunca 200 x g'da döndürerek önceden ıslatılmış 70 μm'lik bir filtreden geçirin.
- Hücreleri sayın ve hacmi, nihai konsantrasyon μL başına 1000 hücre olacak şekilde ayarlayın. Hücresel süspansiyonlar daha sonra FACS, akış sitometrisi veya tek hücreli RNA dizilimine tabi tutulabilir.
- Tüm dokulardan RNA izolasyonu
- Yukarıdaki 4.4.1.1 ve 4.4.1.2 adımlarını izleyin.
- Açıkta kalan her doku odasına yaklaşık 10 μL RNA lizis tamponu ekleyin ve tamponun doğrudan dokuların üzerinde birikmesini sağlayın. Toplamda 100 μL'den fazla RNA lizis tamponu kullanmayın.
- Oda sıcaklığında 3 dakika inkübe edin. Her cihaz ünitesinde yukarı ve aşağı pipetlemek için P20'yi kullanın ve gerekirse doku odasından kalan malzemeleri kazımak için pipet ucunu kullanın.
- Mümkün olduğu kadar çok lizis tamponunu 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın. 4.4.2.2.-4.4.2.3 adımlarını tekrarlayın. kalan cihazlar ve havuz numuneleri için 1,5 mL'lik tüpe.
- Kite veya reaktiflere bağlı olarak RNA'yı izole etmek için üreticinin talimatlarını izleyin.
- Tek hücreli analizler
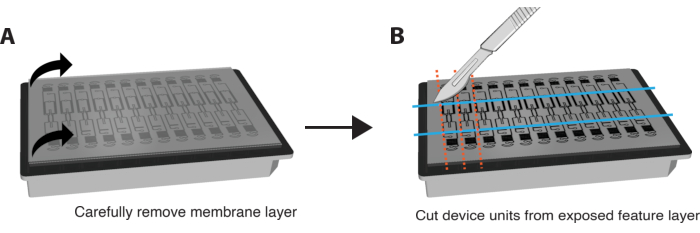
Şekil 3. İmmün boyama için platform hazırlama. (A) Üstte membran tabakası bulunan tamamen monte edilmiş cihaz platformunun şeması. Membranı çıkarmak için, dış katmanın her bir köşesini sabit, yumuşak bir hareketle dikkatlice aşağı doğru çekin. (B) Membran tabakası tamamen çıkarıldıktan sonra, dokunun kendisini kesmemeye dikkat ederek, her bir cihaz ünitesinin doku odasının etrafındaki dikdörtgenleri kesmek için bir bıçak, neşter veya bıçak kullanın. Daha sonra plakadan çıkarmak için her dikdörtgenin altına bir spatula sıkıştırılabilir ve her bir üniteyi boyama için PBS'li 24 oyuklu bir plakanın tek bir kuyusuna yerleştirebilirsiniz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Burada özetlenen protokolleri takiben, VMO'lar ve VMT'ler, ticari olarak satın alınan EC, NHLF ve VMT için üçlü negatif meme kanseri hücre hattı MDA-MB-231 kullanılarak oluşturulmuştur. Yerleşik VMO'lar ayrıca metastazı taklit etmek için kanser hücreleri ile perfüze edildi. Her modelde, ko-kültürün 5. gününde, bir vasküler ağ, doku odası boyunca yerçekimi güdümlü akışa yanıt olarak kendi kendine toplanır ve in vivo olarak besinlerin, terapötiklerin ve kanser veya bağışıklı...
Tartışmalar
Vücuttaki hemen hemen her doku, damar sistemi yoluyla besin ve oksijen alır, bu da onu gerçekçi hastalık modellemesi ve in vitro ilaç taraması için kritik bir bileşen haline getirir. Ayrıca, çeşitli maligniteler ve hastalık durumları vasküler endotel disfonksiyonu ve hiperpermeabilite ile tanımlanır3. Özellikle, kanserde, tümörle ilişkili damar sistemi genellikle kötü perfüze edilir, bozulur ve sızdırır, bu nedenle tümöre terapötik ve bağışıklık hücresi...
Açıklamalar
CCWH, bu yazıda açıklanan teknolojinin bir versiyonunu ticarileştiren Aracari Biosciences, Inc.'de hisse senedi payına sahiptir. Bu düzenlemenin şartları, çıkar çatışması politikalarına uygun olarak Kaliforniya Üniversitesi, Irvine tarafından gözden geçirilmiş ve onaylanmıştır. Başka bir çıkar çatışması yoktur.
Teşekkürler
Dr. Christopher Hughes'un laboratuvarının üyelerine, açıklanan prosedürlere değerli katkıları için ve Dr. Abraham Lee'nin laboratuvarındaki işbirlikçilerimize platform tasarımı ve üretimi konusundaki yardımları için teşekkür ederiz. Bu çalışma aşağıdaki hibelerle desteklenmiştir: UG3/UH3 TR002137, R61/R33 HL154307, 1R01CA244571, 1R01 HL149748, U54 CA217378 (CCWH) ve TL1 TR001415 ve W81XWH2110393 (SJH).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Fabrication | |||
| (3-Mercaptopropyl)trimethoxysilane, 95% | Sigma-Aldrich | 175617-100G | |
| Greiner Bio-One μClear Bottom 96-well Polystyrene Microplates | Greiner Bio-One | 655096 | |
| Methanol ≥99.8% ACS | VWR Chemicals BDH | BDH1135-1LP | |
| MILTEX Sterile Disposable Biopsy Punch with Plunger, 1mm diameter, | Integra Miltex | 33-31AA-P/25 | |
| PDMS membrane | PAX Industries | HT-6240 | |
| Plasma Cleaner PDC-001 | Harrick Plasma | N/A | |
| Smooth-Cast 385 | Smooth-On | N/A | |
| SP Bel-Art Lab Companion Clear Polycarbonate Cabinet Style Vacuum Desiccator | Bel-Art | F42400-4031 | |
| Standard Lids with Condensation Rings, 96-well plate | VWR | 82050-827 | |
| SYLGARD 184 Silicone Elastomer Kit (PDMS) | Dow | 4019862 | |
| Cell culture/Loading | |||
| BioTek Lionheart FX Automated Microscope | Agilent | CYT5MFAW | |
| CELLvo Human Endothelial Progenitor Cells | StemBioSys | N/A | |
| Collagen I, rat tail | Enzo Life Sciences | ||
| Collagenase from Clostridium histolyticum (type 4) | Sigma-Aldrich | C5138 | |
| Corning Hank’s Balanced Salt Solution, 1X without calcium and magnesium | Corning | 21-021-CV | |
| Corning DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10013CV | |
| DAPI | Sigma-Aldrich | D9542 | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Fibrinogen from bovine plasma | Neta Scientific | SIAL-341573 | |
| Fibronectin human plasma | Sigma-Aldrich | F0895 | |
| Fluorescein isothiocyanate–dextran (70kDa) | Sigma-Aldrich | FD70S-1G | |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | |
| Hyaluronidase from sheep testes (type 4) | Sigma-Aldrich | H6254 | |
| Laminin Mouse Protein | Gibco | 23017015 | |
| Leica TCS SP8 | Leica | N/A | |
| MDA-MB-231 | ATCC | HTB-26 | |
| NHLF – Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Nikon Eclipse Ti | Nikon | N/A | |
| Paraformaldehyde 4% in 0.1M Phosphate BufferSaline, pH 7.4 | Electron Microscopy Sciences | 15735-90-1L | |
| PBMCs - Peripheral blood mononuclear cells | Lonza | CC-2702 | |
| PBS, pH 7.4 | Gibco | 10010049 | |
| Premium Grade Fetal Bovine Serum (FBS), Heat Inactivated | Avantor Seradigm | 97068-091 | |
| ProLong Gold Antifade Mountant | Invitrogen | P10144 | |
| Quick-RNA Microprep Kit | Zymo Research | R1051 | |
| Thrombin from bovine plasma | Sigma-Aldrich | T4648 | |
| Triton X-100 (Electrophoresis), | Fisher BioReagents | BP151-100 | |
| TrypLE Express Enzyme (1X), phenol red | Gibco | 12605028 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Vasculife | Lifeline Cell Technology | LL-0003 |
Referanslar
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics, 2023. CA Cancer J Clin. 73 (1), 17-48 (2023).
- Hachey, S. J., Hughes, C. C. W. Applications of tumor chip technology. Lab Chip. 18 (19), 2893-2912 (2018).
- Ewald, M. L., Chen, Y. H., Lee, A. P., Hughes, C. C. W. The vascular niche in next generation microphysiological systems. Lab Chip. 21 (17), 3615-3616 (2021).
- Osaki, T., Sivathanu, V., Kamm, R. D. Vascularized microfluidic organ-chips for drug screening, disease models and tissue engineering. Curr Opin Biotechnol. 52, 116-123 (2018).
- Shirure, V. S., Hughes, C. C. W., George, S. C. Engineering vascularized organoid-on-a-chip models. Annu Rev Biomed Eng. 23, 141-167 (2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798 (2021).
- Sontheimer-Phelps, A., Hassell, B. A., Ingber, D. E. Modelling cancer in microfluidic human organs-on-chips. Nat Rev Cancer. 19 (2), 65-81 (2019).
- Sobrino, A., et al. 3D microtumors in vitro supported by perfused vascular networks. Sci Rep. 6, 31589 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Hachey, S. J., et al. An in vitro vascularized micro-tumor model of human colorectal cancer recapitulates in vivo responses to standard-of-care therapy. Lab Chip. 21 (7), 1333-1351 (2021).
- Hachey, S. J., et al. A Human Vascularized Micro-Tumor Model of Patient-Derived Colorectal Cancer Recapitulates Clinical Disease. Transl Res. 255, 97-108 (2023).
- Liu, Y., et al. Human in vitro vascularized micro-organ and micro-tumor models are reproducible organ-on-a-chip platforms for studies of anticancer drugs. Toxicology. 445, 152601 (2020).
- Jahid, S., et al. Structure-based Design of CDC42 Effector Interaction Inhibitors for the Treatment of Cancer. Cell Rep. 39 (4), 110760 (2022).
- Hsu, Y. H., Moya, M. L., Hughes, C. C. W., George, S. C., Lee, A. P. A microfluidic platform for generating large-scale nearly identical human microphysiological vascularized tissue arrays. Lab Chip. 13 (15), 2990-2998 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Christopher, C. W. H., George, S. C. In vitro perfused human capillary networks. Tissue Eng - Part C: Methods. 19 (9), 730-737 (2013).
- Wang, X., et al. An on-chip microfluidic pressure regulator that facilitates reproducible loading of cells and hydrogels into microphysiological system platforms. Lab Chip. 16 (5), 868-876 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Exp Biol Med. 242 (17), 1669-1678 (2017).
- Kurokawa, Y. K., et al. Human induced pluripotent stem cell-derived endothelial cells for three-dimensional microphysiological systems. Tissue Eng Part C: Methods. 23 (8), 474-484 (2017).
- Romero-López, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Carpenter, A. E., et al. CellProfiler: Image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS one. 6 (11), e27385 (2011).
- Corliss, B. A., et al. REAVER: A program for improved analysis of high-resolution vascular network images. Microcirculation. 27 (5), e12618 (2020).
- Urban, G., et al. Deep learning for drug discovery and cancer research: Automated analysis of vascularization images. IEEE/ACM Trans Comput Biol Bioinform. 16 (3), 1029-1035 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır