Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüksek Çözünürlüklü Yapı Belirleme için Tek Katmanlı Grafenin Kriyo-Elektron Mikroskobu Izgaralarına Uygulanması
Bu Makalede
Özet
Destek katmanlarının kriyojenik elektron mikroskobu (cryoEM) ızgaralarına uygulanması, parçacık yoğunluğunu artırabilir, hava-su arayüzü ile etkileşimleri sınırlayabilir, ışın kaynaklı hareketi azaltabilir ve parçacık yönelimlerinin dağılımını iyileştirebilir. Bu belge, gelişmiş kriyo numunesi hazırlama için cryoEM ızgaralarını tek katmanlı bir grafen ile kaplamak için sağlam bir protokolü açıklamaktadır.
Özet
Kriyojenik elektron mikroskobunda (cryoEM), saflaştırılmış makromoleküller delikli bir karbon folyo taşıyan bir ızgaraya uygulanır; Moleküller daha sonra fazla sıvıyı uzaklaştırmak için lekelenir ve kabaca 1 μm genişliğinde folyo delikleri boyunca asılı duran kabaca 20-100 nm kalınlığında bir camsı buz tabakasında hızla dondurulur. Elde edilen numune, kriyojenik transmisyon elektron mikroskobu kullanılarak görüntülenir ve uygun yazılım kullanılarak görüntü işlendikten sonra, atomik çözünürlüğe yakın yapılar belirlenebilir. cryoEM'nin yaygın olarak benimsenmesine rağmen, numune hazırlama, cryoEM iş akışlarında ciddi bir darboğaz olmaya devam ediyor ve kullanıcılar genellikle asılı camsı buzda kötü davranan numunelerle ilgili zorluklarla karşılaşıyor. Son zamanlarda, cryoEM ızgaralarını, görüntülenen alandaki parçacık yoğunluğunu sıklıkla artıran ve parçacıklar ile hava-su arayüzü arasındaki etkileşimleri azaltabilen bir destek yüzeyi görevi gören tek bir sürekli grafen tabakası ile değiştirmek için yöntemler geliştirilmiştir. Burada, grafenin cryoEM ızgaralarına uygulanması ve ortaya çıkan ızgaraların bağıl hidrofilikliğinin hızlı bir şekilde değerlendirilmesi için ayrıntılı protokoller sunuyoruz. Ek olarak, karakteristik kırınım modelini görselleştirerek grafenin varlığını doğrulamak için EM tabanlı bir yöntem açıklıyoruz. Son olarak, nispeten düşük bir konsantrasyonda saf bir numune kullanarak bir Cas9 kompleksinin 2.7 şçözünürlüklü yoğunluk haritasını hızlı bir şekilde yeniden yapılandırarak bu grafen desteklerinin faydasını gösteriyoruz.
Giriş
Tek parçacıklı kriyojenik elektron mikroskobu (cryoEM), biyolojik makromolekülleri görselleştirmek için yaygın olarak kullanılan bir yönteme dönüşmüştür1. Doğrudan elektron algılama 2,3,4, veri toplama5 ve görüntü işleme algoritmaları6,7,8,9,10'daki gelişmelerle beslenen cryoEM, artık hızla artan sayıda makromolekülün atomik çözünürlüğe yakın 3D yapılarını üretebilmektedir11. Ayrıca, yaklaşımın tek moleküllü doğasından yararlanarak, kullanıcılar tek bir örnekten 12,13,14,15 birden fazla yapı belirleyebilirve heterojen yapısal toplulukları16,17 anlamak için üretilen verileri kullanma vaadini vurgulayabilir. Bu ilerlemeye rağmen, kriyo-numune ızgarası hazırlamadaki darboğazlar devam etmektedir.
CryoEM ile yapısal karakterizasyon için, biyolojik numuneler sulu çözelti içinde iyi bir şekilde dağıtılmalı ve daha sonra vitrifikasyon18,19 adı verilen bir işlemle hızlı dondurulmalıdır. Amaç, tipik olarak amorf bir karbon tabakası halinde kesilen düzenli aralıklı delikler boyunca asılı duran düzgün bir şekilde ince bir vitrifiye buz tabakasındaki parçacıkları yakalamaktır. Bu desenli amorf karbon folyo, bakır veya altın destek çubuklarından oluşan bir ağ taşıyan bir TEM ızgarası ile desteklenir. Standart iş akışlarında, ızgaralar, numunenin uygulanmasından önce bir kızdırma deşarjı plazma işlemi kullanılarak hidrofilik hale getirilir. Fazla sıvı, filtre kağıdı ile lekelenir ve protein çözeltisinin, daldırmalı dondurma sırasında kolayca vitrifiye edilebilen delikler boyunca ince bir sıvı film oluşturmasına izin verilir. Yaygın zorluklar arasında hava-su arayüzüne (AWI) partikül lokalizasyonu ve ardından denatürasyon 20,21,22 veya tercih edilen yönlerinbenimsenmesi 23,24,25, partiküllerin deliklere göç etmek yerine karbon folyoya yapışması ve partiküllerin delikler içinde kümelenmesi ve toplanmasıyer alır 26. Düzgün olmayan buz kalınlığı başka bir endişe kaynağıdır; Kalın buz, artan elektron saçılımı nedeniyle mikrograflarda daha yüksek seviyelerde arka plan gürültüsüne neden olabilirken, aşırı ince buz daha büyük parçacıkları hariç tutabilir27.
Bu zorlukların üstesinden gelmek için, ızgara yüzeylerini kaplamak için çeşitli ince destek filmleri kullanılmıştır, bu da parçacıkların bu desteklerin üzerinde durmasına ve ideal olarak hava-su arayüzü ile etkileşimlerden kaçınmasına izin verir. Grafen destekleri, kısmen, destek katmanı28 tarafından eklenen arka plan sinyalini azaltan minimum saçılma kesiti ile birlikte yüksek mekanik mukavemetleri nedeniyle büyük umut vaat ediyor. Grafen, arka plan gürültüsüne minimum katkısına ek olarak, dikkate değer elektriksel ve termal iletkenlik sergiler29. Grafen ve grafen oksit kaplı ızgaraların daha yüksek parçacık yoğunluğu, daha düzgün parçacık dağılımı30 ve AWI22'ye daha az lokalizasyon sağladığı gösterilmiştir. Ek olarak, grafen, aşağıdakiler için daha fazla değiştirilebilen bir destek yüzeyi sağlar: 1) ızgara yüzeyinin fizyokimyasal özelliklerini işlevselleştirme yoluyla ayarlayın 31,32,33; veya 2) ilgilenilen proteinlerin afinite saflaştırılmasını kolaylaştıran çift bağlayıcı ajanlar 34,35,36.
Bu makalede, cryoEM ızgaralarını tek bir tek tip grafen30 tabakası ile kaplamak için mevcut bir prosedürü değiştirdik. Değişiklikler, verimi ve tekrarlanabilirliği artırmak amacıyla protokol boyunca şebeke kullanımını en aza indirmeyi amaçlıyor. Ek olarak, çeşitli UV/ozon tedavilerinin dalmadan önce ızgaraları hidrofilik hale getirmedeki etkinliğini değerlendirme yaklaşımımızı tartışıyoruz. Grafen kaplı ızgaralar kullanılarak kriyoEM numune hazırlamadaki bu adım kritik öneme sahiptir ve elde edilen ızgaraların nispi hidrofilikliğini ölçmek için basit yöntemimizin yararlı olduğunu gördük. Bu protokolü kullanarak, kılavuz RNA ve hedef DNA ile kompleks halinde katalitik olarak aktif olmayan S. pyogenes Cas9'un yüksek çözünürlüklü bir 3D rekonstrüksiyonunu üreterek yapı belirleme için grafen kaplı ızgaraların kullanılmasının faydasını gösteriyoruz.
Protokol
1. CVD grafenin hazırlanması
- Grafen aşındırma çözeltisini aşağıda açıklandığı gibi hazırlayın.
- 4.6 g amonyum persülfatı (APS) 20 mL moleküler dereceli su içinde 1 M'lik bir çözelti için 50 mL'lik bir beherde çözün ve alüminyum folyo ile kaplayın. Adım 1.2'ye geçerken APS'nin tamamen çözülmesine izin verin.
- Metil metakrilat (MMA) kaplama için CVD grafenin bir bölümünü hazırlayın. CVD grafenin kare bir bölümünü dikkatlice kesin. Kareyi temiz bir Petri kabı içinde bir lamel (50 mm x 24 mm) içine aktarın ve sıkma kaplayıcıya taşıma sırasında örtün.
NOT: 18 mm x 18 mm'lik bir kare, 25-36 grafen kaplı ızgara vermelidir.
2. CVD grafenin MMA ile kaplanması
- Sıkma kaplayıcı ayarlarını 2.500 rpm'de 60 sn yüksek hızlı dönüşe ayarlayın. CVD grafeni uygun boyuttaki aynaya dikkatlice yerleştirin.
NOT: İdeal olarak, CVD grafen, MMA'nın vakum sistemine aspirasyonunu önlemek için seçilen aynanın kenarından 1-2 mm uzanacaktır. - Vakum pompasını devreye sokmak ve CVD grafeni aynaya takmak için Al/Absorbe düğmesine basın. CVD grafen karenin ortasına MMA uygulayın, kapağı kapatın ve hemen Başlat/Durdur düğmesine basın. 18 mm x 18 mm kare CVD grafen için 40 μL MMA yeterlidir.
- Eğirme durduktan sonra, vakum pompasını ayırın ve MMA kaplı CVD grafeni cımbızla dikkatlice alın. CVD grafeni, MMA kaplı tarafı aşağı bakacak şekilde ters çevirin ve cam lamel üzerine geri yerleştirin.
3. Grafen arka yüzünün plazma aşındırması
- Lamel üzerindeki CVD grafeni kızdırma boşaltıcıya aktarın ve düz uçlu cımbız kullanarak 25 mA'da 30 saniye kızdırma deşarjı.
- Lamel üzerindeki CVD grafeni Petri kabına geri koyun ve bakır aşındırma alanına taşıma sırasında örtün. MMA kaplama, üst taraftaki grafen tabakasını plazma aşındırmasından koruyacaktır.
4. Izgara boyutunda MMA kaplı CVD grafen karelerin kesilmesi
- CVD grafen karesini desteklemek için iki çift cımbız kullanın. CVD grafen karesinin yönüne dikkat edin, cımbıza takılıyken MMA tarafını yukarıda tutun (KRİTİK ).
- CVD grafeni yaklaşık 3 mm x 3 mm kareler halinde kesin. CVD grafen karesini sağ tarafı yukarı bakacak şekilde tutmak ve yerine sabitlemek ve ayrıca karenin geri kalanından kestikten sonra 3 mm x 3 mm'lik bir karenin kenarını tutmak için bu adım için iki set ters etkili forseps kullanın.
5. Bakır substratın MMA kaplı CVD grafenden çözülmesi
- APS çözeltisinde her 3 mm x 3 mm kareyi dikkatlice yüzdürün. Her kareyi serbest bırakmadan önce APS çözeltisinin yüzeyiyle temas edin. Beheri, her kare çözeltiye sığ bir açıyla yerleştirilebilecek şekilde eğin; Bu, meydanın batmamasını sağlar.
- Beheri alüminyum folyo ile örtün ve gece boyunca 25 °C'de inkübe edin.
6. MMA/grafen filmlerinin APS'den çıkarılması
- 12 mm x 50 mm boyutlarında bir cam lamel kullanın ve lamel / grafen karelerini APS'ye dikey olarak hafifçe daldırarak ve ardından lamel yüzer bir MMA / grafen karesine dayanacak şekilde yanal olarak hareket ettirerek APS'den çıkarın.
- Lameli dikkatlice çıkarın ve çıkarıldıktan sonra karenin lamelin kenarına tamamen yapıştığından emin olun.
- MMA / grafen karelerini 20 dakika boyunca moleküler dereceli su ile doldurulmuş 50 mL'lik temiz bir behere aktarın. Lameli suya dikey olarak tutturulmuş bir MMA/grafen kare ile hafifçe daldırın ve karenin su yüzeyi ile etkileşime girdiğinde lamelden ayrıldığından emin olun. Tüm MMA/grafen kareleri için tekrarlayın.
7. Grafenin ızgaralara yapıştırılması
- Negatif etkili cımbız kullanarak, karbon tarafı yüzen bir MMA/grafen kareye bakacak şekilde bir ızgarayı dikey olarak suya hafifçe daldırın. Kare ile temas ettikten sonra, ızgarayı dikkatlice çıkarın ve çıkarıldıktan sonra karenin ızgaranın karbon tarafına tamamen yapışmasını sağlayın. Izgara karelerinin zarar görmesini önlemek için suya batırıldığında ızgaranın yanal hareketini en aza indirin (KRİTİK ).
- Izgaraları MMA/grafen tarafı yukarı bakacak şekilde temiz bir lamel üzerine yerleştirin ve 1 ila 2 dakika havayla kurutun. Düz uçlu cımbız kullanarak lamel grafen/MMA kaplı ızgaraları 130 °C'ye ayarlanmış bir sıcak plakaya aktarın.
- Bir cam Petri kabının üstü ile örtün ve 20 dakika inkübe edin. Ateşten alın ve 1 ila 2 dakika oda sıcaklığına soğutun.
DİKKAT: Petri kabının üstü aşırı derecede sıcak olacağından dikkatli olun.
8. MMA'nın aseton ile çözülmesi
- Tüm lameli 15 mL asetonla dolu bir Petri kabına aktarın. 30 dakika inkübe edin.
- Temiz bir cam serolojik pipet kullanarak, ızgaraların inkübe edildiği asetonu bir atık kabına aktarın. Temiz bir cam serolojik pipet kullanarak Petri kabına dikkatlice 15 mL taze aseton ekleyin. 30 dakika inkübe edin.
- Toplam 3 asetonlu yıkama için bu yıkama adımlarını tekrarlayın.
9. İzopropanol ile artık asetonun çıkarılması
- 3 aseton yıkamadan sonra, asetonu çıkarın ve temiz bir cam serolojik pipet kullanarak 15 mL izopropanol ile değiştirin. 20 dakika inkübe edin.
- Toplam 4 izopropanol yıkama için 3x tekrarlayın. Izgaraları izopropanolden dikkatlice çıkarın ve cımbız kullanarak temiz bir lamel üzerinde havayla kurutun.
NOT: Artık izopropanol, ızgaraların cımbızdan çıkarılmasını zorlaştırabilir. Izgarayı cımbızdan çıkarmadan önce ızgara ile temiz lamel arasında temas etmek bu sorunu hafifletebilir. - Grafen kaplı ızgaralara sahip lamel 10 dakika boyunca 100 °C'ye ayarlanmış bir ocak gözüne aktararak artık organikleri buharlaştırın. Oda sıcaklığına soğutun ve kullanana kadar vakum altında saklayın.
10. Grafen kaplı ızgaraların UV / ozon tedavisi
- Ters etkili cımbız kullanarak, ızgaraları grafen kaplı tarafı yukarı bakacak şekilde bir UV/ozon temizleyicinin temiz bir aydınlatma alanına nazikçe yerleştirin.
- Aydınlatma alanını kaydırarak kapatın ve makineyi AÇIN. Izgaraları UV/ozon işlemine başlamak için zaman kadranını belirlenen tedavi süresine çevirin.
NOT: Tedavi süresi ayarlanabilir bir parametredir ve aşırı tedavi şebekeye zarar verme potansiyeline sahiptir. Han ve ark.30 10 dakikalık UV/ozon tedavisi önermektedir ve biz de 10 dakikalık bir tedavinin yeterli olduğunu bulduk. Bu tedavi süresinin ayarlanmasıyla ilgili rehberlik için 12. adıma bakın. - Koh ve ark.37'de açıklandığı gibi daldırma adımlarını izleyerek doğrudan bir kriyoEM örneğini işlenmiş ızgaralara daldırmaya devam edin.
NOT: Atmosferik hidrokarbonlar, UV/ozon işleminden sonra ızgara yüzeyinde birikebilir ve grafen yüzeyinin hidrofobikliğini artırabilir 38,39. Bunu önlemek için, UV/ozon uygulanmış ızgaraları hemen daldırın. UV/ozon işleme ızgaralarını gruplar halinde işlemek avantajlı olabilir, örneğin, UV/ozon altı ızgarayı işlemek ve bu altı ızgarayı hemen daldırmak, ardından ikinci bir ızgara partisini UV/ozon işlemek, ardından ikinci partiyi daldırmak.
11. Bir kırınım görüntüsü yakalama
- Mikroskobun paralel aydınlatma ile iyi ayarlandığından emin olun ve son defokusu -0,2 μm'ye ayarlayın.
- Floresan ekranı takın ve ışın tamamen durun. Kırınım noktalarını net bir şekilde görselleştirmek için kırınım moduna girin.
- Bir CCD kamera kullanarak bir görüntü elde edin ve görüntü analiz yazılımı kullanarak değerlendirin.
NOT: Bir grafen tek tabakası tarafından oluşturulan en kolay gözlemlenen ve tanımlanabilir kırınım noktaları, 2.13 Å'lik bir uzamsal frekansa karşılık gelen 6 noktadır. Kırınım edilen ışının merkezinden karşılıklı birimlerdeki bu kırınım noktalarından birine olan mesafeyi tahmin etmek için bir ölçüm aracı kullanın. Özellikle 2.13 ş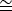 0.47 Å-1.
0.47 Å-1.
12. Şebeke hidrofilikliğinin değerlendirilmesi
- Görüntüleme kurulumunu hazırlayın. Bir telefon standı, masa üstü görüntüleme yüzeyi, kameralı telefon, cam lamel ve parafin filmi bulun. Burada gösterilen görüntüler, sağlanan .stl dosyaları kullanılarak 3D olarak basılan bir telefon standı ve masa üstü görüntüleme yüzeyi kullanılarak elde edilmiştir, bu da daha kolay tekrarlanabilir ve ölçülebilir temas açısı ölçümleri ile sonuçlanmıştır (Ek Şekil 1A).
- Düz yüzeye bir cam lamel yerleştirin, ardından 1 cm'ye 1 cm kare parafin filmi kesin ve cam lamel üzerine yerleştirin. Telefonu, kamera cam lamel ile aynı düzlemde olacak şekilde yönlendirerek telefon standına yerleştirin. Telefonu lastik bantlar kullanarak bu konumda sabitleyin (Ek Şekil 1B). Kameranın görüntüleme yüzeyiyle hizalandığını doğrulamak için örnek bir fotoğraf çekin.
- Grafen kaplı ızgaraların UV / ozon işleminden hemen sonra, cam lamel üzerindeki parafin film karesine tek bir ızgara yerleştirin. Grafen tarafının yukarı baktığından emin olun. Bir pipetle ızgara yüzeyinin ortasına 2 μL'lik bir su damlası ekleyin ve hemen bir fotoğraf çekin.
NOT: Bu adımı şu süreden sonra tekrarlayın: i) yeterli tedavi süresini belirlemek için istenen UV/ozon tedavisi aralıkları; veya ii) ızgara yüzeyinin işlemden ne kadar süre sonra hidrofilik karakterini koruduğunu ölçmek için UV/ozon işleminden sonra istenen zaman aralıkları. - Fotoğrafları ImageJ43'e aktararak ve temas açısı eklentisini kullanarak fotoğraflardan temas açılarını hesaplayın.
13. dCas9 karmaşık veri kümesinin tek parçacık analizi
NOT: Bu protokolde açıklanan tüm görüntü işleme, cryoSPARC sürüm 4.2.1 kullanılarak gerçekleştirilmiştir.
- Patch Motion Correction (Yama Hareket Düzeltme) ve Patch CTF Estimation (Yama CTF Tahmini) işlerini kullanarak filmleri önceden işleyin. Çapı 115 şile 135 şarasında değişen küresel bir blob kullanarak Blob seçici işini kullanarak parçacık toplama gerçekleştirin.
- Normalleştirilmiş korelasyon katsayısı (NCC) ve mikrograf başına yaklaşık 200-300 parçacıkla sonuçlanan güç eşiklerini kullanarak Mikrograflardan Özü çıkarma işini kullanarak parçacıkları çıkarın. Uygun eşiklerin ve ortaya çıkan partikül sayısının değişebileceğini ve kullanıcıların uygun koşulları belirlemek için bir dizi mikrografta toplama kalitesini incelemesi gerektiğini unutmayın.
- Ab-initio yeniden yapılandırma işini kullanarak üç sınıf gerektiren çok sınıflı ilk yeniden yapılandırmalar gerçekleştirin. Üç sınıftan ikisi muhtemelen yüzey kirleticileri de dahil olmak üzere Cas9 olmayan parçacıklar içerecektir. Daha fazla işlem için dCas9'a benzeyen sınıfı seçin.
NOT: Parçacık yığınını daha da iyileştirmek için ek çok sınıflı Ab-initio rekonstrüksiyonu veya Heterojen arıtma turları uygulanabilir. - Varsayılan parametreleri seçerek Tekdüzen Olmayan İyileştirme işini kullanarak 3B iyileştirme gerçekleştirin. Doğrulama (FSC) ve ThreeDFSC işlerini kullanarak, son 3B iyileştirmeden haritaları ve maskeyi kullanarak yeniden yapılandırmanın çözünürlüğünü tahmin edin.
Sonuçlar
Burada özetlenen ekipman (Şekil 1) ve protokol (Şekil 2) kullanılarak grafen kaplı kriyoEM ızgaralarının başarılı bir şekilde üretilmesi, karakteristik kırınım modeli ile doğrulanabilen folyo deliklerini kaplayan tek bir grafen tabakası ile sonuçlanacaktır. Grafen yüzeyine protein adsorpsiyonunu teşvik etmek için, oksijen içeren fonksiyonel gruplar kurarak yüzeyi hidrofilik hale getirmek için UV/ozon işlemi kullanılabilir. Bununla bir...
Tartışmalar
CryoEM numune hazırlama, çoğu iş akışının, araştırmacıların kırılgan ızgaralara zarar vermemek için son derece dikkatli bir şekilde manuel olarak manipüle etmelerini gerektiren bir dizi teknik zorluk içerir. Ek olarak, herhangi bir numunenin vitrifikasyona uygunluğu tahmin edilemez; Parçacıklar genellikle hava-su-arayüzü veya ızgaraları kaplayan katı destek folyosu ile etkileşime girer, bu da parçacıkların tercih edilen yönelimleri benimsemesine veya çok yüksek protein konsantrasyonları...
Açıklamalar
Yazarların ifşa edecek herhangi bir ihtilafı yoktur.
Teşekkürler
Örnekler, Arnold ve Mabel Beckman Vakfı sayesinde elde edilen mikroskoplarda MIT.nano'daki CryoEM Tesisinde hazırlandı ve görüntülendi. Temas açılı görüntüleme cihazları MIT Metropolis Maker Space'de basıldı. Nieng Yan ve Yimo Han'ın laboratuvarlarına ve MIT.nano personeline bu yöntemin benimsenmesi sürecindeki destekleri için teşekkür ederiz. Özellikle, anlayışlı tartışmaları ve geri bildirimleri için Dr. Guanhui Gao ve Sarah Sterling'e teşekkürlerimizi sunuyoruz. Bu çalışma, NIH hibeleri R01-GM144542, 5T32-GM007287 ve NSF-CAREER hibe 2046778 tarafından desteklenmiştir. Davis laboratuvarındaki araştırmalar Alfred P. Sloan Vakfı, James H. Ferry Fonu, MIT J-Clinic ve Whitehead Ailesi tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 250 mL beaker (3x) | Fisher | 02-555-25B | |
| 50 mL beaker (2x) | Corning | 1000-50 | |
| Acetone | Fisher | A949-4 | |
| Aluminum foil | Fisher | 15-078-292 | |
| Ammonium persulfate | Fisher | (I17874 | |
| Coverslips 50 mm x 24 mm | Mattek | PCS-1.5-5024 | |
| CVD graphene | Graphene Supermarket | CVD-Cu-2x2 | |
| easiGlow discharger | Ted-Pella | 91000S | |
| Ethanol | Millipore-Sigma | 1.11727 | |
| Flat-tip tweezers | Fisher | 50-239-60 | |
| Glass cutter | Grainger | 21UE26 | |
| Glass petri plate and cover | VWR | 75845-544 | |
| Glass serological pipette | Fisher | 13-676-34D | |
| Grid Storage Case | EMS | 71146-02 | |
| Hot plate | Fisher | 07-770-108 | |
| Isopropanol | Sigma | W292907 | |
| Kimwipe | Fisher | 06-666 | |
| Lab scissors | Fisher | 13-806-2 | |
| Methyl-Methacrylate EL-6 | Kayaku | MMA M310006 0500L1GL | |
| Molecular grade water | Corning | 46-000-CM | |
| Negative action tweezers (2x) | Fisher | 50-242-78 | |
| P20 pipette | Rainin | 17014392 | |
| P200 pipette | Rainin | 17008652 | |
| Parafilm | Fisher | 13-374-12 | |
| Pipette tips | Rainin | 30389291 | |
| Quantifoil grids with holey carbon | EMS | Q2100CR1 | |
| Spin coater | SetCas | KW-4A | with chuck SCA-19-23 |
| Straightedge | ULINE | H-6560 | |
| Thermometer | Grainger | 3LRD1 | |
| UV/Ozone cleaner | BioForce | SKU: PC440 | |
| Vacuum desiccator | Thomas Scientific | 1159X11 | |
| Whatman paper | VWR | 28297-216 |
Referanslar
- Chua, E. Y. D., et al. cheaper: Recent advances in cryo-electron microscopy. Annu Rev Biochem. 91, 1-32 (2022).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. Elife. 2, 00461 (2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nat Methods. 10 (6), 584-590 (2013).
- Campbell, M. G., et al. Movies of ice-embedded particles enhance resolution in electron cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Cheng, A., et al. Leginon: New features and applications. Protein Sci. 30 (1), 136-150 (2021).
- Scheres, S. H. RELION: implementation of a Bayesian approach to cryo-EM structure determination. J Struct Biol. 180 (3), 519-530 (2012).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nat Methods. 14 (3), 290-296 (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nat Methods. 16 (11), 1146-1152 (2019).
- Grant, T., Rohou, A., Grigorieff, N. cisTEM, user-friendly software for single-particle image processing. Elife. 7, 35383 (2018).
- Bell, J. M., Chen, M., Baldwin, P. R., Ludtke, S. J. High resolution single particle refinement in EMAN2.1. Methods. 100, 25-34 (2016).
- Cheng, Y. Single-particle cryo-EM-How did it get here and where will it go. Science. 361 (6405), 876-880 (2018).
- Kinman, L. F., Powell, B., Zhong, E., Berger, B., Davis, J. H. Uncovering structural ensembles from single particle cryo-EM data using cryoDRGN. Nat Protoc. 18 (2), 319-339 (2022).
- Zhong, E. D., Bepler, T., Berger, B., Davis, J. H. CryoDRGN: reconstruction of heterogeneous cryo-EM structures using neural networks. Nat Methods. 18 (2), 176-185 (2021).
- Chen, M., Ludtke, S. J. Deep learning-based mixed-dimensional Gaussian mixture model for characterizing variability in cryo-EM. Nat Methods. 18 (8), 930-936 (2021).
- Punjani, A., Fleet, D. J. 3D variability analysis: Resolving continuous flexibility and discrete heterogeneity from single particle cryo-EM. J Struct Biol. 213 (2), 107702 (2021).
- Dashti, A., et al. Retrieving functional pathways of biomolecules from single-particle snapshots. Nat Commun. 11 (1), 4734 (2020).
- Sun, J., Kinman, L. F., Jahagirdar, D., Ortega, J., Davis, J. H. KsgA facilitates ribosomal small subunit maturation by proofreading a key structural lesion. Nat Struct Mol Biol. , (2023).
- Dubochet, J., Chang, J. J., Freeman, R., Lepault, J., McDowall, A. W. Frozen aqueous suspensions. Ultramicroscopy. 10 (1-2), 55-61 (1982).
- Dubochet, J. Cryo-EM--the first thirty years. J Microsc. 245 (3), 221-224 (2012).
- Glaeser, R. M., et al. Factors that influence the formation and stability of thin, cryo-EM specimens. Biophys J. 110 (4), 749-755 (2016).
- Glaeser, R. M. Proteins, interfaces, and cryo-Em grids. Curr Opin Colloid Interface Sci. 34, 1-8 (2018).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Tan, Y. Z., et al. Addressing preferred specimen orientation in single-particle cryo-EM through tilting. Nat Methods. 14 (8), 793-796 (2017).
- Chen, J., Noble, A. J., Kang, J. Y., Darst, S. A. Eliminating effects of particle adsorption to the air/water interface in single-particle cryo-electron microscopy: Bacterial RNA polymerase and CHAPSO. J Struct Biol X. 1, 100005 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nat Methods. 15 (10), 793-795 (2018).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallogr D Struct Biol. 74, 560-571 (2018).
- Neselu, K., et al. Measuring the effects of ice thickness on resolution in single particle cryo-EM. J Struct Biol X. 7, 100085 (2023).
- Pantelic, R. S., et al. Graphene: Substrate preparation and introduction. J Struct Biol. 174 (1), 234-238 (2011).
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nat Mater. 6 (3), 183-191 (2007).
- Han, Y., et al. High-yield monolayer graphene grids for near-atomic resolution cryoelectron microscopy. Proc Natl Acad Sci U S A. 117 (2), 1009-1014 (2020).
- Fujita, J., et al. Epoxidized graphene grid for highly efficient high-resolution cryoEM structural analysis. Sci Rep. 13 (1), 2279 (2023).
- Lu, Y., et al. Functionalized graphene grids with various charges for single-particle cryo-EM. Nat Commun. 13 (1), 6718 (2022).
- Naydenova, K., Peet, M. J., Russo, C. J. Multifunctional graphene supports for electron cryomicroscopy. Proc Natl Acad Sci U S A. 116 (24), 11718-11724 (2019).
- Liu, N., et al. Bioactive functionalized monolayer graphene for high-resolution cryo-electron microscopy. J Am Chem Soc. 141 (9), 4016-4025 (2019).
- Benjamin, C. J., et al. Selective capture of histidine-tagged proteins from cell lysates using TEM grids modified with NTA-graphene oxide. Sci Rep. 6, 32500 (2016).
- Wang, F., et al. General and robust covalently linked graphene oxide affinity grids for high-resolution cryo-EM. Proc Natl Acad Sci U S A. 117 (39), 24269-24273 (2020).
- Koh, A., et al. Routine Collection of High-Resolution cryo-EM Datasets Using 200 KV Transmission Electron Microscope. J Vis Exp. (181), (2022).
- Schweizer, P., et al. Mechanical cleaning of graphene using in situ electron microscopy. Nat Commun. 11 (1), 1743 (2020).
- Li, Z., et al. Effect of airborne contaminants on the wettability of supported graphene and graphite. Nat Mater. 12 (10), 925-931 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Zhu, X., et al. Cryo-EM structures reveal coordinated domain motions that govern DNA cleavage by Cas9. Nat Struct Mol Biol. 26 (8), 679-685 (2019).
- Croll, T. I. ISOLDE: a physically realistic environment for model building into low-resolution electron-density maps. Acta Crystallogr D Struct Biol. 74, 519-530 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Prydatko, A. V., Belyaeva, L. A., Jiang, L., Lima, L. M. C., Schneider, G. F. Contact angle measurement of free-standing square-millimeter single-layer graphene. Nat Commun. 9 (1), 4185 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır