Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Применение монослойного графена в решетках криоэлектронной микроскопии для определения структуры с высоким разрешением
В этой статье
Резюме
Применение опорных слоев к сеткам криогенной электронной микроскопии (криоЭМ) может увеличить плотность частиц, ограничить взаимодействие с границей раздела воздух-вода, уменьшить движение, индуцированное лучом, и улучшить распределение ориентаций частиц. В данной работе описан надежный протокол покрытия криоЭМ-решеток монослоем графена для улучшения подготовки криообразцов.
Аннотация
В криогенной электронной микроскопии (криоЭМ) очищенные макромолекулы наносятся на сетку, несущую дырявую углеродную фольгу; Затем молекулы промокают, чтобы удалить лишнюю жидкость, и быстро замораживают в слое стекловидного льда толщиной примерно 20-100 нм, взвешенном в отверстиях фольги шириной примерно 1 мкм. Полученный образец получают с помощью криогенной просвечивающей электронной микроскопии, а после обработки изображения с помощью соответствующего программного обеспечения можно определить структуры с близким к атомному разрешению. Несмотря на широкое распространение криоЭМ, подготовка образцов остается серьезным узким местом в рабочих процессах криоЭМ, и пользователи часто сталкиваются с проблемами, связанными с плохим поведением образцов во взвешенном стекловидном льду. В последнее время были разработаны методы модификации криоЭМ-сеток с помощью одного непрерывного слоя графена, который действует как опорная поверхность, часто увеличивающая плотность частиц в изображаемой области и может уменьшить взаимодействие между частицами и границей раздела воздух-вода. Здесь мы приводим подробные протоколы для нанесения графена на криоЭМ-решетки и для быстрой оценки относительной гидрофильности полученных сеток. Кроме того, мы описываем метод на основе ЭМ для подтверждения присутствия графена путем визуализации его характерной дифракционной картины. Наконец, мы демонстрируем полезность этих графеновых носителей, быстро реконструируя карту плотности с разрешением 2,7 Å комплекса Cas9 с использованием чистого образца при относительно низкой концентрации.
Введение
Криогенная электронная микроскопия одиночных частиц (криоЭМ) превратилась в широко используемый метод визуализации биологических макромолекул1. Благодаря достижениям в области прямого обнаружения электронов 2,3,4, сбора данных5 и алгоритмов обработки изображений 6,7,8,9,10, cryoEM теперь способна создавать 3D-структуры с близким к атомному разрешением быстро растущего числа макромолекул 11. Кроме того, используя одномолекулярную природу подхода, пользователи могут определить несколько структур из одного образца 12,13,14,15, что подчеркивает перспективность использования полученных данных для понимания гетерогенных структурных ансамблей 16,17. Несмотря на этот прогресс, сохраняются узкие места в подготовке сетки для криообразцов.
Для структурной характеристики с помощью криоЭМ биологические образцы должны быть хорошо диспергированы в водном растворе, а затем подвергнуты мгновенной заморозке с помощью процесса, называемого витрификацией18,19. Цель состоит в том, чтобы улавливать частицы в равномерно тонком слое стекловидного льда, взвешенного в равномерно расположенных отверстиях, которые, как правило, вырезаны в слое аморфного углерода. Эта узорчатая аморфная углеродная фольга поддерживается сеткой TEM, несущей сетку из медных или золотых опорных стержней. В стандартных рабочих процессах решетки становятся гидрофильными с помощью плазменной обработки тлеющим разрядом перед нанесением образца. Излишки жидкости промокают фильтровальной бумагой, что позволяет белковому раствору образовывать тонкую жидкую пленку через отверстия, которую можно легко остекловыть во время погружной заморозки. Общие проблемы включают локализацию частиц на границе раздела воздух-вода (AWI) и последующую денатурацию 20,21,22 или принятие предпочтительных ориентаций 23,24,25, прилипание частиц к углеродной фольге вместо того, чтобы мигрировать в отверстия, а также кластеризацию и агрегацию частиц в отверстиях26. Еще одной проблемой является неоднородная толщина льда; Толстый лед может привести к более высокому уровню фонового шума на микрофотографиях из-за повышенного рассеяния электронов, в то время как чрезвычайно тонкий лед может исключать более крупные частицы27.
Для решения этих проблем были использованы различные тонкие опорные пленки для покрытия поверхностей сетки, что позволяет частицам оставаться на этих опорах и, в идеале, избегать взаимодействия с границей раздела воздух-вода. Графеновые опоры показали большие перспективы, отчасти из-за их высокой механической прочности в сочетании с минимальным сечением рассеяния, что снижает фоновый сигнал, добавляемый опорным слоем28. В дополнение к своему минимальному вкладу в фоновый шум, графен также демонстрирует замечательную электро- и теплопроводность29. Было показано, что сетки с покрытием из графена и оксида графена обеспечивают более высокую плотность частиц, более равномерное распределение частиц30 и меньшую локализацию к AWI22. Кроме того, графен обеспечивает опорную поверхность, которая может быть дополнительно модифицирована для: 1) настройки физико-химических свойств поверхности сетки посредством функционализации 31,32,33; или 2) парные связывающие агенты, облегчающие аффинную очистку интересующих белков 34,35,36.
В данной статье мы модифицировали существующую процедуру покрытия криоЭМ-сеток одним однородным слоем графена30. Изменения направлены на минимизацию обработки сетки во всем протоколе с целью повышения производительности и воспроизводимости. Кроме того, мы обсуждаем наш подход к оценке эффективности различных УФ/озоновых обработок для придания решеткам гидрофильности перед погружением. Этот этап подготовки криоЭМ образцов с использованием сеток с графеновым покрытием имеет решающее значение, и мы обнаружили, что наш простой метод количественной оценки относительной гидрофильности полученных сеток является полезным. Используя этот протокол, мы демонстрируем полезность использования сеток с графеновым покрытием для определения структуры путем создания 3D-реконструкции с высоким разрешением каталитически неактивного S. pyogenes Cas9 в комплексе с направляющей РНК и ДНК-мишенью.
протокол
1. Приготовление графена CVD
- Приготовьте раствор для травления графена, как описано ниже.
- Растворите 4,6 г персульфата аммония (APS) в 20 мл молекулярной воды в стакане объемом 50 мл для раствора 1 М и накройте алюминиевой фольгой. Дайте APS полностью раствориться, переходя к шагу 1.2.
- Подготовьте участок графена CVD для покрытия метилметакрилатом (ММА). Аккуратно вырежьте квадратный срез CVD графена. Перенесите квадрат на покровный лист (50 мм x 24 мм) в чистую чашку Петри и накройте крышкой во время транспортировки в машину для нанесения покрытий.
ПРИМЕЧАНИЕ: Квадрат размером 18 мм x 18 мм должен дать 25-36 сеток с графеновым покрытием.
2. Покрытие CVD графеном MMA
- Установите настройки центрифугатора на 60 с высокоскоростной отжим при 2 500 об/мин. Осторожно поместите графен CVD на патрон подходящего размера.
ПРИМЕЧАНИЕ: В идеале графен CVD должен выступать на 1-2 мм за край выбранного патрона, чтобы предотвратить аспирацию MMA в вакуумную систему. - Нажмите кнопку Take/Absorb , чтобы включить вакуумный насос и прикрепить графен CVD к патрону. Нанесите MMA на центр графенового квадрата CVD, закройте крышку и немедленно нажмите кнопку «Старт / Стоп ». Для квадрата CVD-графена размером 18 мм x 18 мм достаточно 40 мкл MMA.
- После остановки отжима отключите вакуумный насос и осторожно извлеките графен CVD с покрытием MMA пинцетом. Переверните графен CVD так, чтобы сторона, покрытая MMA, была обращена вниз, и поместите его обратно на стеклянный защитный лист.
3. Плазменное травление обратной стороны графена
- С помощью пинцета с плоским наконечником перенесите графен CVD на покровное стекло в тлеющий разрядник и тлеющий разряд в течение 30 с током 25 мА.
- Верните графен CVD на покровном стекло в чашку Петри и крышку во время транспортировки в зону травления меди. Покрытие MMA защитит верхний слой графена от плазменного травления.
4. Резка графеновых квадратов CVD размером с сетку MMA
- Используйте две пары пинцетов для поддержки графенового квадрата CVD. Обратите внимание на ориентацию графенового квадрата CVD, держите сторону MMA вверх, когда прикреплена к пинцету (КРИТИЧНО).
- Нарежьте графен CVD на квадраты примерно 3 мм x 3 мм. Используйте два набора щипцов обратного действия для этого шага, чтобы удерживать графеновый квадрат CVD правой стороной вверх и закрепить его в нужном положении, а также удерживать край квадрата размером 3 мм x 3 мм после того, как он отрезал его от остальной части квадрата.
5. Растворение медной подложки из CVD-графена с покрытием MMA
- Осторожно прогладьте каждый квадрат размером 3 мм x 3 мм в растворе APS. Соприкоснитесь с поверхностью раствора APS, прежде чем отпускать каждый квадрат. Наклоните стакан так, чтобы каждый квадрат можно было поместить в раствор под небольшим углом; Это гарантирует, что квадрат не утонет.
- Накройте стакан алюминиевой фольгой и инкубируйте в течение ночи при температуре 25 °C.
6. Удаление пленок MMA/графена из APS
- Используйте стеклянный защитный лист размером 12 мм x 50 мм и извлеките квадраты MMA/графена из APS, осторожно погрузив защитный лист вертикально в APS, а затем переместив покровный лист в сторону так, чтобы он примыкал к плавающему квадрату MMA/графена.
- Осторожно снимите защитный лист и убедитесь, что квадрат полностью прилегает к боковой стороне защитного стекла при снятии.
- Переложите квадраты MMA/графена в чистый стакан объемом 50 мл, наполненный молекулярной водой, на 20 минут. Осторожно погрузите покровное стекло с прикрепленным квадратом MMA/графена в воду вертикально и убедитесь, что квадрат вываливается из покровного стекла при взаимодействии с поверхностью воды. Повторите то же самое для всех квадратов MMA/graphene.
7. Прилипание графена к сеткам
- Используя пинцет отрицательного действия, осторожно опустите сетку вертикально в воду карбоновой стороной, обращенной к плавающему квадрату MMA/графена. После контакта с квадратом осторожно снимите решетку и убедитесь, что квадрат полностью прилегает к углеродной стороне решетки после снятия. Сведите к минимуму боковое смещение сетки при погружении в воду, чтобы не повредить квадраты сетки (КРИТИЧЕСКИЙ).
- Положите решетки на чистый покровный лист MMA/графеновой стороной вверх и сушите на воздухе в течение 1–2 минут. Перенесите сетки с покрытием из графена/MMA на горячую плиту, установленную на 130 °C, с помощью пинцета с плоским наконечником.
- Накрыть крышкой стеклянной чашки Петри и инкубировать 20 мин. Снимите с огня и охладите до комнатной температуры в течение 1-2 минут.
ВНИМАНИЕ: Соблюдайте осторожность, так как верхняя часть чашки Петри будет очень горячей.
8. Растворение ММА ацетоном
- Переложите весь покровный листок в чашку Петри, наполненную 15 мл ацетона. Инкубировать 30 мин.
- С помощью чистой стеклянной серологической пипетки перенесите ацетон, в котором инкубировались сетки, в контейнер для отходов. Осторожно добавьте 15 мл свежего ацетона в чашку Петри с помощью чистой стеклянной серологической пипетки. Инкубировать 30 мин.
- Повторите эти шаги стирки в общей сложности для 3 промывок ацетоном.
9. Удаление остатков ацетона изопропанолом
- После 3 промывок ацетоном удалите ацетон и замените его 15 мл изопропанола с помощью чистой стеклянной серологической пипетки. Инкубировать 20 мин.
- Повторите 3 раза, чтобы в общей сложности выполнить 4 смывания изопропанолом. Осторожно удалите сетки от изопропанола и высушите на воздухе на чистом покровном стекле с помощью пинцета.
ПРИМЕЧАНИЕ: Остаточный изопропанол может затруднить освобождение сетки от пинцета. Установление контакта между сеткой и чистым покровным стеклом перед освобождением сетки от пинцета может облегчить эту проблему. - Испарите остатки органики, перенеся покровное стекло с решетками с графеновым покрытием на конфорку, установленную на 100 °C в течение 10 минут. Остудите до комнатной температуры и храните под вакуумом до использования.
10. УФ/озоновая обработка сеток с графеновым покрытием
- Используя пинцет обратного действия, аккуратно поместите решетки в чистую зону освещения УФ/озонового очистителя стороной с графеновым покрытием вверх.
- Закройте зону освещения и включите машину. Поверните диск времени на назначенное время обработки, чтобы начать обработку решеток ультрафиолетовым излучением / озоном.
ПРИМЕЧАНИЕ: Продолжительность обработки является настраиваемым параметром, при этом избыточная обработка может повредить сетку. Han et al.30 рекомендуют 10-минутную обработку ультрафиолетом/озоном, и мы также обнаружили, что 10-минутной процедуры достаточно. Обратитесь к шагу 12 для получения рекомендаций по настройке этого времени лечения. - Приступайте непосредственно к погружению криоЭМ-образца на обработанные решетки, выполнив шаги погружения, как описано в Koh et al.37.
ПРИМЕЧАНИЕ: Атмосферные углеводороды могут накапливаться на поверхности сетки после обработки УФ/озоном и увеличивать гидрофобность поверхности графена38,39. Чтобы избежать этого, немедленно погрузите решетки, обработанные ультрафиолетом/озоном. Может быть полезно обрабатывать сетки УФ/озоном партиями, например, обработка УФ/озоном шести сеток и немедленное погружение этих шести сеток, затем обработка УФ/озоном второй партии сеток, а затем погружение второй партии.
11. Получение дифракционного изображения
- Убедитесь, что микроскоп хорошо настроен при установленном параллельном освещении, и установите конечную расфокусировку на -0,2 мкм.
- Вставьте люминесцентный экран, и луч полностью остановится. Войдите в дифракционный режим, чтобы четко визуализировать дифракционные пятна.
- Получение изображения с помощью ПЗС-камеры и его оценка с помощью программного обеспечения для анализа изображений.
ПРИМЕЧАНИЕ: Наиболее легко наблюдаемыми и идентифицируемыми дифракционными пятнами, генерируемыми монослоем графена, являются 6 пятен, соответствующих пространственной частоте 2,13 Å. Используйте измерительный инструмент, чтобы оценить расстояние от центра дифрагированного пучка до одного из этих дифракционных пятен в обратных единицах. Примечательно, что 2,13 Х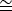 0,47 Е-1.
0,47 Е-1.
12. Оценка гидрофильности сетки
- Подготовьте установку для создания образов. Найдите подставку для телефона, настольную поверхность для визуализации, телефон с камерой, стеклянную защитную пленку и парафиновую пленку. Изображения, показанные здесь, были получены с помощью подставки для телефона и настольной поверхности изображения, которые были напечатаны на 3D-принтере с использованием предоставленных файлов .stl, что привело к более легко воспроизводимым и количественно измеримым измерениям угла контакта (дополнительный рисунок 1A).
- Положите стеклянный покровный листок на плоскую поверхность, затем отрежьте квадрат парафиновой пленки размером 1 см на 1 см и поместите его на стеклянный покровный листок. Поместите телефон на подставку для телефона, расположив телефон так, чтобы камера находилась в плоскости со стеклянной защитной накладкой. Закрепите телефон в этом положении с помощью резинок (дополнительный рисунок 1B). Сделайте образец фотографии, чтобы убедиться, что камера выровнена по поверхности изображения.
- Непосредственно после обработки УФ/озоном решеток с графеновым покрытием поместите одинарную сетку на квадрат парафиновой пленки на стеклянном покровном стекле. Убедитесь, что графеновая сторона обращена вверх. Добавьте каплю воды объемом 2 мкл на центр поверхности решетки с помощью пипетки и сразу же сделайте снимок.
ПРИМЕЧАНИЕ: Повторите этот шаг после: i) желаемых интервалов обработки УФ/озоном, чтобы определить достаточную продолжительность обработки; или ii) желаемые интервалы времени после обработки УФ-излучением/озоном, чтобы измерить, как долго после обработки поверхность сетки сохраняет свои гидрофильные свойства. - Рассчитайте углы контакта по фотографиям, импортировав их в ImageJ43 и используя плагин контактных углов.
13. Одночастичный анализ комплексного набора данных dCas9
ПРИМЕЧАНИЕ: Вся обработка изображений, описанная в этом протоколе, была выполнена с использованием cryoSPARC версии 4.2.1.
- Предварительная обработка фильмов с помощью заданий Patch Motion Correction и Patch CTF Estimation. Выполните выбор частиц с помощью задания Выбор BLOB-объектов, используя сферический BLOB-объект диаметром от 115 Å до 135 Å.
- Извлечение частиц с помощью задания Извлечение из микрофотографий с использованием нормализованного коэффициента корреляции (NCC) и пороговых значений мощности, что дает примерно 200-300 частиц на микрофотографию. Обратите внимание, что соответствующие пороговые значения и результирующее количество частиц могут отличаться, и пользователи должны проверять качество пленки на различных микрофотографиях, чтобы определить подходящие условия.
- Выполните многоклассовые начальные реконструкции с помощью задания реконструкции Ab-initio, для которого требуется три класса. Два из трех классов, вероятно, будут содержать частицы, не относящиеся к Cas9, включая поверхностные загрязнители. Выберите класс, похожий на dCas9, для дальнейшей обработки.
ПРИМЕЧАНИЕ: Для дальнейшего уточнения стека частиц могут быть применены дополнительные раунды мультиклассовой реконструкции Ab-initio или гетерогенного измельчения. - Выполните 3D-уточнение с помощью задания Неравномерное уточнение, выбрав параметры по умолчанию. Оцените разрешение реконструкции с помощью заданий Validation (FSC) и ThreeDFSC, используя карты и маску из окончательного 3D-уточнения.
Результаты
Успешное изготовление криоЭМ сеток с графеновым покрытием с использованием оборудования (рис. 1) и протокола (рис. 2), описанных здесь, приведет к появлению монослоя графена, покрывающего отверстия фольги, что может быть подтверждено его характерной дифра...
Обсуждение
Подготовка образцов для криоЭМ сопряжена с множеством технических проблем, при этом большинство рабочих процессов требуют от исследователей ручных манипуляций с хрупкими сетками с особой осторожностью, чтобы не повредить их. Кроме того, восприимчивость любого образца к витрификации ...
Раскрытие информации
У авторов нет конфликтов, которые можно было бы раскрыть.
Благодарности
Образцы были подготовлены и визуализированы на CryoEM Facility в MIT.nano на микроскопах, приобретенных благодаря Фонду Арнольда и Мейбл Бекман. Устройства для визуализации контактного угла были напечатаны в MIT Metropolis Maker Space. Мы благодарим лаборатории Nieng Yan и Yimo Han, а также сотрудников MIT.nano за их поддержку на протяжении всего процесса внедрения этого метода. В частности, мы выражаем нашу благодарность докторам Гуаньхуэй Гао и Саре Стерлинг за их содержательные дискуссии и отзывы. Эта работа была поддержана грантами NIH R01-GM144542, 5T32-GM007287 и грантом NSF-CAREER 2046778. Исследования в лаборатории Дэвиса поддерживаются Фондом Альфреда. Слоуна, Фондом Джеймса Х. Ферри, J-Clinic Массачусетского технологического института и семьей Уайтхед.
Материалы
| Name | Company | Catalog Number | Comments |
| 250 mL beaker (3x) | Fisher | 02-555-25B | |
| 50 mL beaker (2x) | Corning | 1000-50 | |
| Acetone | Fisher | A949-4 | |
| Aluminum foil | Fisher | 15-078-292 | |
| Ammonium persulfate | Fisher | (I17874 | |
| Coverslips 50 mm x 24 mm | Mattek | PCS-1.5-5024 | |
| CVD graphene | Graphene Supermarket | CVD-Cu-2x2 | |
| easiGlow discharger | Ted-Pella | 91000S | |
| Ethanol | Millipore-Sigma | 1.11727 | |
| Flat-tip tweezers | Fisher | 50-239-60 | |
| Glass cutter | Grainger | 21UE26 | |
| Glass petri plate and cover | VWR | 75845-544 | |
| Glass serological pipette | Fisher | 13-676-34D | |
| Grid Storage Case | EMS | 71146-02 | |
| Hot plate | Fisher | 07-770-108 | |
| Isopropanol | Sigma | W292907 | |
| Kimwipe | Fisher | 06-666 | |
| Lab scissors | Fisher | 13-806-2 | |
| Methyl-Methacrylate EL-6 | Kayaku | MMA M310006 0500L1GL | |
| Molecular grade water | Corning | 46-000-CM | |
| Negative action tweezers (2x) | Fisher | 50-242-78 | |
| P20 pipette | Rainin | 17014392 | |
| P200 pipette | Rainin | 17008652 | |
| Parafilm | Fisher | 13-374-12 | |
| Pipette tips | Rainin | 30389291 | |
| Quantifoil grids with holey carbon | EMS | Q2100CR1 | |
| Spin coater | SetCas | KW-4A | with chuck SCA-19-23 |
| Straightedge | ULINE | H-6560 | |
| Thermometer | Grainger | 3LRD1 | |
| UV/Ozone cleaner | BioForce | SKU: PC440 | |
| Vacuum desiccator | Thomas Scientific | 1159X11 | |
| Whatman paper | VWR | 28297-216 |
Ссылки
- Chua, E. Y. D., et al. cheaper: Recent advances in cryo-electron microscopy. Annu Rev Biochem. 91, 1-32 (2022).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. Elife. 2, 00461 (2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nat Methods. 10 (6), 584-590 (2013).
- Campbell, M. G., et al. Movies of ice-embedded particles enhance resolution in electron cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Cheng, A., et al. Leginon: New features and applications. Protein Sci. 30 (1), 136-150 (2021).
- Scheres, S. H. RELION: implementation of a Bayesian approach to cryo-EM structure determination. J Struct Biol. 180 (3), 519-530 (2012).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nat Methods. 14 (3), 290-296 (2017).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nat Methods. 16 (11), 1146-1152 (2019).
- Grant, T., Rohou, A., Grigorieff, N. cisTEM, user-friendly software for single-particle image processing. Elife. 7, 35383 (2018).
- Bell, J. M., Chen, M., Baldwin, P. R., Ludtke, S. J. High resolution single particle refinement in EMAN2.1. Methods. 100, 25-34 (2016).
- Cheng, Y. Single-particle cryo-EM-How did it get here and where will it go. Science. 361 (6405), 876-880 (2018).
- Kinman, L. F., Powell, B., Zhong, E., Berger, B., Davis, J. H. Uncovering structural ensembles from single particle cryo-EM data using cryoDRGN. Nat Protoc. 18 (2), 319-339 (2022).
- Zhong, E. D., Bepler, T., Berger, B., Davis, J. H. CryoDRGN: reconstruction of heterogeneous cryo-EM structures using neural networks. Nat Methods. 18 (2), 176-185 (2021).
- Chen, M., Ludtke, S. J. Deep learning-based mixed-dimensional Gaussian mixture model for characterizing variability in cryo-EM. Nat Methods. 18 (8), 930-936 (2021).
- Punjani, A., Fleet, D. J. 3D variability analysis: Resolving continuous flexibility and discrete heterogeneity from single particle cryo-EM. J Struct Biol. 213 (2), 107702 (2021).
- Dashti, A., et al. Retrieving functional pathways of biomolecules from single-particle snapshots. Nat Commun. 11 (1), 4734 (2020).
- Sun, J., Kinman, L. F., Jahagirdar, D., Ortega, J., Davis, J. H. KsgA facilitates ribosomal small subunit maturation by proofreading a key structural lesion. Nat Struct Mol Biol. , (2023).
- Dubochet, J., Chang, J. J., Freeman, R., Lepault, J., McDowall, A. W. Frozen aqueous suspensions. Ultramicroscopy. 10 (1-2), 55-61 (1982).
- Dubochet, J. Cryo-EM--the first thirty years. J Microsc. 245 (3), 221-224 (2012).
- Glaeser, R. M., et al. Factors that influence the formation and stability of thin, cryo-EM specimens. Biophys J. 110 (4), 749-755 (2016).
- Glaeser, R. M. Proteins, interfaces, and cryo-Em grids. Curr Opin Colloid Interface Sci. 34, 1-8 (2018).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Tan, Y. Z., et al. Addressing preferred specimen orientation in single-particle cryo-EM through tilting. Nat Methods. 14 (8), 793-796 (2017).
- Chen, J., Noble, A. J., Kang, J. Y., Darst, S. A. Eliminating effects of particle adsorption to the air/water interface in single-particle cryo-electron microscopy: Bacterial RNA polymerase and CHAPSO. J Struct Biol X. 1, 100005 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nat Methods. 15 (10), 793-795 (2018).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallogr D Struct Biol. 74, 560-571 (2018).
- Neselu, K., et al. Measuring the effects of ice thickness on resolution in single particle cryo-EM. J Struct Biol X. 7, 100085 (2023).
- Pantelic, R. S., et al. Graphene: Substrate preparation and introduction. J Struct Biol. 174 (1), 234-238 (2011).
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nat Mater. 6 (3), 183-191 (2007).
- Han, Y., et al. High-yield monolayer graphene grids for near-atomic resolution cryoelectron microscopy. Proc Natl Acad Sci U S A. 117 (2), 1009-1014 (2020).
- Fujita, J., et al. Epoxidized graphene grid for highly efficient high-resolution cryoEM structural analysis. Sci Rep. 13 (1), 2279 (2023).
- Lu, Y., et al. Functionalized graphene grids with various charges for single-particle cryo-EM. Nat Commun. 13 (1), 6718 (2022).
- Naydenova, K., Peet, M. J., Russo, C. J. Multifunctional graphene supports for electron cryomicroscopy. Proc Natl Acad Sci U S A. 116 (24), 11718-11724 (2019).
- Liu, N., et al. Bioactive functionalized monolayer graphene for high-resolution cryo-electron microscopy. J Am Chem Soc. 141 (9), 4016-4025 (2019).
- Benjamin, C. J., et al. Selective capture of histidine-tagged proteins from cell lysates using TEM grids modified with NTA-graphene oxide. Sci Rep. 6, 32500 (2016).
- Wang, F., et al. General and robust covalently linked graphene oxide affinity grids for high-resolution cryo-EM. Proc Natl Acad Sci U S A. 117 (39), 24269-24273 (2020).
- Koh, A., et al. Routine Collection of High-Resolution cryo-EM Datasets Using 200 KV Transmission Electron Microscope. J Vis Exp. (181), (2022).
- Schweizer, P., et al. Mechanical cleaning of graphene using in situ electron microscopy. Nat Commun. 11 (1), 1743 (2020).
- Li, Z., et al. Effect of airborne contaminants on the wettability of supported graphene and graphite. Nat Mater. 12 (10), 925-931 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Zhu, X., et al. Cryo-EM structures reveal coordinated domain motions that govern DNA cleavage by Cas9. Nat Struct Mol Biol. 26 (8), 679-685 (2019).
- Croll, T. I. ISOLDE: a physically realistic environment for model building into low-resolution electron-density maps. Acta Crystallogr D Struct Biol. 74, 519-530 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Prydatko, A. V., Belyaeva, L. A., Jiang, L., Lima, L. M. C., Schneider, G. F. Contact angle measurement of free-standing square-millimeter single-layer graphene. Nat Commun. 9 (1), 4185 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены