A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الطيفية Karyotyping إلى دراسة حالة شذوذ الكروموسومات في البشر والفئران مع مرض الكلى المتعدد الكيسات
In This Article
Summary
Karyotyping الطيفية (السماء) هو تقنية علم الوراثة الخلوية المتقدمة لتحديد الانحرافات الجينية والكروموسومات. هذه التقنية يستفيد من تحقيقات اللوحة كروموسوم، والتي تسمح بتصنيف جميع الكروموسومات. ويمكن أيضا تحديد الانحرافات SKY كروموسوم معقدة وعيوب فصل في الفئران والبشر يعانون من أمراض مختلفة، بما في ذلك مرض الكلى المتعدد الكيسات.
Abstract
الطريقة التقليدية لتحديد وتصنيف الكروموسومات الفردية يعتمد على نمط فريد من ربط كل كروموسوم في فصيلة محددة يجري تحليلها 1 و 2. هذا الأسلوب الكلاسيكي النطاقات، ولكن، لا يمكن الاعتماد عليها في تحديد التشوهات الكروموسومية معقدة مثل تلك التي ترتبط مع مرض السرطان. للتغلب على القيود المفروضة على تقنية النطاقات، هو عرض Karyotyping الطيفي (السماء) لتوفير معلومات موثوق بها كثيرا عن شذوذ صبغي.
SKY هو مضان متعدد الألوان في الموقع التهجين (FISH) تقنية للكشف عن الصبغيات (الكروموسومات) الطورية مع مجهر طيفي 3 و 4. وقد ثبت السماء ليكون أداة قيمة لتحليل خلوي من مجموعة واسعة من الشذوذ الصبغي المرتبط مع عدد كبير من الأمراض الوراثية والأورام الخبيثة 5 و 6. SKY ينطوي على استخدام مجسات DNA fluorescently متعدد الألوان ذات العلامات أعد من oligonucle المنحطةotide الاشعال بواسطة PCR. وبالتالي، كل كروموسوم لها لون فريد من نوعه بعد الطيفية في الموقع التهجين مع تحقيقات، التي وصفت بشكل مختلف مع خليط من الأصباغ الفلورية (رودامين، تكساس الأحمر، Cy5، FITC وCy5.5). تحقيقات المستخدمة في السماء تتكون من ما يصل الى 55 كروموسوم تحقيقات محددة 7-10.
إجراءات SKY ينطوي على عدة خطوات (الشكل 1). SKY يتطلب توافر الخلايا مع ارتفاع مؤشر الإنقسامية من الأنسجة الطبيعية أو مريضة أو الدم. وتنتشر في الصبغيات (الكروموسومات) من خلية واحدة من الخلايا الأولية إما طازجة أو عزل خط الخلية على شريحة زجاجية. يسمى هذا انتشار كروموسوم مع مجموعة مختلفة من الأصباغ الفلورية معينة لكل كروموسوم. الكشف عن التحقيق والحصول على الصور، ونظام التصوير الطيفي يتكون من تداخل سانياك وكاميرا CCD. وهذا يسمح قياس طيف الضوء المرئي المنبعث من العينة والحصول على صورة طيفية جيئة وذهاباالكروموسومات متر فردي. HiSKY، والبرمجيات المستخدمة لتحليل نتائج الصور التي تم التقاطها، ويوفر سهولة تحديد الشذوذ الصبغي. والنتيجة النهائية هي الطورية وصورة تصنيف النمط النووي، والذي كل زوج من الصبغيات (الكروموسومات) لها لون مميز (الشكل 2). وهذا يسمح سهولة تحديد هويات كروموسوم وtranslocations. لمزيد من المعلومات، يرجى زيارة موقع التصوير الطيفي التطبيقية ( http://www.spectral-imaging.com/ ).
وقد استخدم مؤخرا SKY لتحديد العيوب والتشوهات فصل كروموسوم كروموسوم في البشر والفئران مع مرض وراثي جسمي الكلى المتعدد الكيسات (ADPKD)، وهو مرض وراثي يتميز اختلال وظيفي في أهداب الأولية 11-13. باستخدام هذه التقنية، أثبتنا وجود فصل كروموسوم غير طبيعي وتشوهات صبغية في المرضى الذين يعانون ADPKD ونماذج الماوس 14. المزيد من التحليلات باستخدام SKY ليس فقط سمح لنا لتحديد عدد الكروموسومات والهوية، ولكن أيضا للكشف عن التشوهات الكروموسومية بدقة شديدة التعقيد مثل الحذف كروموسوم وtranslocations (الشكل 2).
Protocol
1. خلية المعالجة وإعداد الطورية
- وتزرع هذه الخلايا في تعديل Dulbecco للمتوسط النسر (DMEM) التي تحتوي على 10-15٪ الجنين مصل بقري (FBS) و 1٪ البنسلين / الستربتومايسين على 37 درجة مئوية مع 5٪ CO 2 الحاضنة، حتى تصل إلى 70-80٪ confluency.
- علاج الخلايا مع حل colcemid على 0.05 ميكروغرام / مل لمدة 30-60 دقيقة.
- جمع المتوسطة التي تحتوي على أي خلايا العائمة في 50 مل من أنابيب معقمة للطرد المركزي من طراز فالكون. شطف الخلايا على لوحة مع sterile1X-PBS. بعد تفرخ مع التربسين معقم لمدة 1-2 دقيقة، والحصاد وجمع الخلايا المتبقية في الأنبوب نفسه.
- تدور الأنابيب في 1000 دورة في الدقيقة لمدة 5 دقائق، نضح طاف مغادرة 0.5 مل وتخفيف بيليه بواسطة عبها مع الإصبع فقط.
- اعتمادا على حجم بيليه، إضافة مل 5-10 من حل ناقص التوتر من بوكل 0.56٪ في DH 2 O، واحتضان للتعليق على 37 درجة مئوية عن 30-45 دقيقة.
- إضافة قطرة واحدة من مادة الميثانول / حامض الخليك(3:1 المجلد / المجلد) لكل مل من تعليق خلية ناقص التوتر وعكس الأنبوب برفق لخلط.
- الطرد المركزي في 1200 دورة في الدقيقة لمدة 5 دقائق، وجمع بيليه كخطوة 1.4، ثم يضاف 5 مل من الميثانول الطازجة / حامض الخليك (3:1 المجلد / المجلد) مثبت نقطه نقطه في حين حل لعبها بيليه باستمرار. هذا الإجراء ضروري حتى لا ينتشر الطورية أن المحاصرين في كتل من الخلايا التي من شأنها أن تعرض للخطر التجربة.
- منبذة مرة أخرى في 1200 دورة في الدقيقة لمدة 5 دقائق ويضاف 5-10 مل من الجليد الباردة الميثانول / حامض الخليك مثبت على طول الجدار من الأنبوب. في هذه المرحلة، إذا لزم الأمر، يمكن تخزين هذه الخلايا في حل مثبت في أنبوب شددت ومختومة عند درجة حرارة -20 درجة مئوية لمدة قصيرة أو -80 درجة مئوية لمدة طويلة (سنوات) لاستخدامها في المستقبل.
- الشرائح نظيفة في الايثانول المطلقة، ثم تراجع الشريحة في DH 2 O للapproximately10X من أجل تشكيل غمد من المياه على سطح الشريحة. وضع شريحة على طبق من الزجاج وانخفاض 15-20μl من تعليق خلية (من الخطوة 1.8) في الفترة من 10 "فوق الشرائح. ضع الشريحة في حمام مائي وضعت في 65-70 درجة مئوية لمدة 1-2 دقيقة والسماح ليجف.
- تحقق من الانزلاق تحت المجهر ضوء الأهداف باستخدام جاف 10X 40X والتأكد من عدم ومتباعدة بالتساوي الكروموسومات الطورية وينتشر. التحقق من وجود السيتوبلازم المحيطة الكروموسومات. إذا تم المضي قدما الحالي السيتوبلازم مع المعالجة الشريحة (الببسين الهضم)، إذا لم يكن هناك وجود السيتوبلازم والكروموسومات يكون التشكل جيد، ثم ليست هناك حاجة لمعالجة مسبقة الشريحة.
2. المعالجة الشريحة (البيبسين العلاج)
- تطبيق 120 ميكرولتر من حل ريبونوكلياز 1:200 (20 ملغ / مل) الذائب في 2X-SSC الصعود إلى 24 ملم × 60 ملم ساترة المجهر وعكس الوجه الشريحة الطورية أسفل على ساترة بلطف ثم عكس الوجه الشريحة الطورية صعودا واحتضان في 37 درجة مئوية لمدة 45 دقيقة.
- إزالة بعناية ساترة دون خدش الشريحة، وأغسلها في 2X-SSC العازلة في جرة coplin كل 5 دقائق لمدة 15 دقيقةمع اهتزاز.
- إضافة 5-15 ميكرولتر من محلول المخزون البيبسين (100 ملغ / مل في DH 2 O) في كوب نظيف ثم قم بإضافة 100 مل من prewarmed (37 درجة مئوية) 0.01M حمض الهيدروكلوريك. ومن المهم أن يتم إضافة إلى البيبسين نظيفة الكأس الأولى، وليس مباشرة في محلول HCl، وإلا فإنه لن تذوب في المحلول. احتضان الشريحة في جرة coplin التي تحتوي على محلول HCl / البيبسين على 37 درجة مئوية لمدة 3-5 دقيقة. هذه الخطوة الهامة جدا وهضم الكثير سيؤدي إلى overdigested الصبغيات (الكروموسومات)، وأيضا الهضم قليل سيغادر السيتوبلازم عسر الهضم التي قد تؤدي إلى عدم محددة وملزمة من لجنة التحقيق، وتتداخل مع إشارة التهجين.
- غسل الشريحة في وعاء يحتوي على 100 مل coplin 1X-برنامج تلفزيوني لمدة 5 دقائق مرتين في درجة حرارة الغرفة.
- غسل الشريحة في وعاء يحتوي على 100 مل coplin 1X-PBS/MgCl 2 لمدة 5 دقائق في درجة حرارة الغرفة (50 مل من MgCl 1M 2 في 950 مل من 1X-PBS).
- ضع الشريحة في containin جرة coplinز الفورمالديهايد 100 مل 1٪ لمدة 10 دقيقة في درجة حرارة الغرفة (1.7 مل من الفورمالدهيد 37٪ في 100 مل من 1X-PBS/MgCl 2).
- غسل الشريحة في وعاء يحتوي على 100 مل coplin 1X-برنامج تلفزيوني لمدة 5 دقائق.
- مراقبة الشريحة تحت المجهر ضوء باستخدام عدسة جاف 40X لضمان أن يتم هضمها الشرائح بشكل صحيح وعدم وجود السيتوبلازم، ويتم الحفاظ على التشكل كروموسوم. تحديد منطقة للتهجين باستخدام قلم الماس.
3. كروموسوم وتحقيق تمسخ وتهجين
- إعداد الطازجة حل تبديل طبيعة (70٪ formamide/2X محكمة أمن الدولة، ودرجة الحموضة 7.0) وprewarm إلى 70-80 درجة مئوية في جرة coplin وضعت في مكان ماء حمام الشريحة في جرة coplin التي تحتوي على حل تبديل طبيعة في حمام مائي على 70 درجة مئوية لمدة الكروموسومات الماوس و 80 درجة مئوية لمدة الكروموسومات البشرية ل30S-1.5 دقيقة.
- تضع فورا الشريحة في الجليد الباردة الايثانول 70٪ لمدة 3 دقائق ثم بنسبة 80٪ و 100٪ من الإيثانول لمدة 3 دقائق لكل والهواء الجاف. فحص الشريحةلمورفولوجيا كروموسوم. راشي جيد مورفولوجيا كروموسوم بواسطة الكروموسومات الظلام وليس "مرحلة الضوء" أو هالة الكروموسومات.
- الحارة التحقيق SkyPaint (SKY عدة الطلاء؛ قارورة رقم 1) في 37 درجة مئوية مع الهز لمدة 20 دوامة، دقيقة، وأجهزة الطرد المركزي لفترة وجيزة في 1000 دورة في الدقيقة لبضع ثوان.
- تفسد لجنة التحقيق في thermocycler المبرمجة لدورة على مرحلتين في 85 درجة مئوية للدورة 5 دقائق تليها 37 درجة مئوية لمدة 60 دقيقة للسماح المسمى مسبار الحمض النووي لpreannealing.
- تطبق 10μl من التحقيق التشويه والتحريف على مجال تهجين والغطاء مع 22 ملم X 40 ملم ساترة التأكد من عدم اعتراض فقاعات الهواء. ختم حواف ساترة مع الاسمنت والمطاط واحتضانها في غرفة مرطب على 37 درجة مئوية ل48-72 ساعة.
4. فلوري كشف التحقيق
- إزالة ساترة بعناية ووضع الشرائح في وعاء يحتوي على coplin prewarmed (45 درجة مئوية) غسل الحل الأول (الطازجة formamide 50٪ في محكمة أمن الدولة 2X). يغسل لمدة 5 دقائقثلاث مرات في 45 درجة مئوية في حمام ماء اهتزاز في 45 دورة في الدقيقة
- غسل الشريحة في غسل حل ثانيا (1X SSC) على 45 درجة مئوية لمدة 5 دقائق مرتين مع اهتزاز.
- غسل الشريحة في غسل حل ثالثا (4X SSC/0.1٪ توين 20) لمدة 5 دقائق عند 45 درجة مئوية مع الهز.
- تطبيق 80 ميكرولتر من كاشف حظر (SKY عدة الطلاء؛ قارورة رقم 2)، وضع ساترة واحتضانها في 37 درجة مئوية لمدة 30 دقيقة.
- إزالة الشريحة والسماح لاستنزاف السائل. تطبيق 80 ميكرولتر من كاشف تلطيخ Cy5 (المركزة جسم الكشف CAD عدة؛ قارورة # 3)، وتطبيق ساترة واحتضانها في 37 درجة مئوية لمدة 40 دقيقة.
- غسل الشريحة مع غسل حل ثالثا في 45 درجة مئوية لمدة 5 دقائق ثلاث مرات مع اهتزاز.
- تطبيق 80 ميكرولتر من كاشف تلطيخ Cy5.5 (المركزة جسم الكشف CAD عدة؛ قارورة رقم 4)، وضع ساترة واحتضانها في 37 درجة مئوية لمدة 40 دقيقة.
- غسل الشريحة مع غسل حل ثالثا في 45 درجة مئوية لمدة 5 دقائق ثلاث مرات مع اهتزاز.
- إمالة الشريحة، والسماح للالسائل إلى استنزاف. تطبيق 20 ميكرولتر من كاشف دابي مكافحة تتلاشى (SKY عدة الطلاء؛ قارورة # 5) ووضع 24 ملم × 60 ملم ساترة المجهر. إزالة بعناية فقاعات الهواء التي يمكن أن تشكل. ولا يمكن تصوير الشرائح مباشرة أو تخزينها في 4 درجات مئوية في الظلام لمدة لا تزيد عن 1 في الاسبوع.
5. الحصول على الصور والتحليل
- ويتم إنجاز الحصول على الصور من خلال عرض الشرائح الطورية باستخدام مجهر أوليمبوس مجهزة عدسة النفط غمر 60X، مكعب الطيفي (مصممة خصيصا تمريرة فرقة ثلاثي فلتر)، وهو مرشح دابي ووحدة تداخل سانياك مع كاميرا CCD.
- ونفذت الأطياف بعضها، خارج باستخدام SKY مشاهدة البرامج التطبيقية (النسخة التصوير الطيفي 1.62) بعد دليل المستخدم.
- بعد تحليل الصور، ويمكن أن ينظر إلى الكروموسومات مثل الصور الملونة (مع الألوان الفلورية محددة)، الصور الملونة الزائفة (مع الألوان للتصنيف)، والمقلوب الصور دابي (نمط معين النطاقات).
إجراء SKY كاملة تستغرق عادة حوالي مرة واحدة في الأسبوع (الشكل 1). وهذا يشمل الحصول على الصور والتحليل شريطة أن الخلايا الطورية في إمدادات كافية. تحليل Karyotyping يكشف النمط النووي العادي الماوس (40، XY) من الخلايا من نوع الفئران البرية (الشكل 2A). في المقابل، الخلايا من Pkd1 - / - الماوس (PKD نموذج الفأر) يظهر زيادة كبيرة في عدد الصبغيات والتشوهات الهيكلية، مثل الحذف الصبغي (الكروموزوم رقم 8) وtranslocations (الكروموسومات رقم 11 و 19) (الشكل 2B). نحن أيضا تحليل الأنسجة الوعائية من المرضى ADPKD. وأشارت دراسة بسيطة عن طريق عد الأرقام أن الكروموسومات غير ADPKD وبعض العينات ADPKD الأوعية الدموية وكانت أعداد الكروموسومات عادي من 23 زوجا (الشكل 2C). بشكل عام، ومع ذلك، لاحظنا عدم فصل الكروموسومات، مما أدى في 46 زوجا من الكروموسومات في ADPKD عينات بدلا من 23 زوجا (الشكل 2D).
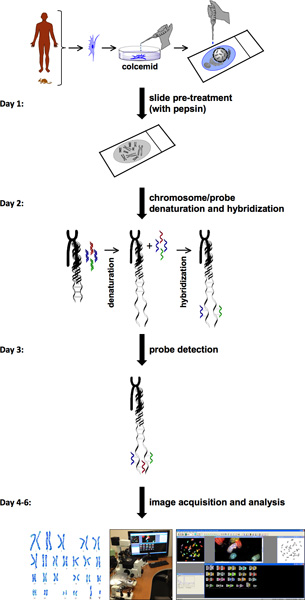
الشكل 1. SKY انسيابي بروتوكول. الرسم البياني للبروتوكول SKY يوضح الخطوات لإكمال تجربة بدءا من خلية المعالجة والتحضير الطورية إلى الحصول على الصور وتحليلها. ويرد تقريبي لمدة أسبوع جدول زمني على اليسار مع خطوة بخطوة إجراءات كل يوم.

الشكل 2. karyotyping الطيفية في خلد خطوط الخلايا الماوس وعزل الخلايا الأولية طازجة الإنسان تظهر. اللون والصور دابي المقلوب من الكروموسومات فردي قبل الفرز الكروموسومات. بعد الفرز، وتعرض الصبغيات (الكروموسومات) في الجدول "تصنيف". صورة السماء) من انتشار الطورية من الماوس النوع البري يحتوي على النمط النووي العادي (40، XY). ب) من انتشار الطورية من Pkd1 - / -. ماوس يظهر الشاذ عدد الكروموزوم (68 بدلا من 40) وشذوذ الكروموسومات مثل الحذف الصبغي (الكروموزوم رقم 8) وtranslocations الصبغي (الكروموسومات رقم 11 و 19) ج) SKY صورة من انتشار الطورية من الأنسجة الوعائية للمريض غير عادي ADPKD لديه النمط النووي (46، XX). د) صورة السماء انتشار الطورية من الأنسجة الوعائية من مريض ADPKD يحتوي على النمط النووي غير طبيعي (92، XXXX). وقد أجزاء من بيانات أبلغ عنها سابقا وإعادة استخدامها بإذن 14.
Discussion
Karyotyping الطيفية (السماء) هو تقنية علم الوراثة الخلوية المستخدمة في دراسة التراكيب الجينية والكروموسومات. هذه التقنية يستفيد من تحقيقات اللوحة كروموسوم، ويتم الحصول على الكشف عن هذه التحقيقات من خلال تداخل سانياك. عملية SKY كاملة تستغرق عادة حوالي أسبوع واحد، وأنها تنط...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
والكتاب أود أن أشكر برايان Muntean، لو شاو، تاكاهاشي ماكي ويمزج بلير للحصول على المساعدة التقنية. وأيد هذا العمل من قبل جوائز من المعاهد الوطنية للصحة (DK080640) وجامعة توليدو بالحركة وProMedica بحوث جائزة تحفيز للدكتور SURYA Nauli.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| DMEM | Cellgro Mediatech المؤتمر الوطني العراقي. | 10-013-CV | |
| الجنين مصل بقري (FBS) | Hyclone | SH30088-03 | |
| Penecillin / الستربتوميسين | الحرارية العلمية | SV30010 | |
| Colcemid | روش تشخيص | 10 295 892 001 | 10 ميكروغرام / مل |
| حمض الهيدروكلوريك | فيشر العلمية | A144-500 | |
| بوكل | فيشر العلمية | S77375-1 | |
| الفوسفات مخزنة المالحة | الحرارية العلمية | SH30256-01 | |
| SKY الطلاء تحقيق مجموعة (الإنسان) | التصوير الطيفي التطبيقية | SKY000028 | |
| SKY الطلاء تحقيق عدة (الماوس) | التصوير الطيفي التطبيقية | SKY000030 | |
| تتركز عدة الضد كشف | التصوير الطيفي التطبيقية | SKY000033 | |
| التربسين | الحرارية العلمية | SH30236.01 | |
| الميثانول | فيشر العلمية | A433P-4 | |
| حمض الخليك | فيشر العلمية | A38-212 | |
| ريبونوكلياز A | روش تشخيص | 10 109 169 001 | |
| البيبسين | سيغما الدريخ | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ML | |
| 37٪ فورمالديهايد | مالينكرودت بيكر | 2106-02 | |
| 20X SSC | Promega | V4261 | |
| Formamide | Fluka | 47671 | إعداد قبل استخدامها |
| توين-20 | فيشر العلمية | BP337-500 | |
| شرائح ميكروسكوب | فيشر العلمية | 12-549 | |
| مجهر الغطاء الزجاجي 24x60mm | VWR فيستا الرؤية | 16004-312 | |
| المطاط الاسمنت | إلمر في (متجر بيع بالتجزئة المحلية) | ||
| تهجين / humidifiedchamber / صينية | Simport | M920-2 | وضع المناشف الورقية الرطبة في الجزء السفلي |
| الحراريةcycler | إيبندورف | Epgradient S | |
| تهتز منصة / المداري شاكر | Bellco التكنولوجيا الحيوية | ||
| يهز حمام / المياه | الدقة العلمية | ||
| دابي مرشح مكعب | صفاء التكنولوجيا | ||
| SKY مرشح مكعب | صفاء التكنولوجيا | ||
| SpectraCube | التصوير الطيفي التطبيقية | ||
| مجهر مقلوب خلية ثقافة | نيكون | نيكون الكسوف TS100 | |
| مضان المجهر | أوليمبوس | IX70 | 60X النفط |
References
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved