Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Spektrale Karyotypisierung zu Chromosomenanomalien in Menschen und Mäusen mit Kidney Disease Study
In diesem Artikel
Zusammenfassung
Spektrale Karyotypisierung (SKY) ist eine fortgeschrittene Technik, um Zytogenetik genomischen und chromosomalen Aberrationen zu identifizieren. Diese Technik nutzt die Vorteile von Chromosom Malerei Sonden, die es erlauben die Einstufung aller Chromosomen. SKY kann auch identifiziert werden komplexe Chromosomenaberrationen und Segregation Defekte in Mäusen und Menschen mit verschiedenen Krankheiten, einschließlich Zystennieren.
Zusammenfassung
Konventionelle Methode zum Identifizieren und Klassifizieren einzelnen Chromosomen hängt von der einzigartigen Bandenmuster jedes Chromosoms einer bestimmten Tierart zu analysierenden 1, 2. Diese klassische Banding-Technik, ist aber nicht bei der Identifizierung von komplexen chromosomalen Aberrationen, wie sie im Zusammenhang mit Krebs zuverlässig. Um die Einschränkungen des Banding-Technik zu überwinden, wird Spektrale Karyotypisierung (SKY) eingeführt, um viel zuverlässige Informationen über Chromosomenanomalien bieten.
SKY ist eine multicolor Fluoreszenz-in-situ Hybridisierung (FISH) Technik, um Metaphasen-Chromosomen mit spektralen Mikroskop 3, 4 zu erfassen. SKY ist nachgewiesen worden, ein wertvolles Werkzeug für die zytogenetische Analyse eines breiten Spektrums von Chromosomenanomalien mit einer großen Anzahl von genetischen Erkrankungen und Malignome 5, 6 verbunden sein. SKY umfasst die Verwendung von Multicolor-fluoreszierend markierten DNA-Sonden aus dem entarteten Oligonucleotid hergestelltotide Primern durch PCR. Somit hat jeder Chromosom einen einzigartigen spektralen Farbe nach in-situ-Hybridisierung mit Sonden, die differentiell mit einem Gemisch von Fluoreszenzfarbstoffen (Rhodamin, Texas Red, Cy5, FITC und Cy5.5) so gekennzeichnet sind. Die Sonden für SKY verwendet werden, bestehen aus bis zu 55 Chromosomen-spezifischen Sonden 10.07.
Das Verfahren für SKY umfasst mehrere Schritte (Abbildung 1). SKY erfordert die Verfügbarkeit von Zellen mit hoher Mitoseindex von normalen oder erkrankten Gewebe oder Blut. Die Chromosomen einer einzelnen Zelle entweder von einem frisch isolierten-Primär-Zelle oder einer Zellinie werden auf einem Glas-Objektträger ausgestrichen. Dieses Chromosom Ausbreitung wird mit einer unterschiedlichen Kombination von Fluoreszenzfarbstoffen spezifisch für jedes Chromosom markiert. Für Sonde Detektion und Bildaufnahme, besteht die Spectral Imaging System der Sagnac-Interferometer und einer CCD-Kamera. Diese erlaubt die Messung der sichtbaren Lichtspektrums von der Probe emittiert und einen spektralen Bild her zu erwerbenm einzelnen Chromosomen. HiSKY, bietet die Software verwendet, um die Ergebnisse der erfassten Bilder zu analysieren, eine leichte Identifizierung von Chromosomenanomalien. Das Endergebnis ist eine Metaphase und ein Karyotyp Klassifizierung Bildes, bei dem jedes Paar von Chromosomen hat eine bestimmte Farbe (Abbildung 2). Dies ermöglicht eine einfache Identifizierung des Chromosoms Identitäten und Translokationen. Für weitere Informationen, besuchen Sie bitte Applied Spectral Imaging Website ( http://www.spectral-imaging.com/ ).
SKY wurde vor kurzem für eine Identifizierung von Chromosomensegregation Mängel und Chromosomenanomalien bei Menschen und Mäusen mit autosomal dominante polyzystische Nierenerkrankung (ADPKD), eine genetische Erkrankung, die durch Funktionsstörungen bei primären Zilien 11-13 gekennzeichnet werden. Mit dieser Technik konnten wir zeigen, das Vorhandensein von abnormen Chromosom Segregation und Chromosomenstörungen in ADPKD Patienten und Mausmodellen 14. Weitere Analysen unter Verwendung SKY nicht nur erlaubt uns, chromosomalen Teilnummer und identifizieren zu identifizieren, sondern auch genau zu erfassen, sehr komplex chromosomalen Abweichungen wie Chromosom Deletionen und Translokationen (Abbildung 2).
Protokoll
1. Zell-Vorbehandlung und Metaphase Vorbereitung
- Die Zellen werden in Dulbeccos Modifizierung von Eagle-Medium (DMEM), das 10-15% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin bei 37 ° C mit 5% CO 2-Inkubator gewachsen, bis sie 70-80% Konfluenz erreichen.
- Behandeln Sie die Zellen mit Colcemid Lösung bei 0,05 pg / ml für 30-60 min.
- Sammeln Sie das Medium, das keine schwimmenden Zellen in 50-ml sterile Falcon Zentrifugenröhrchen. Spülen Sie die Zellen auf der Platte mit sterile1X-PBS. Nach Inkubation mit sterilem Trypsin für 1-2 min, Ernte und sammeln die restlichen Zellen in das gleiche Rohr.
- Drehen Sie die Rohre bei 1000 rpm für 5 min, den Überstand aspirieren Verlassen 0,5 ml und lockern Pellet durch schnippte mit dem Finger nur.
- Abhängig von der Pellet-Größe, fügen 5-10 ml hypotonische Lösung von 0,56% KCl in dH 2 O und inkubieren Sie die Suspension bei 37 ° C für 30-45 min.
- Einen Tropfen Methanol / Essigsäure(3:1 vol / vol) pro ml hypotonische Zellsuspension und das Röhrchen vorsichtig zum Mischen.
- Zentrifugieren bei 1200 rpm für 5 min und sammeln Pellet als Schritt 1,4, dann mit 5 ml frischem Methanol / Essigsäure (3:1 vol / vol) Fixierlösung tropfenweise während flicking des Pellets kontinuierlich. Dieses Verfahren ist kritisch, so dass die Metaphasen Spreads nicht wird auch in den Zellen 'Klumpen, die das Experiment gefährden würde abgefangen werden.
- Zentrifugieren wieder bei 1200 UpM für 5 min an und füge 5-10 ml eiskaltem Methanol / Essigsäure Fixiermittelzusammensetzung entlang der Wand des Rohres. In diesem Stadium, falls erforderlich, können die Zellen in Fixierungsmittel Lösung in einem fest angezogen und dicht Rohr bei -20 ° C für kurze Zeiten oder -80 ° C gelagert werden für lange Laufzeit (Jahre) für die zukünftige Verwendung.
- Sauberkeit Folien in absolutem Ethanol, tauchen Sie dann die Folie in dH 2 O für approximately10X, um eine Hülle aus Wasser auf der Oberfläche des Schiebers zu bilden. Legen Sie den Objektträger auf einer Glasplatte und Tropfen 15-20 &mgr; l der Zellsuspension (aus Schritt 1,8) Von 10 "über der Folie. Legen Sie den Objektträger in einem Wasserbad bei 65-70 ° C eingestellt und für 1-2 Minuten trocknen lassen.
- Überprüfen Sie die Folie unter einem Lichtmikroskop mit 10x und 40x trocken Ziele machen Sie sicher, dass Metaphasechromosomen und die Spreads gleichmäßig verteilt sind. Prüfen Sie, ob Zytoplasma Präsenz rund um die Chromosomen. Wenn Zytoplasma vorhanden ist, mit Rutsche Vorbehandlung (Pepsinverdauung) vorgehen, wenn kein Zytoplasma vorhanden ist und die Chromosomen haben gute Morphologie, dann gibt es keine Notwendigkeit für Dia-Vorbehandlung.
2. Slide Vorbehandlung (Pepsin-Behandlung)
- Tragen Sie 120 ul 1:200 RNase-Lösung (20 mg / ml) in 2X SSC-auf eine 24 mm x 60 mm Deckglas Mikroskop aufgelöst und invertieren die Metaphase Rutsche nach unten auf das Deckglas dann vorsichtig umdrehen der Metaphase Gleitfläche auf und inkubieren Sie bei 37 ° C für 45 min.
- Entfernen Sie vorsichtig das Deckglas ohne zu kratzen und waschen Sie die Folie in 2X SSC-Puffer in einem entsprechenden Gefäß alle 5 min, 15 minunter Schütteln.
- In 5-15 ul von Pepsin-Stammlösung (100 mg / ml in dH 2 O) in ein sauberes Becherglas und fügen Sie dann 100 ml vorgewärmtem (37 ° C) 0,01 M HCl. Es ist wichtig, dass das Pepsin in ein sauberes hinzugefügt wird Becher erste und nicht direkt in die HCl-Lösung, sonst wäre es nicht in Lösung zu lösen. Inkubieren Sie die Folie in einer Glasküvette mit dem HCl / Pepsin-Lösung bei 37 ° C für 3-5 min. Dieser Schritt ist sehr kritisch, da zu viel Verdauung wird bewirken, dass die Chromosomen an overdigested werden und zu wenig Verdauung verlassen das Zytoplasma unverdauten, welche könnte um nicht-spezifische Bindung der Sonde führen und interferieren mit dem Hybridisierungssignal.
- Waschen Sie die Folie in einer Glasküvette mit 100 ml 1X-PBS für 5 min zweimal bei Raumtemperatur.
- Waschen Sie die Folie in einer Glasküvette mit 100 ml 1X-PBS/MgCl 2 für 5 min bei Raumtemperatur (50 ml 1 M MgCl 2 in 950 ml 1X-PBS).
- Legen Sie die Folie in einer Coplin containing 100 ml 1% Formaldehyd für 10 min bei Raumtemperatur (1,7 ml 37% Formaldehyd in 100 ml 1X-PBS/MgCl 2).
- Waschen Sie die Folie in einer Glasküvette mit 100 ml 1X-PBS für 5 min.
- Beachten Sie die Folie unter einem Lichtmikroskop mit 40x Linse trocken, um sicherzustellen, dass die Dias richtig verdaut und kein Zytoplasma vorhanden ist und die Chromosomen-Morphologie erhalten bleibt. Wählen Sie einen Bereich für die Hybridisierung unter Verwendung einer Diamant-Stift.
3. Chromosom und Sonde Denaturierung und Hybridisierung
- Bereiten Sie frische denaturierenden Lösung (70% formamide/2X SSC, pH 7,0) und vorwärmen auf 70-80 ° C in einem entsprechenden Gefäß im Wasserbad Ort platziert die Folie in der Glasküvette mit dem denaturierenden Lösung in einem Wasserbad bei 70 ° C Maus-Chromosomen und 80 ° C für den menschlichen Chromosomen für 30er-1.5 min.
- Anschließend wird der Schlitten in eiskaltem 70% Ethanol für 3 min um 80% gefolgt und 100% Ethanol für je 3 min an der Luft trocknen. Untersuchen Sie die Foliefür Chromosom Morphologie. Gute Chromosom Morphologie wird durch dunkle Chromosomen und nicht "-Phase-light" oder Halogen-Chromosomen bezeichnet.
- Erwärmen Sie die SkyPaint Sonde (SKY Paint Kit; Phiole # 1) bei 37 ° C unter Schütteln für 20 min, vortexen und kurz zentrifugieren bei 1000 rpm für ein paar Sekunden.
- Denaturieren die Sonde in einem Thermocycler für eine Zwei-Schritt-Zyklus mit 85 ° C programmiert für 5 min-Takt um 37 ° C für 60 min auf markierten-Sonden-DNA für preannealing genau verfolgt.
- Übernehmen 10 &mgr; l des denaturierten Sonde auf dem Gebiet der Hybridisierung und Abdeckung mit einem 22 mm x 40 mm Deckglas unter Sicherstellung, nicht Luftblasen einzufangen. Seal die Ränder des Deckglases mit Rubber Cement und inkubieren Sie in einer feuchten Kammer bei 37 ° C für 48-72 Stunden.
4. Fluoreszenzsonde Erkennung
- Entfernen Sie das Deckglas vorsichtig und legen Sie die Folie in einer Glasküvette mit vorgewärmtem (45 ° C) Waschlösung I (frisch zubereitete 50% Formamid in 2 × SSC). Waschen für 5 mindrei Mal bei 45 ° C in einem Schüttelwasserbad bei 45 rpm
- Waschen Sie die Folie in Waschlösung II (1X SSC) bei 45 ° C für 5 min zweimal mit Schütteln.
- Waschen Sie die Folie in Waschlösung III (4X SSC/0.1% Tween 20) für 5 min bei 45 ° C unter Schütteln.
- Bewerben 80 ul Blockierungsreagenz (SKY Paint Kit; Phiole # 2), legen Sie ein Deckglas und bei 37 ° C für 30 min.
- Entfernen Sie die Folie und lassen Sie die Flüssigkeit ablaufen. Bewerben 80 ul Cy5 Färbereagenz (Concentrated Antikörpernachweis CAD-Kit; Phiole # 3), tragen Sie eine Deckglas und bei 37 ° C für 40 min.
- Waschen Sie die Folie mit Waschlösung III bei 45 ° C für 5 min dreimal mit Schütteln.
- Bewerben 80 ul Cy5.5 Färbereagenz (Concentrated Antikörpernachweis CAD-Kit; Fläschchen # 4), legen Sie ein Deckglas und bei 37 ° C für 40 min.
- Waschen Sie die Folie mit Waschlösung III bei 45 ° C für 5 min dreimal mit Schütteln.
- Kippen Sie die Folie und lassen Sie die Flüssigkeit auf abtropfen lassen. Bewerben 20 ul der Anti-Fade DAPI-Reagenz (SKY Paint Kit; Fläschchen # 5) und legen Sie eine 24 mm x 60 mm Mikroskop Deckglas. Entfernen Sie vorsichtig die Luftblasen gebildet haben könnte. Dias können sofort abgebildet werden oder bei 4 ° C im Dunkeln nicht länger als 1 Woche.
5. Bilderfassung und-analyse
- Bildaufnahme wird durch Betrachten der Metaphase Dias mit einem Olympus-Mikroskop mit einem 60X Ölimmersionslinse eine spektrale Würfel (kundenspezifische Triple-Band-Pass-Filter), eine DAPI-Filter und ein Sagnac-Interferometer-Modul mit einer CCD-Kamera ausgestattet ist vollbracht.
- Spectral-Karyotypen wurden mit Sky View Software (Applied Spectral Imaging Version 1.62) nach der Bedienungsanleitung durchgeführt.
- Nach der Analyse der Bilder können die Chromosomen als Farbbilder (mit spezifischen fluoreszierenden Farben), Pseudo-Farbbilder (mit Farben für die Einstufung) und invertierte DAPI Bilder (spezifisches Bandenmuster) eingesehen werden.
Eine komplette SKY Prozedur dauert in der Regel etwa eine Woche Zeit (Abbildung 1). Dies umfasst Bilderfassung und-analyse, sofern die Metaphase-Zellen in ausreichender Menge gibt. Karyotypisierung Analyse zeigt normale Maus Karyotyp (40, XY) von Zellen von Wildtyp-Mäusen (Abbildung 2a). Im Gegensatz dazu Zellen aus PKD1 - zeigt Maus (PKD-Mausmodell) einen signifikanten Anstieg der Chromosomenzahl und strukturelle Anomalien, wie zum Beispiel Chromosom Deletionen (Chromosom # 8) und Translokationen (Chromosomen Nr. 11 und 19) (Abb. 2b) - /. Wir haben auch analysiert Leitgewebe aus den ADPKD Patienten. Eine einfache Untersuchung durch das Zählen der Chromosomen-Zahlen zeigten, dass nicht-ADPKD und einige ADPKD vaskulären Proben normalen Chromosomen-Zahl von 23 Paaren (Abbildung 2c) hatte. Im allgemeinen aber, beobachtet wir ein Versagen der chromosomalen Segregation, was in 46 Paare von Chromosomen in ADPKD Proben anstelle von 23 Paaren (Abbildung 2d).
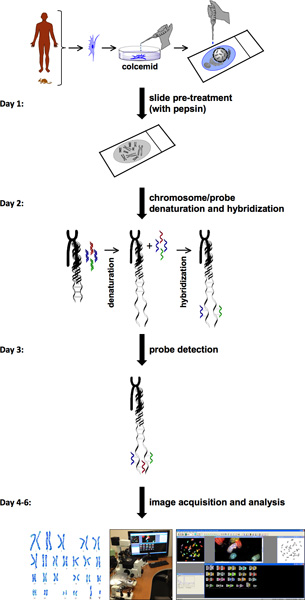
Abbildung 1. SKY-Protokoll Flussdiagramm. Ablaufschema des SKY-Protokoll zeigt Schritte, um ein Experiment, ausgehend von Zelle Vorbehandlung und Metaphase Vorbereitungen zur Bildaufnahme und Analyse abzuschließen. Eine ungefähre einwöchige Timeline ist auf der linken Seite mit Schritt-für-Schritt-Anweisungen für jeden Tag präsentiert.

Abbildung 2. Spektrale Karyotypisierung auf verewigt Maus-Zelllinien und frisch isolierten humanen primären Zellen. Farbe und invertierte DAPI Bilder von einzelnen Chromosomen werden vor der chromosomalen Sortierung dargestellt. Nach dem Sortieren werden Chromosomen in der "Klassifikation" Tabelle dargestellt. A) SKY Bild einer Metaphase Ausbreitung von Wildtyp-Maus enthält normalem Karyotyp (40, XY). B) SKY Bild einer Metaphase Ausbreitung von PKD1 - / -. Maus zeigt abnormale Chromosomenzahl (68 statt 40) und Chromosomenanomalien wie Chromosom Deletionen (Chromosom # 8) und Chromosomentranslokationen (Chromosomen Nr. 11 und 19) c) SKY Bild einer Metaphase Ausbreitung aus dem vaskulären Gewebe eines Nicht-ADPKD Patient hat normalem Karyotyp (46, XX). d) SKY Bild einer Metaphase Ausbreitung aus dem vaskulären Gewebe eines ADPKD Patienten enthält abnormalem Karyotyp (92, XXXX). Ersatzteile in der Daten wurden aus früheren Berichten und wiederverwendet mit Genehmigung 14.
Diskussion
Spektrale Karyotypisierung (SKY) ist eine Technik bei der Untersuchung Zytogenetik genomische und chromosomale Zusammensetzungen verwendet. Diese Technik nutzt die Vorteile von Chromosom Malerei Sonden, und die Detektion dieser Sonden durchstöberst einem Sagnac-Interferometers erfasst. Die komplette SKY Prozess dauert etwa eine Woche, und es sind mehrere wichtige Schritte (Abbildung 1). Die SKY mit einem Standardprotokoll, das zuerst von Padilla-Nash et al 3 beschrieben wurde. Das P...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Autoren möchten sich bei Brian Muntean, Shao Lo, Maki Takahashi und Blair Mell für ihre technische Unterstützung zu danken. Diese Arbeit wurde durch Auszeichnungen von der NIH (DK080640) und der University of Toledo & ProMedica Translational Research Award an Dr. Stimulation Surya Nauli unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| DMEM | Cellgro Mediatech Inc. | 10 bis 013-CV | |
| Fötales Rinderserum (FBS) | Hyclone | SH30088-03 | |
| Penecillin / Streptomycin | Thermo Scientific | SV30010 | |
| Colcemid | Roche Diagnostics | 10 295 892 001 | 10 pg / ml |
| HCl | Fisher Scientific | A144-500 | |
| KCl | Fisher Scientific | S77375-1 | |
| Phosphatgepufferte Kochsalzlösung | Thermo Scientific | SH30256-01 | |
| Himmel zu malen Probe Kit (Human) | Applied Spectral Imaging | SKY000028 | |
| Himmel zu malen Probe Kit (Maus) | Applied Spectral Imaging | SKY000030 | |
| Konzentrierte Antikörper-Nachweis-Kit | Applied Spectral Imaging | SKY000033 | |
| Trypsin | Thermo Scientific | SH30236.01 | |
| Methanol | Fisher Scientific | A433P-4 | |
| Essigsäure | Fisher Scientific | A38-212 | |
| RNase A | Roche Diagnostics | 10 109 169 001 | |
| Pepsin | Sigma-Aldrich | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ML | |
| 37% Formaldehyd | Mallinckrodt Baker | 2106-02 | |
| 20X SSC | Promega | V4261 | |
| Formamid | Fluka | 47671 | Vorbereitung unmittelbar vor Gebrauch |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Mikroskop Objektträger | Fisher Scientific | 12-549 | |
| Mikroskop Deckglas 24x60mm | VWR Vista Vision | 16004-312 | |
| Gummi-Zement | Elmer in die (lokalen Retail Store) | ||
| Hybridisierung / humidifiedchamber / Fach | Simport | M920-2 | nasse Papiertücher an der Unterseite |
| ThermoCycler | Eppendorf | Epgradient S | |
| / TwinCubator Orbitalschüttler | Bellco Biotechnologie | ||
| Schütteln / Wasserbad | Precision Scientific | ||
| DAPI Filterwürfel | Chroma Technology | ||
| SKY Filterwürfel | Chroma Technology | ||
| SpectraCube | Applied Spectral Imaging | ||
| Inverted Zellkultur Mikroskop | Nikon | Nikon Eclipse TS100 | |
| Fluoreszenzmikroskop | Olymp | IX70 | 60X Öl |
Referenzen
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten