É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cariotipagem espectral para o Estudo de Anomalias cromossômicas em humanos e camundongos com doença renal policística
Neste Artigo
Resumo
Cariotipagem espectral (SKY) é uma técnica avançada citogenética para identificar as aberrações cromossômicas e cromossômicas. Essa técnica leva vantagem das sondas cromossômicas de pintura, que permitem a classificação de todos os cromossomos. SKY também pode identificar aberrações cromossômicas e defeitos complexos de segregação em camundongos e humanos, com várias doenças, incluindo doença renal policística.
Resumo
Método convencional para identificar e classificar cromossomos individuais depende do padrão único de bandagem de cada cromossomo em uma espécie específicos que estão sendo analisados 1, 2. Esta técnica clássica de bandagem, no entanto, não é confiável na identificação de complexos aberrações cromossômicas, tais como aqueles associados com o câncer. Para superar as limitações da técnica de anilhamento, cariotipagem espectral (SKY) é introduzido para fornecer informações confiáveis tanto em anormalidades cromossômicas.
SKY é uma fluorescência multicolor hibridização in-situ (FISH) técnica para detectar cromossomos em metafase, com microscópio espectral 3, 4. SKY tem sido comprovada para ser uma ferramenta valiosa para a análise citogenética de uma ampla gama de anormalidades cromossômicas associados com um grande número de doenças genéticas e doenças malignas 5, 6. SKY envolve o uso de sondas de DNA multicolor fluorescentemente-com o Rótulo preparados a partir de o oligonucle degenerarprimers otide por PCR. Assim, cada cromossoma tem uma cor exclusiva espectral depois de hibridização in-situ com sondas, que são diferencialmente rotulados com uma mistura de corantes fluorescentes (Rodamina, Texas Vermelho, Cy5, FITC e Cy5.5). As sondas utilizadas para SKY consistir de até 55 sondas cromossômicas específicas 7-10.
O procedimento para a SKY envolve várias etapas (Figura 1). SKY exige a disponibilidade de células com alto índice mitótico a partir de tecido normal ou doente ou sangue. Os cromossomos de uma única célula a partir de qualquer célula de um recém-isolado primária ou uma linha de células estão espalhados em um slide de vidro. Esse spread cromossomo é rotulado com uma combinação diferente de corantes fluorescentes específicos para cada cromossomo. Para a detecção da sonda e de aquisição de imagem, o sistema de imagem espectral consiste de interferômetro de Sagnac e uma câmera CCD. Este permite a medição do espectro de luz visível emitida a partir da amostra e para adquirir uma imagem espectral frocromossomos m individuais. HiSKY, o software usado para analisar os resultados das imagens capturadas, proporciona uma fácil identificação de anomalias cromossômicas. O resultado final é uma metáfase e uma imagem de classificação cariótipo, no qual cada par de cromossomos tem uma cor distinta (Figura 2). Isso permite a fácil identificação de identidades cromossômicas e translocações. Para mais detalhes, visite o site da Imagem Aplicada (Spectral http://www.spectral-imaging.com/ ).
SKY foi recentemente usada para a identificação de defeitos cromossômicos de segregação e anormalidades cromossômicas em humanos e camundongos com doença renal policística autossômica dominante (ADPKD), uma doença genética caracterizada por uma disfunção em cílios 11-13. Usando esta técnica, foi demonstrada a presença de segregação cromossômica anormal e defeitos cromossômicos em pacientes DPRAD e modelos de mouse 14. Outras análises usando SKY não só nos permitiu identificar o número cromossômico e identidade, mas também para detectar com precisão muito complexos aberrações cromossômicas, como translocações e deleções cromossômicas (Figura 2).
Protocolo
1. Pré-tratamento de célula e preparação metáfase
- As células são cultivadas em alteraç de Dulbecco de Medium de Eagle (DMEM) contendo 10-15% de soro fetal bovino (FBS) e 1% de penicilina / estreptomicina a 37 ° C, com 5% de CO 2 incubadora, até que eles chegar a 70-80% de confluência.
- Trate as células com solução de Colcemid em 0,05 ug / ml para 30-60 min.
- Recolher o meio contendo as células de flutuação em tubos estéreis de 50 ml de centrífuga de falcão. Lavar as células sobre a placa com sterile1X-PBS. Depois de incubar com tripsina estéril para 1-2 min, colheita e coletar as células restantes para dentro do tubo mesmo.
- Spin os tubos a 1000 rpm durante 5 min, aspirar o sobrenadante deixando 0,5 ml e afrouxe pellet por flicking com o dedo somente.
- Dependendo do tamanho do pellet, adicione 5-10 ml de solução hipotônica de KCl 0,56% em dH 2 O e incubar a suspensão a 37 ° C por 30-45 min.
- Adicionar uma gota de metanol / ácido acético(3:1 vol / vol) por ml de suspensão de células hipotônica e inverta suavemente o tubo para a mistura.
- Centrifugar a 1200 rpm durante 5 min e coletar pellet como passo 1,4, em seguida, adicionar 5 ml de metanol fresco / ácido acético (3:1 vol / vol) gota a gota solução fixadora enquanto flicking o pellet continously. Este procedimento é crítico de modo a que os spreads metafásicas não vai ser preso em clumps as células 'que comprometeriam o experimento.
- Centrifugar novamente a 1200 rpm durante 5 min e adicione 5-10 ml de gelo-frio de metanol / fixador de ácido acético ao longo da parede do tubo. Na presente fase, se necessário, as células podem ser armazenadas em solução fixadora em um tubo de apertados e selado à temperatura de -20 ° C para o termo curto ou -80 ° C durante a longo prazo (anos) para uso futuro.
- Slides limpas em etanol absoluto, em seguida, mergulhar o slide no dH 2 O para approximately10X, a fim de formar uma bainha de água sobre a superfície do slide. Coloque o slide sobre uma placa de vidro e gota 15-20 uL de suspensão de células (a partir do passo 1,8) A partir de 10 "acima o slide. Coloque o slide em um banho de água fixado em 65-70 ° C durante 1-2 min e permitir que para secar.
- Verifique se o slide sob um microscópio de luz, utilizando 10X e 40X objetivos secos certificando-se há cromossomos metafásicos e os spreads são uniformemente espaçados. Verifique a presença citoplasma ao redor dos cromossomos. Se citoplasma é presente proceder com pré-tratamento de slide (digestão pepsina), se nenhum citoplasma está presente e os cromossomas tem boa morfologia, em seguida, não há nenhuma necessidade para pré-tratamento slide.
2. Pré-tratamento de slides (pepsina tratamento)
- Aplicar 120 uL de 1:200 solução de RNase (20 mg / ml) dissolvido em 2X-SSC sobre um milímetro 24 lamínula microscópio x 60 mm e inverta o rosto de slide metáfase para baixo sobre o lamínula, em seguida, inverter cuidadosamente o rosto de slide metáfase-se e incubar a 37 ° C durante 45 min.
- Retire cuidadosamente a lamínula sem arranhar a lâmina e lavar com 2X SSC-tampão em uma jarra de Coplin cada 5 min para 15 mincom agitação.
- Adicionar 5-15 uL de pepsina solução estoque (100 mg / ml em dH 2 O), para um copo limpo e em seguida, adicione 100 ml de pré-aquecido (37 ° C) 0,01 M de HCl. É importante que a pepsina é adicionado em um limpo proveta de primeira e não diretamente para dentro da solução HCl, caso contrário ele não iria se dissolver em solução. Incubar o slide em uma jarra de Coplin contendo a solução de HCl / pepsina nas concentrações de 37 ° C durante 3-5 min. Este passo é muito crítico como a digestão demasia fará com que os cromossomos a ser overdigested e demasiado pouca digestão vai deixar o citoplasma não digerido que poderá conduzir a ligação não-específica da sonda e interferir com o sinal de hibridação.
- Lave o slide em uma jarra de Coplin contendo 100 ml 1X-PBS durante 5 min duas vezes à temperatura de quarto.
- Lave o slide em uma jarra de Coplin contendo 100 ml 1X-PBS/MgCl 2 para 5 min à temperatura ambiente (50 ml de MgCl 1M n º 2 em 950 ml de 1X-PBS).
- Coloque o slide em uma jarra de Coplin containing 100 formaldeído ml 1% para 10 min à temperatura ambiente (1,7 ml de formaldeído a 37% em 100 ml de 1X-PBS/MgCl 2).
- Lave o slide em uma jarra de Coplin contendo 100 ml 1X-PBS durante 5 min.
- Observar o slide ao abrigo de um microscópio de luz usando lente seca de 40X para assegurar de que os slides são digeridos corretamente e nenhuma citoplasma está presente e a morfologia cromossomo é preservada. Selecione uma área para a hibridização usando uma caneta de diamante.
3. Cromossoma sonda e desnaturação e hibridização
- Prepare a solução de desnaturação fresco (70% formamide/2X SSC, pH 7,0) e Pré-aquecer a 70-80 ° C em uma jarra de Coplin colocado em um Lugar banho de água o slide no jarra de Coplin contendo a solução de desnaturação em um banho de água a 70 ° C para os cromossomos do rato e em 80 ° C para os cromossomos humanos para a 30s-1.5 min.
- Imediatamente coloque o slide em etanol de gelo-frio 70% para 3 min seguido por 80% e etanol a 100% por 3 min cada um e de ar seco. Examine o slidede morfologia cromossômica. Morfologia cromossômica Bom é denotada por cromossomos escuros e não "fase de luz" ou halo cromossomos.
- Aqueça a sonda de SkyPaint (kit de pintura SKY; frasco para injectáveis # 1) a 37 ° C com agitação durante 20 min vórtice, e centrifugar brevemente a 1000 rpm durante alguns segundos.
- Desnaturar a sonda em um termociclador programado para um ciclo de dois-passo de cada 85 ° C durante 5 ciclo de min seguido por 37 ° C por 60 min para permitir que sonda marcada com-de DNA para preannealing.
- Aplicar 10 ul da sonda desnaturada para a área de hibridação e tampa com uma 22 mm x 40 mm lamela tomando cuidado para não prender as bolhas de ar. Selar as bordas da lamínula com cimento de borracha e incubar em uma câmara de umidificado a 37 ° C durante 48-72 hrs.
4. Detecção de sonda fluorescente
- Remova a lamínula cuidadosamente e coloque o slide em uma jarra de Coplin contendo pré-aquecido (45 ° C) de lavar roupa solução que eu (preparado de fresco formamida a 50% em 2X SSC). Lave por 5 mintrês vezes a 45 ° C em um banho de água agitação a 45 rpm
- Lave o slide em uma solução de lavagem II (1X SSC) a 45 ° C por 5 min duas vezes com a tremer.
- Lave o slide em uma solução de lavagem III (% SSC/0.1 4X de Tween 20) durante 5 min a 45 ° C com agitação.
- Aplicar 80 uL de reagente de bloqueio (kit de pintura SKY; frasco para injectáveis # 2), coloque uma lamela e incubar a 37 ° C durante 30 min.
- Remova o slide e permita que o fluido para drenar. Aplicar 80 uL de Cy5 reagente de coloração (Concentrada anticorpo de detecção CAD kit; frasco para injectáveis # 3), aplique uma lamínula e incubar a 37 ° C durante 40 min.
- Lave o slide com uma solução de lavagem III a 45 ° C por 5 min três vezes com a tremer.
- Aplicar 80 uL de Cy5.5 reagente de coloração (Concentrada anticorpo de detecção CAD kit; frasco para injectáveis # 4), coloque uma lamínula e incubar a 37 ° C durante 40 min.
- Lave o slide com uma solução de lavagem III a 45 ° C por 5 min três vezes com a tremer.
- Incline o slide e permitir que o fluido a escorrer. Aplicar 20 ul do reagente DAPI anti-fade (kit de pintura SKY; frasco # 5) e colocar uma lamela de microscópio 24 mm x 60 mm. Retire cuidadosamente as bolhas de ar que são formadas. Slides pode ser imaged imediatamente ou armazenado a 4 ° C no escuro por nenhuma mais tempo do que 1 semana.
5. Aquisição e análise de imagem
- De aquisição de imagem é realizado por que visualizaram o slides metáfase usando um microscópio Olympus equipado com uma lente de 60X óleo de imersão, um cubo Espectral (personalizado projetado triplo band-pass filtro), um filtro de DAPI e um módulo de interferômetro de Sagnac com uma câmera CCD.
- Spectral-cariótipos foram realizadas usando o software SKY Ver (Versão imagem Aplicada espectral 1,62) Seguindo o manual do usuário.
- Depois de analisar as imagens, os cromossomos podem ser visualizadas como imagens de cores específicas (com cores fluorescentes), imagens a cores (com pseudo cores para a classificação) e imagens invertidas DAPI (padrão de bandas específico).
Um procedimento de SKY completa geralmente leva cerca de uma tempo de semanas (Figura 1). Isso inclui aquisição de imagem e de análise, desde que as células em metafase, estão em oferta adequada. Análise de cariotipagem revela cariótipo mouse normal (40, XY) de células de camundongos do tipo selvagem (Figura 2a). Em contraste, as células a partir de Pkd1 - / - do mouse (PKD modelo do rato) mostra um aumento significativo no número de cromossomos e anormalidades estruturais, tais como as deleções cromossômicas (cromossomo # 8) e translocações (cromossomos # 11 e 19) (Figura 2b). Analisamos também os tecidos vasculares dos pacientes DPRAD. Um estudo simples por meio da contagem os números de cromossômicas indicaram que não-ADPKD e algumas amostras DPRAD vasculares teve normais números de cromossômicas de 23 pares (Figura 2c). Em geral, porém, observou-se falha de segregação cromossômica, resultando em 46 pares de cromossomos em UmAmostras de DPKD em vez de 23 pares (Figura 2d).
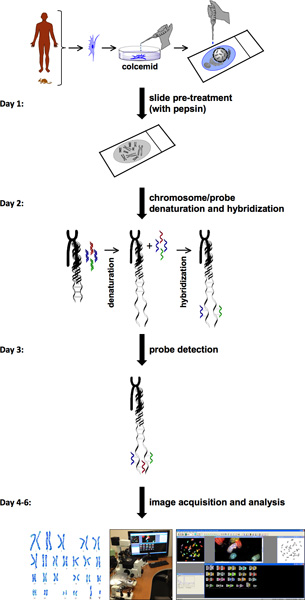
Figura 1. SKY fluxograma protocolo. Fluxograma do protocolo SKY ilustra passos para completar uma experiência a partir de pré-tratamento das células e preparações metáfase para aquisição e análise de imagem. Um cronograma de uma semana aproximada é apresentado à esquerda com o passo-a-passo os procedimentos para cada dia.

Figura 2. Cariotipagem espectral em linhas mouse imortalizados celulares e recém-isoladas células humanas primárias. Cores e imagens invertidas DAPI de cromossomos individuais são mostrados antes a classificação cromossômica. Após a triagem, os cromossomos são apresentados na "classificação" da tabela. Uma imagem SKY) de um spread metáfase de rato do tipo selvagem contém cariótipo normal (40, XY). B) de um spread a partir de metáfase Pkd1 - / -. mouse mostra o número de cromossomos anormais (68 em vez de 40) e alterações cromossômicas, como deleção do cromossomo (cromossomo # 8) e translocações cromossômicas (cromossomos 11 e # 19) c) SKY imagem de um spread metáfase do tecido vascular de um paciente não tem ADPKD cariótipo normal (46, XX). d) SKY imagem de um spread metáfase do tecido vascular de um paciente ADPKD contém cariótipo anormal (92, XXXX). Parte dos dados foram previamente relatados e reutilizado com permissão 14.
Discussão
Cariotipagem espectral (SKY) é uma técnica utilizada em citogenética estudar composições genômicas e cromossômicas. Essa técnica leva vantagem das sondas de pintura de cromossomos, ea detecção destas sondas são adquiridas através de um interferômetro de Sagnac. O processo de SKY completa geralmente leva cerca de uma semana, e ele, envolve várias etapas-chave (Figura 1). A SKY usa um protocolo padrão, que foi primeiramente descrita por Padilla-Nash et al 3. O protocolo ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer Brian Muntean, Shao Lo, Maki Takahashi e Blair Mell para a sua assistência técnica. Este trabalho foi financiado por concessões do NIH (DK080640) e da Universidade de Toledo & ProMedica Prêmio Estímulo à Pesquisa Translacional Dr. Surya Nauli.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| DMEM | Cellgro Mediatech Inc. | 10-013-CV | |
| Fetal de soro de bovino (FBS) | Hyclone | SH30088-03 | |
| Penecillin Estreptomicina / | Thermo Scientific | SV30010 | |
| Colcemid | Roche Diagnostics | 10 295 892 001 | 10 ug / ml |
| HCl | Fisher Scientific | A144-500 | |
| KCl | Fisher Scientific | S77375-1 | |
| Fosfato de solução salina tamponada com | Thermo Scientific | SH30256-01 | |
| SKY pintura sonda kit (Humana) | Aplicado imagem espectral | SKY000028 | |
| SKY pintura sonda kit (Mouse) | Aplicado imagem espectral | SKY000030 | |
| Kit de detecção de Concentrada anticorpo | Aplicado imagem espectral | SKY000033 | |
| Tripsina | Thermo Scientific | SH30236.01 | |
| Metanol | Fisher Scientific | A433P-4 | |
| O ácido acético | Fisher Scientific | A38-212 | |
| RNase A | Roche Diagnostics | 10 109 169 001 | |
| Pepsina | Sigma-Aldrich | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ML | |
| Formaldeído 37% | Mallinckrodt Baker | 2106-02 | |
| 20X SSC | Promega | V4261 | |
| Formamida | Fluka | 47671 | preparar pouco antes de usar |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Vidro lâminas de microscópio | Fisher Scientific | 12-549 | |
| Microscópio tampa de vidro 24x60mm | VWR Vista Visão | 16004-312 | |
| Borracha cimento | Elmer (loja de varejo local) | ||
| Hibridação humidifiedchamber / / Bandeja | Simport | M920-2 | colocar toalhas de papel molhadas no fundo |
| Thermociclista | Eppendorf | Epgradient S | |
| Plataforma de agitação / agitador orbital | Bélico Biotecnologia | ||
| Agitando banheira / água | Precisão científica | ||
| DAPI cubo filtro | Tecnologia Chroma | ||
| SKY cubo filtro | Tecnologia Chroma | ||
| SpectraCube | Aplicado imagem espectral | ||
| Microscópio invertido cultura de células | Nikon | Nikon Eclipse TS100 | |
| Microscópio de fluorescência | Olimpo | IX70 | Óleo de 60X |
Referências
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados