A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Karyotyping רפאים ללמוד חריגות כרומוזום בבני אדם ועכברים עם מחלת כליות פוליציסטיות
In This Article
Summary
Karyotyping ספקטרלי (שמים) היא טכניקה מתקדמת cytogenetics לזהות סטיות כרומוזומליות גנומית. שיטה זו מנצלת את בדיקות ציור כרומוזום, המאפשרים סיווג של כרומוזומים כל. SKY יכול גם לזהות סטיות כרומוזום מורכבים ופגמים הפרדה בעכברים ובבני אדם עם מחלות שונות, לרבות מחלת כליות פוליציסטיות.
Abstract
השיטה המקובלת לזהות ולסווג כרומוזומים בודדים תלוי בדגם פסים ייחודי של כל כרומוזום בעוד כמה מינים ספציפיים שאנו מנתחים 1, 2. זו טכניקה קלאסית פסים, לעומת זאת, אינה אמינה בזיהוי סטיות כרומוזומליות מורכבים, כגון אלה הקשורים בסרטן. כדי להתגבר על המגבלות של טכניקה פסים, Karyotyping ספקטרלית (SKY) הוא הציג לספק מידע אמין יותר על אי תקינות הכרומוזומים.
SKY היא הקרינה ססגוניות in-situ הכלאה (דגים) טכניקה לזהות כרומוזומים metaphase עם מיקרוסקופ רפאים 3, 4. SKY הוכח להיות כלי רב ערך לניתוח cytogenetic של מגוון רחב של מומים כרומוזום הקשורים למספר רב של מחלות גנטיות ומחלות ממאירות 5, 6. SKY כרוכה בשימוש של בדיקות ה-DNA ססגוניות fluorescently שכותרתו שהוכנו oligonucle מנוונתprimers otide על ידי PCR. לכן, כל כרומוזום יש צבע ייחודי רפאים לאחר ההכלאה in-situ עם בדיקות, אשר שכותרתו דיפרנציאלי בתערובת של צבעי ניאון (Rhodamine, טקסס רד, Cy5, FITC ו Cy5.5). בדיקות המשמשות SKY מורכב של עד 55 בדיקות ספציפיות כרומוזום 7-10.
הליך SKY כרוכה במספר שלבים (איור 1). SKY דורש זמינות של תאים עם מדד mitotic גבוהה מן הרקמות או חולה או דם. הכרומוזומים של תא בודד מתא בודד או העיקרי טרי או שורת תאים מפוזרים על שקופיות זכוכית. התפשטות זו כרומוזום מסומן עם שילוב שונה של צבעי ניאון ספציפיים עבור כל כרומוזום. בדיקה לאיתור ורכישת תמונה, מערכת דימות ספקטרלי מורכב interferometer sagnac ומצלמת CCD. זה מאפשר מדידה של ספקטרום האור הנראה הנפלט המדגם לרכוש תמונת רפאים הלוך ושובמ כרומוזומים בודדים. HiSKY, תוכנה להשתמש כדי לנתח את התוצאות של תמונות שנתפסו, מספק זיהוי קל של אנומליות כרומוזום. התוצאה הסופית היא metaphase ו סיווג קריוטיפ התמונה, שבה כל זוג כרומוזומים יש צבע מיוחד (איור 2). זה מאפשר זיהוי קל של זהויות כרומוזום translocations. לפרטים נוספים, בקר באתר יישומי הדמיה ספקטרלית ( http://www.spectral-imaging.com/ ).
SKY שימש לאחרונה לזיהוי ההפרדה פגמים כרומוזום הפרעות כרומוזום בבני אדם ועכברים עם מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD), מחלה גנטית המאופיינת בתפקוד ב cilia העיקרי 11-13. באמצעות טכניקה זו, הפגנו נוכחות של הפרדה כרומוזום נורמלי פגמים כרומוזומליים בחולים ADPKD ומודלים עכבר 14. ניתוחים נוספים באמצעות SKY לא רק מאפשר לנו לזהות את מספר הזהות ואת כרומוזומליות, אלא גם כדי לזהות במדויק סטיות כרומוזומליות מורכבים מאוד כגון מחיקות כרומוזום טרנסלוקציות (איור 2).
Protocol
1. התא טיפול מקדים והכנה metaphase
- התאים גדלים שינוי של Dulbecco בינוני של הנשרים (DMEM) המכיל 10-15% בסרום שור עוברית (FBS) ו 1% פניצילין / סטרפטומיצין על 37 מעלות צלזיוס עם 5% CO 2 באינקובטור, עד שהם מגיעים 70-80% confluency.
- פנקו את התאים עם פתרון colcemid ב 0.05 מיקרוגרם / מ"ל 30-60 דקות.
- איסוף הבינוני המכיל את כל התאים הצפים בתוך 50 מ"ל צינורות סטריליים בז צנטריפוגות. שוטפים את התאים בצלחת עם sterile1X-PBS. לאחר דוגרים עם טריפסין סטרילי עבור 1-2 דקות, הקציר לאסוף את התאים הנותרים לתוך צינור אחד.
- לסובב את הצינורות ב 1000 סל"ד במשך 5 דקות, לשאוב supernatant לעזוב 0.5 מ"ל לשחרר גלולה ידי מצליף עם האצבע בלבד.
- תלוי בגודל גלולה, מוסיפים 5-10 מ"ל של תמיסת KCl hypotonic של 0.56% ב DH 2 O ו דגירה ההשעיה על 37 מעלות צלזיוס במשך 30-45 דקות.
- הוסף טיפה אחת של מתנול / חומצה אצטית(03:01 Vol / Vol) לכל מ"ל של תרחיף תאים hypotonic והפוך את הצינור בעדינות לערבוב.
- סרכזת בסל"ד 1200 דקות 5 ולאסוף גלולה כצעד 1.4, ולאחר מכן להוסיף 5 מ"ל מתנול רעננה / חומצה אצטית (03:01 כרך / כרך א ') dropwise הפתרון מקבע בעוד מצליף גלולה ברציפות. הליך זה הוא קריטי, כך מתפשט metaphase לא יהיה לכוד בתוך גושים של תאים אשר היה לסכן את הניסוי.
- סרכזת שוב בסל"ד 1200 5 דקות ומוסיפים 5-10 מ"ל של מתנול קר כקרח / מקבע חומצה אצטית לאורך הקיר של הצינור. בשלב זה, אם יש צורך, התאים ניתן לאחסן את הפתרון מקבע בצינור להדק ונחתם ב -20 ° C לטווח קצר או -80 ° C לטווח ארוך (שנים) לשימוש עתידי.
- שקופיות נקיים באתנול מוחלטת, ואז לטבול שקופית 2 DH O עבור approximately10X על מנת ליצור מעטפת של מים על פני השטח של השקופית. מניחים את השקף על צלחת זכוכית ירידה של 15 20μl ההשעיה תא (משלב 1.8) מ 10 "מעל השקופית. מניחים את שקף באמבט מים נקבע על 65-70 מעלות צלזיוס במשך 1-2 דקות ולאפשר לו להתייבש.
- בדוק את השקופיות מתחת למיקרוסקופ אור באמצעות יעדים יבשים 10X ו 40X מוודא שיש הוא הכרומוזומים metaphase ו המרווחים הם מחולקת באופן שווה. לבדוק את קיומו הציטופלסמה סביב הכרומוזומים. אם הציטופלסמה היא להמשיך הנוכחי עם טיפול מקדים שקופיות (העיכול פפסין), אם הציטופלסמה לא קיים ואת הכרומוזומים יש מורפולוגיה טוב, אז אין צורך המקדים שקופיות.
2. Slide המקדים (טיפול עכלן)
- החל 120 μl של פתרון RNase 1:200 (20 מ"ג / מ"ל) מומס 2X-SSC על 24 מ"מ coverglass מיקרוסקופ x 60 מ"מ ו להפוך את פני השקופית metaphase על coverglass אז בעדינות ללא מרחב הפנים שקופיות metaphase מעלה דגירה ב 37 מעלות צלזיוס במשך 45 דקות.
- מוציאים בזהירות את coverglass מבלי לשרוט את השקופית ולשטוף במאגר 2X-SSC בצנצנת coplin כל 5 דקות במשך 15 דקותעם רעד.
- הוסף 5-15 μl של פתרון המניות עכלן (100 מ"ג / מ"ל ב DH 2 O) לתוך מבחנה נקייה ולאחר מכן להוסיף 100 מ"ל של prewarmed (37 ° C) 0.01M HCl. חשוב עכלן מתווסף לתוך נקי 1 כוס ולא ישירות פתרון ה-HCL, אחרת זה לא מתמוססים פתרון. דגירה שקופיות בצנצנת coplin המכיל את הפתרון HCl / עכלן על 37 מעלות צלזיוס במשך 3-5 דקות. שלב זה הוא קריטי מאוד לעיכול יותר מדי יגרום הכרומוזומים להיות overdigested מדי לעיכול מעט יעזוב הציטופלסמה לא מעוכל אשר עשוי להוביל מחייב הלא ספציפית של החללית ולהפריע האות ההכלאה.
- לשטוף את השקופית בצנצנת המכילה 100 מ"ל coplin 1X-PBS דקות 5 פעמיים בטמפרטורת החדר.
- לשטוף את השקופית בצנצנת המכילה 100 מ"ל coplin 1X-PBS/MgCl 2 דקות 5 בטמפרטורת החדר (50 מ"ל של 1M MgCl 2 ב 950 מ"ל של 1X-PBS).
- מניחים את שקופית צנצנת coplin containinז 100 מ"ל פורמלדהיד 1% עבור 10 דקות בטמפרטורת החדר (1.7 מ"ל של פורמלדהיד 37% ל -100 מ"ל של 1X-PBS/MgCl 2).
- לשטוף את השקופית בצנצנת המכילה 100 מ"ל coplin 1X-PBS דקות 5.
- שימו לב שקופיות תחת מיקרוסקופ אור באמצעות עדשה יבש 40X כדי להבטיח את השקופיות מתעכל כראוי הציטופלסמה לא קיים ואת המורפולוגיה כרומוזום נשמר. בחר אזור הכלאה באמצעות עט היהלומים.
3. כרומוזום ו החללית denaturation ואת ההכלאה
- הכן פתרון denaturing טרי (70% formamide/2X SSC, pH 7.0) ו prewarm ל 70-80 מעלות צלזיוס בתוך צנצנת coplin ממוקם במקום אמבט מים שקופיות בצנצנת coplin המכיל את הפתרון denaturing באמבט מים 70 ° C על כרומוזומים העכבר ו -80 מעלות צלזיוס במשך הכרומוזומים אדם בשנות ה -30 דקות, 1.5.
- מיד למקם את השקופית באתנול קפוא 70% עבור 3 דקות לאחר מכן 80% אתנול ו 100% עבור 3 דקות כל אחד ואוויר יבש. לבחון את השקופיתהמורפולוגיה של כרומוזום. מורפולוגיה כרומוזום טוב הוא כונה על ידי הכרומוזומים כהים ולא "שלב האור", או הילה כרומוזומים.
- לחמם את החללית SkyPaint (ערכת צבע השמים: בקבוקון # 1) על 37 מעלות צלזיוס עם רועדת על המערבולת 20 דק ', ו צנטריפוגות בקצרה בסל"ד 1000 למשך מספר שניות.
- לפגל בדיקה ב thermocycler מתוכנת עבור מחזור שני שלבים על 85 מעלות צלזיוס במשך מחזור 5 דקות לאחר מכן 37 מעלות צלזיוס במשך 60 דקות כדי לאפשר בדיקה שכותרתו-DNA של preannealing.
- החל 10μl של החללית מפוגל על שטח של הכלאה ומכסים 22 מ"מ x 40 מ"מ coverglass לוודא שלא ללכוד בועות אוויר. סוגרים את הקצוות של coverglass במלט גומי דגירה בתא humidified על 37 מעלות צלזיוס במשך 48-72 שעות.
4. בדיקה לגילוי פלורסנט
- הסר את coverglass בזהירות ומניחים את השקופית בצנצנת coplin המכיל prewarmed (45 ° C) כביסה פתרון אני (לפוראמיד 50% מוכן טרי 2X SSC). לשטוף 5 דקותשלוש פעמים ב 45 מעלות צלזיוס באמבט מים רועד בסל"ד 45
- לשטוף את שקופית כביסה הפתרון השני (1X SSC) על 45 מעלות צלזיוס למשך 5 דקות פעמיים עם רעד.
- לשטוף את שקופית כביסה פתרון III (% 4X SSC/0.1 Tween 20) 5 דקות ב 45 מעלות צלזיוס עם רעד.
- החל 80 μl של ריאגנט חוסם (ערכת צבע השמים: בקבוקון # 2), במקום coverslip ו דגירה על 37 מעלות צלזיוס למשך 30 דקות.
- להסיר את השקופית ולאפשר נוזל לנקז. החל 80 μl של מגיב Cy5 מכתים (מרוכז זיהוי נוגדן CAD הערכה: בקבוקון # 3), להחיל coverglass ו דגירה על 37 מעלות צלזיוס במשך 40 דקות.
- לשטוף את השקופית עם הכביסה הפתרון השלישי על 45 מעלות צלזיוס למשך 5 דקות שלוש פעמים עם רעד.
- החל 80 μl של מגיב Cy5.5 מכתים (מרוכז זיהוי נוגדן CAD הערכה: בקבוקון מס '4), במקום coverglass ו דגירה על 37 מעלות צלזיוס במשך 40 דקות.
- לשטוף את השקופית עם הכביסה הפתרון השלישי על 45 מעלות צלזיוס למשך 5 דקות שלוש פעמים עם רעד.
- הטה את השקופית ולאפשר נוזלים לנקז. החל 20 μl של מגיב DAPI נגד דהייה (ערכת צבע השמים: בקבוקון # 5) ומקום 24 מ"מ coverglass מיקרוסקופ x 60 מ"מ. מוציאים בזהירות את בועות אוויר שאולי נוצרו. שקופיות ניתן הדמיה באופן מיידי או לשמור על 4 מעלות צלזיוס בחושך לא יותר משבוע 1.
5. תמונה הרכישה וניתוח
- רכישת התמונה נעשית על ידי הצגת שקופיות metaphase באמצעות מיקרוסקופ אולימפוס מצוידת בעדשה טבילה 60x שמן, קוביית ספקטרלית (אישית מעוצבת משולשת לעבור הלהקה מסנן), מסנן DAPI ואת מודול interferometer sagnac עם מצלמת CCD.
- ספקטרליים למוצרי Karyotypes בוצעו באמצעות Sky View תוכנה (יישומי דימות ספקטרלי גרסה 1.62), לאחר ידנית של המשתמש.
- לאחר ניתוח התמונות, הכרומוזומים ניתן לראות תמונות צבע (עם צבעי ניאון ספציפיים), תמונות צבע פסאודו (עם צבעים לסיווג) ו הפוכים תמונות DAPI (דפוס רצועות ספציפי).
הליך SKY מלאה בדרך כלל לוקח בערך פעם בשבוע (איור 1). זה כולל רכישת התמונה וניתוח ובלבד התאים metaphase נמצאים אספקה נאותה. ניתוח Karyotyping מגלה קריוטיפ עכבר רגיל (40, XY) של תאים מעכברים סוג בר (איור 2 א). לעומת זאת, תאים Pkd1 - / - עכבר (מודל PKD העכבר) מראה גידול משמעותי במספר הכרומוזומים וכן מומים מבניים, כגון מחיקות כרומוזומים (כרומוזום מס '8) ו (טרנסלוקציות # כרומוזומים 11 ו 19) (איור 2b). אנחנו גם ניתח רקמות כלי דם מן החולים ADPKD. מחקר שנערך על ידי פשוט לספור את מספר הכרומוזומים ציינו כי לא ADPKD וכמה דוגמאות כלי הדם ADPKD היו מספרים כרומוזומליות נורמליות של 23 זוגות (איור 2 ג). באופן כללי, עם זאת, צפינו כישלון של הפרדה כרומוזומלית, וכתוצאה מכך 46 זוגות של כרומוזומים בדגימות DPKD במקום 23 זוגות (איור 2).
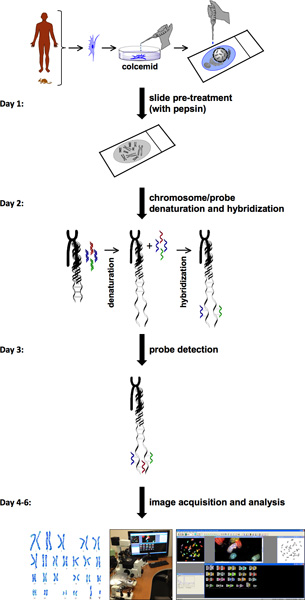
באיור 1. תרשים זרימה SKY פרוטוקול. תרשים זרימה של פרוטוקול SKY מדגים צעדים כדי להשלים את הניסוי החל טיפול מקדים התא ההכנות metaphase לרכישת התמונה וניתוח. ציר הזמן המשוער של שבוע מוצג בצד שמאל עם צעד אחר צעד את התהליכים עבור כל יום.

איור 2. Karyotyping רפאים הנציח על שורות תאים של העכבר או מבודדים טרי תאים ראשוניים אדם. צבע ותמונות DAPI כפולות של כרומוזומים בודדים מוצגים לפני מיון כרומוזומלית. לאחר מיון, הכרומוזומים מופיעים בטבלה "סיווג". תמונה) השמיים של התפשטות metaphase של העכבר סוג בטבע מכיל קריוטיפ תקין (40, XY). ב) SKY תמונה של התפשטות metaphase Pkd1 מ - / -. העכבר מראה מספר כרומוזומים לא תקין (68 במקום 40) וכן מומים כרומוזום כגון מחיקות כרומוזומים (כרומוזום מס '8) ו translocations כרומוזום (כרומוזומים 11 ו - # 19) ג) SKY תמונה של התפשטות metaphase מרקמת הדם של החולה לא ADPKD יש קריוטיפ תקין (46, XX). ד) תמונת השמיים של התפשטות metaphase מרקמת הדם של החולה ADPKD מכיל קריוטיפ תקין (92, XXXX). חלקים של הנתונים דווחו קודם לכן ולעשות בהם שימוש חוזר ברשות 14.
Discussion
Karyotyping ספקטרלי (שמים) היא טכניקה cytogenetics השתמשו בלימוד יצירות גנומית כרומוזומלית. שיטה זו מנצלת את בדיקות ציור כרומוזום, ואת גילוי של בדיקות אלה נרכשים דרך interferometer sagnac. תהליך SKY מלאה בדרך כלל לוקח בערך שבוע, והיא כוללת מספר שלבים עיקריים (איור 1). SKY משתמשת בפרוט?...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מבקשים להודות בריאן Muntean, שאו הנה מאקי טקהאשי ובלייר מל לקבלת סיוע טכני שלהם. עבודה זו נתמכה על ידי פרסים מ-NIH (DK080640) ואת אוניברסיטת טולדו & ProMedica פרס גירוי Translational מחקר של ד"ר Surya נאולי.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| DMEM | Cellgro Mediatech בע"מ | 10-013-CV | |
| העובר שור בסרום (FBS) | Hyclone | SH30088-03 | |
| Penecillin / סטרפטומיצין | Thermo Scientific | SV30010 | |
| Colcemid | Roche Diagnostics | 10 295 892 001 | 10 מיקרוגרם / מ"ל |
| HCl | פישר סיינטיפיק | A144-500 | |
| KCl | פישר סיינטיפיק | S77375-1 | |
| פוספט שנאגרו מלוחים | Thermo Scientific | SH30256-01 | |
| צבע SKY ערכת בדיקה (האדם) | Spectral Imaging יישומית | SKY000028 | |
| צבע SKY ערכת בדיקה (עכבר) | Spectral Imaging יישומית | SKY000030 | |
| נוגדנים מרוכזת איתור ערכת | Spectral Imaging יישומית | SKY000033 | |
| טריפסין | Thermo Scientific | SH30236.01 | |
| מתנול | פישר סיינטיפיק | A433P-4 | |
| חומצה אצטית | פישר סיינטיפיק | A38-212 | |
| RNase | Roche Diagnostics | 10 109 169 001 | |
| עכלן | Sigma-Aldrich | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ml | |
| 37% פורמלדהיד | Mallinckrodt בייקר | 2106-02 | |
| 20X SSC | Promega | V4261 | |
| לפוראמיד | Fluka | 47671 | להכין ממש לפני השימוש |
| Tween-20 | פישר סיינטיפיק | BP337-500 | |
| זכוכית מיקרוסקופ שקופיות | פישר סיינטיפיק | 12-549 | |
| כיסוי זכוכית מיקרוסקופ 24x60mm | VWR Vista חזון | 16004-312 | |
| גומי מלט | אלמר של (הפצה מסחרית מקומית) | ||
| ההכלאה / humidifiedchamber / מגש | Simport | M920-2 | לשים מגבות נייר רטובות בתחתית |
| ThermoCycler | Eppendorf | Epgradient S | |
| רועד פלטפורמה / Orbital שאכר | Bellco ביוטכנולוגיה | ||
| אמבטיה / מים רועדת | דיוק מדעי | ||
| DAPI קוביית המסנן | Chroma טכנולוגיה | ||
| SKY קוביית המסנן | Chroma טכנולוגיה | ||
| SpectraCube | Spectral Imaging יישומית | ||
| תא הפוכה תרבות מיקרוסקופ | ניקון | Nikon TS100 Eclipse | |
| מיקרוסקופ פלואורסצנטי | אולימפוס | IX70 | 60x שמן |
References
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved