Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Спектральный Кариотипирование по изучению хромосомных аномалий у человека и мыши с поликистозом почек
В этой статье
Резюме
Спектральный Кариотипирование (SKY) является передовой техникой цитогенетики для идентификации геномных и хромосомных аберраций. Эта техника использует датчики хромосомы картины, которые позволяют классификации всех хромосом. SKY можно также определить комплекс хромосомных аберраций и разделение дефектов у мышей и людей с различными заболеваниями, в том числе поликистоз почек.
Аннотация
Conventional method to identify and classify individual chromosomes depends on the unique banding pattern of each chromosome in a specific species being analyzed 1, 2. This classical banding technique, however, is not reliable in identifying complex chromosomal aberrations such as those associated with cancer. To overcome the limitations of the banding technique, Spectral Karyotyping (SKY) is introduced to provide much reliable information on chromosome abnormalities.
SKY is a multicolor fluorescence in-situ hybridization (FISH) technique to detect metaphase chromosomes with spectral microscope 3, 4. SKY has been proven to be a valuable tool for the cytogenetic analysis of a broad range of chromosome abnormalities associated with a large number of genetic diseases and malignancies 5, 6. SKY involves the use of multicolor fluorescently-labelled DNA probes prepared from the degenerate oligonucleotide primers by PCR. Thus, every chromosome has a unique spectral color after in-situ hybridization with probes, which are differentially labelled with a mixture of fluorescent dyes (Rhodamine, Texas Red, Cy5, FITC and Cy5.5). The probes used for SKY consist of up to 55 chromosome specific probes 7-10.
The procedure for SKY involves several steps (Figure 1). SKY requires the availability of cells with high mitotic index from normal or diseased tissue or blood. The chromosomes of a single cell from either a freshly isolated primary cell or a cell line are spread on a glass slide. This chromosome spread is labeled with a different combination of fluorescent dyes specific for each chromosome. For probe detection and image acquisition,the spectral imaging system consists of sagnac interferometer and a CCD camera. This allows measurement of the visible light spectrum emitted from the sample and to acquire a spectral image from individual chromosomes. HiSKY, the software used to analyze the results of the captured images, provides an easy identification of chromosome anomalies. The end result is a metaphase and a karyotype classification image, in which each pair of chromosomes has a distinct color (Figure 2). This allows easy identification of chromosome identities and translocations. For more details, please visit Applied Spectral Imaging website (http://www.spectral-imaging.com/).
SKY was recently used for an identification of chromosome segregation defects and chromosome abnormalities in humans and mice with Autosomal Dominant Polycystic Kidney Disease (ADPKD), a genetic disease characterized by dysfunction in primary cilia 11-13. Using this technique, we demonstrated the presence of abnormal chromosome segregation and chromosomal defects in ADPKD patients and mouse models 14. Further analyses using SKY not only allowed us to identify chromosomal number and identity, but also to accurately detect very complex chromosomal aberrations such as chromosome deletions and translocations (Figure 2).
протокол
1. Предварительная обработка клеток и метафазных подготовки
- Клетки, выращенные в модификации Дульбекко среднего орла (DMEM), содержащих 10-15% эмбриональной телячьей сыворотки (FBS) и 1% пенициллина / стрептомицина при 37 ° С с 5% СО 2 инкубатора, пока они не достигают 70-80% слияния.
- Относитесь к клеткам с колцемид решение на уровне 0,05 мкг / мл в течение 30-60 мин.
- Соберите среде, содержащей любой плавающих клеток в 50 мл стерильной труб сокол центрифуги. Промойте клетки на пластине с sterile1X-би-эс. После инкубации с трипсином стерильной в течение 1-2 мин, урожай и собрать оставшиеся клетки в одну трубу.
- Вращайте труб при 1000 оборотов в минуту в течение 5 мин, аспирации супернатант оставляя 0,5 мл и ослабить гранул, щелкая пальцами только.
- В зависимости от размера гранул, добавьте 5-10 мл гипотонического раствора 0,56% KCl в дН 2 O и инкубировать подвески при 37 ° С в течение 30-45 мин.
- Добавить по одной капле метанол / уксусная кислота(3:1 об / об) в мл суспензии клеток гипотоническим и перевернуть трубку осторожно для смешивания.
- Центрифуга на 1200 оборотов в минуту в течение 5 мин и собирают гранулы как шаг 1.4, затем добавить 5 мл свежего метанол / уксусная кислота (3:1 об / об) фиксирующий раствор по каплям при стряхивая осадок непрерывно. Эта процедура очень важно, чтобы метафазы распространяется не будет в ловушке скопления клеток ", которые поставили бы под угрозу эксперимент.
- Центрифуга снова в 1200 оборотов в минуту в течение 5 минут и добавить 5-10 мл ледяной метанол / уксусная кислота фиксатор вдоль стенки трубы. На данном этапе, в случае необходимости, клетки можно хранить в фиксирующий раствор в затянуты и опечатаны трубы при температуре -20 ° C на короткий срок или -80 ° C на длительный срок (лет) для дальнейшего использования.
- Чистая слайды в абсолютном этаноле, а затем окунуться в слайд дН 2 O для approximately10X для того, чтобы сформировать оболочку воды на поверхности слайда. Поместите слайд на стекло и падение 15-20 мкл клеточной суспензии (с шагом 1,8) От 10 "над слайд. Поместите слайд в ванну с водой устанавливается на 65-70 ° С в течение 1-2 мин и дайте высохнуть.
- Проверьте слайдов под световым микроскопом использованием 10X и 40X сухой цели убедившись, что есть метафазных хромосом и спреды равномерно. Проверьте наличие цитоплазме окружающих хромосом. Если цитоплазме присутствует продолжить слайд предварительной обработки (пепсином), если не цитоплазме присутствует и хромосомы имеют хорошие морфологии, то есть нет необходимости в предварительной обработке слайдов.
2. Слайд предварительной обработки (пепсин лечения)
- Применение 120 мкл РНКазы 1:200 раствор (20 мг / мл), растворенного в 2 раза-SSC на 24 мм х 60 мм микроскоп покровного стекла и инвертировать метафазы лица скатываются на покровного стекла затем аккуратно переверните метафазы лицо слайдов и инкубировать в 37 ° C в течение 45 мин.
- Осторожно снимите покровного стекла без царапин слайдов и мыть в 2х-SSC буфера в банке Коплин каждые 5 минут в течение 15 минутпри встряхивании.
- Добавить 5-15 мкл исходного раствора пепсина (100 мг / мл в дН 2 O) в чистый стакан, а затем добавьте 100 мл нагретого (37 ° C) 0,01 М HCl. Важно, что пепсин добавляется в чистую Стакан первой и не непосредственно в раствор соляной кислоты, в противном случае он не будет растворяться в растворе. Инкубировать слайд в банке Коплин содержащих HCl / пепсин решение при 37 ° С в течение 3-5 мин. Этот шаг очень важный, как слишком много пищеварения приведет хромосом быть overdigested и слишком мало пищеварение выйдет в цитоплазме непереваренной которые могут привести к неспецифического связывания зонда и вмешиваться в гибридизации сигнала.
- Промыть стекло в банке Коплин, содержащей 100 мл 1X-PBS в течение 5 минут два раза при комнатной температуре.
- Промыть стекло в банке Коплин, содержащей 100 мл 1X-PBS/MgCl 2 на 5 минут при комнатной температуре (50 мл 1 М MgCl 2 в 950 мл 1X-PBS).
- Поместите слайд Коплин банку containinг 100 мл 1% формальдегида в течение 10 мин при комнатной температуре (1,7 мл 37% формальдегида в 100 мл 1X-PBS/MgCl 2).
- Промыть стекло в банке Коплин, содержащей 100 мл 1X-PBS в течение 5 мин.
- Обратите внимание на слайд под световым микроскопом использованием 40X сухой объектив для того, чтобы слайды переваривается должным образом и не цитоплазме присутствует и морфологии хромосом сохраняется. Выберите область для гибридизации с использованием алмазов ручкой.
3. Хромосомы и зонд денатурации и гибридизации
- Подготовить свежие денатурации раствора (70% formamide/2X SSC, рН 7,0) и prewarm до 70-80 ° C в банке Коплин помещен в место водяной бане слайдов в банке Коплин содержащие денатурации раствора в водяной бане при температуре 70 ° C для мыши хромосом и 80 ° C для хромосом человека для 30-х годов, 1,5 мин.
- Немедленно поместить слайд в ледяной 70% этанола в течение 3 мин, а затем на 80% и 100% этилового спирта в течение 3 минут каждый, и воздух сухой. Изучить слайдовпо морфологии хромосом. Хорошо морфологии хромосом обозначается темно хромосом, а не «фаза-легкие" или гало хромосом.
- Нагрейте датчик SkyPaint (комплект SKY краски; флакон № 1) при 37 ° C при встряхивании в течение 20 мин, вихревые и центрифуги кратко на 1000 оборотов в минуту в течение нескольких секунд.
- Денатурации зонда в Термоциклер запрограммирована на два шага цикла при 85 ° C в течение 5 мин цикл затем 37 ° C в течение 60 минут, чтобы меченый зонд ДНК для preannealing.
- Применение 10 мкл в денатурированный зонд на области гибридизации и крышки с 22 мм х 40 мм, покровного стекла следя, чтобы не поймать пузырьки воздуха. Печать края покровного стекла с цементом резиновых и инкубировать во влажной камере при 37 ° С в течение 48-72 часов.
4. Флуоресцентные обнаружения зонда
- Удалить покровного стекла тщательно и поместить слайд в банке Коплин содержащие нагретого (45 ° C) моющего раствора I (свежеприготовленный 50% формамид в 2Х SSC). Промыть в течение 5 минв три раза при 45 ° С в дрожащей водяной бане 45 мин
- Вымойте слайд в моющем растворе II (1X SSC) при 45 ° С в течение 5 минут два раза при встряхивании.
- Вымойте слайд в моющем растворе III (4X SSC/0.1% Твин-20) в течение 5 мин при 45 ° C при встряхивании.
- Применение 80 мкл блокирующего реагента (комплект SKY краски; флакон № 2), разместить покровное и инкубировать при температуре 37 ° С в течение 30 мин.
- Удалить слайд и позвольте жидкости стечь. Применение 80 мкл Cy5 окрашивания реагентов (концентрированная антител CAD комплект, флакон № 3), применять покровного стекла и инкубировать при температуре 37 ° C в течение 40 мин.
- Вымойте слайд с моющим раствором III при 45 ° С в течение 5 минут три раза при встряхивании.
- Применение 80 мкл Cy5.5 окрашивания реагентов (концентрированная антител CAD комплект, флакон № 4), разместите покровного стекла и инкубировать при температуре 37 ° C в течение 40 мин.
- Вымойте слайд с моющим раствором III при 45 ° С в течение 5 минут три раза при встряхивании.
- Наклоните слайдов и позволяет жидкости процедить. Применение 20 мкл против исчезают DAPI реагента (комплект SKY краски; флакон № 5) и разместить 24 мм х 60 мм микроскопа покровного стекла. Осторожно удалите воздушные пузырьки, которые могли образоваться. Слайды могут быть отображены сразу или хранить при температуре 4 ° С в темноте в течение не более 1 недели.
5. Приобретение и анализа изображений
- Изображение приобретение осуществляется путем просмотра метафазы слайды, используя микроскоп Olympus оснащена объективом 60X иммерсионного масла, Спектральный куба (специально созданных тройной полосовой фильтр), DAPI фильтр и модуль Саньяка интерферометра с ПЗС-камерой.
- Спектрально-Кариотипы проводились Sky View программного обеспечения (прикладного спектрального версии изображения 1.62) после руководстве пользователя.
- После анализа изображений, хромосомы можно рассматривать как цветные изображения (с конкретными флуоресцентные цвета), псевдо-цветное изображение (с цветами для классификации) и перевернутые изображения DAPI (специфические полосы шаблон).
Вся процедура SKY обычно занимает около недели времени (рис. 1). Это включает в себя приобретение и анализа изображений при условии, что метафазных клеток в адекватных поставок. Кариотипирование анализ показывает, нормальным кариотипом мыши (40, XY) клеток от мышей дикого типа (рис. 2а). В отличие от клеток PKD1 - / - мышей (ПКД модели мыши) показывает значительное увеличение числа хромосом и структурные аномалии, такие как удаление хромосом (хромосомы № 8) и транслокации (хромосомы № 11 и 19) (рис. 2б). Мы также проанализировали сосудистых тканей ADPKD пациентов. Простое исследование путем подсчета хромосомных чисел показал, что без ADPKD и некоторые ADPKD сосудистой образцы имели нормальный хромосомный количестве 23 пар (рис. 2). В целом, однако, мы наблюдали провал хромосомной сегрегации, в результате чего 46 пар хромосом вDPKD образцы вместо 23 пар (рис. 2, г).
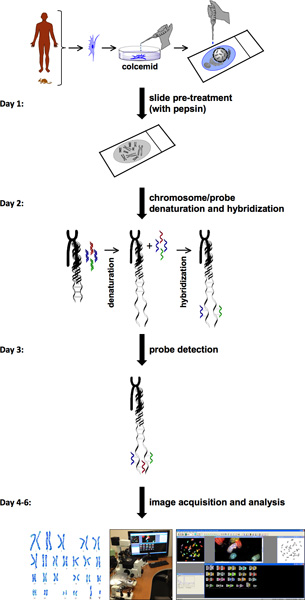
Рисунок 1. SKY протокол блок-схемы. Блок-схема SKY протокол иллюстрирует шаги для завершения эксперимента, начиная с предварительной обработки клеток и метафазных препаратов для захвата изображений и анализа. Приблизительно одну неделю сроки представлены на левой шаг за шагом процедуры каждый день.

Рисунок 2. Спектральное кариотипирование на увековечены мыши клеточных линий и свежевыделенных человека первичных клеток. Цвет и перевернутое изображение DAPI отдельных хромосом представлены до хромосомных сортировки. После сортировки хромосом представлены в "классификации" стол.) SKY образ метафазы распространения дикого типа мыши содержит нормальный кариотип (40, XY). Б) SKY образ метафазы с распространением PKD1 - / -. мышь показывает ненормальное число хромосом (68 вместо 40) и хромосомные аномалии, такие как удаление хромосом (хромосомы № 8) и хромосомные транслокации (хромосомы № 11 и 19) в) SKY Образ метафазы распространение из сосудистой ткани, не ADPKD пациент имеет нормальный кариотип (46, XX). г) SKY образ метафазы распространение из сосудистой ткани ADPKD пациента содержит аномальный кариотип (92, ХХХХ). Часть данных была ранее и используется с ее разрешения 14.
Обсуждение
Спектральный Кариотипирование (SKY) является цитогенетики техника, используемая в изучении генома и хромосомные композиций. Эта техника использует датчики хромосомы живописи, и обнаружение этих зондов, полученных в результате Саньяка интерферометра. Весь процесс SKY обычно занимает ок?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Брайана Мунтян, Шао вот, Маки Такахаши и Блэр Мелл за техническую помощь. Эта работа была поддержана награды от NIH (DK080640) и Университет Толедо и ProMedica Поступательное премии стимулирование исследований доктора Сурья Наули.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| DMEM | CellGro Mediatech Инк | 10-013-CV | |
| Эмбриональной телячьей сыворотки (FBS) | Hyclone | SH30088-03 | |
| Penecillin / стрептомицином | Thermo Scientific | SV30010 | |
| Колцемид | Roche Diagnostics | 10 295 892 001 | 10 мкг / мл |
| HCl | Fisher Scientific | A144-500 | |
| KCl | Fisher Scientific | S77375-1 | |
| Фосфатного буфера | Thermo Scientific | SH30256-01 | |
| SKY краски зонд комплект (Human) | Прикладные спектральных изображений | SKY000028 | |
| SKY краски зонда набор (мышь) | Прикладные спектральных изображений | SKY000030 | |
| Концентрированный комплект обнаружения антител | Прикладные спектральных изображений | SKY000033 | |
| Трипсин | Thermo Scientific | SH30236.01 | |
| Метанол | Fisher Scientific | A433P-4 | |
| Уксусная кислота | Fisher Scientific | A38-212 | |
| РНКазы | Roche Diagnostics | 10 109 169 001 | |
| Пепсин | Sigma-Aldrich | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ML | |
| 37% формальдегида | Mallinckrodt Бейкер | 2106-02 | |
| 20-кратный SSC | Promega | V4261 | |
| Формамид | Fluka | 47671 | готовить непосредственно перед употреблением |
| Твин-20 | Fisher Scientific | BP337-500 | |
| Слайды стекло микроскопа | Fisher Scientific | 12-549 | |
| Микроскоп покровного стекла 24x60mm | VWR Vista, Видение | 16004-312 | |
| Резиновый цемент | Элмер (местный розничный магазин) | ||
| Гибридизация / humidifiedchamber / лоток | Simport | M920-2 | положить мокрые полотенца бумаги на дне |
| Thermoвелосипедист | Эппендорф | Epgradient S | |
| Тряска платформы / Орбитальный шейкер | Bellco биотехнологии | ||
| Тряска / водяной бане | Точность научного | ||
| DAPI фильтр куб | Chroma технологии | ||
| SKY фильтр куб | Chroma технологии | ||
| SpectraCube | Прикладные спектральных изображений | ||
| Инвертированный микроскоп культуре клеток | Nikon | Nikon Eclipse TS100 | |
| Флуоресцентный микроскоп | Олимп | IX70 | 60X нефти |
Ссылки
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены