JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Polycystic 신장 질환과 함께 인간과 마우스의 염색체 이상을 공부하는 스펙트럼 Karyotyping
요약
스펙트럼 Karyotyping (SKY)는 게놈 및 염색체 aberrations를 식별하기위한 고급 cytogenetics의 기술이다. 이 기술은 모든 염색체의 분류를 허용하는 염색체 페인팅 프로브를 이용 걸립니다. 스카이는 또한 polycystic 신장병 등 각종 질병을 가진 생쥐와 인간의 복잡한 염색체 aberrations 및 분리 결함을 식별할 수 있습니다.
초록
식별하고 각각의 염색체를 분류하는 종래의 방법은 1, 2를 분석중인 특정 종족의 각 염색체의 독특한 banding 패턴에 따라 달라집니다. 이것은 고전 banding 기술은 그러나, 그러한 암과 연관된 것과 같은 복잡한 염색체 aberrations을 확인하는 신뢰할 수 없습니다. banding 기술의 한계를 극복하기 위해 스펙트럼 Karyotyping (SKY)는 염색체 이상에 대한 많은 신뢰할 수있는 정보를 제공하기 위해 도입된다.
하늘은 여러 가지 빛깔의의 형광에 원위치 하이브리드화 (물고기) 분광 현미경 3, 4 metaphase 염색체를 감지하는 기술입니다. 하늘이 유전 질환과 malignancies 5, 6의 큰 번호와 연관된 염색체 이상의 광범위한 범위의 cytogenetic 분석에 유용한 도구로 입증되었습니다. 하늘은 타락한 oligonucle에서 준비한 여러 가지 빛깔의 fluorescently-라벨의 DNA 프로브의 사용과 관련된PCR에 의한 otide primers. 따라서, 모든 염색체는 differentially 형광 염료의 혼합물 (Rhodamine, 텍사스 빨강, Cy5, FITC와 Cy5.5)으로 표시되는 프로브와 원위치 하이브리드화 후 독특한 스펙트럼 색상을 가지고 있습니다. SKY에 사용되는 프로브는 7-10 55 번 염색체 특정 프로브에로를 구성됩니다.
SKY에 대한 절차는 여러 단계 (그림 1)을 포함한다. 스카이는 정상이나 병에 걸린 조직이나 혈액에서 높은 mitotic 지수와 세포의 가용성을 필요로합니다. 갓 격리 기본 셀 또는 셀 라인 중 하나에서 단일 세포의 염색체는 유리 슬라이드에 전파됩니다. 이 염색체 확산은 각 염색체의 특정 형광 염료의 다른 조합으로 표시됩니다. 프로브 감지 및 이미지 수집의 경우 스펙트럼 이미징 시스템 sagnac 간섭계와 CCD 카메라로 구성되어 있습니다. 이것은 시료로부터 방출되는 가시 광선 스펙트럼의 측정이 가능하며 오가는 스펙트럼 이미지를 얻기 위해m 각 염색체. HiSKY, 촬영된 이미지의 결과를 분석하는 데 사용되는 소프트웨어는 염색체 이상 현상의 쉬운 식별을 제공합니다. 최종 결과는 metaphase와 염색체의 각 페어는 독특한 컬러 (그림 2)를 가지고있는 핵형 분류 이미지입니다. 이것은 염색체 정체성과 translocations을 쉽게 식별할 수 있습니다. 자세한 내용은 응용 스펙트럼 이미징 홈페이지를 (참조하십시오 http://www.spectral-imaging.com/ ).
스카이는 최근 염색체 분리 결함 및 Autosomal 지배 Polycystic 신장 질환 (ADPKD), 기본 속눈썹 11-13의 장애가 특징 유전 질환과 인간과 생쥐의 염색체 이상의 식별을 위해 사용되었다. 이 기법을 사용하여, 우리는 ADPKD 환자와 마우스 모델 14 비정상적인 염색체 분리 및 염색체 결함의 존재를 증명. SKY를 사용하여 더 자세한 분석은 우리가 염색체 번호와 ID를 식별하는 것이 아니라 정확하게 같은 염색체 삭제 및 translocations (그림 2)와 같은 매우 복잡한 염색체 aberrations를 검색할 수 없습니다 전용.
프로토콜
1. 세포 전처리와 metaphase 준비
- 그들이 70~80%가 confluency 도달할 때까지 세포는 5 % CO 2 배양기로 37 10-15% 태아 소 혈청 (FBS) 및 1퍼센트 페니실린 / 스트렙토 마이신 ° C를 포함하는 이글 배지 (DMEM)의 Dulbecco의 변경 재배하고 있습니다.
- 0.05 μg / 30-60 분 ML에 colcemid 솔루션 세포를 드셔보세요.
- 50-ML 멸균 매의 원심 튜브에 어떤 떠다니는 세포를 포함하는 매체를 수집합니다. sterile1X-PBS로 접시에 세포를 씻어. 1-2 분, 추수와 같은 튜브에 남아있는 세포를 수집을 위해 멸균 트립신과 잠복기 후에.
- 5 분, 1,000 rpm으로 튜브 던가, 뜨는 떠나는 0.5 ML을 대기음 오직 손가락으로 flicking하여 펠렛을 푸세요.
- 펠렛의 크기에 따라, DH 2 O에서 0.56 %의 KCl의 hypotonic 솔루션의 5-10 ML을 추가하고 30-45 분 동안 37 ° C에서 정학을 품어.
- 메탄올 / 초산 한 방울 추가(3시 1분 권 / 권) 당 ML hypotonic 세포 현탁액과 믹싱을 위해 부드럽게 튜브를 바꾸란.
- continously 펠렛을 flicking 동안 5 분 동안 1,200 rpm으로 원심과 스텝 1.4으로 펠렛을 수집 후 신선한 메탄올 / 초산 (3시 1분 권 / 권) 정착액 솔루션 dropwise 5 ML에 추가합니다. 이 절차는 metaphase 확산이 실험에 해가 될 세포 '대단히 짧은 시간에 갇혀되지 않도록 중요합니다.
- 5 분을위한 1,200 rpm으로 다시 원심 분리기와 튜브 벽을 따라 얼음처럼 차가운 메탄올 / 아세트산 정착액의 5-10 ML을 추가합니다. 필요한 경우이 단계에서는, 세포는 단기 또는 -80 용 -20 ° C에서 강화하고 밀폐 튜브에 고정력있는 용액에 저장할 수 ° C에서 나중에 사용할 장기 (년)입니다.
- 절대 에탄올의 클린 슬라이드 다음 슬라이드의 표면에 물을 칼집을 형성하기 위해 approximately10X 대한 DH 2 O의 슬라이드를 찍어. (단계 1.8에서 세포 현탁액의 유리 접시 놓기 15-20μl에 슬라이드를 놓으십시오) "에서 10 슬라이드 위에. 1-2 분 65-70에서 설정 물 목욕 ° C에서 슬라이드를 삽입하고 건조 수 있습니다.
- metaphase의 염색체와 확산이 균등하게 게재됩니다이 확인하는 10X 및 40X 건조 목표를 사용하여 가벼운 현미경 슬라이드를 확인합니다. 염색체를 둘러싼 세포질에 존재를 확인합니다. 세포질은 현재 슬라이드 전처리 (펩신의 소화)을 진행하는 경우에는 세포질이 존재하지 않고 염색체가 좋은 형태가있다면 다음 슬라이드 전처리를위한 필요가 없습니다.
2. 슬라이드 전처리 (펩신 처리)
- X 60mm 현미경의 coverglass 24mm에 2X-SSC에 녹아있는 1:200 RNase 용액 (20 밀리그램 / ML) 120 μl를 적용하고 metaphase 슬라이드 얼굴 반전을 부드럽게 coverglass에 metaphase 슬라이드 얼굴을 아래로 반전과에서 부화 37 ° C 45 분입니다.
- 조심스럽게 15 분 때마다 5 분 슬라이드를 긁적없이 coverglass를 제거하고 coplin 항아리에 2X-SSC 버퍼에 씻어떨고있는.
- 깨끗한 비커에 펩신 주식 솔루션의 5-15 μl (DH 2 O 100 밀리그램 / ML)를 추가하고 prewarmed 100 ML 추가 (를 37 ° C) 0.01M HCL. 그것은 펩신이 깨끗한로 추가되는 것이 중요합니다 직접 HCL 용액으로 먼저하지 비커가, 그렇지 않으면 그것은 용액에 용해되지 것입니다. 37 HCL / 펩신 용액을 포함 coplin 항아리에 슬라이드를 품어 3-5 분 ° C에서. 너무 많은 소화가 염색체가 overdigested되는 원인이되며 너무 적게 소화는 프로브가 아닌 특정 바인딩으로 이어질과 하이브리드화 신호를 방해할 수있는 세포질은 소화되지 않은 떠날하므로이 단계는 매우 중요합니다.
- 상온에서 두 번 5 분 동안 100 ML-1X PBS를 포함 coplin 항아리에 슬라이드를 씻으십시오.
- 실온 (1X-PBS은 950 ML에 1M MgCl 2의 50 ML)에서 5 분 동안 100 ML 1X-PBS/MgCl 2를 포함하는 coplin 항아리에 슬라이드를 씻으십시오.
- coplin 항아리 containin에있는 슬라이드를 삽입실온 (1X-PBS/MgCl 2의 100 ML 37 %의 포름 알데히드의 1.7 ML)에서 10 분 g 100 ML 1 %의 포름 알데히드.
- 5 분 동안 100 ML-1X PBS를 포함 coplin 항아리에 슬라이드를 씻으십시오.
- 슬라이드가 제대로 소화되며 세포질이 존재하지 않고 염색체 형태가 보존되도록 40X 건조한 렌즈를 사용하여 가벼운 현미경 슬라이드를 관찰. 다이아몬드 펜을 사용하여 하이브 리다이 제이션을위한 영역을 선택합니다.
3. 염색체와 프로브 변성과 하이브리드화
- 신선한 denaturing 용액 (70 % formamide/2X SSC, 산도 7.0) 및 70-80까지 prewarm ° C ~ 70 물 목욕에 denaturing 솔루션을 포함하는 coplin 항아리에 슬라이드 물 목욕 장소에 배치 coplin 항아리에 ° 준비 마우스 염색체 80에 해당하는 C ° C ~ 30 대 - 1.5 분 인간의 염색체를위한.
- 바로 3 분 각각의 공기 건조 3 80 % 다음 분 및 100 % 에탄올에 대해 얼음처럼 차가운 70 % 에탄올에 슬라이드를 넣습니다. 슬라이드를 검사염색체 형태입니다. 좋은 염색체 형태는 어두운 염색체가 아닌 "위상 빛"또는 후광 염색체으로 표시됩니다.
- 몇 초 동안 1,000 rpm으로 짧게 20 분, 와동 및 원심 젖는와 37 ° C에서, SkyPaint 프로브 (유리병 # 1 스카이 페인트 키트)를 따뜻하게.
- preannealing 위해 라벨 - 프로브 DNA를 허용하는 60 분 동안 37 ° C이어서 5 분주기 위해 85 ° C에서 두 단계의주기 위해 프로그래밍 thermocycler에 프로브를 변성.
- 22mm와 하이브리드화 및 커버 영역에 변성 프로브의 10μl를 적용 기포를 잡을수 않도록하는 X 40mm의 coverglass. 48-72 시간 동안 37 ° C에서 humidified 챔버의 고무 시멘트와 부화와 coverglass의 가장자리를 밀봉합니다.
4. 형광 프로브 감지
- 신중 coverglass를 제거하고 포함된 coplin 항아리에 슬라이드를 배치 prewarmed (45 ° C) 솔루션을 씻는 I (2X SSC의 신선한 50 % 포름 아미드). 5 분 동안 씻으45 세 번이나 45 rpm으로 흔들어 물을 욕조에 ° C
- 떨고로 5 분 대한 ° C ~ 두번 45 용액 II (1X SSC)를 세척에서 슬라이드를 씻으십시오.
- 45시 5 분에 대한 해결책 III을 (4X SSC/0.1 % 십대 초반 20) 세정 ° C를 흔들어으로 슬라이드를 씻으십시오.
- 차단 시약의 80 μl (스카이 페인트 키트, 유리병 # 2)를 적용, 30 분 동안 37 ° C에서 coverslip과 부화를 놓습니다.
- 슬라이드를 제거하고 액체 드레인 수 있습니다. Cy5 염색법 시약 (고농도 항체 검출 CAD 키트, 유리병 # 3)의 80 μl를 적용, 40 분 동안 37 ° C에서 coverglass과 부화를 적용합니다.
- 떨고으로 5 분 동안 45 ° C에서 세 번 용액 III을 세척과 함께 슬라이드를 씻으십시오.
- Cy5.5 염색법 시약 (고농도 항체 검출 CAD 키트, 유리병 # 4) 80 μl를 적용, 40 분 동안 37 ° C에서 coverglass과 부화를 놓습니다.
- 떨고으로 5 분 동안 45 ° C에서 세 번 용액 III을 세척과 함께 슬라이드를 씻으십시오.
- 슬라이드를 기울이고 유체에 허용 배수. 안티 페이드 DAPI 시약 (스카이 페인트 키트, 유리병 # 5) 20 μl를 적용하고 X 60mm 현미경의 coverglass 24mm 넣으십시오. 조심스럽게 형성했을 수도 기포를 제거합니다. 슬라이드 바로 몇 군데 또는 4에 저장할 수 일주보다 더 이상의 어둠 속에서 ° C에서.
5. 이미지 수집 및 분석
- 이미지 취득 60X 기름 침지 렌즈, CCD 카메라와 스펙트럼 큐브 (사용자 정의 설계된 트리플 밴드 패스 필터), DAPI 필터 sagnac 간섭계 모듈을 갖춘 올림푸스 현미경을 사용하여 metaphase 슬라이드를 보는하여 수행됩니다.
- 스펙트럼-Karyotypes은 사용자의 설명서에 따라 스카이 뷰 소프트웨어 (응용 스펙트럼 이미징 버전 1.62)를 사용하여 수행되었다.
- 이미지를 분석 후, 염색체는 컬러 이미지 (특정 형광 색상), 의사 컬러 이미지 (구분을위한 색상)과 거꾸로 DAPI 이미지 (특정 banding 패턴)로 볼 수 있습니다.
전체 SKY 절차는 일반적으로 일주일에 하루는 시간 (그림 1) 소요됩니다. 이것은 metaphase 세포가 적절한 공급에 한해 이미지 수집 및 분석을 포함합니다. Karyotyping 분석은 야생 형 마우스 (그림 2A)에서 세포의 정상적인 마우스 핵형을 (40, XY) 밝힌다. 반대로, Pkd1의 세포는 - / - 마우스 (PKD 마우스 모델) 염색체 번호와 같은 염색체 삭제 (염색체 # 8)과 translocations (염색체 # 11, 19) (그림 2B)와 같은 구조적 이상에서 상당한 증가를 보여줍니다. 우리는 또한 ADPKD 환자에서 혈관 조직을 분석했다. 염색체 숫자를 계산하여 간단한 연구는 비 ADPKD와 일부 ADPKD 혈관 샘플 23쌍 정상 염색체 숫자 (그림 2C)을 가지고 있다고 지적했다. 그러나 일반적으로, 우리는에서 염색체 46 쌍으로 결과, 염색체 분리의 실패를 관찰DPKD 샘플 대신 23 쌍 (그림 2D).
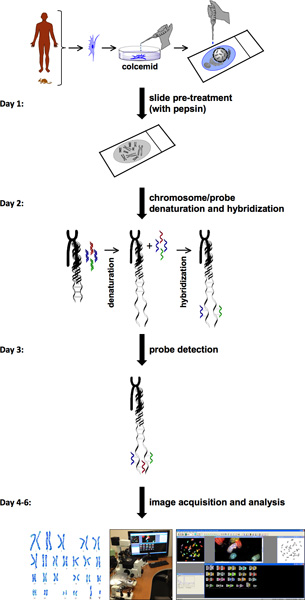
1 그림. SKY 프로토콜 순서도 있습니다. 스카이 프로토콜의 흐름 차트는 이미지 수집 및 분석으로 세포 전처리와 metaphase의 준비부터 실험을 완료하는 단계를 보여줍니다. 대략 1 주일 스케줄은 매일 매일 단계별 절차는 왼쪽에 표시됩니다.

그림 2. 불후의 마우스 세포 라인과 갓 고립된 인간의 일차 세포에 대한 분광 karyotyping가. 색상 및 개별 염색체의 거꾸로 DAPI 이미지는 염색체 정렬하기 전에 표시됩니다. 정렬 후, 염색체는 "분류"테이블에 표시됩니다. 야생 형 마우스 metaphase 확산의) 스카이 이미지 (40, XY) 정상 핵형을 설명합니다. B)이 C) - / -. Pkd1에서 metaphase의 소문의 주인 공인 국영> 스카이 이미지 비 ADPKD 환자의 혈관 조직에서 metaphase의 전파의 이미지는 정상 핵형 (46, XX). d)에 ADPKD 환자의 혈관 조직에서 metaphase 확산의 스카이 이미지 (92, XXXX) 비정상 핵형이 포함되어 있습니다. 데이터의 일부는 이전에보고하고 허가를 14으로 재사용되었습니다.
토론
스펙트럼 Karyotyping (SKY)는 게놈 및 염색체 작곡을 공부에 사용 cytogenetics의 기술이다. 이 기술은 염색체 페인팅 프로브 활용, 이러한 프로브 감지 sagnac 간섭계를 통해 찾았습니다. 전체 SKY 과정은 보통 일주일에 하루는 걸립니다, 그리고 몇 가지 주요 단계 (그림 1)을 포함한다. SKY 먼저 빠디야-내시 외 3 설명한 표준 프로토콜을 사용합니다. 프로토콜은 이후 우리를 포함?...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
저자는 기술 지원을 위해 브라이언 Muntean, Shao 소호, 마키 다카하시와 블레어 MELL 감사드립니다. 이 작품은 NIH (DK080640) 및 박사 Surya Nauli로 톨레도 & ProMedica Translational 연구 자극 수상의 대학에서 수상에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| DMEM | Cellgro Mediatech 주식 회사 | 10-013 - 이력서 | |
| 태아 소 혈청 (FBS) | Hyclone | SH30088-03 | |
| Penecillin / 스트렙토 마이신 | 써모 과학 | SV30010 | |
| Colcemid | 로슈 진단 | 10 295 892 001 | 10 μg / ML |
| HCL | 피셔 과학 | A144-500 | |
| KCl | 피셔 과학 | S77375-1 | |
| 인산염은 염분 버퍼 | 써모 과학 | SH30256-01 | |
| 스카이 페인트 프로브 키트 (인간) | 응용 스펙트럼 이미징 | SKY000028 | |
| 스카이 페인트 프로브 키트 (마우스) | 응용 스펙트럼 이미징 | SKY000030 | |
| 농축 항체 검출 키트 | 응용 스펙트럼 이미징 | SKY000033 | |
| 트립신 | 써모 과학 | SH30236.01 | |
| 메탄올 | 피셔 과학 | A433P-4 | |
| 초산 | 피셔 과학 | A38-212 | |
| RNase | 로슈 진단 | 10 109 169 001 | |
| 펩신 | 시그마 - 올드 리치 | P6887-5G | |
| MgCl 2 | Fluka | 63069-500ML | |
| 37%의 포름 알데히드 | Mallinckrodt 베이커 | 2106-02 | |
| 20X SSC | Promega | V4261 | |
| 포름 아미드 | Fluka | 47,671 | 사용하기 전에 그냥 준비 |
| 십대 초반-20 | 피셔 과학 | BP337-500 | |
| 현미경의 유리 슬라이드 | 피셔 과학 | 12-549 | |
| 현미경 덮개 유리 24x60mm | VWR 비스타 비전 | 16004-312 | |
| 고무 시멘트 | 엘머 (현지 소매점) | ||
| 하이브리드화 / humidifiedchamber / 트레이 | Simport | M920-2 | 하단에 젖은 종이 수건을 넣어 |
| 써모자전거 타는 사람 | Eppendorf | Epgradient S | |
| 플랫폼을 떨고 / 궤도 흔드는 | Bellco 생명 공학 | ||
| 흔들어봐 / 물 목욕 | 정밀 과학 | ||
| DAPI 필터 큐브 | 채도 기술 | ||
| SKY 필터 큐브 | 채도 기술 | ||
| SpectraCube | 응용 스펙트럼 이미징 | ||
| 거꾸로 세포 배양 현미경 | 니콘 | 니콘 이클립스 TS100 | |
| 형광 현미경 | 올림포스 산 | IX70 | 60X 오일 |
참고문헌
- Caspersson, T., Farber, S., Foley, G. E., Kudynowski, J., Modest, E. J., Simonsson, E., Wagh, U., Zech, L. Chemical differentiation along metaphase chromosomes. Experimental Cell Research. 49, 219-222 (1968).
- Seabright, M. A rapid banding technique for human chromosomes. Lancet. 2, 971-972 (1971).
- Padilla-Nash, H. M., Barenboim-Stapleton, L., Difilippantonio, M. J., Ried, T. Spectral karyotyping analysis of human and mouse chromosomes. Nature Protocols. 1, 3129-3142 (2006).
- Schrock, E., Zschieschang, P., O'Brien, P., Helmrich, A., Hardt, T., Matthaei, A., Stout-Weider, K. Spectral karyotyping of human, mouse, rat and ape chromosomes--applications for genetic diagnostics and research. Cytogenetic and Genome Research. 114, 199-221 (2006).
- Padilla-Nash, H. M., Heselmeyer-Haddad, K., Wangsa, D., Zhang, H., Ghadimi, B. M., Macville, M., Augustus, M., Schrock, E., Hilgenfeld, E., Ried, T. Jumping translocations are common in solid tumor cell lines and result in recurrent fusions of whole chromosome arms. Genes, Chromosomes & Cancer. 30, 349-363 (2001).
- Veldman, T., Vignon, C., Schrock, E., Rowley, J. D., Ried, T. Hidden chromosome abnormalities in haematological malignancies detected by multicolour spectral karyotyping. Nature Genetics. 15, 406-410 (1997).
- Karpf, A. R., Matsui, S. Genetic disruption of cytosine DNA methyltransferase enzymes induces chromosomal instability in human cancer cells. Cancer Research. 65, 8635-8639 (2005).
- Matsui, S., Faitar, S. L., Rossi, M. R., Cowell, J. K. Application of spectral karyotyping to the analysis of the human chromosome complement of interspecies somatic cell hybrids. Cancer Genetics and Cytogenetics. 142, 30-35 (2003).
- Nestor, A. L., Hollopeter, S. L., Matsui, S. I., Allison, D. A model for genetic complementation controlling the chromosomal abnormalities and loss of heterozygosity formation in cancer. Cytogenetic and Genome Research. 116, 235-247 (2007).
- Ried, T., Liyanage, M., du Manoir, S., Heselmeyer, K., Auer, K., Macville, M., Schrock, E. Tumor cytogenetics revisited: comparative genomic hybridization and spectral karyotyping. Journal of Molecular Medicine (Berlin, Germany). 75, 801-814 (1997).
- AbouAlaiwi, W. A., Takahashi, M., Mell, B. R., Jones, T. J., Ratnam, S., Kolb, R. J., Nauli, S. M. Ciliary polycystin-2 is a mechanosensitive calcium channel involved in nitric oxide signaling cascades. Circulation Research. 104, 860-869 (2009).
- Nauli, S. M., Alenghat, F. J., Luo, Y., Williams, E., Vassilev, P., Li, X., Elia, A. E., Lu, W., Brown, E. M., Quinn, S. J., Ingber, D. E., Zhou, J. Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nature Genetics. 33, 129-137 (2003).
- Nauli, S. M., Kawanabe, Y., Kaminski, J. J., Pearce, W. J., Ingber, D. E., Zhou, J. Endothelial cilia are fluid shear sensors that regulate calcium signaling and nitric oxide production through polycystin-1. Circulation. 117, 1161-1171 (2008).
- AbouAlaiwi, W. A., Ratnam, S., Booth, R. L., Shah, J. V., Nauli, S. M. Endothelial cells from humans and mice with polycystic kidney disease are characterized by polyploidy and chromosome segregation defects through survivin down-regulation. Human Molecular Genetics. 20, 354-367 (2011).
- Padilla-Nash, H. M., Nash, W. G., Padilla, G. M., Roberson, K. M., Robertson, C. N., Macville, M., Schrock, E., Ried, T. Molecular cytogenetic analysis of the bladder carcinoma cell line BK-10 by spectral karyotyping. Genes, Chromosomes & Cancer. 25, 53-59 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유