A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
رصد الخلية التي تتمتع بحكم ذاتي إيقاعات الساعة اليومية في التعبير الجيني باستخدام مراسلون ضوء بارد وسيفيراز
In This Article
Summary
الساعة البيولوجية تعمل الساعات داخل الخلايا الفردية، أي أنها خلية مستقلة. هنا، نحن تصف طرق لتوليد نماذج على مدار الساعة خلية المستقلة باستخدام غير الغازية، وسيفيراز التكنولوجيا القائمة على تلألؤ بيولوجي في الوقت الحقيقي. خلايا مراسل توفير لين العريكة، ونظم نموذج وظيفي لدراسة علم الأحياء الإيقاعية.
Abstract
في الثدييات، وينظم العديد من جوانب السلوك وعلم وظائف الأعضاء مثل دورات النوم واليقظة والتمثيل الغذائي في الكبد عن طريق الساعات الساعة البيولوجية الداخلية (مراجعة 1،2). والإيقاعية الوقت لحفظ النظام هو الهرمي متعدد مذبذب الشبكة، مع ساعة المركزي الموجود في نواة suprachiasmatic (SCN) مزامنة وتنسيق الساعات خارج SCN والطرفية في أماكن أخرى 1،2. الخلايا الفردية هي وحدات وظيفية للجيل وصيانة إيقاعات الساعة البيولوجية 3،4، وهذه مؤشرات التذبذب من أنواع الأنسجة المختلفة في الكائن الحي على حصة متشابهة بشكل ملحوظ البيوكيميائية آلية تغذية مرتدة سلبي. ومع ذلك، نظرا للتفاعلات على مستوى الشبكة العصبية في SCN ومن خلال العظة، الإيقاعي النظامية على المستوى العضوي، إيقاعات الساعة البيولوجية على المستوى العضوي ليست بالضرورة خلية مستقلة 5-7. دراسات مقارنة للنشاط الحركي التقليدية في الجسم الحي وSCN إإكسبلنتس خارج الجسم، جالذراع التي يوجد مقرها في المقايسات المختبر تسمح لاكتشاف خلية مستقلة العيوب الإيقاعية 5،8. استراتيجيا، خلية النماذج القائمة على أكثر لين العريكة تجريبيا لتوصيف المظهري والاكتشاف السريع للآليات الأساسية على مدار الساعة 5،8-13.
لأن الإيقاع اليومي الحيوية، وهناك حاجة إلى قياسات الطولية العالية لقرار الزمنية لتقييم وظيفة على مدار الساعة. في السنوات الأخيرة، أصبح في الوقت الحقيقي باستخدام تسجيل تلألؤ بيولوجي يراعة luciferase كمراسلة تقنية مشتركة لدراسة الإيقاع اليومي في الثدييات 14،15، لأنه يتيح للفحص لاستمرار وديناميات الجزيئية الإيقاعات. لرصد الخلايا المستقلة إيقاعات الساعة البيولوجية في التعبير الجيني، يمكن عرض صحفيين في الخلايا عن طريق وسيفيراز ترنسفكأيشن عابرة 13،16،17 أو تنبيغ مستقرة 5،10،18،19. نحن هنا وصف بروتوكول تنبيغ مستقرة باستخدام الفيروسة البطيئة بوساطة توصيل الجينات. Tانه نظام ناقلات lentiviral متفوقة على الطرق التقليدية مثل ترنسفكأيشن عابرة وانتقال سلالة الجرثومية بسبب كفاءتها وبراعة: أنه يسمح التنفيذ الفعال والتكامل مستقرة في الجينوم المضيف على حد سواء وعدم تقسيم تقسيم الخلايا 20. مرة واحدة يتم إنشاء خط خلية مراسل، يمكن فحص وظيفة ديناميكية على مدار الساعة من خلال تسجيل تلألؤ بيولوجي. وصفنا لأول مرة جيل من (Per2) P-خطوط مراسل د لوك، ومن ثم تقديم بيانات من هذا وصحفيين الإيقاعية الأخرى. في هذه المقايسات، وتستخدم الخلايا الليفية الماوس 3T3 وU2OS خلايا عظمية الإنسان كنماذج الخلوية. نناقش أيضا سبل مختلفة لاستخدام هذه النماذج على مدار الساعة في الدراسات الإيقاعية. ويمكن تطبيق الأساليب المذكورة هنا لمجموعة كبيرة ومتنوعة من أنواع الخلايا لدراسة أساس الخلوية والجزيئية من الساعات الإيقاعية، وربما تكون مفيدة في معالجة المشاكل في النظم البيولوجية الأخرى.
Protocol
1. بناء مراسلون وسيفيراز Lentiviral
A الثدييات بناء مراسل الإيقاعية يحتوي عادة كاسيت التعبير التي تنصهر مع الساعة البيولوجية أحد المروجين الجين وسيفيراز. ويشيع استخدام استراتيجيات ربط كل وإعادة التركيب القائم على استنساخ الحمض النووي ل. وكمثال على ذلك، ونحن هنا وصف الاستنساخ عبارة إعادة التركيب القائم على طريقة لتوليد (Per2) P-د مراسل لوك lentiviral، الذي وسيفيراز زعزعة الاستقرار (د لوك) تحت سيطرة المروج Per2 الماوس.
- استنساخ Per2 المروج. استخدام PCR لتضخيم الحمض النووي المروج Per2 جزء من 526 سنة مضت، المنبع من النسخ من موقع بداية استنساخ الماوس BAC Per2 9-13، باستخدام التمهيدي إلى الأمام (5'-TC-3 CTCGAGCGGATTACCGAGGCTGGTCACG ') وعكس التمهيدي (5' CTCGAGTCCCTTGCTCGGCCCGTCAC-TTGG-3 ')، واستنساخ في pENTR5'-TOPO مكافحة ناقلات (إينفيتروجن) لتوليدpENTR5'-P (Per2).
- استنساخ لوك د. ولوك د يحتوي على الجينات وسيفيراز اليراع وتسلسل PEST C-محطة لتدهور البروتين السريع كما هو موضح سابقا 21. استخدام PCR لتضخيم جزء د DNA لوك، واستنساخ في pENTR / D-TOPO مكافحة ناقلات (إينفيتروجن) لتوليد pENTR / يوم لوك.
- بناء ناقلات مراسل. مزج البلازميدات pENTR اثنين، pENTR5'-P (Per2) ولوك pENTR / يوم، مع ناقلات lentiviral جهة pLV7 بي إس دي (BSD، blasticidin الجينات المقاومة)، وتنفيذ أعمال إعادة التركيب باستخدام Clonase رد فعل لإنشاء pLV7-BSD-P (Per2)-د مراسل لوك (الشكل 1). pLV7-BSD هو نسخة معدلة (صنع في مختبرنا) من pLenti6/R4R2/V5-DEST (إينفيتروجن) التي أدرجت في الفيروس التهاب الكبد الفأر الجبلي بعد النسخي التنظيمية عنصر (WPRE) تسلسل 22 على الفور المصب من كاليفورنيا التعبير ssette لتعزيز التعبير الجيني.
2. انتاج جسيمات Lentiviral
1. خلايا البذور 293T (اليوم 1)
- تنمو الكلى الجنينية البشرية (HEK) 293T الخلايا لالتقاء 90-100٪ في DMEM تستكمل مع FBS العادية 10٪ و1X-البنسلين الستربتوميسين-الجلوتامين (PSG) في 10 سم الأطباق الثقافة. (الخلايا سريعة النمو مع مرور عدد منخفضة بالغة الأهمية بالنسبة لكفاءة ترنسفكأيشن.)
- قبل البذر الخلايا لوحات ترنسفكأيشن، ومعطف الثقافة 6 جيدا بإضافة 1 مل من 0.001٪ بولي-L-يسين في كل بئر إلى PBS واحتضان في درجة حرارة الغرفة لمدة 20 دقيقة. نضح الحل وشطف مرة واحدة مع برنامج تلفزيوني 1X قبل الاستخدام.
- فصل الخلايا 293T مع التربسين والبذور 0،75 × 10 6 خلايا على كل بئر من لوحات ما قبل المغلفة مع DMEM 2 مل العادية. دوامة لوحات بدقة للحصول على توزيع عادل للخلايا في كل بئر. تنمو الخلايا في الحاضنة عند 37 درجة مئوية خلال الليل.
- مراقبة الخلايا المصنفة من يوم 1. يجب أن تصل إلى الخلية التقاء 80-90٪.
- إعداد البلازميد مزيج ترنسفكأيشن في أنبوب مل ميكروسنتريفوج 1،5 بإضافة 2 ميكروغرام من الحمض النووي البلازميد lentiviral مراسل (على سبيل المثال، pLV7-P (Per2)-د لوك؛ ليو المختبر) وناقلات التعبئة والتغليف 3 (1.3 ميكروغرام الكمامة / بول، 0.5 ميكروغرام مراجعة، و 0.7 ميكروغرام VSVG؛ إينفيتروجن). كعنصر تحكم لكلا ترنسفكأيشن والعدوى اللاحقة، ونحن عادة ما تشمل بئر إضافية في ترنسفكأيشن لناقلات GFP التعبير lentiviral، pLV156-CMV-EGFP (الشكل 1A)، وإيواء تعزيز بروتين الفلورية الخضراء (EGFP) تحت سيطرة المروج CMV كما هو موضح سابقا 20.
- إضافة 100 ميكرولتر من CaCl M 0.25 2 (المخفف مع الدناز / ريبونوكلياز خالية DDH O 2 من المخزون M 2.5) إلى المزيج البلازميد في الخطوة 2 ويخلط جيدا. إضافة ميكرولتر من ثم 100 2X حل BBS (50 ملم BES، 280 مم كلوريد الصوديوم، 1.5 مم نا 2 HPO 4، درجة الحموضة 6.95) والمزيج بلطف ولكن بدقة. احتضان هذا المزيج DNA في درجة حرارة الغرفة لمدة 15 دقيقة.
- أثناء انتظار، نضح المتوسطة من الخلايا 293T وتغيير والمتوسطة 2 مل الطازجة. العودة إلى لوحة الحاضنة لا يقل عن 10 دقيقة للتوازن درجة الحموضة المتوسطة قبل ترنسفكأيشن.
- إضافة مزيج ترنسفكأيشن من الخطوة 3 إلى انخفاض الخلايا 293T قطرة. دوامة لوحة بلطف ومراقبة تشكيل الجسيمات تحت المجهر. احتضان عند 5٪ CO 2، 37 ° C بين عشية وضحاها. (الجسيمات الجميلة تشكيل راسب من 4 كابو / DNA هو أمر حاسم لترنسفكأيشن كفاءة.)
3. الجسيمات الفيروسية الحصاد (3-4 أيام)
- حوالي 16 ساعة بعد ترنسفكأيشن (اليوم 3) من الخلايا التي ينبغي أن تصل إلى نقطة التقاء الوقت 100٪، نضح المتوسطة من الخلايا واستبدال مع 2 مل DMEM العادية الطازجة. احتضان عند 37 درجة مئوية خلال الليل.
- في يوم 4، تقييم الكفاءة ترنسفكأيشن من خلال مراقبة التعبير في EGFP ترانالخلايا السيطرة sfection (الكفاءة ترنسفكأيشن من 90-100٪ مع ارتفاع EGFP التعبير هو مؤشر موثوق بها من الإعدادية فيروسية جيدة.)
- جمع المتوسطة تحتوي على جسيمات فيروسية معدية يفرز. أجهزة الطرد المركزي في XG 2000> لمدة 5 دقائق لإزالة الخلايا المتبقية وجمع 293T طاف الفيروسات التي تحتوي على. وبدلا من ذلك، قد يتم مسح المتوسطة مع فلتر ميكرون الغشاء 0.45. الجسيمات الفيروسية هي جاهزة للاستخدام في العدوى.
3. إصابة خلايا 3T3
1. خلايا البذور 3T3 (اليوم 3)
انقسام وعدد البذور المناسبة (~ 12،000) من الخلايا 3T3 على طبق 12-جيدا للحصول على 20-30٪ من التقاء اليوم التالي. احتضان عند 37 درجة مئوية خلال الليل.
2. تصيب الخلايا 3T3 (يوم 4)
- مراقبة خلايا المصنف. هو المطلوب التقاء 20-30٪ (أقل من 50٪) للإصابة.
- إضافة إلى polybrene تركيز النهائي من 5 ميكروغرام / مل إلى جمع المتوسطة التي تحتوي على فيروساتالجسيمات. مزيج جيد من قبل pipetting.
- نضح المتوسطة من الخلايا 3T3، وإضافة 1 مل من خليط من فيروسات أعلاه لكل بئر. احتضان عند 37 درجة مئوية خلال الليل. (يتم استخدام Polybrene لتعزيز كفاءة عدوى، ولكن غير مطلوب على الاطلاق. لأنها قد تكون سامة للبعض الخلايا، فمن المستحسن اختبار مسبق.)
3. حدد الخلايا المصابة (يوم 5 وما بعده)
- أربع وعشرين ساعة بعد الإصابة، نضح المتوسطة التي تحتوي على الفيروسات والخلايا المصابة من polybrene، وغسل مرة واحدة مع برنامج تلفزيوني 1X، وتغيير والمتوسطة الطازجة. احتضان عند 37 درجة مئوية خلال الليل لالانتعاش والنمو.
- عندما متموجة (عادة 1-2 أيام في وقت لاحق)، وتقسيم الخلايا واحتضان عند 37 درجة مئوية خلال الليل.
- transduced في اليوم التالي والمتوسطة الرشفة من الخلايا (هو المطلوب <التقاء 50٪) ويستعاض عنها المتوسطة الطازجة تحتوي على 10 ميكروغرام / مل Blasticidin لتحديد ثابت لالخلايا. (Blasticidin قتل منحنى يحتاج إلى تحديد تجريبيا للحصول على خط خلية معينة.) تغيير إلى متوسطة جديدة تحتوي على Blasticidin كل 2-3 أيام لاختيار المستمر لخلايا المقاومة للمضادات الحيوية معربا عن صحفيين ساعة (عادة 4-6 أيام المجموع).
4. تسجيل تلألؤ بيولوجي من الخلايا مراسل
1. خلايا البذور مراسل
نشر خلايا مقاومة للBlasticidin مراسل وتقسيم على الأطباق الثقافة 35-مم. احتضان في C ° 37 حتى متموجة. نحن نستعد عادة ≥ 3 أطباق لكل مراسل خط الخلية تحت كل حالة لphenotyping الإيقاعية.
2. التزامن والتغيير إلى تسجيل المتوسط
- نضح المتوسطة من الخلايا مراسل متموجة، وغسل مرة واحدة مع برنامج تلفزيوني، واستبدال DMEM تحتوي على 10 ميكرومتر forskolin (أو 200 نانومتر ديكساميثازون). احتضان في C ° 37 لمدة 1 ساعة لمزامنة الخلايا. (بدلا من ذلك، يمكن مزامنة الخلايا عن طريق دورات درجة حرارة 23 أو صدمة المصل 24.)
- في انتظار، وإعداد سجلجي المتوسطة للخلايا 3T3 على النحو التالي: 1X DMEM (HyClone) تحتوي على 10٪ FBS، 1X القلم / بكتيريا / GLN، 1 ميكرومتر forskolin، 1 ملم وسيفيرين، 25 ملم HEPES، ودرجة الحموضة 7.4. يمكن تحديد المصل وتركيز forskolin تجريبيا. لخلايا قاتمة جدا، يمكن استخدام الفينول الحمراء الخالية من المتوسط.
- في نهاية العلاج forskolin، نضح المتوسطة واستبدالها مع تسجيل المتوسط الطازجة.
3. تسجيل تلألؤ بيولوجي من الخلايا مراسل
- بعد تغيير المتوسطة، تغطية أطباق الثقافة مع coverslips 40 ملم وختم العقيمة في مكان مع الشحوم فراغ لمنع التبخر.
- تحميل الأطباق على لluminometer LumiCycle، التي يتم الاحتفاظ داخل الحاضنة في مجموعة C ° 36 دون H 2 O CO 2 أو.
- بدء التسجيل في الوقت الحقيقي تلألؤ بيولوجي. عادة نسجل ايقاعات لمدة 1 أسبوع، تليها تغير المتوسطة والتسجيل المتواصل لمدة أسبوع الثاني (انظر سافيليف وآخرون للحصول على التفاصيل) 25. (للتسجيل ونحن-96لوحات ليرة لبنانية، تم استخدام التآزر SL2 كجهاز تسجيل، وانظر مناقشة 1.1 ل التفاصيل).
5. تحليل البيانات وعرضها
خلايا مراسل تسهيل تسجيل عالية الدقة التلألؤ الكمي، وهو أمر حاسم لتحديد آثار المظهري على وظيفة الساعة البيولوجية على مدار الساعة. للحصول على المعلمات بما في ذلك المرحلة الإيقاعية، وطول الفترة، السعة الإيقاع، ومعدل التخميد، ونحن نستخدم برنامج تحليل LumiCycle (Actimetrics) لتحليل البيانات تلألؤ بيولوجي 5،14. لفترة وجيزة، والبيانات الخام هي الأساس جاهزة الأولى، ومجهزة بخطوط الأساس تطرح البيانات إلى موجة جيبية، والتي يتم تحديد المعايير. للعينات التي تظهر الإيقاعات الثابتة، والخير من بين نوبة> وعادة ما يتحقق 90٪. بسبب تلألؤ بيولوجي عابرة عالية على تغيير المتوسطة، عادة ما استثنينا في الجولة الأولى من البيانات من التحليل.
لعرض البيانات، ونحن عادة رسم البيانات الخام (تلألؤ بيولوجي، تعول / ثانية) ضد منظمة الشفافية الدوليةلي (الأيام). عند الضرورة، يمكن رسم البيانات الأساسية، تطرح لمقارنة السعة والمرحلة.
6. ممثل النتائج
1. المرحلة الخاصة للصحفيين الساعة البيولوجية
يستند الساعة اليومية على آلية تغذية مرتدة سلبي البيوكيميائية 1. رد الفعل الأساسية يتكون من تفعيل النسخي BMAL1 وCLOCK، والقمع واستعراضات النفقات CRYS، والتي تعمل على العناصر الإيقاعية محسن E / E'بوكس لإنتاج الإيقاعي التعبير الجيني (مع المرحلة الصباح، على سبيل المثال، القس-α إرب). الحلقة الأساسية ينظم ويدمج ما لا يقل عن اثنين آخرين الإيقاعية رابطة الدول المستقلة، عناصر، العنصر DBP/E4BP4 ملزمة (D-مربع؛ للمرحلة اليوم، على سبيل المثال، Per3) وعنصر ROR / REV-إرب ملزمة (RRE؛ للمرحلة الليل، على سبيل المثال، Bmal1) 17. يمكن تنظيم الساعة البيولوجية اندماجي من قبل عناصر متعددة المراحل المتوسطة توليد الرواية. على سبيل المثال، Cry1 transcripوتوسطت نشوئها من قبل جميع العناصر الثلاثة الإيقاعية (عناصر أي، E / E'مربع وD-مربع في المروج وRREs في إنترون الأول من الجينات Cry1)، مما أدى إلى مرحلة متميزة في الوقت مساء Cry1 13.
بناء على هذه الآليات من تنظيم الجينات، ولدت لدينا أربعة بنيات مختلفة مراسل: P (Per2)-P د لوك و(Cry1)-د صحفيين لوك تحتوي على كل من E / E'مربع ومربع D-العناصر التنظيمية في المنطقة 17، 26،27؛ P (Cry1) - إنترون-D لوك تمثل التنظيم اندماجي جميع العناصر الثلاثة (أي، E / E'بالغرف، D-مربع، وRRE) 13،17، وP (Bmal1)-د لوك التنظيم حصريا RRE 9،17،19،21. قدمنا هذه صحفيين في الخلايا لإنتاج 3T3 المراحل المتوقعة متميزة التعبير مراسل (الشكل 2).
2. ضربة قاضية الجينات عبر رني وموارد الوراثية الحيوانية عقاقيريهاء المركبات
عندما كفاءة عالية ترنسفكأيشن، يمكن سيرنا الاصطناعية عابر في الخلايا لاسقاط التعبير الجيني. عندما ترنسفكأيشن من الصعب من الناحية الفنية، يمكن التعبير متجه shRNA يكون transduced ثابت في الخلايا عن طريق العدوى lentiviral، بحيث تتم معالجة shRNA التي تنتجها الخلية لسيرنا ضربة قاضية لجين (KD). هنا نقدم الآثار KD من Cry1 وCry2 الجينات في الخلايا باستخدام سيرنا U2OS (الشكل 3A) وshRNA في الخلايا 3T3 باستخدام تعبير بوابة pLL3.7 ناقلات 9 (الشكل 3B). بالإضافة إلى خلايا 3T3، أصبح نموذج بارز آخر U2OS نموذج ساعة الخلوية إلى حد كبير لأنه يلبي المتطلبات الرئيسية لالفرز الفائق الإنتاجية المتاحة تجاريا من المكتبات سيرنا الإنسان (على سبيل المثال، والأصل الإنسان، قادرة على توليد إيقاعات الساعة البيولوجية قوية، وظيفة التحقق من صحة من جميع جينات الساعة المعروفة، وقابلة للترنسفكأيشن كفاءة عالية والكمية تسجيل التلألؤ). في كل أنواع الخلايا، أدى رني بوساطة KD في الظواهر على مدار الساعة بما يتفق مع خروج المغلوب الماوس السابقة (KO) والخلوية الدراسات KD 5،10،11،28. على سبيل المثال، Cry1 الفترة يقصر طول KD ويقلل استمرار الإيقاع، في حين Cry2 KD يطيل الفترة. وبالإضافة إلى ذلك، يمكن استخدام جزيئات صغيرة مختارة لهدف عقاقيري والتشويش على وظيفة البروتين (الشكل 3C).
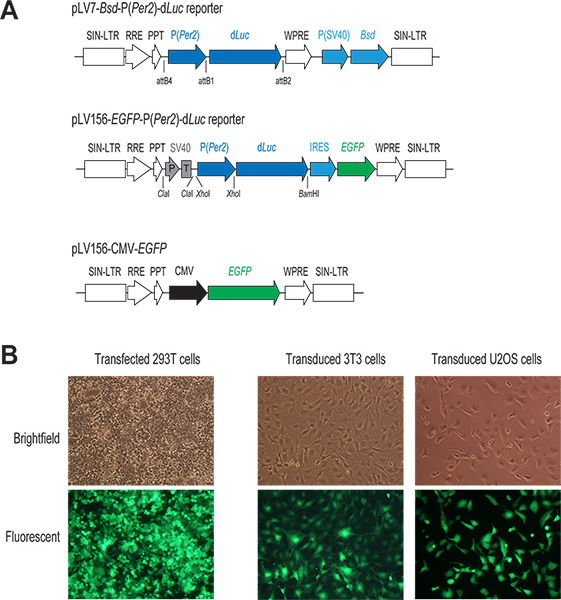
الشكل 1. تسليم الجينات الفيروسة البطيئة بوساطة النظام. (A) رسم تخطيطي لاثنين P lentiviral (Per2)-د ناقلات مراسل لوك وCMV-EGFP بناء. حيث يظهر ذلك فقط في المنطقة للاندماج في الجينوم المضيف الخلية. في كل من يبني مراسل، ونسخ لوك د تحت السيطرة المباشرة للمروج Per2. في بي إس دي pLV7-P (Per2)-د ناقلات لوك (إعادةتركيبة القائمة على استنساخ)، مقاومة Blasticidin coexpressed الجين (BSD) يسهل تحديد الخلايا المصابة. في P-pLV156 (Per2)-د لوك ناقلات (ربط القائم على استنساخ)، وتوسط EGFP الترجمة عن طريق موقع الريبوسوم دخول الداخلية (IRES) من المصب لوك د، مما يسمح للالملاحظة البصرية وFACS فرز الخلايا المصابة. وبالإضافة إلى ذلك، ويتم استخدام SV40 المروج / فاصل (P / T) بمثابة عازل (انظر المناقشة 1.3). في مكافحة ناقلات CMV-EGFP، EGFP التعبير تحت السيطرة من المروج CMV قوية. (B) من الصور نيون، معربا عن GFP بالنقل والخلايا المصابة. عادة، ونحن تحقيق كفاءة عالية سواء في ترنسفكأيشن عابرة من الخلايا 293T والعدوى في lentiviral من خطوط الخلايا من مصلحتنا، كما يتضح من التعبير GFP في هذه الخلايا. اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 2. المرحلة الخاصة من التعبير للصحفيين تلألؤ بيولوجي في الخلايا 3T3 وناقلات lentiviral مراسل المستخدمة في هذه التجربة هي pLV7-BSD-P (Per2)-د لوك، P (Cry1)-د لوك، P (Cry1) - إنترون د لوك، وP (Bmal1)-د لوك. يسلك كل مرحلة مراسل متميزة من التذبذب، كما يتضح من الأسهم. في حين أن Per2 وCry1 تلألؤ بيولوجي محرك المروجين الذروة في الصباح يوم مراحل والمروج Bmal1 في مرحلة ليلة، والتنظيم من قبل اندماجي P (Cry1) - إنترون إيواء E-مربع، مربع D-، وعناصر RRE يمنح مرحلة الذروة مساء تلألؤ بيولوجي . اضغط هنا لمشاهدتها بشكل اكبر شخصية .
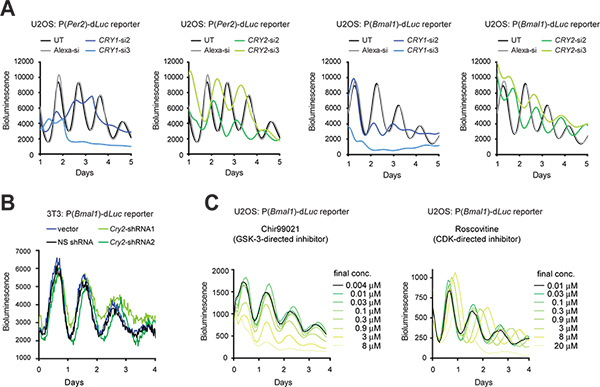
الشكل 3. الجينية والدوائية من اضطراب الإيقاعات اليومية في الخلايا تلألؤ بيولوجي مراسل. (A) آثار Cry1 وCry2 ضربة قاضية من قبل siRNAs على إيقاعات الخلوية للخلايا مراسل U2OS. تم استخدام luminometer LumiCycle لتسجيل تلألؤ بيولوجي من الخلايا في أطباق 35 ملم. ويتم تكييف الرقم من مرجع رقم 10، بإذن من السيفير (2009). (B) آثار ضربة قاضية من قبل Cry2 shRNAs على إيقاعات الخلوية للخلايا مراسل 3T3. تم استخدام ناقلات بوابة pLL3.7 يحتوي على راديو كاسيت U6-shRNA لضربة قاضية الجينات Cry2. shRNA2 لديه كفاءة أفضل ضربة قاضية من shRNA1 على النحو الذي يحدده تحليل لطخة غربية (المعطيات غير معروضة). تم استخدام luminometer التآزر لتسجيل تلألؤ بيولوجي من الخلايا في لوحة 96-أيضا. إعدادات التسجيل على النحو التالي:. حاضنة درجة حرارة و 33 ° C؛ الوقت التكامل، 15 ثانية؛ الوقت الفاصل الزمني، و 30 دقيقة (C) آثار مثبطات جزيء صغير على سلlular إيقاعات من الخلايا مراسل U2OS. Chir99021 وRoscovitine هي مثبطات الموجهة ضد GSK-3 وCDK، على التوالي. تم استخدام نظام ViewLux (Chir99021 مقايسة) وluminometer TECAN (Roscovitine الفحص) للتسجيلات تلألؤ بيولوجي من الخلايا في 384 لوحات جيدة. ويتم تكييف الرقم المرجعي من رقم 19 (حقوق الطبع محفوظة 2008 الأكاديمية الوطنية للعلوم، الولايات المتحدة الأمريكية). اضغط هنا لمشاهدتها بشكل اكبر شخصية .
Discussion
1. تعديلات على البروتوكول الحالي
أجهزة تسجيل 1.1 و اعتبارات الإنتاجية
بسبب توافر التجاري، أصبح LumiCycle (Actimetrics) الأكثر شيوعا جهاز luminometer الآلي في الوقت الحقيقي تسجيل 4،5،9،19،29-31. وتوظف LumiCycle أناب...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل في جزء من المؤسسة الوطنية للعلوم (IOS-0920417) (ACL).
Materials
| اسم كاشف | شركة | كتالوج رقم | تعليقات |
| DMEM | HyClone | SH30243FS | لنمو الخلايا العادية |
| DMEM | إينفيتروجن | 12100-046 | لluminometry |
| FBS | HyClone | SH3091003 | |
| القلم / بكتيريا / GLN (100X) | HyClone | SV3008201 | |
| B-27 | إينفيتروجن | 17504-044 | |
| D-وسيفيرين | Biosynth | L-8220 | |
| بولي يسين-L- | سيجما | P4707 | |
| Polybrene | ميليبور | TR-1003-G | |
| Forskolin | سيجما | F6886 | |
| جميع المواد الكيميائية الأخرى | سيجما | ||
| معدات | |||
| زراعة الأنسجة حاضنة | CO2 5٪ عند 37 ° C | ||
| زراعة الأنسجة هود | BSL-2 مصدقة | ||
| ضوء الفلورسنت والمجهر | على النقيض مرحلة اختيارية | ||
| LumiCycle | Actimetrics |
References
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Hastings, M. H., Reddy, A. B., Maywood, E. S. A clockwork web: circadian timing in brain and periphery, in health and disease. Nat. Rev. Neurosci. 4, 649-661 (2003).
- Nagoshi, E. Circadian gene expression in individual fibroblasts: cell-autonomous and self-sustained oscillators pass time to daughter cells. Cell. 119, 693-705 (2004).
- Welsh, D. K. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Curr. Biol. 14, 2289-2295 (2004).
- Liu, A. C. Intercellular coupling confers robustness against mutations in the SCN circadian clock network. Cell. 129, 605-616 (2007).
- Kornmann, B. System-driven and oscillator-dependent circadian transcription in mice with a conditionally active liver clock. PLoS Biol. 5, e34 (2007).
- Hogenesch, J. B., Herzog, E. D. Intracellular and intercellular processes determine robustness of the circadian clock. FEBS Lett. 585, 1427-1434 (2011).
- DeBruyne, J. P., Weaver, D. R., Reppert, S. M. Peripheral circadian oscillators require CLOCK. Curr. Biol. 17, 538-539 (2007).
- Liu, A. C. Redundant function of REV-ERBalpha and beta and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms. PLoS Genet. 4, e1000023 (2008).
- Zhang, E. E. A genome-wide RNAi screen for modifiers of the circadian clock in human cells. Cell. 139, 199-210 (2009).
- Baggs, J. E. Network features of the mammalian circadian clock. PLoS Biol. 7, e52 (2009).
- Hirota, T. High-throughput chemical screen identifies a novel potent modulator of cellular circadian rhythms and reveals CKIalpha as a clock regulatory kinase. PLoS Biol. 8, e1000559 (2010).
- Ukai-Tadenuma, M. Delay in feedback repression by cryptochrome 1 is required for circadian clock function. Cell. 144, 268-281 (2011).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Sato, T. K. Feedback repression is required for mammalian circadian clock function. Nat. Genet. 38, 312-319 (2006).
- Ueda, H. R. System-level identification of transcriptional circuits underlying mammalian circadian clocks. Nat. Genet. 37, 187-192 (2005).
- Brown, S. A. The period length of fibroblast circadian gene expression varies widely among human individuals. PLoS Biol. 3, e338 (2005).
- Hirota, T. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc. Natl. Acad. Sci. U.S.A. 105, 20746-20751 (2008).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat. Protoc. 1, 241-245 (2006).
- Ueda, H. R. A transcription factor response element for gene expression during circadian night. Nature. 418, 534-539 (2002).
- Zufferey, R., Donello, J. E., Trono, D., Hope, T. J. Woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors. J. Virol. 73, 2886-2892 (1999).
- Buhr, E. D., Yoo, S. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330, 379-385 (2010).
- Balsalobre, A., Damiola, F., Schibler, . U.A serum shock induces circadian gene expression in mammalian tissue culture cells. Cell. 93, 929-937 (1998).
- Savelyev, S. A., Larsson, K. C., Johansson, A., Lundkvist, G. B. S. Slice Preparation, Organotypic Tissue Culturing and Luciferase Recording of Clock Gene Activity in the Suprachiasmatic Nucleus. J. Vis. Exp. (48), e2439 (2011).
- Akashi, M., Ichise, T., Mamine, T., Takumi, T. Molecular mechanism of cell-autonomous circadian gene expression of Period2, a crucial regulator of the mammalian circadian clock. Mol. Biol. Cell. 17, 555-565 (2006).
- Ohno, T., Onishi, Y., Ishida, N. A novel E4BP4 element drives circadian expression of mPeriod2. Nucleic Acids Res. 35, 648-655 (2007).
- Maier, B. A large-scale functional RNAi screen reveals a role for CK2 in the mammalian circadian clock. Genes Dev. 23, 708-718 (2009).
- Yoo, S. H. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc. Natl. Acad. Sci. U.S.A. 101, 5339-5346 (2004).
- Liu, A. C., Lewis, W. G., Kay, S. A. Mammalian circadian signaling networks and therapeutic targets. Nat. Chem. Biol. 3, 630-639 (2007).
- Ko, C. H. Emergence of noise-induced oscillations in the central circadian pacemaker. PLoS Biol. 8, e1000513 (2010).
- Izumo, M., Johnson, C. H., Yamazaki, S. Circadian gene expression in mammalian fibroblasts revealed by real-time luminescence reporting: temperature compensation and damping. Proc. Natl. Acad. Sci. U.S.A. 100, 16089-16094 (2003).
- Izumo, M., Sato, T. R., Straume, M., Johnson, C. H. Quantitative analyses of circadian gene expression in mammalian cell cultures. PLoS Comput. Biol. 2, e136 (2006).
- Chen, Z. Identification of diverse modulators of central and peripheral circadian clocks by high-throughput chemical screening. Proc. Natl. Acad. Sci. U.S.A. 109, 101-106 (2011).
- Yamaguchi, S. Synchronization of cellular clocks in the suprachiasmatic nucleus. Science. 302, 1408-1412 (2003).
- Akashi, M., Hayasaka, N., Yamazaki, S., Node, K. Mitogen-activated protein kinase is a functional component of the autonomous circadian system in the suprachiasmatic nucleus. J. Neurosci. 28, 4619-4623 (2008).
- Hoshino, H., Nakajima, Y., Ohmiya, Y. Luciferase-YFP fusion tag with enhanced emission for single-cell luminescence imaging. Nat. Methods. 4, 637-639 (2007).
- Asai, M. Visualization of mPer1 transcription in vitro: NMDA induces a rapid phase shift of mPer1 gene in cultured SCN. Curr. Biol. 11, 1524-1527 (2001).
- Wilsbacher, L. D. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc. Natl. Acad. Sci. U.S.A. 99, 489-494 (2002).
- Yamazaki, S. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Welsh, D. K., Noguchi, T., Yuste, R. Cellular bioluminescence imaging. Imaging: A Laboratory Manual. , 369-385 (2011).
- Nakajima, Y. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, e10011 (2010).
- Guilding, C. A riot of rhythms: neuronal and glial circadian oscillators in the mediobasal hypothalamus. Mol. Brain. 2, 28 (2009).
- O'Neill, J. S. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Fuller, P. M., Lu, J., Saper, C. B. Differential rescue of light- and food-entrainable circadian rhythms. Science. 320, 1074-1077 (2008).
- Mukherjee, S. Knockdown of Clock in the ventral tegmental area through RNA interference results in a mixed state of mania and depression-like behavior. Biol. Psychiatry. 68, 503-511 (2010).
- Saijo, K. A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death. Cell. 137, 47-59 (2009).
- Elias, G. M. Synapse-specific and developmentally regulated targeting of AMPA receptors by a family of MAGUK scaffolding proteins. Neuron. 52, 307-320 (2006).
- Isojima, Y. CKIepsilon/delta-dependent phosphorylation is a temperature-insensitive, period-determining process in the mammalian circadian clock. Proc. Natl. Acad. Sci. U.S.A. 106, 15744-15749 (2009).
- Bucan, M., Abel, T. The mouse: genetics meets behaviour. Nat. Rev. Genet. 3, 114-123 (2002).
- Hughes, M. E. Harmonics of circadian gene transcription in mammals. PLoS Genet. 5, e1000442 (2009).
- Atwood, A. Cell-autonomous circadian clock of hepatocytes drives rhythms in transcription and polyamine synthesis. Proc. Natl. Acad. Sci. U.S.A. 108, 18560-18565 (2011).
- Panda, S. Coordinated transcription of key pathways in the mouse by the circadian clock. Cell. 109, 307-320 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved