Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мониторинг Cell-автономных циркадные ритмы часы экспрессии гена люциферазы Использование Репортеры Биолюминесценция
В этой статье
Резюме
Суточные часы функционировать в рамках отдельных клеток, т. е. они являются клетки-автономные. Здесь мы опишем методы для создания клеточного часов автономной модели с помощью неинвазивного, люциферазы основе в режиме реального времени биолюминесценции технологии. Репортер клетки обеспечивают послушный, функциональных систем моделью для изучения циркадных биологии.
Аннотация
In mammals, many aspects of behavior and physiology such as sleep-wake cycles and liver metabolism are regulated by endogenous circadian clocks (reviewed1,2). The circadian time-keeping system is a hierarchical multi-oscillator network, with the central clock located in the suprachiasmatic nucleus (SCN) synchronizing and coordinating extra-SCN and peripheral clocks elsewhere1,2. Individual cells are the functional units for generation and maintenance of circadian rhythms3,4, and these oscillators of different tissue types in the organism share a remarkably similar biochemical negative feedback mechanism. However, due to interactions at the neuronal network level in the SCN and through rhythmic, systemic cues at the organismal level, circadian rhythms at the organismal level are not necessarily cell-autonomous5-7. Compared to traditional studies of locomotor activity in vivo and SCN explants ex vivo, cell-based in vitro assays allow for discovery of cell-autonomous circadian defects5,8. Strategically, cell-based models are more experimentally tractable for phenotypic characterization and rapid discovery of basic clock mechanisms5,8-13.
Because circadian rhythms are dynamic, longitudinal measurements with high temporal resolution are needed to assess clock function. In recent years, real-time bioluminescence recording using firefly luciferase as a reporter has become a common technique for studying circadian rhythms in mammals14,15, as it allows for examination of the persistence and dynamics of molecular rhythms. To monitor cell-autonomous circadian rhythms of gene expression, luciferase reporters can be introduced into cells via transient transfection13,16,17 or stable transduction5,10,18,19. Here we describe a stable transduction protocol using lentivirus-mediated gene delivery. The lentiviral vector system is superior to traditional methods such as transient transfection and germline transmission because of its efficiency and versatility: it permits efficient delivery and stable integration into the host genome of both dividing and non-dividing cells20. Once a reporter cell line is established, the dynamics of clock function can be examined through bioluminescence recording. We first describe the generation of P(Per2)-dLuc reporter lines, and then present data from this and other circadian reporters. In these assays, 3T3 mouse fibroblasts and U2OS human osteosarcoma cells are used as cellular models. We also discuss various ways of using these clock models in circadian studies. Methods described here can be applied to a great variety of cell types to study the cellular and molecular basis of circadian clocks, and may prove useful in tackling problems in other biological systems.
протокол
1. Строительство Lentiviral Luciferase Репортеры
Млекопитающих циркадного репортера конструкции обычно содержит кассету экспрессии, в которых суточный промоутер слит с геном люциферазы. Оба перевязки и рекомбинации стратегий, основанных на которые обычно используются для клонирования ДНК. В качестве примера, здесь мы описываем рекомбинации на основе шлюза метод клонирования для создания P (Per2)-г Люк лентивирусные репортера, в котором дестабилизировали люциферазы (г Luc) находится под контролем мыши Per2 промоутер.
- Клонирование Per2 промоутер. Использование ПЦР для амплификации фрагмента ДНК Per2 промоутер из 526 б.п., вверх по течению от сайта начала транскрипции от мыши Per2 BAC 9-13 клона, с использованием прямого праймера (5'-CTCGAGCGGATTACCGAGGCTGGTCACG TC-3 ') и обратного праймера (5' -CTCGAGTCCCTTGCTCGGCCCGTCAC TTGG-3 »), а клон в pENTR5'-TOPO вектор (Invitrogen) для созданияpENTR5'-P (Per2).
- Клонирование г Люк. D Люк содержит ген люциферазы светлячка и С-концевыми PEST последовательности для быстрого разложения белка, как описано выше 21. Использование ПЦР для амплификации г Люк фрагмент ДНК, а клон в pENTR / D-TOPO вектор (Invitrogen) для создания pENTR / Dd Люк.
- Строительство репортер вектор. Смешайте два pENTR плазмиды, pENTR5'-P (Per2) и pENTR / Dd Люк, с лентивирусов вектор назначения pLV7-BSD (BSD, бластицидин ген устойчивости), а также выполнять реакции рекомбинации использованием Clonase для создания pLV7-BSD-P (Per2)-г Люк репортер (рис. 1). pLV7-BSD представляет собой модифицированную версию (сделано в нашей лаборатории) из pLenti6/R4R2/V5-DEST (Invitrogen), в которых вирус гепатита сурка пост-транскрипционного регуляторного элемента (WPRE) последовательностей 22 были вставлены непосредственно после выражения ок ssette для повышения экспрессии генов.
2. Производство Lentiviral Частицы
1. Семенной 293T клеток (день 1)
- Расти человеческих эмбриональных почек (НЕК) 293T клетки до 90-100% слияния в регулярном DMEM с добавлением 10% FBS и 1 пенициллина-стрептомицина-Глютамин (PSG) на 10 см блюд культуры. (Быстро растущие клетки с низким числом прохождения имеют решающее значение для эффективной трансфекции.)
- До посева клеток для трансфекции, герб 6-луночных культуры путем добавления 1 мл 0,001% поли-L-лизин в PBS в каждую лунку и инкубировать при комнатной температуре в течение 20 мин. Аспирируйте раствор и промыть один раз 1x PBS перед использованием.
- Диссоциируют 293T клеток трипсином и семян 0,75 х 10 6 клеток на каждую лунку предварительно покрытых пластинами с 2 мл регулярные DMEM. Swirl пластины тщательно для получения равномерного распределения клеток в каждой лунке. Рост клеток в инкубаторе при температуре 37 ° С в течение ночи.
- Соблюдайте посеянных клеток от 1 дня. Сотовые должны достичь слияния 80-90%.
- Подготовьте смесь для трансфекции плазмиды в 1,5 мл трубки микроцентрифужных добавлением 2 мкг лентивирусные репортера плазмиды ДНК (например, pLV7-P (Per2)-г Люк; Лю лаборатории) и 3 упаковки векторов (1,3 мкг Gag / Pol, 0,5 мкг Rev, и 0,7 мкг VSVG; Invitrogen). В качестве контроля для трансфекции и последующей инфекции, мы обычно включает дополнительный а в трансфекции для лентивирусов вектор экспрессии GFP, pLV156-CMV-EGFP (рис. 1А), укрывательство расширения зеленого флуоресцентного белка (EGFP) под контролем промотора CMV как описано выше 20.
- Добавить 100 мкл 0,25 М CaCl 2 (разбавляют ДНКазы / РНКазы DDH 2 O от 2,5 складе M) с плазмидой смеси в шаге 2 и тщательно перемешать. Затем добавьте 100 мкл раствора 2x BBS (50 МтS, 280 мм NaCl, 1,5 мМ Na 2 HPO 4, рН 6,95) и аккуратно перемешать, но тщательно. Инкубируйте ДНК смесь при комнатной температуре в течение 15 мин.
- Во время ожидания, аспирации среды от 293T клетки и изменить до 2 мл свежей среды. Вернуться пластины в инкубатор, по крайней мере 10 минут, чтобы уравновесить рН среды до трансфекции.
- Добавить трансфекции смесь шаги от 3 до 293T клетки капля за каплей. Swirl пластины аккуратно и наблюдать формирование частиц под микроскопом. Инкубировать при 5% CO 2, 37 ° C в течение ночи. (Fine формирования частиц CaPO 4 / ДНК осадок имеет решающее значение для эффективной трансфекции.)
3. Урожай вирусных частиц (дни 3-4)
- Около 16 часов после трансфекции (день 3) к этому времени клетки должны достигать 100% слияния, аспирации среды из клетки и замените 2 мл свежего регулярные DMEM. Инкубировать при 37 ° С в течение ночи.
- На 4-й день, оценить эффективность трансфекции, наблюдая EGFP выражение в переходsfection контрольных клеток (Трансфекция эффективностью 90-100% с высокой экспрессией EGFP является надежным предиктором хорошего вирусного преп.)
- Сбор среде, содержащей выделяется, инфекционные вирусные частицы. Центрифуга в> 2000 мкг в течение 5 мин для удаления остаточных клеток 293Т и собирать содержащих вирус супернатант. Кроме того, среда может быть очищен с 0,45 мкм мембранный фильтр. Вирусные частицы готовы для использования в инфекции.
3. Инфекция 3Т3
1. Семенной 3Т3 (день 3)
Сплит и семян соответствующее количество (~ 12.000) из 3T3 клеток на 12-луночный планшет для получения 20-30% слияния на следующий день. Инкубировать при 37 ° С в течение ночи.
2. Infect 3Т3 (день 4)
- Соблюдайте посеянных клеток. Слияние 20-30% (менее 50%) требуется для инфекции.
- Добавить полибрен до конечной концентрации 5 мкг / мл, собранные среде, содержащей вирусныйчастицами. Тщательно перемешать с помощью пипетки.
- Аспирируйте среды от 3Т3, и добавьте 1 мл указанного выше вирусная смеси на лунку. Инкубировать при 37 ° С в течение ночи. (Полибрен используется для повышения эффективности инфекции, но не абсолютно необходимо. Как это может быть токсично для некоторых клетках, предварительное тестирование рекомендуется).
3. Выберите инфицированных клеток (5-й день и далее)
- Двадцать четыре часа после инфицирования, аспирации среде, содержащей вирус и полибрен из инфицированных клеток, мыть один раз 1x PBS, и изменить на свежую среду. Инкубировать при 37 ° С в течение ночи для восстановления и роста.
- Когда вырожденная (обычно через 1-2 дня), разделение клеток и инкубируют при 37 ° C в течение ночи.
- На следующий день, аспират среды от клеток (<50% слияния желательно) и заменить свежей средой, содержащей 10 мкг / мл бластицидин, чтобы выбрать для стабильно преобразованных клеток. (Бластицидин убить кривая должна быть определены эмпирически для конкретной линии клеток). Измените на свежую среду, содержащую бластицидин каждые 2-3 дня непрерывной селекции устойчивых к антибиотикам клеток, экспрессирующих часов журналисты (как правило, 4-6 дней всего).
4. Биолюминесценция запись Reporter клетки
1. Клеток семени Репортер
Распространить бластицидин-устойчивых клеток репортер и разделен на 35-мм блюд культуры. Инкубировать при температуре 37 ° C до вырожденная. Мы обычно готовят ≥ 3 блюд для каждой клеточной линии репортер под каждым условием для суточного фенотипирования.
2. Синхронизация и изменение носителя
- Аспирируйте среды от сливной клетки репортер, мыть один раз PBS, и заменить DMEM, содержащей 10 мкМ форсколина (или 200 нМ дексаметазона). Инкубировать при 37 ° С в течение 1 часа, чтобы синхронизировать клетки. (Кроме того, клетки могут быть синхронизированы с помощью температурных циклов 23 или сыворотки шок 24).
- Во время ожидания, подготовить отчетния среды для 3Т3 следующим образом: 1x DMEM (HyClone), содержащей 10% FBS, 1 Pen / Strep / Gln, 1 мкМ форсколина, 1 мМ люциферин, 25 мМ HEPES, рН 7,4. Сыворотка и форсколина концентрация может быть определена опытным путем. Для очень тусклые клетки, фенола красного бесплатно среда может быть использована.
- В конце лечения форсколин, аспирации среднего и заменить недавно сделал запись среды.
3. Биолюминесценция записи репортера клеток
- После среде изменений, охватывают культуру блюд с 40 мм стерильной покровные и уплотнение в месте с вакуумной смазкой для предотвращения испарения.
- Загрузите блюда на LumiCycle люминометра, которая хранится в инкубатор при 36 ° C, без H 2 O или CO 2.
- Начало реального времени биолюминесценции записи. Мы обычно записывают ритмы в течение 1 недели, затем средние изменения и непрерывной записи в течение второй недели (см. Савельев и соавт. Подробности) 25. (Для записи 96-мыLL пластин, Synergy SL2 был использован в качестве записывающего устройства, см. обсуждение 1.1 для подробностей).
5. Анализа и представления данных
Репортер клеток способствовать высоким разрешением количественных записи люминесценции, решающее значение для определения фенотипические эффекты на циркадный функцию часов. Для получения циркадные параметры, включая фазу, длина периода, ритм амплитуды и скорости затухания, мы используем программу LumiCycle анализа (Actimetrics) для анализа биолюминесценции данных 5,14. Короче говоря, исходные данные являются базовыми Встроенная первыми, и базовой линии вычитаются данные устанавливаются на синусоиду, из которой параметры определяются. Для образцов, которые показывают постоянный ритм, добра, согласия,> 90%, как правило, достигается. В связи с высоким переходным биолюминесценции от среднего изменения, мы обычно исключают первом цикле данные из анализа.
Для представления данных, мы обычно построить исходные данные (биолюминесценции, имп / сек) от TIМне (дней). При необходимости, базовый-вычитаются данные могут быть нанесены для сравнения амплитуды и фазы.
6. Представитель Результаты
1. Фаза конкретных циркадных журналистами
Циркадные часы основана на биохимических механизм отрицательной обратной связи 1. Цикл основной обратной связи состоит из транскрипционных активаторов BMAL1 и часы, и репрессоры PERs и кристаллы, которые действуют на циркадный E / Е 'ящик элементов усилителя для создания ритмической экспрессии генов (с утра фазы, например, Rev-Еврорадио α). Основной цикл регулирует и интегрирует крайней мере два других циркадных цис-элементов, DBP/E4BP4 обязательным элементом (D-коробка; за день фазы, например, PER3) и ROR / REV-ERB обязательным элементом (RRE; для ночной фазы, например, BMAL1) 17. Комбинаторные регулирования циркадных нескольких элементов может генерировать новые промежуточные фазы. Например, Cry1 транскрипцииния при посредничестве все три циркадных элементы (например, E / Е 'ящик и D-элементов в окне промоутер и Rres в первый интрон гена Cry1), что приводит к различным Cry1 вечернее время фазы 13.
Основываясь на этих механизмах регуляции генов, мы получили четыре различных конструкций репортер: P (Per2)-г Люк и P (Cry1)-г Люк журналистам, содержащих как E / Е 'ящик и D-коробка элементов в регуляторной области 17, 26,27; P (Cry1) - Интрон-й Люк представляющих комбинаторной регулирование всех трех элементов (например, E / Е 'ящик, D-Box, и РРЭ) 13,17, а P (BMAL1)-г Люк регулируемом исключительно RRE 9,17,19,21. Мы представили эти журналистам в 3Т3 для получения ожидаемого различных фазах репортер выражении (рис. 2).
2. Гена нокдаун через RNAi и фармакологически ACTiве соединений
При трансфекции эффективность высока, синтетических миРНК может быть временно трансфицировали в клетки, чтобы сбить экспрессии генов. При трансфекции технически сложно, вектор ShRNA выражение может быть стабильно трансдуцированных в клетки через лентивирусные инфекции, так что ShRNA производства ячейки обрабатывается для миРНК для генной нокдаун (KD). Здесь мы представляем KD последствия Cry1 и Cry2 генов с помощью миРНК в клетки U2OS (рис. 3А) и ShRNA в 3T3 клеток с использованием pLL3.7 шлюз вектор экспрессии 9 (рис. 3В). В дополнение к 3Т3, модель U2OS стало еще одним выдающимся сотовый модель часов основном потому, что отвечает основным требованиям для высокопроизводительного скрининга коммерчески доступных человеческих библиотеки миРНК (например, человеческого происхождения, способные генерировать надежные циркадные ритмы, подтверждено функции все известные часовые гены, и поддаются высокоэффективной трансфекции иколичественные записи люминесценции). В обоих типах клеток, RNAi-опосредованной KD привело часы фенотипы согласуются с предыдущими нокаут мышей (KO) и клеточных исследований KD 5,10,11,28. Например, Cry1 KD сокращает длину периода и снижает ритм настойчивость, в то время как Cry2 KD удлиняет период. Кроме того, отдельные небольшие молекулы могут быть использованы для фармакологической мишени и возмущают функции белка (рис. 3).
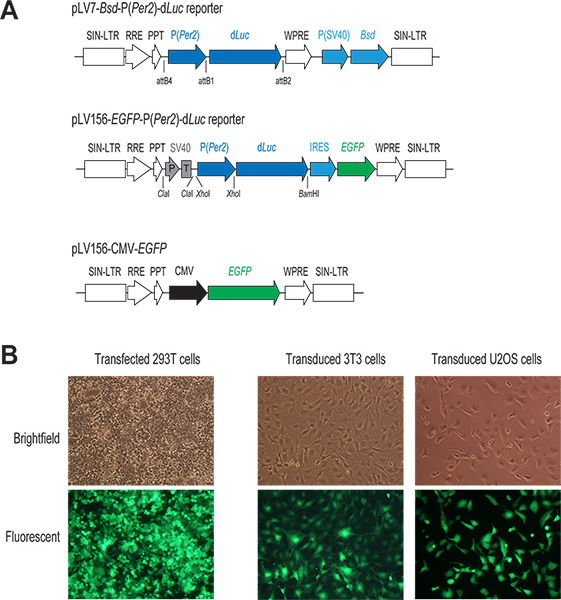
Рисунок 1. Лентивирус-опосредованной доставки генов системы. (A) схема из двух лентивирусные P (Per2)-г векторов Люк репортер и CMV-EGFP построить. Только региона к интеграции в геном клетки-хозяина показано. В обоих репортер конструкций, транскрипция г Люк находится под прямым контролем Per2 промоутер. В pLV7-BSD-P (Per2)-г Люк вектор (повторноКомбинация на основе клонирования), экспрессируются сопротивление бластицидин гена (BSD) облегчает выбор инфицированных клеток. В pLV156-P (Per2)-г Люк вектор (перевязка на основе клонирования), EGFP перевод опосредовано внутренних рибосомы сайте вступления (IRES) вниз по течению от D Люк, позволяющий для визуального наблюдения и FACS сортировки инфицированных клеток. Кроме того, SV40 промотор / терминатор (P / T) используется в качестве диэлектрика (см. обсуждение 1,3). В CMV-EGFP векторного управления, EGFP выражение находится под контролем сильного промотора CMV. (B) флуоресцентных изображений трансфицированных и инфицированных GFP-экспрессирующих клеток. Как правило, мы достигаем высокой эффективности как в переходном трансфекции клетки и 293T в лентивирусные заражение клеточных линиях наших интересах, как указано GFP выражение в этих клетках. Нажмите, чтобы увеличить показатель .

Рисунок 2. Фаза-конкретное выражение биолюминесценции журналистам в 3Т3 лентивирусов векторов репортера, используемые в этом эксперименте pLV7-BSD-P (Per2)-г Люк, P (Cry1)-г Люк, P (Cry1) -. Интрон-й Luc, и P (BMAL1)-г Люк. Каждый репортер отчетливо демонстрирует фаза колебаний, как показано стрелками. В то время как Per2 и Cry1 промоутеров диск пик биолюминесценции на утро-день фаз и BMAL1 промоутер ночью фазы, комбинаторные регулирования P (Cry1) - Интрон укрывательство E-окна, D-Box, и RRE элементов придает вечеру фазы пика биолюминесценции . Нажмите, чтобы увеличить показатель .
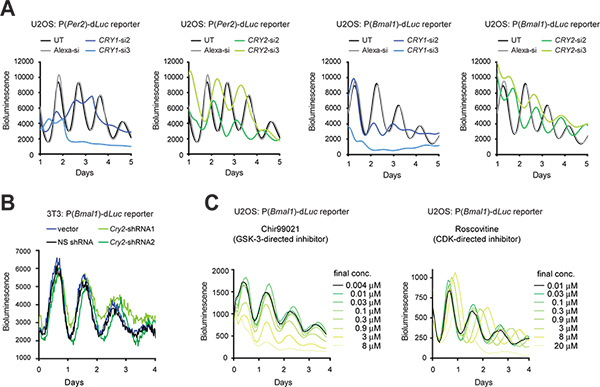
Рисунок 3. Генетические и фармакологических возмущение циркадных ритмов биолюминесценции в репортеру клеток. (A) Воздействие Cry1 и Cry2 нокдаун от siRNAs на клеточном ритмы клеток U2OS репортер. LumiCycle люминометра был использован для записи биолюминесценции клеток в 35 блюд мм. Рисунок выполнен Ссылка с № 10, с разрешения Elsevier (2009). (B) Влияние Cry2 нокдаун от shRNAs на клеточном ритмы 3Т3 репортер. PLL3.7 шлюз вектор, содержащий U6-ShRNA кассета была использована для Cry2 гена нокдаун. shRNA2 имеет лучшую эффективность, чем нокдаун shRNA1, как это определено Вестерн-блоттинга (данные не показаны). Synergy люминометра был использован для записи биолюминесценции клеток в 96-луночный планшет. Установки для записи следующим образом:. Инкубатора температура 33 ° C, время интегрирования, 15 сек; интервал времени, 30 минут (C) Влияние низкомолекулярных ингибиторов на челlular ритмы клеток U2OS репортер. Chir99021 и росковитина являются ингибиторами направлены против GSK-3 и CDK, соответственно. Система ViewLux (Chir99021 анализ) и люминометра Tecan (росковитина анализа) были использованы для записи биолюминесценции клеток в 384-луночных планшетах. Рисунок заимствован из Справочник № 19 (Copyright 2008 Национальная академия наук, США). Нажмите, чтобы увеличить показатель .
Обсуждение
1. Изменения в данной протокола
1,1 записывающих устройств и пропускную способность соображения
Из-за своей коммерческой доступности, LumiCycle (Actimetrics) стал наиболее часто используемых автоматизированных устройств люминометра для записи в реальном времени 4,...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была выполнена при частичной поддержке Национального научного фонда (IOS-0920417) (ACL).
Материалы
| Название реагента | Компания | Номер в каталоге | Комментарии |
| DMEM | HyClone | SH30243FS | Для регулярного роста клеток |
| DMEM | Invitrogen | 12100-046 | Для luminometry |
| FBS | HyClone | SH3091003 | |
| Pen / Strep / Gln (100x) | HyClone | SV3008201 | |
| B-27 | Invitrogen | 17504-044 | |
| D-Luciferin | Biosynth | L-8220 | |
| Поли-L-лизин | Сигма | P4707 | |
| Полибрен | Millipore | TR-1003-G | |
| Форсколин | Сигма | F6886 | |
| Все остальные химические вещества | Сигма | ||
| Оборудование | |||
| Культура ткани инкубатора | 5% CO2 при 37 ° C | ||
| Капот культуры ткани | BSL-2 сертифицированных | ||
| Свет и флуоресцентного микроскопа | Фазового контраста дополнительно | ||
| LumiCycle | Actimetrics |
Ссылки
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Hastings, M. H., Reddy, A. B., Maywood, E. S. A clockwork web: circadian timing in brain and periphery, in health and disease. Nat. Rev. Neurosci. 4, 649-661 (2003).
- Nagoshi, E. Circadian gene expression in individual fibroblasts: cell-autonomous and self-sustained oscillators pass time to daughter cells. Cell. 119, 693-705 (2004).
- Welsh, D. K. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Curr. Biol. 14, 2289-2295 (2004).
- Liu, A. C. Intercellular coupling confers robustness against mutations in the SCN circadian clock network. Cell. 129, 605-616 (2007).
- Kornmann, B. System-driven and oscillator-dependent circadian transcription in mice with a conditionally active liver clock. PLoS Biol. 5, e34 (2007).
- Hogenesch, J. B., Herzog, E. D. Intracellular and intercellular processes determine robustness of the circadian clock. FEBS Lett. 585, 1427-1434 (2011).
- DeBruyne, J. P., Weaver, D. R., Reppert, S. M. Peripheral circadian oscillators require CLOCK. Curr. Biol. 17, 538-539 (2007).
- Liu, A. C. Redundant function of REV-ERBalpha and beta and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms. PLoS Genet. 4, e1000023 (2008).
- Zhang, E. E. A genome-wide RNAi screen for modifiers of the circadian clock in human cells. Cell. 139, 199-210 (2009).
- Baggs, J. E. Network features of the mammalian circadian clock. PLoS Biol. 7, e52 (2009).
- Hirota, T. High-throughput chemical screen identifies a novel potent modulator of cellular circadian rhythms and reveals CKIalpha as a clock regulatory kinase. PLoS Biol. 8, e1000559 (2010).
- Ukai-Tadenuma, M. Delay in feedback repression by cryptochrome 1 is required for circadian clock function. Cell. 144, 268-281 (2011).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Sato, T. K. Feedback repression is required for mammalian circadian clock function. Nat. Genet. 38, 312-319 (2006).
- Ueda, H. R. System-level identification of transcriptional circuits underlying mammalian circadian clocks. Nat. Genet. 37, 187-192 (2005).
- Brown, S. A. The period length of fibroblast circadian gene expression varies widely among human individuals. PLoS Biol. 3, e338 (2005).
- Hirota, T. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc. Natl. Acad. Sci. U.S.A. 105, 20746-20751 (2008).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat. Protoc. 1, 241-245 (2006).
- Ueda, H. R. A transcription factor response element for gene expression during circadian night. Nature. 418, 534-539 (2002).
- Zufferey, R., Donello, J. E., Trono, D., Hope, T. J. Woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors. J. Virol. 73, 2886-2892 (1999).
- Buhr, E. D., Yoo, S. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330, 379-385 (2010).
- Balsalobre, A., Damiola, F., Schibler, . U.A serum shock induces circadian gene expression in mammalian tissue culture cells. Cell. 93, 929-937 (1998).
- Savelyev, S. A., Larsson, K. C., Johansson, A., Lundkvist, G. B. S. Slice Preparation, Organotypic Tissue Culturing and Luciferase Recording of Clock Gene Activity in the Suprachiasmatic Nucleus. J. Vis. Exp. (48), e2439 (2011).
- Akashi, M., Ichise, T., Mamine, T., Takumi, T. Molecular mechanism of cell-autonomous circadian gene expression of Period2, a crucial regulator of the mammalian circadian clock. Mol. Biol. Cell. 17, 555-565 (2006).
- Ohno, T., Onishi, Y., Ishida, N. A novel E4BP4 element drives circadian expression of mPeriod2. Nucleic Acids Res. 35, 648-655 (2007).
- Maier, B. A large-scale functional RNAi screen reveals a role for CK2 in the mammalian circadian clock. Genes Dev. 23, 708-718 (2009).
- Yoo, S. H. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc. Natl. Acad. Sci. U.S.A. 101, 5339-5346 (2004).
- Liu, A. C., Lewis, W. G., Kay, S. A. Mammalian circadian signaling networks and therapeutic targets. Nat. Chem. Biol. 3, 630-639 (2007).
- Ko, C. H. Emergence of noise-induced oscillations in the central circadian pacemaker. PLoS Biol. 8, e1000513 (2010).
- Izumo, M., Johnson, C. H., Yamazaki, S. Circadian gene expression in mammalian fibroblasts revealed by real-time luminescence reporting: temperature compensation and damping. Proc. Natl. Acad. Sci. U.S.A. 100, 16089-16094 (2003).
- Izumo, M., Sato, T. R., Straume, M., Johnson, C. H. Quantitative analyses of circadian gene expression in mammalian cell cultures. PLoS Comput. Biol. 2, e136 (2006).
- Chen, Z. Identification of diverse modulators of central and peripheral circadian clocks by high-throughput chemical screening. Proc. Natl. Acad. Sci. U.S.A. 109, 101-106 (2011).
- Yamaguchi, S. Synchronization of cellular clocks in the suprachiasmatic nucleus. Science. 302, 1408-1412 (2003).
- Akashi, M., Hayasaka, N., Yamazaki, S., Node, K. Mitogen-activated protein kinase is a functional component of the autonomous circadian system in the suprachiasmatic nucleus. J. Neurosci. 28, 4619-4623 (2008).
- Hoshino, H., Nakajima, Y., Ohmiya, Y. Luciferase-YFP fusion tag with enhanced emission for single-cell luminescence imaging. Nat. Methods. 4, 637-639 (2007).
- Asai, M. Visualization of mPer1 transcription in vitro: NMDA induces a rapid phase shift of mPer1 gene in cultured SCN. Curr. Biol. 11, 1524-1527 (2001).
- Wilsbacher, L. D. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc. Natl. Acad. Sci. U.S.A. 99, 489-494 (2002).
- Yamazaki, S. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Welsh, D. K., Noguchi, T., Yuste, R. Cellular bioluminescence imaging. Imaging: A Laboratory Manual. , 369-385 (2011).
- Nakajima, Y. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, e10011 (2010).
- Guilding, C. A riot of rhythms: neuronal and glial circadian oscillators in the mediobasal hypothalamus. Mol. Brain. 2, 28 (2009).
- O'Neill, J. S. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Fuller, P. M., Lu, J., Saper, C. B. Differential rescue of light- and food-entrainable circadian rhythms. Science. 320, 1074-1077 (2008).
- Mukherjee, S. Knockdown of Clock in the ventral tegmental area through RNA interference results in a mixed state of mania and depression-like behavior. Biol. Psychiatry. 68, 503-511 (2010).
- Saijo, K. A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death. Cell. 137, 47-59 (2009).
- Elias, G. M. Synapse-specific and developmentally regulated targeting of AMPA receptors by a family of MAGUK scaffolding proteins. Neuron. 52, 307-320 (2006).
- Isojima, Y. CKIepsilon/delta-dependent phosphorylation is a temperature-insensitive, period-determining process in the mammalian circadian clock. Proc. Natl. Acad. Sci. U.S.A. 106, 15744-15749 (2009).
- Bucan, M., Abel, T. The mouse: genetics meets behaviour. Nat. Rev. Genet. 3, 114-123 (2002).
- Hughes, M. E. Harmonics of circadian gene transcription in mammals. PLoS Genet. 5, e1000442 (2009).
- Atwood, A. Cell-autonomous circadian clock of hepatocytes drives rhythms in transcription and polyamine synthesis. Proc. Natl. Acad. Sci. U.S.A. 108, 18560-18565 (2011).
- Panda, S. Coordinated transcription of key pathways in the mouse by the circadian clock. Cell. 109, 307-320 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены