Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lusiferaz Biyoparlaklık Gazeteciler kullanma Gen Ekspresyonunun Hücre-özerk Sirkadiyen Saat Ritimleri İzlenmesi
Bu Makalede
Özet
Sirkadiyen saatler tek tek hücrelerin içinde fonksiyon, yani, bu hücre-özerktir. Burada, non-invaziv, lusiferaz tabanlı gerçek zamanlı biyolüminesans teknolojisini kullanarak cep özerk saat modelleri üretme yöntemleri açıklanmaktadır. Muhabir hücreleri sirkadiyen biyoloji eğitimi için uysal, fonksiyonel model sistemleri sağlıyoruz.
Özet
Memelilerde, davranış ve uyku-uyanıklık döngüsü ve karaciğer metabolizması gibi fizyolojisi birçok açıdan endojen sirkadiyen saat (1,2 yorumlanan) tarafından düzenlenir. Sirkadiyen zaman tutma sistemi senkronize ve başka yerlerde 1,2 ekstra SCN ve periferik saatler koordine suprakiazmatik nükleus (SCN) bulunan merkez saati ile, hiyerarşik bir multi-osilatör ağıdır. Bireysel hücrelerin üretimi ve sirkadiyen ritim 3,4 ve organizma payı farklı doku tiplerinin bir oldukça benzer biyokimyasal negatif geribildirim mekanizmasının bu osilatörler bakımı için fonksiyonel birimlerdir. Bununla birlikte, SCN nöronal ağ seviyesinde ve organizma seviyesinde ritmik, sistemik işaretler ile etkileşimler nedeniyle, organizma seviyesinde ritminin hücre-bağımsız 5-7 olması gerekli değildir. In vivo ve SCN eksplantlar ex vivo, c lokomotor aktivite geleneksel çalışmaları ile karşılaştırıldığındaell-tabanlı cep özerk sirkadiyen kusurları 5,8 keşfi için izin vitro tayinlerde. Stratejik, hücre tabanlı modeller fenotipik karakterizasyonu ve temel saat mekanizmaları 5,8-13 hızlı keşif için daha fazla deneysel uysal vardır.
Sirkadiyen ritim dinamik olduğundan, yüksek zamansal çözünürlüğe sahip boylamasına ölçümleri saat fonksiyonu değerlendirmek için gereklidir. Son yıllarda, bir muhabir olarak ateşböceği lusiferaz kullanarak gerçek zamanlı biyolüminesans kayıt, moleküler ritimlerin sebat ve dinamiklerinin incelenmesi için izin verir gibi, memeliler 14,15 bölgesindeki sirkadiyen ritim eğitimi için ortak bir teknik haline gelmiştir. Gen ekspresyonu hücre-özerk sirkadiyen ritim izlemek için, lusiferaz gazetecilere geçici transfeksiyon 13,16,17 veya stabil transdüksiyon 5,10,18,19 yoluyla hücre içine sokulabilir. Burada lentivirüs-aracılı gen teslimat kullanarak istikrarlı iletimi protokol açıklar. TO lentiviral vektör sistemi böyle nedeniyle verimlilik ve çok yönlülük geçici transfeksiyon ve germline iletimi gibi geleneksel yöntemlere üstündür: bölünerek ve hücreler 20 sigara bölünmesi hem konak genom içine verimli teslimat ve istikrarlı entegrasyonuna izin verir. Bir muhabir hücre hattı kurulduktan sonra, saat fonksiyonu dinamikleri biyolüminesans kayıt yoluyla incelenebilir. İlk olarak P (Per2)-D Luc raportör hatları, ve daha sonra bu ve diğer sirkadyen muhabirlerden mevcut veri üretimini açıklıyoruz. Bu analizlerde, 3T3 fare fibroblastlarının ve U2OS insan osteosarkom hücre hücresel model olarak kullanılmıştır. Biz de sirkadiyen çalışmalarda bu saat modelleri kullanmanın çeşitli yollarını tartışmak. Burada anlatılan Yöntemleri sirkadiyen saatlerin hücresel ve moleküler temeli incelemek için hücre tipleri çok çeşitli uygulanabilir, ve diğer biyolojik sistemlerde sorunlara mücadelede yararlı olabilir.
Protokol
1. Lentiviral Lusiferaz Muhabirleri İnşaatı
Bir memeli sirkadyen raportör yapı genellikle sirkadiyen bir promotör, lusiferaz gen ile birleşmesini sağlayan bir ifade kaseti içerir. Hem ligasyonu ile rekombinasyon bazlı stratejilerin genellikle DNA klonlama için kullanılır. Bir örnek olarak, burada istikrarsız lusiferaz (d Luc) fare Per2 promotörün kontrolü altında olduğu bir P (Per2)-D Luc lentiviral raportör üretilmesi için bir rekombinasyon bazlı ağ geçidi klonlama yöntem açıklanmaktadır.
- Per2 organizatörü klonlanması. Bir ileri primer (5'-CTCGAGCGGATTACCGAGGCTGGTCACG TC-3 ') ve bir ters primeri (5' ile, yukan doğru bir fare BAC klon Per2 9-13 transkripsiyon başlatma sitesinin 526 bp promoter Per2 DNA fragmanı amplifiye etmek için PCR kullanarak -CTCGAGTCCCTTGCTCGGCCCGTCAC TTGG-3 '), ve pENTR5' TOPO-vektörüne (İnvitrojen) içine klon elde edilmektedirpENTR5'-P (Per2).
- D Luc klonlanması. D Luc ateşböceği lusiferaz gen ve daha önce 21 açıklandığı gibi hızlı protein yıkımı için bir C-terminal PEST dizisi içerir. Pentr / Dd Luc üretmek için pentr / D-TOPO vektörüne (İnvitrojen) içine d Luc DNA fragmanı, ve klon amplifiye etmek için PCR kullanarak.
- Muhabir vektör İnşaatı. Lentiviral hedef vektör pLV7-BSD (BSD, blasticidin e dirençli gen) ile iki pentr plazmidler, pENTR5'-P (Per2) ve pentr / Dd Luc, karıştırılır, ve bir pLV7-BSD-P oluşturmak için klonaz kullanılarak rekombinasyon tepkime gerçekleştirmek (Per2)-d Luc muhabiri (Şekil 1). pLV7-BSD woodchuck hepatit virüsü transkripsiyon sonrası düzenleyici element (WPRE) dizileri 22 ifadenin ca aşağı hemen takılı edildiği pLenti6/R4R2/V5-DEST (Invitrogen) değiştirilmiş bir sürümü (bizim laboratuarımızda yapılan) gen ekspresyonunu artırmak için ssette.
2. Lentiviral Parçacıkların Üretimi
1. Tohum 293T hücreleri (1. gün)
- % 10 FBS ve 1x 10 cm kültür tabaklarında üzerine Penisilin-Streptomisin-Glutamin (PSG) ile desteklenmiş düzenli DMEM% 90-100 izdiham insan embriyonik böbrek (HEK) 293T hücreleri büyümek. (Düşük geçiş sayısı ile hızla büyüyen hücreler verimli transfeksiyon için önemlidir.)
- Önceki her oyuğa PBS içinde% 0.001 poli-L-lizin, 1 ml eklenmesi ve 20 dakika süre ile oda sıcaklığında inkübe ile transfeksiyon, ceket 6 oyuklu kültür plakaları için hücreler ile tohumlama. Solüsyonu aspire ve kullanımdan önce 1x bir kez PBS ile yıkayın.
- Tripsin ve tohum 0.75 ile 293T hücreleri ayrışır 2 x 10 ml normal DMEM ile önceden kaplanmış plakalar her bir yanı üzerine 6 hücre. Karıştırıcı levha iyice her bir kuyu içinde hücrelerinin eşit bir dağılım elde edilir. 37 ° C'da gece boyunca kuluçka makinesi içinde hücreler büyütün.
- Gün 1 numaralı seribaşı hücreleri gözlemleyin. Hücre% 80-90 arasında izdiham ulaştırılması gerekmektedir.
- Ve 3 paketleme vektörleri (1.3 ug Gag / Pol, 0.5 ug; lentiviral raportör plazmid DNA 2 mg (Liu laboratuvar örneğin, pLV7-P (Per2)-d Luc) ilave edilerek 1.5 mL mikrosantrifüj tüpü içinde plazmid transfeksiyon karışımı hazırlayın Rev, ve 0.7 mikrogram VSVG; Invitrogen). Transfeksiyondan ve sonraki enfeksiyon her ikisi için bir kontrol olarak, genellikle, CMV promotörün kontrolü altında gelişmiş yeşil flüoresan protein (EGFP) barındıran bir lentiviral GFP ifade vektörü için transfeksiyon ek bir yanı, pLV156-CMV-EGFP (Şekil 1A) da içermektedir daha önce 20 tarif.
- 2. adımda plazmid karışımı 0.25 M CaCl2 100 ul (2,5 M stoktan DNaz / RNaz-serbest GKD 2 O ile seyreltilmiş) ekleyin ve iyice karıştırın. Daha sonra 2x BBS çözeltisinden 100 ul (50 mm eklemekS, 280 mM NaCl, 1.5 2 HPO 4, pH 6.95) Na mM ve yavaşça ama iyice karıştırın. 15 dakika süreyle oda sıcaklığında DNA karışımı inkübe edin.
- Beklerken, 293T hücreleri orta aspirat ve 2 ml taze orta değiştirin. Transfeksiyondan önce ortam pH dengelemek için, en azından 10 dakika boyunca kuluçka makinesi ile levha geri dönün.
- Damla 293T hücreleri damlasına kadar adım 3 transfeksiyon karışımı ekleyin. Swirl hafifçe plaka ve mikroskop altında partikül oluşumunu gözlemlemek. % 5 ° C de bir gece CO2, 37 inkübe edin. (Capo 4 / DNA çökelti Güzel parçacık oluşumu verimli transfeksiyon için önemlidir.)
3. Hasat viral partiküller (günde 3-4)
- Hakkında 16 saat sonrası transfeksiyon (günde 3) hangi zaman hücreler,% 100 izdiham ulaşması gerektiğini hücrelerinden orta aspirat ve 2 ml taze düzenli DMEM ile değiştirin. 37 ° C de bir gece inkübe edin.
- 4. günde, tran EGFP ifade gözlemleyerek transfeksiyon verimliliği değerlendirmeksfection kontrol hücreleri (yüksek EGFP ifadesi ile% 90-100 arasında Transfeksiyon verimliliği iyi bir viral hazırlık güvenilir bir belirleyicisidir.)
- Salgılanan, bulaşıcı viral partiküller içeren orta toplayın. Rezidüel 293T hücreleri kaldırmak ve virüs içeren süpernatant toplamak için 5 dakika süreyle> 2.000 x g'de santrifüjleyin. Alternatif olarak, ortam bir 0.45 mikron membran filtre ile temizlenebilir. Viral parçacıkların enfeksiyon kullanıma hazırdır.
3. 3T3 Hücreleri Enfeksiyon
1. Tohum 3T3 hücreleri (günde 3)
12-plaka üzerinde Split ve 3T3 hücreleri tohum uygun sayıda (~ 12.000) tarafından ertesi gün% 20-30 izdiham elde etmek. 37 ° C de bir gece inkübe edin.
2. 3T3 hücreleri (günde 4) Infect
- Numaralı seribaşı hücreleri gözlemleyin. % 20-30 (en az% 50) izdiham enfeksiyon için arzu edilir.
- Viral içeren toplanmış ortama 5, ug / ml 'lik nihai bir konsantrasyona polybrene eklemeparçacıklar. Pipetleme ile iyice karıştırın.
- 3T3 hücreleri, orta aspire ve kuyu başına yukarıda viral karışım 1 ml ekleyin. 37 ° C de bir gece inkübe edin. (Polybrene enfeksiyon etkinliğini arttırmak için kullanılır, ancak kesinlikle gerekli değildir. Bazı hücrelere karşı toksik olabilir gibi, testten önce önerilir.)
3. Enfekte hücreler (Günde 5 ve yukarısı) seçin
- Yirmi dört saat sonrası enfeksiyon, enfekte olmuş hücrelerde virüs ve polybrene içeren orta aspire, 1x kez PBS ile yıkayın ve taze orta değiştirin. 37 iyileşme ve büyüme için ° C'de gece boyunca inkübe edin.
- Ne zaman konfluent (genellikle 1-2 gün sonra), 37 ° C'de gece boyunca inkübe hücreleri ve ayrıldı.
- Ertesi gün, aspirat hücreleri (<% 50 kesişme noktası tercih edilir) arasından orta ve stabil bir şekilde seçmek için 10 ug / ml Blasticidin içeren taze aracı madde ile yerine hücreleri transdük. (Blasticidin kill-eğrisi ampirik belirli bir hücre hattı için tespit edilmesi gerekmektedir.)
- Saat gazetecilere (genellikle 4-6 gün toplam) ifade antibiyotiğe dirençli hücrelerin sürekli seçim için 2-3 günde Blasticidin içeren taze orta değiştirin.
4. Muhabir Hücrelerinin Biyoparlaklık Kaydı
1. Tohum muhabiri hücreleri
Blasticidin dayanıklı muhabiri hücreleri yayma ve 35-mm'lik kültür kaplarına yayılmıştır. Konfluent kadar 37 ° C'de inkübe edin. Biz genellikle sirkadiyen fenotipleme için her koşulda, her muhabiri hücre hattı için ≥ 3 yemekleri hazırlamak.
2. Senkronizasyon ve kayıt ortamı değişiklik
- Konfluent muhabiri hücrelerden orta aspire kez PBS ile yıkayın ve DMEM 10 uM forskolin (veya 200 nM deksametazon) içeren ile değiştirin. Hücreler senkronize etmek için 1 saat boyunca 37 ° C'de inkübe edin. (Alternatif olarak, hücre sıcaklık döngüleri 23 veya serum şok 24 ile senkronize edilebilir.)
- Beklerken, kayıt hazırlamakaşağıdaki gibi 3T3 hücreleri için ing orta: FBS, 1x Pen / Strep / Gln, 1 uM forskolin, 1 mM lusiferin, 25 mM HEPES, pH 7.4 ile% 10 oranında içeren 1x DMEM (HyClone). Serum ve forskolin konsantrasyon ampirik olarak belirlenmektedir. Çok loş hücreleri, fenol kırmızı içermeyen aracı madde kullanılabilir.
- Forskolin ile tedavi sonunda, ortam aspire ve taze kayıt ortamı ile değiştirin.
3. Raportör hücrelerin Bio-ışıldama, kayıt
- Orta değişikliğinin ardından, buharlaşmayı önlemek için vakum gres ile yerde 40 mm steril lamelleri ve mühür ile kültür kaplarına kapsamaktadır.
- H 2 O veya CO 2 olmadan 36 ° C'de bir inkübatör set içinde tutulur LumiCycle luminometre, üzerine yemekleri yükleyin.
- Gerçek zamanlı biyolüminesans kayda başlayın. Biz genellikle bir ikinci hafta için orta değişim ve sürekli kayıt (Savelyev ark. Ayrıntılar için) 25, ardından 1 hafta ritimleri kaydetmek. (96-biz kayıt edilmesi için,ll plakaları, Sinerji SL2 kayıt cihazı olarak kullanılan; detaylar için Tartışma 1.1).
5. Veri Analizi ve Sunumu
Muhabir hücreleri sirkadiyen saat fonksiyonu üzerinde fenotipik etkileri belirlemek için kritik yüksek çözünürlüklü kantitatif lüminesans kayıt kolaylaştırır. Faz, periyot uzunluğu, ritim genlik ve sönüm oranı dahil sirkadiyen parametrelerini elde etmek için, biz biyolüminesans verileri 5,14 analiz LumiCycle Analiz programı (Actimetrics) kullanın. Kısaca, ham veri taban ilk donatılmıştır ve bazal çıkarıldığı veri parametreleri belirlenmiştir hangi bir sinüs dalgası için donatılmıştır. Kalıcı ritimleri,>% 90 genellikle elde edilir iyiliği-of-fit gösteren örnekler için. Orta değişim üzerine yüksekten geçici biyoparlaklık nedeniyle, biz genellikle analiz verilerinin ilk döngüsü hariç.
Veri sunumu için, genellikle ti karşı ham veri (biyoparlaklık, sayım / sn) çizmekBana (gün). Gerektiğinde, bazal çıkarıldığı veri genlik ve faz karşılaştırmak için çizilebilir.
6. Temsilcisi Sonuçlar
1. Faz-spesifik sirkadiyen gazetecilere
Sirkadiyen saat biyokimyasal bir negatif geri bildirim mekanizması 1 dayanmaktadır. Çekirdek geribesleme döngüsü ritmik gen ekspresyonu (sabah faz, örneğin, Rev-erb α ile) üretmek için sirkadiyen E / E'-box arttırıcı unsurları harekete transkripsiyonel aktivatörleri BMAL1 ve SAAT ve baskılayıcılar pers ve crys oluşmaktadır. Çekirdek döngü en az diğer iki sirkadiyen cis-elementler, DBP/E4BP4 bağlama elemanı düzenler ve entegre (D-box; günlük faz, örneğin, Per3 için); gece faz ve ROR / REV-ERB bağlama elemanı (HKD örneğin, BMAL1) 17. Birden sirkadiyen elemanları tarafından Kombinatoryal düzenleme yeni ara fazları üretebilirsiniz. Örneğin, Cry1 transkripsiyontion farklı Cry1 akşam-zaman aralığı 13 'nün her üç sirkadyen elemanları (Cry1 geninin ilk intron içinde promotör ve RREs yani, D / E'-kutu ve D-box elemanları), aracılık etmektedir.
Gen regülasyonu bu mekanizmaların dayanarak, dört farklı muhabiri yapıları oluşturulur: P (Per2)-d Luc ve P (Cry1) E / E'-box ve düzenleyici bölgesinde 17 D-box elemanları hem de içeren-d Luc gazetecilere, 26,27; P (Cry1) - Tüm üç unsur tarafından kombinatoryal düzenlenmesi (örneğin, E / E'-kutusu, D-box ve HKD) 13,17 temsil Intron-d Luc ve P (BMAL1)-d Luc düzenlenmiş münhasıran RRE 9,17,19,21 tarafından. Biz muhabiri ifade beklenen farklı faz (Şekil 2) üretmek için 3T3 hücreleri içine bu gazetecilere tanıtıldı.
2. RNAi ve farmakolojik acti yoluyla Gen devirmeDaha önce bileşikleri
Transfeksiyon verimliliği yüksek olduğunda, sentetik siRNA geçici gen ekspresyonu yıkmak için hücrelere transfekte edilebilir. Transfeksiyondan teknik olarak zor olduğunda, bir ifade vektörü shRNA hücre tarafından üretilen shRNA gen devirme (KD) için siRNA için işlemden geçirilir, böylece stabil bir şekilde lentiviral enfeksiyon yoluyla hücre içine transdüksiyon ile olabilir. Burada bir ağ geçidi pLL3.7 ifade vektörü 9 (Şekil 3B) kullanılarak 3T3 hücreleri içinde U2OS hücrelerinde siRNA (Şekil 3A) ve shRNA kullanılarak Cry1 ve cry2 genlerin KD etki yaratmadığı. 3T3 hücreleri ek olarak, U2OS modeli, piyasada bulunan bir insan siRNA kütüphanelerinin yüksek verimli tarama teknikleri (örn., insan kaynaklı, sağlam sirkadyen ritim, nin onaylanmış fonksiyon üretme yeteneğine sahip için anahtar gereksinimlerini büyük ölçüde karşılayan bir üstün hücresel saat modeli olmuştur bilinen tüm saat genler ve yüksek verimli transfeksiyon ve mükellefkantitatif lüminesans kaydı). Her iki hücre tiplerinde, RNAi-aracılı KD önceki fare nakavt (KO) ve hücresel KD çalışmalar 5,10,11,28 ile tutarlı saat fenotipler ile sonuçlanmıştır. Örneğin, Cry1 KD kısaltır süre uzunluğu ve ritim sebat azaltır, cry2 KD dönemi uzatır oysa. Buna ek olarak, seçilmiş küçük moleküller ve farmakolojik olarak hedef protein işlevi perturb (Şekil 3C) için de kullanılabilir.
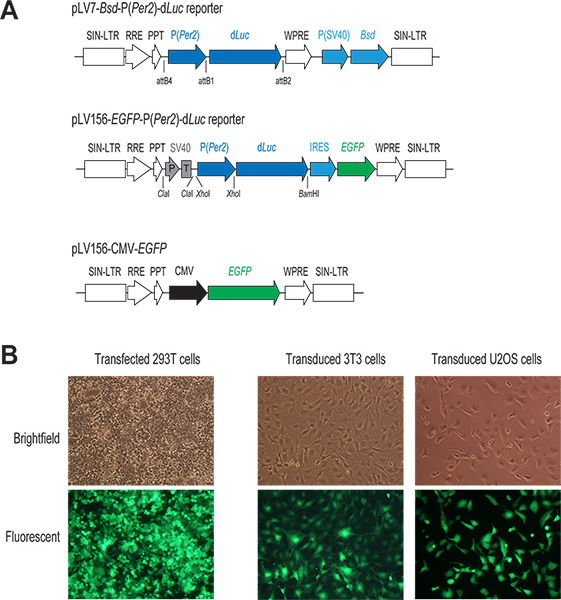
Şekil 1. Lentivirüs-aracılı gen dağıtım sistemi. İki lentiviral P (Per2)-d Luc muhabiri vektörler ve CMV-EGFP (A) şematik diyagramı oluşturmak. Konak hücre genomu içine entegre için sadece bölge gösterilmiştir. Her iki muhabiri yapıları, d Luc transkripsiyon Per2 organizatörü doğrudan kontrolü altındadır. PLV7-BSD-P (Per2)-d Luc vektör (rekombinasyon bazlı klonlama), bir coexpressed Blasticidin direnç geni (BSD) ile enfekte olan hücrelerin seçilmesi mümkündür. PLV156-P (Per2) In-d Luc vektörü (ligasyon bazlı klonlama), EGFP çeviri görsel gözlem ile enfekte olmuş hücreler FACS sıralamak için izin veren bir dahili ribozom giriş bölgesini (IRES) d Luc aşağı aracılık etmektedir. Buna ek olarak, bir SV40 promoter / terminatör (P / T) bir yalıtkan (tartışma 1.3) olarak kullanılır. CMV-EGFP kontrol vektör olarak, EGFP ifade güçlü bir CMV promotörün kontrolü altındadır. Transfekte edilen ve enfekte GFP-ifade eden hücrelerin (B) Floresan görüntüler. Genellikle, 293T hücreleri geçici transfeksiyon ve bu hücreleri GFP ile gösterilir bizim ilgi hücre hatları, lentiviral enfeksiyon hem de yüksek verim elde etmek. büyük bir rakam görmek için buraya tıklayın .

Şekil 2. 3T3 hücreleri biyolüminesans gazetecilere Faz-spesifik ekspresyonu Bu deneyde kullanılan lentiviral muhabiri vektörleri pLV7-BSD-P (Per2)-d Luc, P (Cry1)-d Luc, P (Cry1) -. Intron-d Luc, ve P (BMAL1)-d Luc. Her bir raportör olarak oklarla gösterilen salınım farklı bir faz sergiler. Per2 ve sabah günlük evreleri ve gece aşamasında BMAL1 organizatörü, P (Cry1) tarafından kombinatoryal düzenlenmesine Cry1 yararlanıcı sürücü pik biyolüminesans iken - Intron E-box barındıran, D-box ve RRE elemanlar pik biyolüminesensin akşamı faz bahşeder . büyük bir rakam görmek için buraya tıklayın .
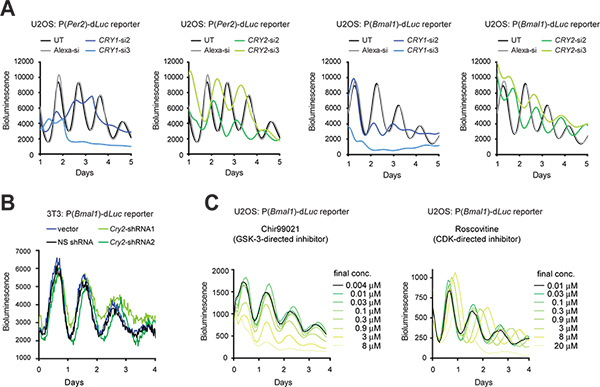
Şekil 3. Muhabir hücrelerinde sirkadiyen biyolüminesans ritimlerin genetik ve farmakolojik pertürbasyon. (A) Cry1 Etkileri ve U2OS muhabiri hücresel ritimleri siRNA'lar tarafından cry2 devirme. LumiCycle luminometrede 35 mm tabaklar içinde hücre biyolüminesans kayıt için kullanılmıştır. Şekil uyarlanmıştır Referans Elsevier (2009) izni ile 10.. 3T3 muhabiri hücresel ritimleri shRNAs tarafından cry2 knockdown (B) Etkileri. gelen Bir U6-shRNA kaset içeren bir ağ geçidi pLL3.7 vektör cry2 gen demonte için kullanılmıştır. shRNA2 Western blot analizi (veriler gösterilmemiştir) tarafından belirlendiği gibi shRNA1 daha iyi bir devirme verimliliğine sahiptir. A Sinerji luminometrede 96 çukurlu bir plaka içinde biyolüminesans hücrelerin kayıt için kullanılmıştır. Kayıt için ayarları aşağıdaki gibidir:. Inkübatör sıcaklığı, 33 ° C; entegrasyon süresi, 15 saniye; cel küçük molekül inhibitörlerin zaman aralığı, 30 dk (C) EtkileriU2OS raportör hücre lular ritim. Chir99021 ve Roscovitine sırasıyla, GSK-3 ve CDK karşı inhibitörleridir. ViewLux sistemi (Chir99021 tahlil) ve bir Tecan luminometrede (Roscovitine tahlil) 384 oyuklu plakalar hücre biyolüminesans kayıtlar için kullanılmıştır. Şekil Referans # 19 (Bilimler Copyright 2008 Ulusal Bilimler Akademisi, ABD) 'den uyarlanmıştır. büyük bir rakam görmek için buraya tıklayın .
Tartışmalar
1. Mevcut Protokol Değişiklikler
1.1 Kayıt cihazları ve üretilen düşünceler
Çünkü ticari durumu, LumiCycle (Actimetrics) gerçek zamanlı kayıt 4,5,9,19,29-31 için en sık kullanılan otomatik luminometre aygıt haline gelmiştir. LumiCycle son derece yüksek hassasiyet ve düşük gürültü 14 sağlamak ışık dedektörü olarak fotoçoğaltıcı borular (Proje Yönetim Ekipleri) kullanır, ve bu nedenle son derece loş lusiferaz ...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, Ulusal Bilim Vakfı (IOS-0920417) (ACL) tarafından kısmen desteklenmiştir.
Malzemeler
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| DMEM | HyClone | SH30243FS | Düzenli hücre büyümesi için |
| DMEM | Invitrogen | 12100-046 | Luminometry için |
| FBS | HyClone | SH3091003 | |
| Kalem / Strep / Gln (100x) | HyClone | SV3008201 | |
| B-27 | Invitrogen | 17504-044 | |
| D-lusiferin | Biosynth | L-8220 | |
| Poli-L-lisin | Sigma | P4707 | |
| Polybrene | Millipore | TR-1003-G | |
| Forskolin | Sigma | F6886 | |
| Tüm diğer kimyasal maddeler | Sigma | ||
| Ekipman | |||
| Doku kültürü inkübatör | 37 ° C'de% 5 CO2 | ||
| Doku kültürü kaputu | BSL-2 sertifikalı | ||
| Floresan ve Işık mikroskobu | Isteğe Faz kontrast | ||
| LumiCycle | Actimetrics |
Referanslar
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Hastings, M. H., Reddy, A. B., Maywood, E. S. A clockwork web: circadian timing in brain and periphery, in health and disease. Nat. Rev. Neurosci. 4, 649-661 (2003).
- Nagoshi, E. Circadian gene expression in individual fibroblasts: cell-autonomous and self-sustained oscillators pass time to daughter cells. Cell. 119, 693-705 (2004).
- Welsh, D. K. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Curr. Biol. 14, 2289-2295 (2004).
- Liu, A. C. Intercellular coupling confers robustness against mutations in the SCN circadian clock network. Cell. 129, 605-616 (2007).
- Kornmann, B. System-driven and oscillator-dependent circadian transcription in mice with a conditionally active liver clock. PLoS Biol. 5, e34 (2007).
- Hogenesch, J. B., Herzog, E. D. Intracellular and intercellular processes determine robustness of the circadian clock. FEBS Lett. 585, 1427-1434 (2011).
- DeBruyne, J. P., Weaver, D. R., Reppert, S. M. Peripheral circadian oscillators require CLOCK. Curr. Biol. 17, 538-539 (2007).
- Liu, A. C. Redundant function of REV-ERBalpha and beta and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms. PLoS Genet. 4, e1000023 (2008).
- Zhang, E. E. A genome-wide RNAi screen for modifiers of the circadian clock in human cells. Cell. 139, 199-210 (2009).
- Baggs, J. E. Network features of the mammalian circadian clock. PLoS Biol. 7, e52 (2009).
- Hirota, T. High-throughput chemical screen identifies a novel potent modulator of cellular circadian rhythms and reveals CKIalpha as a clock regulatory kinase. PLoS Biol. 8, e1000559 (2010).
- Ukai-Tadenuma, M. Delay in feedback repression by cryptochrome 1 is required for circadian clock function. Cell. 144, 268-281 (2011).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Sato, T. K. Feedback repression is required for mammalian circadian clock function. Nat. Genet. 38, 312-319 (2006).
- Ueda, H. R. System-level identification of transcriptional circuits underlying mammalian circadian clocks. Nat. Genet. 37, 187-192 (2005).
- Brown, S. A. The period length of fibroblast circadian gene expression varies widely among human individuals. PLoS Biol. 3, e338 (2005).
- Hirota, T. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc. Natl. Acad. Sci. U.S.A. 105, 20746-20751 (2008).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat. Protoc. 1, 241-245 (2006).
- Ueda, H. R. A transcription factor response element for gene expression during circadian night. Nature. 418, 534-539 (2002).
- Zufferey, R., Donello, J. E., Trono, D., Hope, T. J. Woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors. J. Virol. 73, 2886-2892 (1999).
- Buhr, E. D., Yoo, S. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330, 379-385 (2010).
- Balsalobre, A., Damiola, F., Schibler, . U.A serum shock induces circadian gene expression in mammalian tissue culture cells. Cell. 93, 929-937 (1998).
- Savelyev, S. A., Larsson, K. C., Johansson, A., Lundkvist, G. B. S. Slice Preparation, Organotypic Tissue Culturing and Luciferase Recording of Clock Gene Activity in the Suprachiasmatic Nucleus. J. Vis. Exp. (48), e2439 (2011).
- Akashi, M., Ichise, T., Mamine, T., Takumi, T. Molecular mechanism of cell-autonomous circadian gene expression of Period2, a crucial regulator of the mammalian circadian clock. Mol. Biol. Cell. 17, 555-565 (2006).
- Ohno, T., Onishi, Y., Ishida, N. A novel E4BP4 element drives circadian expression of mPeriod2. Nucleic Acids Res. 35, 648-655 (2007).
- Maier, B. A large-scale functional RNAi screen reveals a role for CK2 in the mammalian circadian clock. Genes Dev. 23, 708-718 (2009).
- Yoo, S. H. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc. Natl. Acad. Sci. U.S.A. 101, 5339-5346 (2004).
- Liu, A. C., Lewis, W. G., Kay, S. A. Mammalian circadian signaling networks and therapeutic targets. Nat. Chem. Biol. 3, 630-639 (2007).
- Ko, C. H. Emergence of noise-induced oscillations in the central circadian pacemaker. PLoS Biol. 8, e1000513 (2010).
- Izumo, M., Johnson, C. H., Yamazaki, S. Circadian gene expression in mammalian fibroblasts revealed by real-time luminescence reporting: temperature compensation and damping. Proc. Natl. Acad. Sci. U.S.A. 100, 16089-16094 (2003).
- Izumo, M., Sato, T. R., Straume, M., Johnson, C. H. Quantitative analyses of circadian gene expression in mammalian cell cultures. PLoS Comput. Biol. 2, e136 (2006).
- Chen, Z. Identification of diverse modulators of central and peripheral circadian clocks by high-throughput chemical screening. Proc. Natl. Acad. Sci. U.S.A. 109, 101-106 (2011).
- Yamaguchi, S. Synchronization of cellular clocks in the suprachiasmatic nucleus. Science. 302, 1408-1412 (2003).
- Akashi, M., Hayasaka, N., Yamazaki, S., Node, K. Mitogen-activated protein kinase is a functional component of the autonomous circadian system in the suprachiasmatic nucleus. J. Neurosci. 28, 4619-4623 (2008).
- Hoshino, H., Nakajima, Y., Ohmiya, Y. Luciferase-YFP fusion tag with enhanced emission for single-cell luminescence imaging. Nat. Methods. 4, 637-639 (2007).
- Asai, M. Visualization of mPer1 transcription in vitro: NMDA induces a rapid phase shift of mPer1 gene in cultured SCN. Curr. Biol. 11, 1524-1527 (2001).
- Wilsbacher, L. D. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc. Natl. Acad. Sci. U.S.A. 99, 489-494 (2002).
- Yamazaki, S. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Welsh, D. K., Noguchi, T., Yuste, R. Cellular bioluminescence imaging. Imaging: A Laboratory Manual. , 369-385 (2011).
- Nakajima, Y. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, e10011 (2010).
- Guilding, C. A riot of rhythms: neuronal and glial circadian oscillators in the mediobasal hypothalamus. Mol. Brain. 2, 28 (2009).
- O'Neill, J. S. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Fuller, P. M., Lu, J., Saper, C. B. Differential rescue of light- and food-entrainable circadian rhythms. Science. 320, 1074-1077 (2008).
- Mukherjee, S. Knockdown of Clock in the ventral tegmental area through RNA interference results in a mixed state of mania and depression-like behavior. Biol. Psychiatry. 68, 503-511 (2010).
- Saijo, K. A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death. Cell. 137, 47-59 (2009).
- Elias, G. M. Synapse-specific and developmentally regulated targeting of AMPA receptors by a family of MAGUK scaffolding proteins. Neuron. 52, 307-320 (2006).
- Isojima, Y. CKIepsilon/delta-dependent phosphorylation is a temperature-insensitive, period-determining process in the mammalian circadian clock. Proc. Natl. Acad. Sci. U.S.A. 106, 15744-15749 (2009).
- Bucan, M., Abel, T. The mouse: genetics meets behaviour. Nat. Rev. Genet. 3, 114-123 (2002).
- Hughes, M. E. Harmonics of circadian gene transcription in mammals. PLoS Genet. 5, e1000442 (2009).
- Atwood, A. Cell-autonomous circadian clock of hepatocytes drives rhythms in transcription and polyamine synthesis. Proc. Natl. Acad. Sci. U.S.A. 108, 18560-18565 (2011).
- Panda, S. Coordinated transcription of key pathways in the mouse by the circadian clock. Cell. 109, 307-320 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır