A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تتبع الفيروسية من الدوائر العصبية تعريف وراثيا
In This Article
Summary
ووصف طريقة تتبع الخلايا العصبية مرتبطة synaptically. نستخدم TVA خصوصية خلية المنبع لبحث ما إذا كان السكان الخلية ذات الاهتمام يتلقى مساهمات من أنواع الخلايا متشابك تعريف وراثيا.
Abstract
الطرق التقليدية لدراسة الدوائر العصبية هي الإنتاجية منخفضة نسبيا. الفيروسات عبر التشابك، وخاصة داء الكلب الكاذب (PRV) وفيروس داء الكلب (RABV)، وفيروس التهاب الفم الحويصلي مؤخرا (VSV)، لدراسة الدوائر، تزداد شعبية. هذه الأساليب أعلى إنتاجية استخدام الفيروسات التي تنقل بين الخلايا العصبية في الاتجاه إما تقدمي أو رجعي.
مؤخرا، تم وضع RABV تعديل لتتبع أحادي المشبك الوراء. (الشكل 1A). في هذه الطريقة، يتم حذف بروتين سكري (G) الجينات من الجينوم الفيروسي، والامدادات فقط في الخلايا العصبية المستهدفة. ويتحقق خصوصية العدوى عن طريق استبدال لG خيالية، ويتألف من مجال خارج الخلية من بروتين سكري ASLV A-والمجال حشوية من RABV-G (A RG /)، لG-RABV العادية 1. هذا G خيالية يصيب الخلايا على وجه التحديد التعبير عن مستقبلات TVA 1. يمكن للترميز الجين TVA كان دelivered بطرق مختلفة 2-8. بعد RABV-G إصابة الخلايا العصبيه TVA، معربا عن، يمكن أن يحيل إلى RABV الخلايا العصبية، وغيرها من توصيل synaptically في اتجاه الوراء حسب طبيعة G الخاصة الذي شارك في تسليمها مع مستقبلات TVA. تصف هذه التقنية عدد كبير نسبيا من المدخلات (5-10٪) 2 الصعود إلى نوع من الخلايا المحددة، وتوفير عينات من كل من المدخلات على نوع الخلية كاتب محدد.
ونحن مؤخرا تعديل هذه التقنية لاستخدام VSV باعتباره التتبع عبر التشابك 9. VSV ديها العديد من المزايا، بما في ذلك سرعة التعبير الجيني. نحن هنا التفاصيل جديد الفيروسية نظام تتبع باستخدام VSV مفيدة لسبر الدارات الدقيقة للقرار زيادة. في حين أن الاستراتيجيات التي نشرتها الأصلي يكرشام وآخرون (4) وبيير وآخرون .. 9 وضع العلامات تصريح من أي الخلايا العصبية التي يصاب المشروع على TVA-في البداية، معربا عن خلايا، وهنا تم تصميم VSV أن يحيل فقط إلى TVA-معربا عن الخلايا (1B الشكل). وpseudotyped الفيروس لاول مرة مع RABV-G للسماح إصابة الخلايا العصبية المصب من TVA، معربا عن الخلايا العصبية. بعد اصابة هذه الفئة من السكان الأولى من الخلايا، الذي صدر الفيروس يمكن أن تصيب فقط TVA، معربا عن الخلايا. لأنه يقتصر انتشار عبر التشابك الفيروسية لTVA، معربا عن الخلايا، ووجود عدم وجود اتصال من أنواع الخلايا المحددة يتم استكشافها مع ارتفاع القرار. يظهر مخطط تدفق تجريبية لهذه التجارب في الشكل 2. هنا نعرض نموذج الدائرة، وذلك من الانتقائية الاتجاه في شبكية العين الماوس. ندرس التواصل بين الخلايا عديم الاستطالات النجمي (الحويصلات) إلى خلايا الشبكية العقدة (RGCs).
Protocol
1. صنع الفيروسات من [كدنا]: استرداد VSV من [كدنا] باستخدام الوقس-T7 نظام 10
- تقسيم يوم واحد قبل التجربة، BsrT7 الخلايا في صحن 60 ملم تحتوي على DMEM + 10٪ FBS. خلايا البذور في صحن 2E6. وتستمد BsrT7 الخلايا من BHK21، أو الطفل الهامستر الكلى، وخلايا.
- PBS دافئة مع المغنيسيوم و 1 مم 1 مم إلى الكالسيوم 37 ° C.
- الحصول على قسامة الصغيرة vTF7-3، وهو فيروس الوقس معربا عن T7 بوليميريز، وذوبان الجليد إلى درجة حرارة الغرفة. vTF7-3 هو فيروس المعدية الوقس معربا عن البلمرة T7 11، وينبغي ألا تستخدم إلا في احتواء السلامة الأحيائية المستوى 2. ويستخدم هذا النظام لتوليد مستويات التعبير القصوى للنصوص المطلوب من البلازميدات تقاس في الخطوة 1.9. دوامة الفيروس لمدة 30 ثانية بسرعة قصوى. يصوتن في sonicator الطاولة لمدة 2 دقيقة في حمام مائي في درجة حرارة الغرفة. دوامة مرة أخرى لمدة 30 ثانية لتفريق كتل الفيروسية.
- إزالة وسائل الإعلام من الخلايا BSRT7.
- إضافة ميكرولتر 11،7 vTF7-3إلى 600 ميكرولتر PBS مع المغنيسيوم والكالسيوم وإضافة الخليط على الخلايا.
- الانتقال إلى لوحات حاضنة 34 C ° مع 5٪ CO 2. لوحات الصخور بلطف مرة واحدة كل 10 دقيقة.
- بعد 45 دقيقة انقضت، تبدأ ترنسفكأيشن. إضافة 20 ميكرولتر lipofectamine 2،000 إلى 1 مل DMEM والمزيج. الانتظار 5 دقائق.
- إضافة 5،25 ميكروغرام PN، 2.3 ميكروغرام PP، و 1.2 ميكروغرام رر، 1 ميكروغرام pCAG RABV-G، و 6 ميكروغرام الجينومية VSV [كدنا] إلى 500 ميكرولتر DMEM. PN وبولي بروبلين وجمع والبلازميدات القيادة التعبير عن الجينات الفيروسية VSV تحت المروج T7 10، مع المبالغ المحددة تجريبيا للانقاذ الأمثل للفيروس.
- الجمع بين كل من أنابيب والمزيج. الانتظار 15 دقيقة في درجة حرارة الغرفة.
- إزالة PBS ويغسل مرة واحدة مع لوحات DMEM 1.5 مل.
- نضح شطف سائل الإعلام. إضافة إلى مزيج ترنسفكأيشن وحة. الانتقال إلى لوحات 34 ° C الحاضنة.
- انتظر 5 ساعة، ثم إزالة وسائل الإعلام.
- تغيير وسائل الإعلام إلى 4 مل + 2٪ DMEM FBS + 1X-البنسلين الستربتوميسين + 10 ملي HEPES درجة الحموضة 7.4. إضافة Penicillin-الستربتوميسين، لمنع التلوث، وHEPES، للحفاظ على درجة الحموضة وسائل الإعلام، مهمة جدا. يمكن الاستغناء محتوى FBS إلى 2٪، كما سيتم تدمير هذه الخلايا في غضون أيام من الفيروس، وبالتالي لا تحتاج FBS 10٪.
- لوحات مكان إلى 34 درجة مئوية الحاضنة ل 48-72 ساعة.
- جمع وسائل الاعلام في 3 و 6 أيام بعد ترنسفكأيشن، وحقنة مباشرة من خلال مرشح 0.20 ميكرون التصفية. هذا الفلتر حجم يزيل الفيروس الوقس، ولكن ليس VSV.
- لأننا نريد لتوريد RABV-G إلى المغلف الفيروسية، والجينوم لا ترميز الجين RABV-G، لا بد من توفيره باستمرار في غير المشبعة. للقيام بذلك، وجعل لوحة منفصلة من TVA800 293T (TVA800) الخلايا. هذه هي الخلايا التي تعبر عن مستقبلات جوهري TVA، والسماح EnvA بوساطة عدوى فيروسية 12. في 80٪ confluency، تغيير إلى وسائل الإعلام DMEM فقط، ثم بالنقل الخلايا مع 5 ميكروغرام من بلازميد ترميز البروتين G (أي pCAG RABV-G) في لوحة. نستخدم PEI كاشف ترنسفكأيشن، بوليمر polycationic التي هي أرخص بكثير من الطرق القائمة على الدهون مقارنة. ومع ذلك، يمكن أيضا أن تستخدم على نحو فعال lipofectamine لهذا الغرض. وPEI الأمثل: نسبة DNA يحتاج إلى تحديد تجريبيا. القيام بذلك في تجربة منفصلة مع مراسل الفلورسنت، أي pCAG GFP. نحن استخدام 10 ميكرولتر PEI: 4 ميكروغرام DNA.
- تطبيق طاف من الخطوة 16 على طبق من TVA800 بالنقل الخلايا.
- مراقبة هذا الطبق في اليوم التالي للحصول على أدلة من مضان من fluorophore أعرب فيروسي. ومضان وحظ لأول مرة الفيروسية تبنى خلية واحدة، وينتشر تدريجيا مع مرور الوقت (أي الشكل 3). يجب أن ينتقل الفيروس في غضون ساعات قليلة.
2. مرور وتركيز VSV
- تقسيم الخلايا في وسائل الإعلام TVA800 تحتوي على DMEM FBS + 10٪ بحيث سيكون لديك 4 10-سم لوحات في confluency 80٪ ~ في اليوم التالي. 293T على أساس الخلايا تعمل بشكل جيد بسبب تران العاليةsfectability، واستخدام TVA، معربا عن الخلايا يعزز السرعة التي الخلايا في الطبق بالعدوى. قد خطوط الخلايا الأخرى transfectable عالية تخدم الغرض أيضا.
- في 80٪ confluency، تغيير إلى وسائل الإعلام DMEM فقط، ثم بالنقل الخلايا مع 5 ميكروغرام من ترميز البلازميد البروتين G الذي تريد استخدامه (أي pCAG RABV-G) في لوحة. نستخدم PEI، ولكن باستخدام الدهن / Lipofectamine العمل أيضا.
- الانتظار بعد يوم واحد ترنسفكأيشن لتراكم التعبير / سطح بروتين سكري. تغيير وسائل الإعلام (5 مل / لوحة) لFBS 10٪ + DMEM، ثم تصيب مع rVSV (A RG /) على الفيروس في تعدد العدوى (وزارة الداخلية) بنسبة 0.01 <0.1
- تحقق من كمية العدوى 24 ساعة في وقت لاحق. يجب أن تشاهد الخلايا المصابة (GFP مضان التي حددتها)، مع بعض البقع المحيطة الخلايا المصابة (أي الشكل 3). عادة انها الوحيدة التي تستحق جمع طاف إذا كنت ترى> 50٪ من الخلايا المصابة، وإلا فإن التتر الفيروسية obtaineوسوف يكون تركيز د من دون المستوى الأمثل.
- إذا> 50٪، وجمع 5 مل من وسائل الإعلام / لوحة، واستبدالها مع 5 مل من وسائل الإعلام الجديدة. إذا يصاب عدد قليل جدا من الخلايا، والانتظار لمدة ساعة 12-24، والتحقق مرة أخرى. تجميد supernatants جمعها في -80 ° C.
- جمع كل على مدار 24 ساعة لمدة 3 أيام بعد ذلك، ليصبح المجموع 4 أيام.
- تماما، إذا كنت بدأت مع 4 لوحات، ويجب أن يكون 20 مل من وسائل الإعلام من كل يوم - حتى مل مجموع 80، أو أنابيب نابذة فائقة السرعة بقيمة 2 طاف. ذوبان الجليد في supernatants في 37 ° C وتصفية أكثر من 0،45 ميكرون مرشحات على الجليد. قسامة 36 مل من الفيروس في أنابيب الطرد المركزي بيكمان.
- تركيز طاف (21،000 K في الدوار SW28 (= 80000 XG) لمدة 90 دقيقة) في 4 درجات مئوية. صب طاف في كوب يحتوي على مواد التبييض 10٪، وبينما هو مقلوب الأنبوب، استخدام الشافطة لإزالة وسائل الإعلام بقدر من الجانب من الأنبوب ممكن.
- بينما تغطيتها. يهز أنابيب الفيروسي C ° 4 في ل1 ساعة. A شاكر ابو القياسية فيدورة في الدقيقة 120 T كافية.
- يسحن بلطف بيليه في وسائل الإعلام المتبقية pipetting بلطف صعودا وهبوطا 30 مرة. يجب الحرص على عدم إدخال فقاعات الهواء. يجب أن يكون حجم وسائل الإعلام المتبقية حوالي 30 ميكرولتر. قسامة هذا الحجم في أنابيب متعددة وذلك لمنع ذوبان الجليد متعددة تجميد دورات لأي سهم معين، وهذا يمكن أن يؤدي إلى انخفاض في عيار الفيروسية. يمكن تجميد هذه مأخوذة في -80 ° C.
- عيار الفيروس. Titering في حوالي 2 يوما بعد العدوى هو الأمثل. ويمكن ملاحظة الإصابة الأولية في غضون ساعات، ولكن تحصل على التمثيل الناقص للعيار إذا كنت تنتظر فقط 1 يوم. من أجل الحصول على عيار الفيروسية، إجراء تجربة التخفيف الحد من الفيروس تتركز على خط الخلية المناسبة (293T الخلايا تعمل بشكل جيد) في لوحة 24-حسنا، إضعاف الفيروس يساوي 10-fold 1 حتي 1: 1،000،000. والتتر نحصل عادة ما تكون في حدود 10 8 -10 وحدة التقريب 10 التشكيل (FFU) / مل.
3. فيرلنا حقن
- نستخدم الفئران، وعادة ما بين 6-10 أسابيع من العمر، لهذه التجارب. وأي عمر بعد ذلك تم تأسيس الدوائر يكفي. سوف نختار انتقال من خلايا الشبكية العقدة (RGCs) إلى الخلايا عديم الاستطالات النجمي (الحويصلات) كمثال على ذلك. هذه التجربة، كما diagramed في الشكل 2، يتطلب حيوان الثلاثي المعدلة وراثيا وعلى بعد حقنة واحدة من الفيروس. (تمت الموافقة على جميع الإجراءات التي أبداها IACUC في كلية الطب بجامعة هارفارد، وكان فقا للمبادئ التوجيهية المؤسسية).
- أولا، تحتاج إلى الحيوانات السليمة يمكن إنشاء. الهدف هو أن يكون TVA التي أعرب عنها في نوع من الخلايا أن أحد يرغب في تعيين في، عن طريق فيروس (أي الفيروس المرتبط بالفيروس الغدي، AAV)، أو عن طريق أليل المعدلة وراثيا. عادة يتم الحصول على نوع من الخلايا خصوصية التعبير من قبل لجنة المساواة العرقية. هنا، ونحن أيضا عبرت في أليل التعبير الشرطي TVA 7 إلى الكولين أسيتيل (الدردشة)-لجنة المساواة العرقية أليل 13، بحيث يتم التعبير عن TVAفي جميع الخلايا التي لها تاريخ التعبير لجنة المساواة العرقية (الحويصلات). عبرنا أيضا مشروطة أليل tdTomato التعبير (R26TdT) لرؤية TVA، معربا عن الخلايا.
- الإحداثيات للموقع الحقن لا بد من تحديد. ويمكن الاطلاع على هذه الإحداثيات من مصلحة في الدماغ الأطلس، أي فرانكلين وPaxinos مخ الفأر أطلس 14. هذه الإحداثيات بحاجة إلى أن يلاحظ بالنسبة لمعلم معين على الجمجمة الماوس. نستخدم bregma، ولكن أي نظام الإحداثيات كافية.
- إعداد جهاز التجسيمي. تشغيل وحدة تحكم microinjector، ونقل الغواص وحامل قطب كهربائي في مكانها. ثم العودة شغل الإبرة حقن مع الزيوت المعدنية لتوفير واجهة مع الفيروس. وضع الإبرة ثم الى والغطاس، والتأكد من عدم وجود فقاعات الهواء تبقى في الإبرة.
- ذوبان الجليد الفيروس، ومكان على الجليد لمنع انخفاض عيار الفيروسية. تعيين microinjector "سحب" ونقل أنبوب من الفيروسات مثل أن هذا هو contactiنانوغرام في شعري على microinjector. سحب المبلغ اللازم من rVSV (A RG /) pseudotyped مع RABV-G للتجربة.
- يتم إعطاء جرعة الحيوانات قبل العملية من البوبرينورفين (0،05-0،1 ملغ / كلغ) قبل الجراحة تبدأ. لتخدير الحيوان، إما استنشاق isoflurane، أو حقنة داخل الصفاق من الكيتامين (40-80 مغ / كغ) وزيلازين (5-10 ملغ / كغ) خليط كافية. اختيار مخدر يعتمد على المستخدم. ثم يتم تنفيذ A قرصة أخمص القدمين للتأكد من أن الحيوانات هي تخدير كامل، وإذا كان الحيوان لا يستجيب، يمكنك المضي قدما في الإجراء. تأكد من الحصول على تراخيص سليمة قبل استخدام هذه الأدوية.
- توضع على وسادة الحيوانات ساخنة، التي دعمت على حامل متحرك لتحديد المواقع الماوس. لا يزال هناك الحيوان طوال فترة العملية الجراحية. تطبيق مرهم لمنع جفاف العين للقرنية في حين أن الحيوان للتخدير.
- رئيس الماوس، ثم يحتاج إلى أن يستقر في التجسيمي علىpparatus. استخدام أشرطة الأذن على جهاز التجسيمي للتأكد من أن الرأس هو المضمون جيدا، على ان يكون رئيس موازية على الأرض، ولا تدوير أفقيا. بمجرد الانتهاء من هذه، وضبط شريط دغة للمساعدة في استقرار الرأس.
- وحلق الفراء الحيوان في منطقة شق على قمة الرأس. ثم بعد ذلك يتم غسل هذه المنطقة ثلاث مرات مع الإيثانول، وذلك ثلاث مرات مع اليود. ثم يتم إجراء شق في الجلد مع مشرط، وكشف عن الجمجمة.
- مرة واحدة يتم إعداد وتركيب الماوس الحقن، bregma يجب ان يكون موجودا. هذا هو المجال في وسط الرأس إلى أن السهمي واثنين من الغرز الاكليلية تلبية. مرة واحدة وتقع هذه المنطقة، ويمكن استخدام الجهاز على الأوجه التجسيمي لضبط microinjector إلى إحداثيات المناسبة. هنا، ونحن حقن نواة الركبي الجانبي (LGN)، وذلك باستخدام إحداثيات A P / -2،46 من bregma، L / M 2، D / V 2.75.
- بمجرد طلبه للإحداثيات في، يجب أن يتم تجميعها في الحفر.ضع قمة الحفر في الحفر، ثم قم بتشغيل الحفر. يجب حفر حفرة صغيرة في موقع يدعى موقع الحقن. أن يكون لطيف جدا مع الحفر لكي لا تسبب ضررا على لحمة الدماغ. عندما العظام رقيقة جدا، والأوعية الدموية على الجافية تصبح واضحة. عند هذه النقطة، خرم بعناية حواف حج القحف مع إبرة (30 مقياس) الصغيرة وغرامة ملقط (# 5) لإزالة العظام المتبقية.
- ضبط الشعرية إلى موضع الظهرية فقط من سطح الدماغ، حيث تم حفر حفرة فقط. يجب أن تكون الإبرة حادة بما فيه الكفاية لاختراق الأم الجافية مع سهولة. ثم خفض الإبرة إلى العمق المطلوب، والبدء في الحقن. نحن حقن الفيروس بمعدل من 100 NL / دقيقة.
- الإجراء حقن لهذه النقطة يأخذ ما يقرب من عشر دقائق. بعد الحقن، والإبرة لا تزال في الدماغ لمدة سبع دقائق. هذا أمر بالغ الأهمية، إذ أنه يسمح نشر الفيروس من موقع الحقن. إزالة بسرعة على شكل إبرة في injeالنتائج ction في موقع الإصابة انخفاض الكفاءة في موقع الحقن، والعدوى على طول الجهاز إبرة.
- وببطء شديد رفعت الإبرة من موقع الحقن، وعلى مدى فترة من حوالي دقيقتين. ويهدف هذا مرة أخرى للحد من العدوى على طول الجهاز إبرة.
- إزالة مرة واحدة، ثم يتم خياطة الجلد. يتم مراقبة الحيوانات باستمرار حتى التعافي من التخدير. إدارة البوبرينورفين (0،05-0،1 ملغ / كغ) كل ساعة 12 لأيام 2.
4. حصاد الأنسجة / النسيج إعداد
- لحصاد الأنسجة من الفائدة، والوقت الأمثل يعتمد على أهداف التجربة. عموما يمكن، أولا عبر التشابك انتشار VSV يجب مراعاتها من قبل أقل من 24 ساعة بعد الحقن. ومع ذلك، سوف تنتظر أوقات أطول يؤدي إلى مزيد من الانتشار.
- لحصاد شبكية العين، يصرح باستخدامها 1 الحيوانات باستخدام الكربون استنشاق ثاني أكسيد الكربون ويتم تنفيذ خلع عنق الرحم. ثم تتم إزالة مقلة العين، ووضع في أنبوب يخدعالحتفاظ الفورمالديهايد 4٪ في برنامج تلفزيوني لمدة 1 ساعة في درجة حرارة الغرفة.
- ثم يتم وضع مقلة العين في طبق بتري مع PBS. ثم يتم تشريح الشبكية بعيدا عن الأنسجة الأخرى.
- لتحليل جبل كله، وقطع الشبكية وذلك لوضع مسطح، وضعت على شريحة زجاجية، ثم شنت وسائل الإعلام مع إطالة الذهب وتصاعد مغطاة ساترة الزجاج سمك صفر. يتم وضع الفواصل بين الشريحة السيليكون وساترة لتقليل الضغط على القوات شبكية العين. لتحليل القسم، يتم وضع شبكية العين في السكروز 30٪ في برنامج تلفزيوني حتى يغطس شبكية العين. ثم يتم وضع الخليط قبل أن تتحول إلى حرب أكتوبر 50٪ و 50٪ سكروز حل 30٪ لمدة 3 ساعة. وبعد ذلك فلاش المجمدة، والاحتفاظ بها في -80 درجة مئوية حتى جاهزة للقطع.
5. ممثل النتائج
ينبغي أن الفيروس الذي ينجو من الموت من [كدنا] تكون قادرة على إصابة خلايا TVA800، ولكن ليس 293T الخلايا (الشكل 3). تزويد RABV-G يسمح إصابة ر خلايا متعددةypes، بما في ذلك 293T. ومع ذلك، منذ يتم ترميز الجينوم A RG / في الجينوم، وانتشار الخلايا يحدث بين بمعدل أعلى من ذلك بكثير في TVA، معربا عن الخلايا.
وبمجرد أن الفيروس هو المركزة، ومجموعة نموذجية بين التتر FFU 8 10/10 10 مل وFFU / مل. هذه هي التتر كافية للاستخدام في الجسم الحي.
خلال حقن LGN في الماوس، ونحن لا تميز LGN الظهرية (dLGN) من LGN بطني (vLGN)، وعادة ما تصبح كل المصابين. لذلك، تصبح صفت أنواع متعددة RGC (الشكل 4)، بما في ذلك تلك التي المشروع إلى vLGN، مثل RGCs melanopsin (الشكل 4D) وON-DSGCs (4E الشكل)، وتلك التي المشروع إلى dLGN، مثل الصغيرة الشجرة RGCs (الشكل 4C) ON-OFF و-DSGCs (4F الشكل). على الرغم من أن أكثر من نوع واحد من فيروس ينتقل إلى RGC الحويصلات، كما ورد في مكان آخر (بيير وآخرون، في الاستعراض)، وهنا علينا أن نركز فقط على اتصالات مدروسة من DSGCs-ON-OFF لالحويصلات.
عندما كنا حقن الفئران من cTVA النمط الجيني (+) / الدردشة لجنة المساواة العرقية-(-)، حيث ينبغي التعبير عن أي TVA، وصفت RGCs فقط (أي الشكل 4). هذه هي نتيجة لامتصاص الأولي للفيروس RABV-G pseudotyped من RGCs، ويحدث انتشار لا. يصاب أي من عدوى RGCs LGN من rVSV (A RG /) فيروس لا pseudotyped مع RABV-G، وذلك بسبب عدم قدرة هذه virions لمحاور عصبية من عرضية طويلة من هذه RGCs. ومع ذلك، عندما حقن cTVA (+) / ChATCre (+) (وR26TdT (+)) في الفئران LGN، انتشار فيروس لم يحدث، فقط لخلايا الدم الحمراء، التي تعبر عن مراسل لجنة المساواة العرقية (أي الشكل 5). هذه الخلايا أيضا شارك في التسمية مع الأجسام المضادة المضادة للدردشة، وتطبق فقط في الصفائح الدردشة اثنين، مؤكدا هويتهم والحويصلات (أرقام 5B '، C'). تراوح عدد الحويصلات المسمى فيروسي في DSGC 1-9.
GE = "دائما"> 
الشكل 1. لدينا نظام تعقب الوراء عبر التشابك مقارنة مع طريقة تم تطويرها في الأصل. (A) (ط) في طريقة تم تطويرها من قبل يكرشام والزملاء، "خلايا كاتب" نحن transfected مع ثلاثة جينات: مستقبلات TVA، وتستخدم للسماح الإصابة على وجه التحديد من الخلايا المصابة بالعدوى بالنقل، وRABV-G، وتستخدم لاستكمال RABV، التي كان الجين نفسه G حذف، وبروتين فلوري الأحمر لتحديد الخلايا المصابة بالعدوى بالنقل. (الثاني) A RABV pseudotyped مع البروتين A RG / TVA يصيب الخلايا، معربا عن، مما يجعلها الصفراء. (الثالث) نقل عبر التشابك الوراء يحدث لخلايا عصبية المنبع. (B) (ط) في المنهج في آن، وتعرف TVA، معربا عن الخلايا وراثيا، والمسماة مع الشرطي المتواجد الفلورسنت الأحمرفيها (الثاني) و"خلايا كاتب" هي تلك إصابة قبل VSV ترميز الجين A RG / في الجينوم الفيروسي. كاتب هذه الخلايا لا تعبر عن مستقبلات TVA. (الثالث) نقل عبر التشابك الوراء يحدث لTVA، معربا عن الخلايا العصبية فقط إذا هذه الخلايا توفير مدخلات متشابك على الخلايا العصبية كاتب. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
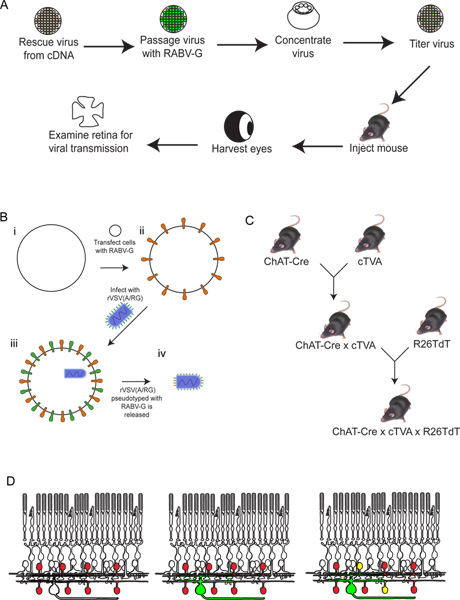
الشكل 2. تخطيطي للإجراء التجريبي. (أ) أولا، هو انقاذ الفيروس من [كدنا]. وبعد ذلك وpassaged pseudotyped مع RABV-G، ويتركز وtitered. ثم يتم حقن هذا الفيروس إلى الدماغ، حيث يتم السماح لها احتضان للفترة المطلوبة من الوقت. بعد هذاالوقت، هو المقطوع العين، وشبكية العين تشريح وتحليلها. (B) رسم تخطيطي للpseudotyping الفيروس مع RABV-G. هذا ضروري لإصابة خلايا الشبكية العقدة من حقن الدماغ. وتقاس أولا الجينات RABV-G إلى خلايا الأنسجة التعبير عن مستقبلات TVA. ثم يصاب هذه الخلايا مع rVSV (A RG /) الفيروس. سوف يكون الافراج virions RABV-G في المغلف الفيروسية، ولكن لن يكون لهذا الجين RABV-G في الجينوم الفيروسي. (C) A التخطيطي من الفأرة يعبر اللازمة للحيوانات المعدلة وراثيا الثلاثي. وعبرت المشروط TVA وtdTomato الأليلات إلى برنامج تشغيل لجنة المساواة العرقية في الاختيار، بحيث يتم التعبير عن كل من TVA وtdTomato فقط في الخلايا التي لها تاريخ التعبير لجنة المساواة العرقية. في هذا المثال، استخدمنا الدردشة لجنة المساواة العرقية. (D) A التخطيطي للعدوى الشبكية من أجل اقتفاء أثر DSGC-SAC الدوائر. يتم إجراء الدردشة لخلايا TVA صريحة وtdTomato، كما هو مبين في (C). يصاب RGCs من LGN فيأنتجت fection من الفيروس في (B). بأنه الفيروس عن GFP، فإن هذه RGCs تكون خضراء. وانتشر الفيروس بعد ذلك فقط إلى TVA، معربا عن الخلايا عديم الاستطالات الدردشة إذا كانت متصلة إلى RGC المسمى. وسوف تكون هذه الخلايا الحمراء و الخضراء، أو الصفراء. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
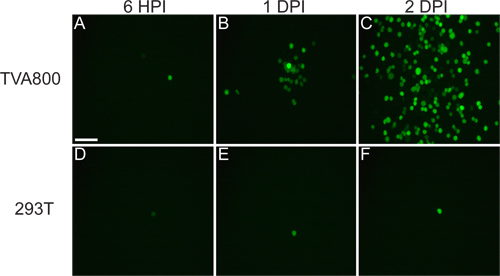
الشكل 3. سلوك rVSV (A RG /) فيروس على 293T وTVA800 الخلايا. وهذه الخلايا المصابة مع rVSV عيار منخفض (A RG /) pseudotyped مع RABV-G. ينتشر الفيروس بين TVA، معربا عن الخلايا في غضون ساعات، كما هو مبين في 6 ساعات العدوى آخر (HPI)، 1 و 2 العدوى آخر أيام (DPI). ومع ذلك، فإن انتشار الخلايا على 293T، والتي لا تعبر عن مستقبلات TVA، على الرغم من أننير لا يحدث ذلك، يحدث أبطأ بكثير. شريط النطاق = 100 ميكرومتر.
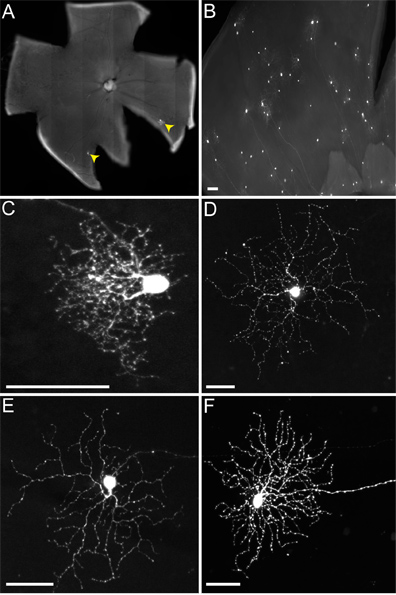
الشكل 4. التهابات ممثل RGCs غير TVA الفئران معربا عن. تم حقن الحيوانات في LGN مع rVSV (A RG /) فيروس pseudotyped مع RABV-G، والأنسجة تحصد 2 نقطة في البوصة. (A) (أشارت RGCs من رؤوس الأسهم الصفراء) متفرقة أو (B) ويمكن الحصول على العدوى الكثيفة، اعتمادا على عيار من الفيروسات ونوعية الحقن. ويمكن تحديد أنواع مختلفة من RGCs يعتمد على التشكل، بما في ذلك (C) RGCs الشجرة الصغيرة، (D) من النوع 1 RGCs melanopsin، (E)-ON DSGCs، و (F) ON-OFF-DSGCs، وغيرها. على نطاق والحانات = 50 ميكرومتر.

الشكل 5. rVSV (A RG /) نقل من DSGCs-ON-OFF لالحويصلات يتبع النمط المتوقع. (A) ON-OFF-DSGCs (رأس السهم الأبيض مع ملء الأخضر) فيروس يحيل إلى الحويصلات المتعددة (رؤوس الأسهم الصفراء). (A '). كل الخلايا الخضراء التي ليست DSGC شارك في التسمية مع مراسل لجنة المساواة العرقية، مما يشير إلى أنها TVA، معربا عن الحويصلات. (BC) وDSGC (رأس السهم الأبيض مع ملء الأخضر) والحويصلات (رؤوس الأسهم الصفراء) تطبق في طبقات الدردشة المناسبة لطبقة الشبكية الداخلية ضفيري (IPL). الخلايا التي تكون ينقل الفيروس تشمل داخل وخارج الحويصلات. أرقام لوحات B في "وC 'تشير إلى الصفائح IPL. يشار فقط إلى موقع سوما DSGC من رأس السهم ولكن لا يظهر في لوحة C لتسليط الضوء على الحويصلات. على نطاق والحانات = 50 ميكرومتر.
Discussion
باستخدام الفيروسات لدراسة الدوائر العصبية هي طريقة إنتاجية عالية نسبيا من الخلايا العصبية تحليل المتصلة. ومع ذلك، على حد سواء توليد VSV وvirions RABV ليست تافهة. على الرغم من أن يتم توفير بروتوكول المذكورة أعلاه لإنقاذ الفيروس من [كدنا]، فإنه لا يزال حدثا المنخفضة الاحتمال....
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نود أن نعترف شون ويلان للحصول على مساعدة إنقاذ المتغيرات VSV المؤتلف، وديدم بيدا وChrenek ريان للمساعدة التقنية. وأيد هذا العمل من قبل HHMI (CLC)، و# NS068012-01 (KTB).
Materials
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
References
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved