Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Trazado de Circuitos Viral genéticamente definidos Neural
En este artículo
Resumen
Un método de rastreo de neuronas conectadas sinápticamente se describe. Usamos especificidad TVA de una célula de aguas arriba para probar si una población celular de interés recibe la entrada sináptica de tipos de células genéticamente definidos.
Resumen
Los métodos clásicos para el estudio de los circuitos neuronales están rendimiento bastante bajo. Transsynaptic virus, particularmente la pseudorrabia (PRV) y virus de la rabia (RABV), y más recientemente virus de la estomatitis vesicular (VSV), para el estudio de circuitos, es cada vez más popular. Estos métodos de rendimiento más altos utilizan virus que transmiten entre las neuronas, ya sea en la dirección anterógrada o retrógrada.
Recientemente, un RABV modificado para monosináptico retrógrada rastreo fue desarrollado. (Figura 1A). En este método, la glicoproteína (G) de genes se elimina del genoma viral, y reabastecidos sólo en las neuronas específicas. Especificidad infección se logra mediante la sustitución de una G quimérico, formado por el dominio extracelular de la glicoproteína ASLV-A y el dominio citoplásmico de la RABV-G (A / RG), para el normal RABV-G 1. Este G quimérica específicamente infecta las células que expresan el receptor TVA 1. El gen que codifica TVA puede sido delivered por diversos métodos 2-8. Tras RABV-G infección de una neurona TVA-expresando, el RABV puede transmitir a otras neuronas, conectadas sinápticamente en una dirección retrógrada por la naturaleza de su propio G que fue cosuministrado con el receptor de TVA. Esta técnica etiqueta un número relativamente grande de entradas (5-10%) 2 en un tipo celular definido, proporcionando un muestreo de todas las entradas en un tipo de célula de arranque definido.
Recientemente hemos modificado esta técnica a utilizar VSV como un trazador transsynaptic 9. VSV tiene varias ventajas, incluyendo la rapidez de la expresión génica. A continuación detallamos un nuevo sistema de rastreo viral utilizando útiles para sondear microcircuitos con mayor resolución VSV. Mientras que las estrategias original publicado por Wickersham et al. 4 y Beier et al. 9 permiso de etiquetado de cualquier neuronas que se proyectan hacia inicialmente infectado-TVA-expresando células, aquí VSV fue diseñado para transmitir sólo a TVCélulas que expresan A-(Figura 1B). El virus es primero pseudotyped con RABV-G para permitir la infección de aguas abajo de las neuronas que expresan TVA neuronas. Después de infectar esta primera población de células, el virus liberado sólo pueden infectar células que expresan TVA. Debido a la propagación viral transsynaptic se limita a las células que expresan TVA, la presencia de ausencia de la conectividad de los tipos de células definidos pueden ser explorados con alta resolución. Un diagrama de flujo experimental de estos experimentos se muestra en la Figura 2. Aquí se muestra un circuito de modelo, el de la dirección de selectividad en la retina del ratón. Se examina la conectividad de las células amacrinas starburst (ZEC) a las células ganglionares de la retina (CGR).
Protocolo
1. Haciendo Virus de cDNA: Recuperación de VSV de cDNA utilizando la vacuna-T7 System 10
- Un día antes del experimento, dividir BsrT7 células en placa de 60 mm que contiene DMEM + 10% de FBS. Semillas 2E6 células por placa. BsrT7 células se derivan de BHK21, o riñón de cría de hámster, células.
- PBS caliente con magnesio 1 mM y 1 mM de calcio a 37 ° C.
- Obtener una pequeña alícuota vTF7-3, un virus vaccinia que expresa la polimerasa T7, y descongelación a temperatura ambiente. vTF7-3 es un virus vaccinia infeccioso que expresa la polimerasa T7 11, y se debe utilizar solamente en el nivel de Bioseguridad 2 de contención. Este sistema de expresión se utiliza para generar los niveles máximos de las transcripciones deseados procedentes de plásmidos transfectados en el paso 1,9. Vortex virus durante 30 segundos a velocidad máxima. Someter a ultrasonidos en un baño de ultrasonidos de sobremesa durante 2 minutos en baño de agua a temperatura ambiente. Vórtice de nuevo durante 30 segundos para romper agregados virales.
- Retire el medio de las células BSRT7.
- Añadir 11,7 l vTF7-3a 600 l de PBS con calcio y magnesio y añadir la mezcla sobre las células.
- Mueva las placas en una incubadora de 34 ° C con 5% de CO 2. Placas de piedra suavemente una vez cada 10 min.
- Después de 45 minutos han transcurrido, comienza la transfección. Añadir 20 l de lipofectamina 2.000 a 1 ml de DMEM y mezcla. Espere 5 minutos.
- Añadir 5,25 g pN, 2,3 g PP, 1,2 g j, 1 mg g pCAG RABV-G, y 6 genómico VSV cDNA a 500 l DMEM. pN, PP y j son plásmidos de conducir la expresión de genes virales VSV bajo el promotor T7 10, con las cantidades determinadas de forma empírica para rescate óptima del virus.
- Combinar ambos tubos y mezclar. Esperar 15 minutos a temperatura ambiente.
- Retire PBS y se lavan las placas una vez con 1,5 ml de DMEM.
- Aspirar enjuague medios de comunicación. Agregue la mezcla de transfección de la placa. Mueva las placas en 34 ° C incubadora.
- Espere 5 horas, luego retire los medios de comunicación.
- Cambiar el medio a 4 ml de DMEM + 2% de FBS + 1x penicilina-estreptomicina + 10 mM de HEPES, pH 7,4. La adición de Penicillin-estreptomicina, para evitar la contaminación, y HEPES, para mantener el pH de los medios de comunicación, son muy importantes. El contenido de FBS se redujo a 2%, ya que las células serán destruidas en cuestión de días por el virus y por lo tanto no es necesario FBS 10%.
- Colocar las placas a 34 ° C incubadora durante 48-72 h.
- Recoge los medios de comunicación a las 3 y 6 días después de la transfección, e inmediatamente a través de un filtro de jeringa de 0,20 micras filtro. Este filtro de tamaño quita el virus vaccinia, pero no el VSV.
- Dado que queremos suministrar RABV-G a la envoltura viral, y el genoma no codifica el gen RABV-G, que debe ser continuamente suministradas en trans. Para ello, haga una placa separada de 293T TVA800 (TVA800) las células. Estas son células que expresan constitutivamente el receptor de TVA, permitiendo EnvA mediada por la infección viral 12. En la confluencia 80%, cambiar el medio a DMEM solo, a continuación, transfectar las células con 5 ug de plásmido que codifica la proteína G (es decir pCAG RABV-G) por placa. Usamos el PEI reactivo de transfección, un polímero policatiónico que es mucho más barato que comparables basados en lípidos métodos. Sin embargo, lipofectamina también se puede utilizar eficazmente para este propósito. El óptimo de PEI: relación de ADN tiene que ser determinado empíricamente. Hacer esto en un experimento separado con un indicador fluorescente, es decir, pCAG GFP. Utilizamos 10 l PEI: 4 g de ADN.
- Aplicar el sobrenadante de la etapa 16 en la placa transfectada de TVA800 células.
- Observe esta placa el día siguiente para pruebas de fluorescencia del fluoróforo viralmente expresado. Viral fluorescencia se observó por primera vez como una sola célula, y se extiende gradualmente con el tiempo (es decir, la Figura 3). El virus debe propagarse en unas pocas horas.
2. Pasaje y Concentración de VSV
- Dividir TVA800 células en un medio que contiene FBS DMEM + 10% de tal manera que usted tendrá cuatro placas de 10 cm en ~ 80% de confluencia al día siguiente. 293T células basadas funcionan bien debido a su alto transfectability, y el uso de células que expresan TVA aumenta la velocidad a la que las células en el plato de infectarse. Otras líneas de células altamente transfectables pueden servir al propósito también.
- En la confluencia del 80%, cambiar el medio a DMEM solo, entonces transfectar las células con 5 ug de plásmido que codifica la proteína G que desea utilizar (es decir pCAG RABV-G) por placa. Utilizamos PEI, pero FUGENE / trabajo Lipofectamine también.
- Espere un día después de la transfección para la glicoproteína expresión / superficie acumulación. Cambiar los medios de comunicación (5 ml / placa) a DMEM + 10% de FBS, a continuación, infectar con VEVr (A / RG) virus a una multiplicidad de infección (MOI) de 0,01
- Compruebe la cantidad de infección 24 horas más tarde. Debería ver las células infectadas (identificado por la fluorescencia de GFP), algunos con parches circundantes de las células infectadas (Figura es decir 3). Típicamente sólo vale la pena recogiendo el sobrenadante ver si> 50% de células infectadas, de lo contrario los títulos virales obtained de concentración será subóptima.
- Si> 50%, recoger los 5 ml de los medios de comunicación / placa, y reemplazar con 5 ml de medio fresco. Si muy pocas células están infectadas, esperar otra hora 12-24, y puedes volver a intentarlo. Congelar los sobrenadantes recogidos a -80 ° C.
- Recoger cada 24 horas a partir de entonces durante 3 días, para un total de 4 días.
- En general, si usted empieza con 4 placas, usted debe tener 20 ml de medio de cada día - así que 80 ml en total, o 2 tubos de ultracentrífuga pena de sobrenadante. Descongelar los sobrenadantes a 37 ° C y se filtra a través de filtros de 0,45 micras en hielo. Alícuota de 36 ml de virus en tubos de centrífuga Beckman.
- Se concentra el sobrenadante (21.000 K en un rotor SW28 (= 80.000 xg) durante 90 min) a 4 ° C. Decantar el sobrenadante en un vaso de precipitados que contiene 10% de lejía, y mientras el tubo se invierte, utilizar un aspirador para eliminar el medio tanto desde el lado del tubo como sea posible.
- Si bien cubierto. agitar los tubos virales a 4 º C durante 1 hr. Un agitador estándar en about 120 rpm es suficiente.
- Suavemente triturar pellet en el resto del papel suavemente pipeteando arriba y abajo 30 veces. Tenga cuidado de no introducir burbujas de aire. El volumen medio restante será de unos 30 l. Alícuota de este volumen en tubos múltiples a fin de evitar múltiples ciclos de congelación-descongelación para cualquier acción particular, ya que esto puede resultar en una disminución en el título vírico. Estas alícuotas se congelaron a -80 ° C.
- Titular el virus. Titulación en alrededor de 2 días después de la infección es óptima. La infección inicial puede observar en cuestión de horas, pero se obtiene una representación insuficiente de título si se espera sólo 1 día. Con el fin de obtener el título viral, realizar un experimento de dilución limitante del virus concentrada en la línea celular apropiada (células 293T funcionan bien) en una placa de 24-así, diluyendo el virus 10-veces a partir de 1 a 1: 1.000.000. Los títulos que obtenemos son típicamente en el rango de 10 -10 10 8 unidades formadoras de foco (ffu) / ml.
3. Virnos inyección
- Utilizamos ratones, típicamente entre 6-10 semanas de edad, para estos experimentos. De cualquier edad después de lo cual se establece un circuito sería suficiente. Vamos a elegir la transmisión de las células ganglionares de la retina (CGR) a las células amacrinas starburst (ZEC) como un ejemplo. Este experimento, como esquematizado en la Figura 2, requiere un animal transgénico triples y sólo una única inyección de virus. (Todos los procedimientos que se muestran fueron aprobados por el IACUC en la Harvard Medical School, y estaban en conformidad con las directrices institucionales).
- En primer lugar, los propios animales necesitan ser generados. El objetivo es tener TVA expresado en el tipo de célula que se desea trazar en, por medio de un virus (es decir, virus adeno-asociados, AAV), o por un alelo transgénico. La especificidad de tipo celular se obtiene normalmente mediante expresión Cre. Aquí, también cruzado en una expresión condicional alelo TVA 7 a una colina acetiltransferasa (ChAT)-Cre alelo 13, de tal manera que se expresa TVAen todas las células con antecedentes expresión Cre (las ZEC). También cruzó una expresión condicional alelo tdTomato (R26TdT) para la visualización de TVA-que expresan las células.
- Las coordenadas para el punto de inyección deben ser identificados. Estas coordenadas de interés se pueden encontrar en un atlas del cerebro, es decir, el Franklin y Paxinos ratón atlas del cerebro 14. Estas coordenadas deben tenerse en cuenta con relación a un punto de referencia dado en el cráneo del ratón. Usamos bregma, pero cualquier sistema de coordenadas es suficiente.
- Prepare el aparato estereotáxico. Encienda el controlador microinyector, y mover el émbolo y el soporte del electrodo en su lugar. Luego de vuelta a llenar la aguja de inyección con aceite mineral para proporcionar una interfaz con el virus. Ponga la aguja después sobre el émbolo, asegurándose de que no queden burbujas de aire en la aguja.
- Descongelar el virus, y colocar en hielo para evitar una caída en el título vírico. Ajuste el microinyector de "retirar" y mover el tubo de virus de manera que es contacting del capilar en el microinyector. Extraer la cantidad necesaria de VEVr (A / RG) pseudotyped con RABV-G para el experimento.
- Los animales se les administró una dosis pre-operatorio de la buprenorfina (0.05 a 0.1 mg / kg) antes de que inicie la cirugía. Para anestesiar al animal, ya sea por inhalación de isoflurano, o una inyección intraperitoneal de una mezcla de cetamina (40-80 mg / kg) y xilazina (5-10 mg / kg) mezcla es suficiente. Elección del anestésico depende del usuario. Una pizca dedo del pie se realiza a continuación para asegurarse de que los animales son completamente anestesiado, si el animal no responde, puede continuar con el procedimiento. Asegúrese de obtener las licencias correspondientes antes de usar estos medicamentos.
- Los animales se colocan en una almohadilla de calefacción, que está apoyada en un soporte móvil para el posicionamiento del ratón. El animal permanece allí durante toda la duración del procedimiento quirúrgico. Aplique ungüento para los ojos para evitar la desecación de la córnea mientras el animal está anestesiado.
- La cabeza del ratón, entonces tiene que ser estabilizado en el estereotáxica unpparatus. Utilice las barras de oreja en el aparato estereotáxico para asegurar que la cabeza es completamente segura, tal que la cabeza es paralelo al suelo, y no gira lateralmente. Una vez que se termine esto, ajuste la barra de bocado para ayudar a estabilizar la cabeza.
- La piel del animal se afeita en la región de la incisión en la parte superior de la cabeza. Esta área se lava luego tres veces con etanol, seguido de tres veces con yodo. Una incisión se hace en la piel con un bisturí, revelando el cráneo.
- Una vez que el ratón y la configuración de la inyección se preparan, bregma necesita ser localizado. Esta es el área en el centro de la cabeza que el sagital y dos suturas coronales satisfacer. Una vez que esta zona se encuentra, los diales en el aparato estereotáxico puede ser utilizado para ajustar el microinyector a las coordenadas correctas. Aquí, se inyecta el núcleo geniculado lateral (LGN), utilizando las coordenadas de un P / -2,46 de bregma, L / M 2, D / V 2,75.
- Una vez que las coordenadas se han marcado en, el taladro debe ser ensamblado.Coloque la broca en el taladro y vuelva a encender el taladro. Un pequeño agujero debe ser perforado en el sitio identificado como el lugar de la inyección. Sea muy cuidadoso con el taladro con el fin de no causar daño al parénquima cerebral. Cuando el hueso es muy fina, los vasos sanguíneos en la duramadre se aclarará. En este punto, cuidadosamente perforar los bordes de la craneotomía con un pequeño (30 gauge) de aguja y unas pinzas finas (# 5) para retirar el hueso restante.
- Ajuste el capilar a una posición justo dorsal de la superficie del cerebro, donde se perforó el agujero sólo. La aguja debe ser lo suficientemente aguda para penetrar la duramadre con facilidad. Luego bajar la aguja hasta la profundidad deseada, y comenzar la inyección. Se inyecta virus a una tasa de 100 NL / min.
- El procedimiento de inyección a este punto es de unos diez minutos. Después de la inyección, la aguja permanece en el cerebro durante aproximadamente siete minutos. Esto es fundamental, ya que permite la difusión de virus desde el sitio de la inyección. Rápidamente retirar la aguja de la forma Injection resultados del sitio en una eficiencia de la infección reducida en el sitio de inyección, y la infección a lo largo del tracto de la aguja.
- La aguja es muy eleva lentamente desde el sitio de la inyección, en un período de aproximadamente dos minutos. Esto es otra vez la intención de reducir la infección a lo largo del trayecto de la aguja.
- Una vez retirado, la piel se sutura. Los animales se controlan continuamente hasta que se recuperen de la anestesia. La buprenorfina (0,05-0,1 mg / kg) se administra cada 12 horas durante 2 días.
4. La recolección de tejidos / Tejidos Preparación
- Para cosechar el tejido de interés, el tiempo óptimo depende de los objetivos del experimento. Generalmente, propagación VSV transsynaptic primero puede ser observado por menos de 24 horas después de la inyección. Sin embargo, los mayores tiempos de espera se traducirá en más spread.
- Para cosechar la retina, los animales son sacrificados mediante inhalación primera dióxido de carbono y la dislocación cervical se realiza. El globo ocular se retira entonces, y se coloca en un tubo concontengan formaldehído al 4% en PBS durante 1 hora a temperatura ambiente.
- El globo ocular se coloca entonces en una placa Petri con PBS. La retina se diseca a otros tejidos.
- Para el análisis de todo el montaje, las retinas se cortan de manera que en posición plana, se coloca sobre un portaobjetos de vidrio, luego se monta con prolongar medios de montaje y de oro cubiertos con un cubreobjetos de vidrio de espesor cero. Espaciadores de silicona se coloca entre el portaobjetos y el cubreobjetos para minimizar las fuerzas de compresión sobre la retina. Para el análisis de la sección, la retina se coloca en 30% de sacarosa en PBS hasta los sumerge retina. Entonces se coloca en una mezcla de 50% y 50% octubre 30% de solución de sacarosa durante 3 hr. A continuación se congelaron, y se mantuvo a -80 ° C hasta el momento de cortar.
5. Los resultados representativos
El virus que es rescatado de cDNA debe ser capaz de infectar TVA800 células, pero no en células 293T (Figura 3). El suministro de la RABV-G permite la infección de células T múltipleipos, incluyendo 293T. Sin embargo, ya que el genoma A RG / es codificada en el genoma, se propaga entre las células se produce a una tasa mucho más alta en las células que expresan TVA.
Una vez que el virus es amplia concentrado, los títulos típico entre 10 8 ffu / ml y 10 10 ffu / ml. Estos títulos son adecuados para su uso in vivo.
Durante la inyección LGN en el ratón, no distinguimos LGN dorsal (dLGN) de LGN ventral (vLGN), ya que ambos suelen infectarse. Por lo tanto, múltiples tipos de RGC quedan marcados (Figura 4), incluyendo aquellos que proyectan al vLGN, tales como melanopsina CGR (Figura 4D) y ON-DSGCs (4E Figura), y aquellos que proyectan al dLGN, tales como la-pequeña cenador CGR (Figura 4C) y ON-OFF-DSGCs (Figura 4F). Aunque más de un tipo de virus de la RGC transmitida a las ZEC, según ha informado en otras partes (Beier et al., En revisión), aquí nos centramos sóloen las conexiones bien estudiadas de ON-OFF-DSGCs a las ZEC.
Cuando inyectamos ratones de genotipo de cTVA (+) / ChAT Cre-(-), donde no TVA se debe expresar, sólo CGR están etiquetados (es decir, la Figura 4). Estos se deben a la absorción inicial del virus-G pseudotyped RABV por la CGR, y no se produce propagación. No hay CGR están infectadas de una infección de LGN VEVr (A / RG) virus no pseudotyped con RABV-G, debido a la incapacidad de estos viriones a transversales de los axones largos de estos CGR. Sin embargo, si la inyección cTVA (+) / ChATCre (+) (y R26TdT (+)) ratones en el LGN, la propagación viral llega a producirse, a los glóbulos rojos, que expresan el reportero Cre (Figura es decir, 5). Estas células también co-etiqueta con el anticuerpo anti-chat, y estratificar sólo en las dos láminas ChAT, confirmando su identidad como ZEC (figuras 5B ', C'). El número de sacos viralmente marcados por DSGC varió de uno a nueve.

Figura 1. Nuestro sistema retrógrado transsynaptic rastreo en comparación con el método desarrollado originalmente. (A) (i) En el método desarrollado por Wickersham y colegas ", las células iniciales" son transfectadas con tres genes: el receptor TVA, que se utilizan para permitir la infección específica de las células transfectadas, la RABV-G, que se utiliza para complementar la RABV, que en sí tenía el gen G eliminada, y una proteína fluorescente de color rojo para identificar las células transfectadas. (Ii) Un RABV pseudotyped con la proteína A RG / TVA infecta las células que expresan, haciéndolos amarillo. (Iii) la transmisión transsynaptic retrógrada se produce en las neuronas ascendentes. (B) (i) En nuestro método, las células que expresan TVA se define genéticamente, y están marcadas con un condicional prote fluorescente rojapulgadas (ii) Las "células iniciales" son aquellos infectados por un VSV que codifica el gen A RG / en el genoma viral. Estas células iniciales no expresan el receptor de TVA. (Iii) la transmisión transsynaptic retrógrada ocurre TVA-expresando neuronas sólo si estas células proporcionan entrada sináptica en las neuronas de arranque. Haga clic aquí para ampliar la cifra .
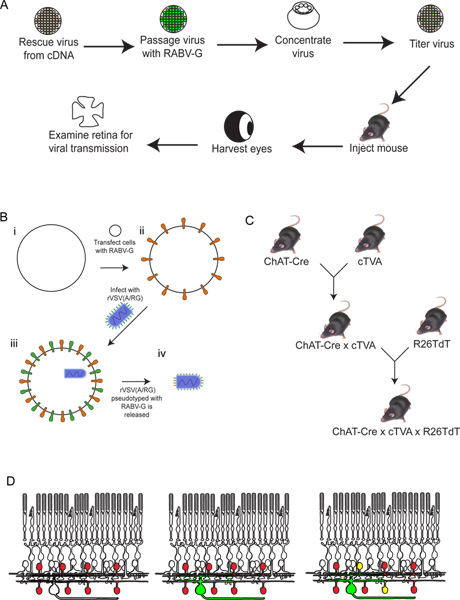
Figura 2. Esquemática del procedimiento experimental. (A) En primer lugar, el virus es rescatado de cDNA. A continuación se passaged y pseudotyped con RABV-G, y se concentró y se titularon. Este virus se inyecta entonces en el cerebro, donde se dejó incubar durante el período de tiempo deseado. Después de estetiempo, el ojo se cosecha, y la retina diseccionaron y analizaron. (B) Esquema de pseudotipado con el virus RABV-G. Esto es necesario para la infección de las células ganglionares de la retina de una inyección de cerebro. El gen RABV-G está primero transfectadas en células de cultivo de tejidos que expresan el receptor TVA. Estas células se infectaron con el VEVr (A / RG) virus. Los viriones liberados tendrá RABV-G en la envoltura viral, pero no tienen el gen de RABV-G en el genoma viral. (C) Un esquema de la necesaria para ratón pasa triples animales transgénicos. Alelos condicionales de TVA y tdTomato se cruzan a un controlador de Cre de elección, de modo que tanto TVA y tdTomato se expresan sólo en células con una historia de expresión Cre. En este ejemplo, se utilizó ChAT-Cre. (D) Un esquema de la infección de retina con el fin de rastrear DSGC-SAC circuitos. Las células ChAT se hacen para expresar TVA y tdTomato, como se muestra en (C). CGR se infectan de un LGN eninfección del virus producido en (B). A medida que el virus expresa GFP, estos CGR será verde. El virus se transmite sólo a TVA-expresión de ChAT células amacrinas si están conectados a la RGC etiquetados. Estas células serán rojo y verde o amarillo. Haga clic aquí para ampliar la cifra .
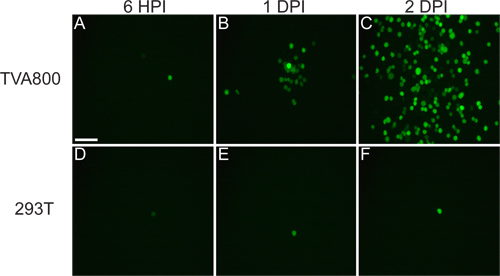
Figura 3. Comportamiento de VEVr (A / RG) virus en células 293T y TVA800. Estas células se infectaron con un bajo VEVr título (A / RG) pseudotyped con RABV-G. El virus se propaga entre TVA-que expresan las células en cuestión de horas, como se muestra a las 6 horas después de la infección (IPH), 1 y 2 días después de la infección (DPI). Sin embargo, la propagación en células 293T, que no expresan el receptor de TVA, aunque it ocurre, ocurre mucho más lento. Barra de escala = 100 micras.
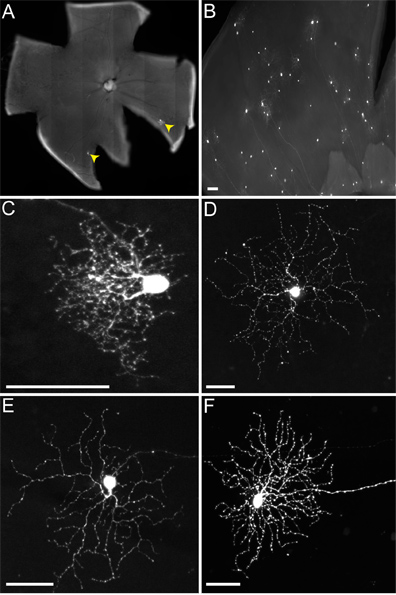
Figura 4. Infecciones representativas de RGC de no TVA ratones que expresan. Los animales fueron inyectados en el LGN con el VEVr (A / RG) virus pseudotyped con RABV-G, y tejido recogido 2 dpi. (A) Disperso (CGR indica por puntas de flecha de color amarillo) o (B) infecciones densas se puede conseguir, según el título de virus y la calidad de la inyección. Hay muchos tipos de CGR se pueden identificar basándose en la morfología, incluyendo (C) CGR pequeño cenador, (d) Tipo 1 CGR melanopsina, (E) en DSGCs-, y (F) ON-OFF-DSGCs, entre otros. Las barras de escala = 50 micras.

Figura 5. VEVr (A / RG) de transmisión de ON-OFF-DSGCs a las ZEC sigue el patrón esperado. (A) ON-OFF-DSGCs (punta de flecha blanca con verde relleno) transmitir virus a las ZEC múltiples (flechas amarillas). (A '). Todas las células verdes que no son el DSGC co-etiqueta con el reportero de CRE, que indica que son TVA-expresión de los sacos. (BC) El DSGC (punta de flecha blanca con verde relleno) y ZEC (puntas de flecha amarilla) estratificar en las capas ChAT apropiados de la capa retiniana interna plexiforme (IPL). Las células a las que transmite el virus incluyen en ON y OFF ZEC-. Los números en los paneles B 'y C' indican las láminas IPL. La ubicación del soma DSGC sólo está indicado por la punta de flecha, pero no se muestra en el panel C para resaltar las ZEC. Las barras de escala = 50 micras.
Discusión
Uso de virus para estudiar circuitos neuronales es un método de rendimiento relativamente alto de analizar neuronas conectadas. Sin embargo, generar tanto VSV y viriones RABV no es trivial. Aunque el protocolo enumerados anteriormente para el virus de rescate a partir de ADNc se proporciona, todavía es un evento de baja probabilidad. Los niveles de cada uno de los N, P, L y plásmidos necesitan ser ajustado con precisión, ya que muchos ensayos y replica necesita hacer para asegurar rescate viral. La formación de la ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría reconocer Sean Whelan para obtener ayuda con el rescate de las variantes recombinantes VSV y Didem Goz y Chrenek Ryan de asistencia técnica. Este trabajo fue financiado por el HHMI (CLC), y # NS068012-01 (KTB).
Materiales
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Referencias
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados