È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Viral Tracciamento di geneticamente definito circuiti neurali
In questo articolo
Riepilogo
Un metodo di tracciare neuroni sinapticamente collegate è descritto. Usiamo specificità TVA di una cella a monte per sondare se una popolazione di cellule riceve input sinaptico da tipi di cellule geneticamente definiti.
Abstract
I metodi classici per studiare i circuiti neuronali sono velocità piuttosto bassa. Transsynaptic virus, in particolare la pseudorabbia (PRV) e del virus della rabbia (RABV), e più recentemente virus della stomatite vescicolare (VSV), per lo studio di circuiti, sta diventando sempre più popolare. Questi metodi di throughput superiori usare virus che trasmettono tra neuroni sia in direzione anterograda o retrograda.
Recentemente, un RABV modificato per monosinaptico retrograda traccia è stata sviluppata. (Figura 1A). In questo metodo, la (G) gene glicoproteina viene eliminato dal genoma virale, e fornita solo in neuroni mirati. Specificità infezione si ottiene sostituendo un G chimerico, composto del dominio extracellulare del ASLV A-glicoproteina e il dominio citoplasmatico del RABV-G (A / RG), per il normale RABV-G 1. Questo G chimerico infetta specificamente le cellule che esprimono il recettore TVA 1. Il gene che codifica TVA può essere delivered con vari metodi 2-8. Dopo RABV-G infezione di un TVA che esprimono neurone, il RABV può trasmettere ad altri neuroni, sinapticamente collegate in senso retrogrado di natura della sua G privato, che era co-espresso con il recettore TVA. Questa tecnica etichetta un numero relativamente elevato di ingressi (5-10%) 2 su un tipo di cellula definito, fornendo un campione di tutti gli ingressi su un tipo di avviamento definito cella.
Recentemente abbiamo modificato questa tecnica da utilizzare VSV come transsynaptic tracciante 9. VSV ha diversi vantaggi, tra cui la rapidità di espressione genica. Qui i dettagli di un nuovo sistema di tracciamento virale utilizzando utile per sondare microcircuiti con risoluzione maggiore VSV. Mentre le strategie originali pubblicati da Wickersham et al. 4 e Beier et al. 9 etichettatura permesso di eventuali neuroni che sul progetto inizialmente-infetti TVA esprimono cellule, qui VSV è stato progettato per trasmettere solo alla TVA-cellule esprimenti (Figura 1B). Il virus viene prima pseudotyped con RABV-G per consentire infezione di neuroni a valle di TVA-neuroni che esprimono. Dopo aver infettato questa prima popolazione di cellule, il virus rilasciato può infettare solo TVA-esprimenti cellule. Perché la diffusione transsynaptic virale è limitata a TVA-esprimenti cellule, presenza di assenza di connettività di tipi cellulari definiti può essere esplorato con alta risoluzione. Un diagramma di flusso sperimentale di questi esperimenti è mostrata in Figura 2. Qui mostriamo un modello di circuito, che di direzione selettività nella retina di topo. Esaminiamo la connettività di starburst cellule amacrine (ZSC) a cellule gangliari della retina (RGC).
Protocollo
1. Fare Virus da cDNA: Recupero di VSV da cDNA utilizzando Vaccinia-T7 sistema 10
- Un giorno prima di sperimentare, dividere BsrT7 cellule in antenna di 60 mm contenente DMEM + 10% FBS. Cellule Seed 2E6 al piatto. BsrT7 cellule derivano da BHK21, o bambino renali di criceto, cellule.
- PBS caldo con 1 mM di magnesio e 1 mM di calcio a 37 ° C.
- Ottenere una piccola aliquota vTF7-3, un virus vaccinia esprimere polimerasi T7, e scongelamento a temperatura ambiente. vTF7-3 è un vaccinia virus infettivo che esprime la polimerasi T7 11, e deve essere usato solo nel livello di biosicurezza 2 di contenimento. Questo sistema di espressione è usata per generare livelli massimi dei trascritti desiderati da plasmidi trasfettati in fase 1,9. Vortex virus per 30 secondi alla massima velocità. Sonicazione in un sonicatore tavolo per 2 minuti in bagno d'acqua a temperatura ambiente. Vortex di nuovo per 30 secondi per rompere grumi virali.
- Rimuovere i supporti dalle BSRT7 cellule.
- Aggiungi 11,7 microlitri vTF7-3aggiungere 600 microlitri di PBS magnesio e calcio e miscela sulle celle.
- Spostare le piastre in un 34 ° C incubatore con il 5% di CO 2. Piastre rock delicatamente una volta ogni 10 min.
- Dopo 45 minuti sono trascorsi, iniziare trasfezione. Aggiungere 20 microlitri lipofectamina 2.000 a 1 ml di DMEM e mescolare. Attendere 5 min.
- Aggiungere 5,25 mg pN, 2.3 mg pP, 1.2 mg pl, 1 mg mg pCAG RABV-G, e 6 genomica VSV cDNA a 500 microlitri DMEM. PN, PP e pl sono plasmidi guidando espressione dei geni virali VSV sotto il promotore T7 10, ai valori determinati empiricamente per salvataggio ottimale del virus.
- Unire entrambi i tubi e mescolare. Attendere 15 minuti a temperatura ambiente.
- Rimuovere PBS e lavare i piatti una volta con 1,5 ml DMEM.
- Aspirare risciacquo media. Aggiungi mix di trasfezione alla piastra. Portare le piastre in 34 ° C incubatore.
- Attendere 5 ore, quindi rimuovere il supporto.
- Cambiare i media a 4 ml DMEM + 2% FBS + 1x penicillina-streptomicina + mm 10 HEPES pH 7.4. L'aggiunta di Penicillin-Streptomicina, per prevenire la contaminazione, e HEPES, per mantenere il pH del mezzo, sono molto importanti. Il contenuto può essere eliminato FBS al 2%, le cellule vengono distrutte in pochi giorni dal virus e quindi non è necessario 10% FBS.
- Inserire le piastre in 34 ° C incubatore per 48-72 ore.
- Raccogliere i media a 3 e 6 giorni dopo la trasfezione, e subito la siringa attraverso un filtro 0,20 micron filtro. Questo filtro taglia rimuove il virus vaccinia, ma non il VSV.
- Poiché si desidera fornire RABV-G per l'involucro virale, e il genoma non codifica il gene RABV-G, deve essere continuamente forniti in trans. Per fare questo, fare un piatto a parte di 293T TVA800 (TVA800) cellule. Queste sono le cellule che esprimono costitutivamente il recettore TVA, permettendo ENVA-mediata infezione virale 12. A 80% di confluenza, cambiare il supporto di DMEM solo, quindi trasfettare le cellule con 5 mcg di proteina plasmide codificante G (cioè pCAG RABV-G) per piastra. Usiamo il PEI reagente di trasfezione, un polimero policationico che è molto più economica di base di lipidi metodi. Tuttavia, lipofectamina può essere utilizzato efficacemente per questo scopo. Il PEI ottimale: rapporto di DNA deve essere determinato empiricamente. Fare questo in un esperimento separato con un reporter fluorescente, cioè pCAG GFP. Usiamo 10 pl PEI: 4 mg DNA.
- Applicare il surnatante dal punto 16 sulla piastra di TVA800 cellule transfettate.
- Osservare questo piatto il giorno seguente per la prova di fluorescenza del fluoroforo virale espresso. Fluorescenza virale viene prima osservato come una singola cellula, e si diffonde gradualmente nel tempo (cioè Figura 3). Il virus dovrebbe diffondersi nel giro di poche ore.
2. Passaggio e concentrazione di VSV
- Split TVA800 celle in supporti contenenti FBS DMEM + 10% in modo tale che si avrà quattro 10 cm di piastre a ~ 80% di confluenza il giorno successivo. 293T a base di cellule funzionano bene grazie alla loro elevata transfectability, e l'uso di TVA-esprimenti cellule aumenta la velocità con cui le cellule del piatto infettati. Altre linee cellulari altamente transfectable può servire allo scopo pure.
- A 80% di confluenza, cambiare il supporto di DMEM solo, quindi trasfettare le cellule con 5 microgrammi di plasmide codificante la proteina G che si desidera utilizzare (ad esempio pCAG RABV-G) per piastra. Usiamo PEI, ma Fugene / Lipofectamine lavoro pure.
- Aspetta un giorno dopo la trasfezione per glicoproteina espressione / superficie di accumulo. Cambiare il supporto (5 ml / piastra) per DMEM + 10% FBS, quindi infettare con rVSV (A / RG) virus ad una molteplicità di infezione (MOI) di 0,01
- Controllare la quantità di infezione 24 ore più tardi. Si dovrebbe vedere cellule infettate (identificate da fluorescenza GFP), alcune con macchie circostanti di cellule infette (ad esempio la figura 3). In genere è solo vale la pena raccogliere il surnatante se si vede> 50% delle cellule infettate, altrimenti i titoli virali richiederlod da concentrazione sarà sub-ottimale.
- Se> 50%, raccogliere il 5 ml / piastra di supporto, e sostituirlo con 5 ml di mezzo fresco. Se le cellule sono infettate troppo pochi, aspettare un'altra ora 12-24, e controllare di nuovo. Congelare i surnatanti raccolti a -80 ° C.
- Raccogli tutte le 24 h, successivamente, per 3 giorni, per un totale di 4 giorni.
- Nel complesso, si è partiti con 4 piastre, si dovrebbe avere 20 ml di mezzi di ogni giorno - in modo totale 80 ml, o 2 tubi ultracentrifuga valore di surnatante. Scongelare i surnatanti a 37 ° C e oltre filtro 0,45 micron filtri su ghiaccio. Aliquotare 36 ml di virus in provette da centrifuga Beckman.
- Concentrare il supernatante (21.000 K in un rotore SW28 (= 80.000 xg) per 90 min) a 4 ° C. Decantare il supernatante in un becher contenente il 10% di candeggina, e mentre la provetta viene invertita, utilizzare un aspiratore per rimuovere supporti tanto dal lato del tubo possibile.
- Mentre coperti. agitare le provette virali a 4 ° C per 1 ora. Un agitatore standard a about 120 rpm è sufficiente.
- Delicatamente triturare pellet nei media rimanenti pipettando gentilmente su e giù per 30 volte. Fare attenzione a non introdurre bolle d'aria. Il volume residuo dei media dovrebbe essere di circa 30 microlitri. Aliquotare questo volume in tubi multipli in modo da evitare di congelamento-scongelamento per qualunque azione particolare, in quanto ciò può comportare una diminuzione del titolo virale. Tali aliquote possono essere congelati a -80 ° C.
- Titolo del virus. Titolazione a circa 2 giorni dopo l'infezione è ottimale. Infezione iniziale può essere osservato in una questione di ore, ma si ottiene una sottorappresentazione di titolo se si aspetta solo 1 giorno. Per ottenere il titolo virale, eseguire un esperimento diluizione limitante del virus concentrato sulla linea cellulare appropriata (293T funzionano bene) in una piastra a 24 pozzetti, diluendo il virus 10 volte da 1 a 1: 1.000.000. I titoli che otteniamo sono tipicamente nella gamma di 10 8 -10 10 unità formanti fuoco (ffu) / ml.
3. Virnoi iniezione
- Usiamo topi, tipicamente tra 6-10 settimane di età, per questi esperimenti. Qualsiasi età dopo la quale è stabilito circuiti sarebbe sufficiente. Noi sceglieremo la trasmissione da cellule gangliari della retina (RGC) per starburst cellule amacrine (ZSC) come esempio. Questo esperimento, come diagramed in figura 2, richiede un animale transgenico tripla e solo una singola iniezione di virus. (Tutte le procedure indicate sono state approvate dal IACUC alla Harvard Medical School, ed erano in accordo con le linee guida istituzionali).
- Primo, gli animali appropriati devono essere generati. L'obiettivo è di avere TVA espresso nel tipo cellulare che si vuole mappare in, per mezzo di un virus (ad esempio virus adeno-associato, AAV), o da un allele transgenica. La specificità tipo di cella è normalmente ottenuto espressione Cre. Qui, abbiamo anche attraversato in un allele espressione condizionale TVA 7 un colina acetiltransferasi (ChAT) Cre allele-13, in modo tale che TVA è espressoin tutte le cellule con una storia di espressione Cre (ZSC). Abbiamo anche attraversato un allele condizionale espressione tdTomato (R26TdT) per la visualizzazione di TVA-cellule che esprimono.
- Le coordinate per la posizione di iniezione devono essere identificati. Queste le coordinate di interesse può essere trovato in un atlante del cervello, cioè la Franklin e Paxinos cervello di topo atlante 14. Queste coordinate devono essere notato rispetto a un punto di riferimento dato sul cranio mouse. Usiamo bregma, ma qualsiasi sistema di coordinate è sufficiente.
- Preparare l'apparato stereotassico. Accendere il controller microiniettore, e spostare lo stantuffo e pinza porta elettrodo in posizione. Quindi riempire il back-ago per iniezione con olio minerale per fornire un'interfaccia con il virus. Inserire l'ago poi sul pistone, facendo attenzione che non rimangano bolle d'aria nella siringa.
- Scongelare il virus, e posto in ghiaccio per evitare una caduta del titolo virale. Impostare il microiniettore di "ritirarsi" e spostare il tubo di virus in modo tale che questo è contacting il capillare sul microiniettore. Prelevare la quantità necessaria di rVSV (A / RG) pseudotyped con RABV-G per l'esperimento.
- Animali viene dato un pre-operatoria dose di buprenorfina (0,05-0,1 mg / kg) prima della chirurgia inizia. Per anestetizzare l'animale, o inalazione isoflurano, o una iniezione intraperitoneale di ketamina (40-80 mg / kg) e xilazina (5-10 mg / kg) miscela è sufficiente. Scelta di anestetico dipende dall'utente. Un pizzico punta non viene quindi eseguita per assicurare che gli animali sono completamente anestetizzati, se l'animale non risponde, è possibile procedere con la procedura. Essere sicuri di ottenere le licenze appropriate prima di usare questi farmaci.
- Animali siano posti su un tampone riscaldato, che viene appoggiato su un supporto mobile per il posizionamento del mouse. L'animale vi rimane per tutta la durata della procedura chirurgica. Applicare pomata oftalmica contro l'essiccamento della cornea, mentre l'animale è anestetizzato.
- La testa del mouse deve quindi essere stabilizzata in un stereotassicopparecchi. Utilizzare le barre orecchio sull'apparecchio stereotassico per garantire che la testa è completamente protetto, in modo tale che la testa è parallelo al terreno, e non ruota lateralmente. Una volta che questo è completato, regolare la barra di morso per contribuire a stabilizzare la testa.
- Pelliccia dell'animale viene rasato nella regione di incisione sulla parte superiore della testa. Questa zona è poi lavato tre volte con etanolo, seguita da tre volte con iodio. L'incisione viene poi realizzata in pelle con un bisturi, rivelando il cranio.
- Una volta che il mouse e la configurazione di iniezione sono preparati, bregma deve essere collocato. Questa è la zona al centro della testa che la sagittale e due suture coronali incontrano. Una volta che questa zona si trova, i quadranti sull'apparato stereotassico può essere usato per regolare il microiniettore alle coordinate corretta. Qui, iniettare il nucleo genicolato laterale (LGN), utilizzando le coordinate A / P -2,46 dal bregma, L / M 2, D / V 2.75.
- Una volta che le coordinate sono state effettuate in, il trapano deve essere assemblato.Inserire la punta nel trapano, quindi accendere il trapano. Un piccolo foro deve essere praticato nel sito individuato come sito di iniezione. Essere molto gentile con il trapano in modo da non danneggiare il parenchima cerebrale. Quando l'osso è molto sottile, i vasi sanguigni sulla dura ormai chiaro. A questo punto, attentamente forare i bordi della craniotomia con un piccolo (30 gauge) dell'ago e una multa (# 5) pinza per rimuovere l'osso residuo.
- Regolare il capillare in una posizione appena dorsale della superficie del cervello, dove il foro è stato appena forato. L'ago deve essere forte abbastanza per penetrare la dura madre con facilità. Quindi abbassare l'ago alla profondità desiderata, e cominciare l'iniezione. Si inietta virus ad una velocità di 100 Nl / min.
- La procedura di iniezione a questo punto dura circa dieci minuti. Dopo l'iniezione, l'ago rimane nel cervello per circa sette minuti. Questo è fondamentale, in quanto permette la diffusione del virus dal sito di iniezione. Rapidamente rimuovere la forma dell'ago della Injesite risultati ction in una efficienza ridotta infezione nel sito di iniezione, e infezione nel tratto dell'ago.
- L'ago è sollevato molto lentamente dal sito di iniezione, in un arco di circa due minuti. Questo è ancora destinato a ridurre l'infezione lungo il tratto dell'ago.
- Una volta rimossa, la pelle viene poi suturata. Gli animali sono costantemente monitorati fino a quando non riprendersi dall'anestesia. Buprenorfina (0,05-0,1 mg / kg) è somministrato ogni 12 ore per 2 giorni.
4. Raccolta del tessuto / tessuto di preparazione
- Per raccogliere il tessuto di interesse, il tempo ottimale dipende dagli obiettivi dell'esperimento. In generale, la diffusione VSV transsynaptic può prima essere osservato da meno di 24 ore dopo l'iniezione. Tuttavia, lunghi tempi di attesa si tradurrà in maggiore diffusione.
- Per raccogliere la retina, gli animali vengono prima eutanasia con l'anidride carbonica e l'inalazione dislocazione cervicale viene eseguita. Il bulbo viene poi rimosso, e posta in un tubo concontenente formaldeide al 4% in PBS per 1 ora a temperatura ambiente.
- Il bulbo oculare è quindi posto in una capsula di Petri con PBS. La retina è poi sezionato lontano da altri tessuti.
- Per l'analisi di montaggio intero, il retine sono tagliati in modo da definire piatta, posta su un vetrino, quindi montato con oro prolungare supporti di montaggio e coperto con uno zero-spessore coprioggetto. Distanziali in silicone sono inseriti tra il vetrino coprioggetto e ridurre al minimo le forze di compressione sulla retina. Per l'analisi sezione, la retina è posto in 30% saccarosio in PBS fino alle sommerge retina. Viene quindi posto in una miscela di 50% e soluzione di saccarosio ottobre 50% 30% per 3 ore. Viene poi istantaneamente congelati e conservati a -80 ° C fino al momento di tagliare.
5. Risultati rappresentativi
Il virus che viene salvata da cDNA dovrebbe essere in grado di infettare TVA800 cellule, ma non le cellule 293T (Figura 3). Fornendo il RABV-G permette l'infezione di cellule T piùIPI, incluse 293T. Tuttavia, poiché il genoma A / RG è codificato nel genoma, diffuso tra cellule avviene ad una velocità molto più elevata TVA-esprimenti cellule.
Una volta che il virus è concentrato, tipica gamma titoli tra 10 8 ffu / ml e 10 10 ffu / ml. Questi titoli sono adeguati per l'utilizzo in vivo.
Durante l'iniezione LGN nel mouse, non distinguiamo LGN dorsale (dLGN) da ventrale LGN (vLGN), sia come di solito si infettano. Pertanto, più tipi di RGC diventano etichettata (Figura 4), compresi quelli che progetto al vLGN, come melanopsina RGCs (Figura 4D) e ON-DSGCs (figura 4E), e quelli che progetto al dLGN, come la piccola pergolato RGC (Figura 4C) e ON-OFF-DSGCs (4F Figura). Anche se più di un tipo di virus RGC trasmessa alle ZSC, come riportato altrove (Beier et al., In revisione), qui ci concentriamo solole ben studiate connessioni di ON-OFF-DSGCs alle ZSC.
Quando si inietta topi del genotipo cTVA (+) / chat-Cre (-), in cui non TVA dovrebbe essere espresso, solo RGC sono etichettati (ad esempio Figura 4). Questi sono dovuti alla captazione iniziale della RABV G-virus pseudotyped dai RGCs, e non si verifica diffusione. Non RGC sono infettati da una infezione di LGN rVSV (A / RG) virus non pseudotyped con RABV-G, a causa di una incapacità di questi virioni trasversali per gli assoni lunghi di questi RGC. Tuttavia, quando si inietta cTVA (+) / ChATCre (+) (e R26TdT (+)) topi nel LGN, diffusione virale si verifica, solo a globuli rossi, che esprimono il reporter Cre (cioè Figura 5). Queste cellule anche co-etichette con l'anti-ChAT anticorpo, e stratificare solo in due lamine ChAT, confermando la loro identità come ZSC (5B Figure ', C'). Il numero delle ZSC viralmente marcate per DSGC variava da uno a nove.

Figura 1. Retrograda nostro sistema di rintracciamento transsynaptic rispetto al metodo originariamente sviluppato. (A) (i) Nel metodo sviluppato da Wickersham e colleghi, "cellule avviamento" sono trasfettate con tre geni: il recettore TVA, utilizzati per consentire specificamente infezione di cellule trasfettate, la RABV-G, utilizzato per integrare il RABV, che sé aveva il gene G soppresso e una proteina fluorescente rossa per identificare cellule trasfettate. (Ii) Un RABV pseudotyped con la proteina A / RG infetta TVA-esprimenti cellule, rendendole giallo. (Iii) la trasmissione retrograda transsynaptic si verifica per i neuroni a monte. (B) (i) Nel nostro metodo, TVA cellule che esprimono sono definite geneticamente, e sono etichettate con un condizionale prote rosso fluorescentepollici (ii) Le "celle di avviamento" sono quelli infettati da un VSV codificante il gene A / RG nel genoma virale. Queste cellule di avviamento non esprimono il recettore TVA. (Iii) la trasmissione retrograda transsynaptic viene in TVA-neuroni che esprimono solo se queste cellule fornire input sinaptico sui neuroni avviamento. Clicca qui per ingrandire la figura .
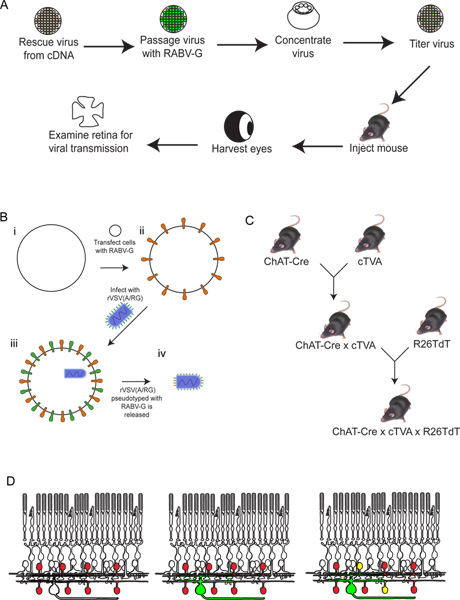
Figura 2. Schematica della procedura sperimentale. (A) In primo luogo, il virus viene salvato da cDNA. Viene poi diversi passaggi e con pseudotyped RABV-G, e concentrata e titolati. Questo virus viene poi iniettato nel cervello, dove viene fatta incubare per il periodo di tempo desiderato. Dopo questotempo, l'occhio è raccolto, e la retina dissezionato e analizzato. (B) Schema di pseudotipizzazione il virus con RABV-G. Ciò è necessario per l'infezione delle cellule gangliari retiniche da un'iniezione cervello. Il RABV-G gene viene prima transfettato in cellule di coltura tissutale esprime il recettore TVA. Queste cellule vengono quindi infettate con il rVSV (A / RG) virus. I virioni rilasciati avranno RABV-G nella busta virale, ma non hanno il gene per RABV-G nel genoma virale. (C) Un schematica del mouse attraversa necessaria triple animali transgenici. Condizionali alleli TVA tdTomato e sono attraversate da un driver Cre di scelta, in modo tale che sia TVA e tdTomato sono espressi solo in cellule con anamnesi espressione Cre. In questo esempio, abbiamo usato ChAT-Cre. (D) Un schematico della retina infezione per rintracciare DSGC SAC-circuiti. Le cellule ChAT sono fatti per esprimere TVA e tdTomato, come mostrato in (C). RGC sono infettati da un LGN inperfezione del virus prodotto in (B). Come il virus esprime GFP, questi RGC sarà verde. Il virus viene poi diffuso solo a TVA-esprimono ChAT cellule amacrine se sono collegati al RGC etichetta. Queste cellule saranno sia rosso e verde, o giallo. Clicca qui per ingrandire la figura .
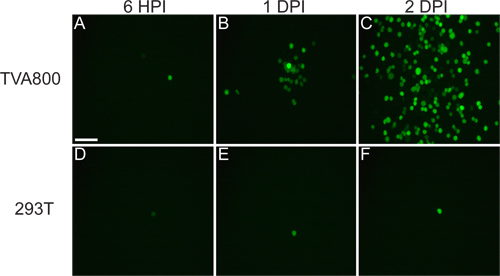
Figura 3. Comportamento del rVSV (A / RG) virus sul 293T e TVA800 cellule. Queste cellule sono state infettate con un basso titolo rVSV (A / RG) pseudotyped con RABV-G. Il virus si diffonde tra TVA-cellule che esprimono in poche ore, come mostrato a 6 ore dopo l'infezione (HPI), 1 e 2 giorni dopo l'infezione (DPI). Tuttavia, la diffusione di cellule 293T, che non esprimono il recettore TVA, se it si verifica, avviene molto più lentamente. Barra di scala = 100 micron.
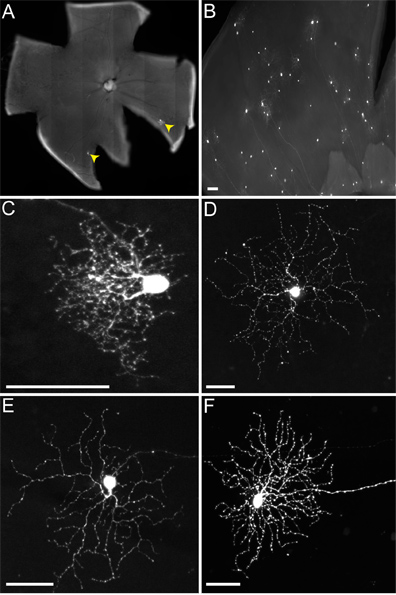
Figura 4. Infezioni rappresentativi di RGC di non TVA topi che esprimono. Animali sono stati iniettati nella LGN con il rVSV (A / RG) virus pseudotyped con RABV-G, e tessuto raccolto 2 dpi. (A) Sparse (RGC indicato da frecce gialle) o (B) infezioni dense può essere ottenuta, a seconda del titolo del virus e la qualità di iniezione. Molti tipi differenti di RGC possono essere identificati in base alla morfologia, anche (C) piccolo pergolato RGC, (D) di tipo 1 RGC melanopsina, (E) ON-DSGCs, e (F) ON-OFF-DSGCs, tra gli altri. Barre di scala = 50 micron.

Figura 5. RVSV (A / RG) trasmissione da ON-OFF-DSGCs alle ZSC segue lo schema previsto. (A) ON-OFF-DSGCs (freccia bianca con verde riempimento) trasmettere virus al ZSC multiple (frecce gialle). (A '). Tutte le celle verdi che non sono il DSGC co-etichetta con il giornalista Cre, che indica che essi sono TVA che esprimono ZSC. (BC) Il DSGC (freccia bianca con verde di riempimento) e ZSC (frecce gialle) stratificano negli strati ChAT appropriate della retina strato interno plessiforme (IPL). Le celle a cui trasmette virus includono sia ON e OFF-ZSC. Numeri in pannelli B 'e C' indicano le lamine IPL. La posizione del soma DSGC è solo indicato dalla freccia, ma non come da tabella C per evidenziare le ZSC. Barre di scala = 50 micron.
Discussione
Usando virus per studiare circuiti neurali è un metodo relativamente elevata velocità di analizzare neuroni collegati. Tuttavia, generando sia VSV e virioni RABV non è banale. Anche se il protocollo di cui sopra per il salvataggio virus dal cDNA è fornito, è ancora una bassa probabilità dell'evento. I livelli di ciascuna delle N, P, L e plasmidi bisogno di essere regolato con precisione, e molte prove e repliche deve essere fatto per garantire soccorso virale. La formazione della particella ribonucleotide inco...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Si desidera ringraziare Sean Whelan per l'assistenza con il salvataggio varianti VSV ricombinanti, e Didem Goz e Ryan Chrenek per l'assistenza tecnica. Questo lavoro è stato sostenuto da HHMI (CLC), e # NS068012-01 (KTB).
Materiali
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Riferimenti
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon