É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Rastreamento de viral geneticamente definido Neural dos circuitos
Neste Artigo
Resumo
Um método de rastreio neurónios ligados sinapticamente é descrito. Usamos TVA especificidade de uma célula de montante para investigar se uma população de células de interesse recebe entrada sináptica de tipos de células geneticamente definidos.
Resumo
Os métodos clássicos para o estudo de circuitos neuronais são o rendimento relativamente baixo. Vírus da pseudo-raiva transsináptica, particularmente o (PRV) e do vírus da raiva (RABV), e, mais recentemente, o vírus da estomatite vesicular (VSV), para o estudo de circuitos, está a tornar-se cada vez mais popular. Estes métodos maior rendimento use vírus que transmitem entre os neurônios em qualquer direção do anterógrada ou retrógrada.
Recentemente, um RABV modificados para monossináptico rastreio retrógrado foi desenvolvido. (Figura 1A). Neste método, o gene da glicoproteína (G) é eliminado a partir do genoma viral, e reabastecido apenas em neurónios-alvo. Especificidade infecção é conseguida por substituição de um G quimérica, composta pelo domínio extracelular do ASLV-A glicoproteína e o domínio citoplasmático da RABV-G (A RG /), para o normal RABV-G 1. Este G quimérico especificamente infecta as células que expressam o receptor TVA 1. O gene que codifica a TVA pode sido delivered por vários métodos 2-8. Seguindo RABV-G infecção de um neurónio TVA-expressar, o RABV pode transmitir a outros neurónios ligados sinapticamente em sentido retrógrado, por natureza, do seu próprio G, que foi co-fornecido com o receptor TVA. Esta técnica rotula um número relativamente grande de entradas (5-10%) 2 para um tipo de célula definidos, proporcionando uma amostra de todas as entradas para um tipo definido de arranque da célula.
Recentemente modifiquei esta técnica de usar VSV como traçador transsináptica 9. VSV tem várias vantagens, incluindo a rapidez da expressão do gene. Aqui nós detalhes de um sistema viral novo rastreamento usando VSV útil para sondar microcircuitos com maior resolução. Embora as estratégias originais publicados por Wickersham et al. 4 e Beier et al. 9 rotulagem autorização de neurónios que qualquer projecto para inicialmente infectadas TVA-expressando células, aqui VSV foi concebido para transmitir apenas a TVAs células que expressam A-(Figura 1B). O vírus é primeiro pseudotipado com RABV-G para permitir a infecção de neurónios jusante da TVA-expressam os neurónios. Depois de infectar esta primeira população de células, o vírus libertado só pode infectar células que expressam TVA. Porque a propagação viral transsináptica está limitada a células que expressam TVA, presença ou ausência de ligação a partir de tipos de células definidas pode ser explorada com alta resolução. Um diagrama de fluxo experimental destas experiências é mostrado na Figura 2. Aqui nós mostramos um circuito modelo, o da direção-seletividade na retina do rato. Examinamos a conectividade das células amácrinas starburst (SACs) para as células ganglionares da retina (CGR).
Protocolo
1. Fazendo Vírus de cDNA: Recuperação de VSV a partir de ADNc, utilizando Vaccinia-T7 System 10
- Um dia antes da experiência, as células em divisão BsrT7 prato 60 mm contendo meio DMEM + 10% FBS. Células de sementes 2E6 por prato. BsrT7 células são derivadas de BHK21, ou rim de hamster bebé, células.
- PBS quente com 1 mM de magnésio e 1 mM de cálcio a 37 ° C.
- Obter uma pequena alíquota vTF7-3, um vírus da vacina expressando polimerase de T7, e descongelamento à temperatura ambiente. vTF7-3 é um vírus de vaccinia infeccioso que expressa a polimerase de T7 11, e deve ser utilizado apenas em Biossegurança confinamento de grau 2. Este sistema de expressão é usada para gerar níveis máximos dos transcritos desejados de plasmídeos transfectados no passo 1.9. Vortex vírus por 30 segundos a velocidade máxima. Sonicar num sonicador de mesa durante 2 min em banho de água à temperatura ambiente. Vortex novamente por 30 segundos para quebrar pedaços virais.
- Remova a mídia da BSRT7 células.
- Adicionar 11,7 ul vTF7-3e 600 ul de PBS com cálcio e magnésio e adicionar mistura para as células.
- Mover as placas para uma incubadora de 34 ° C com 5% de CO 2. Placas de rocha suavemente uma vez a cada 10 min.
- Após 45 min ter decorrido, começam a transfecção. Adicionar 20 uL de lipofectamina 2000 de 1 ml de DMEM e misturar. Esperar 5 min.
- Adicionar 5,25 ug pN, 2,3 ug pP, 1,2 ug pl, 1 ug pCAG RABV-G, e de 6 ug de ADNc genómico VSV a 500 ul de DMEM. pN, PP e PL são plasmídeos comandar a expressão de genes virais sob o VSV promotor T7 10, com os valores determinados empiricamente para o salvamento óptima do vírus.
- Combine ambos os tubos e misture. Esperar 15 min à temperatura ambiente.
- Remover PBS e lavar as placas uma vez com 1,5 ml de DMEM.
- Aspirar lavar mídia. Adicionar mistura de transfecção para a chapa. Mover as placas para 34 ° C incubadora.
- Espere 5 horas, em seguida, remover a mídia.
- Alterar media a 4 ml de DMEM + FBS a 2% + 1x Penicilina-Estreptomicina 10 mM pH 7,4 + HEPES. A adição de Penicillin-Estreptomicina, para prevenir a contaminação e HEPES, para manter o pH do meio, são muito importantes. O conteúdo pode ser descartado FBS a 2%, tal como as células serão destruídos em questão de dias até que o vírus e, portanto, não precisa de FBS a 10%.
- Placas lugar em 34 ° C incubadora por 48-72 h.
- Colete media de 3 e 6 dias após a transfecção, e imediatamente através de um filtro de seringa de 0,20 uM de filtro. Este filtro de tamanho remove o vírus vaccinia, mas não o VSV.
- Uma vez que deseja fornecer RABV-G do envelope viral, e o genoma não codifica o gene RABV-G, deve ser continuamente fornecido em trans. Para fazer isso, fazer um prato separado de 293T TVA800 (TVA800) células. Estas são as células que expressam o receptor constitutivamente TVA, permitindo EnvA mediada por infecção viral 12. A 80% de confluência, muda meios para DMEM só, então transfectar as células com 5 ug do plasmídeo que codifica a proteína G (ou seja, pCAG RABV-G) por placa. Usamos o PEI reagente de transfecção, um polímero policatiónico, que é muito mais barato do que comparáveis à base de lípidos métodos. No entanto, lipofectamina também pode ser utilizado de forma eficaz para esta finalidade. O PEI óptima: razão de ADN necessita de ser determinada empiricamente. Fazer isso de uma experiência separada com um repórter fluorescente, ou seja, pCAG GFP. Usamos 10 ul PEI: 4 ug de ADN.
- Aplicar-se o sobrenadante a partir do passo 16 para a placa de TVA800 transfectadas células.
- Observar esta placa no dia seguinte para a evidência de fluorescência do fluoróforo viralmente expressa. Viral fluorescência é observado pela primeira vez como uma única célula, e gradualmente se espalha com o tempo (ou seja, Figura 3). O vírus deve espalhar dentro de algumas horas.
2. Passagem e concentração de VSV
- Dividir TVA800 células em meio contendo FBS DMEM + 10% de tal modo que vai ter quatro placas de 10 cm em ~ 80% de confluência no dia seguinte. 293T baseados em células funcionam bem devido à sua alta transfectability, e a utilização de células que expressam TVA aumenta a velocidade com que as células do prato de ser infectado. Outras linhas de células altamente transfectable pode servir o objectivo também.
- Em 80% de confluência, mudar de mídia para DMEM só, então transfectar as células com 5 mg de plasmídeo a proteína G que você deseja usar (ou seja pCAG RABV-G) por placa. Usamos PEI, mas Fugene / trabalho Lipofectamine também.
- Esperar um dia após a transfecção para a acumulação de expressão de glicoproteína / superfície. Alterar os meios de comunicação (5 ml / placa) para meio DMEM + 10% de FBS, em seguida, infectar com VSVD (A RG /) do vírus a uma multiplicidade de infecção (MOI) de 0,01
- Verificar a quantidade de infecção 24 horas mais tarde. Deverá ver células infectadas (identificada por fluorescência GFP), alguns deles com manchas circundantes de células infectadas (ou seja, Figura 3). Normalmente é só vale a pena recolher o sobrenadante se você ver> 50% de células infectadas, caso contrário, os títulos virais obtained de concentração serão os melhores.
- Se> 50%, coletar os 5 ml de mídia / placa, e substituir com 5 ml de meio fresco. Se poucas células são infectadas, esperar outra hora 12-24, e verifique novamente. Congelar os sobrenadantes recolhidos a -80 ° C.
- Recolher cada 24 h, subsequentemente, durante 3 dias, para um total de 4 dias.
- Ao todo, se você começou com 4 placas, você deve ter 20 ml de mídia de cada dia - tão total 80 ml, ou 2 tubos de ultracentrífuga valor de sobrenadante. Descongelar os sobrenadantes a 37 ° C, e filtrar sobre filtros de 0,45 uM em gelo. Alíquota de 36 ml em tubos de centrífuga de vírus de Beckman.
- Concentra-se o sobrenadante (21.000 K num rotor SW28 (= 80000 xg) durante 90 minutos) a 4 ° C. Decanta-se o sobrenadante para um copo contendo 10% de cloro, e enquanto o tubo é invertido, usar um aspirador para remover media, tanto do lado do tubo que possível.
- Enquanto coberto. agitar os tubos virais, a 4 ° C durante 1 h. Um agitador padrão em about 120 rpm é suficiente.
- Gentilmente triturar pelota na mídia restantes cuidado pipetando para cima e para baixo 30 vezes. Tenha cuidado para não introduzir bolhas de ar. O volume de mídia restante deve ser cerca de 30 ul. Volume da alíquota isto em tubos múltiplos, de modo a evitar que vários ciclos de congelamento-descongelamento para qualquer acção especial, como o que pode resultar numa diminuição do título viral. Estas alíquotas podem ser congeladas a -80 ° C.
- Titule a vírus. Titulação em cerca de 2 dias após a infecção é o ideal. Infecção inicial pode ser observada em uma questão de horas, mas você tem uma sub-representação do título, se você esperar apenas 1 dia. A fim de obter o título viral, realizar uma experiência de diluição limitante do vírus concentrado sobre a linha de células adequada (células 293T funcionam bem) numa placa de 24 cavidades, por diluição do vírus de 10 vezes, de 1 a 1: 1000000. Os títulos que obtemos estão tipicamente na gama de 10 8 -10 10 unidades formadoras de focus (ffu) / ml.
3. Virnos Injeção
- Usamos ratos, tipicamente, entre 6-10 semanas de idade, para estas experiências. Qualquer idade após a qual circuito é estabelecido seria suficiente. Vamos escolher a transmissão a partir de células ganglionares da retina (CGRs) às células amácrinas starburst (SAC) como um exemplo. Nesta experiência, como diagramado na Figura 2, requer um animal transgénico triplo e apenas uma única injecção de vírus. (Todos os procedimentos apresentados foram aprovados pelo IACUC na Harvard Medical School, e estavam de acordo com as diretrizes institucionais).
- Em primeiro lugar, os animais apropriados devem ser gerados. A meta é ter TVA expresso no tipo de célula que se pretende mapear para, por meio de um vírus (ou seja, vírus adeno-associado, AAV), ou por um alelo transgénica. A especificidade do tipo de células é geralmente obtida por expressão de Cre. Aqui, nós também atravessada em um alelo expressão condicional TVA 7 a uma colina-acetiltransferase (ChAT)-Cre alelo 13, de tal forma que é expressa TVAem todas as células com uma história de expressão de Cre (as ZEC). Nós também atravessou uma expressão condicional alelo tdTomato (R26TdT) para visualização de TVA-expressando células.
- As coordenadas para o local de injecção devem ser identificados. Estas coordenadas de interesse pode ser encontrada em um cérebro atlas, ou seja, o Franklin e Paxinos rato cérebro atlas 14. Estas coordenadas necessitam de ser notado em relação a um dado ponto de referência no crânio mouse. Usamos bregma, mas qualquer sistema de coordenadas é suficiente.
- Preparar o aparelho estereotáxico. Ligue o controlador microinjetor, e mover o êmbolo e suporte do eletrodo no lugar. Em seguida, voltar a encher a agulha de injecção com o óleo mineral para proporcionar uma interface com o vírus. Colocar a agulha em seguida, para o êmbolo, assegurando-se de que não há bolhas de ar permanece na agulha.
- Descongelar o vírus, e colocar em gelo para evitar a queda do título de vírus. Definir o microinjector para "retirar" e mova o tubo de tal modo que o vírus que é contacting do capilar no microinjector. Retirar a quantidade necessária de VSVD (A RG /) pseudotipado com RABV-G para o experimento.
- Os animais são tratados com uma dose pré-operatória de buprenorfina (0,05-0,1 mg / kg) antes da cirurgia começar. Para anestesiar o animal, ou por inalação de isoflurano, ou uma injecção intraperitoneal de uma mistura de cetamina (40-80 mg / kg) e xilazina (5-10 mg / kg) mistura é suficiente. Escolha do anestésico é dependente do utilizador. Uma pitada do dedo do pé deve ser feita para garantir que os animais são totalmente anestesiado, se o animal não responder, você pode prosseguir com o procedimento. Certifique-se de obter as licenças apropriadas antes de usar essas drogas.
- Os animais são colocados numa almofada aquecida, que está apoiado sobre um suporte móvel para o posicionamento do rato. O animal fica ali durante todo o período de duração do procedimento cirúrgico. Aplicar pomada para evitar a secagem da córnea enquanto o animal é anestesiado.
- A cabeça do rato, então, precisa ser estabilizado no estereotáxico umpparatus. Use as barras de orelha no aparelho estereotáxico para assegurar que a cabeça é completamente seguro, de tal modo que a cabeça é paralelo ao solo, e não roda lateralmente. Quando isso for concluído, ajuste a barra mordida para ajudar a estabilizar a cabeça.
- A pele do animal é raspado na região da incisão no topo da cabeça. Esta área é então lavado três vezes com etanol, seguindo-se três vezes com iodo. Uma incisão é então feita na pele com um bisturi, revelando o crânio.
- Uma vez que a configuração do rato e injecção são preparadas, bregma deve ser localizado. Esta é a área no centro da cabeça do que o sagital e coronal satisfazer duas suturas. Uma vez que esta área está localizada, os mostradores, sobre o aparelho estereotáxico pode ser usado para ajustar o microinjector às coordenadas apropriado. Aqui, nós injetar o núcleo geniculado lateral (LGN), através de coordenadas A / P -2,46 de bregma, L / M 2, D / V 2,75.
- Uma vez que as coordenadas foram marcados em, a broca tem de ser montado.Coloque a broca na furadeira, em seguida, ligue a broca. Um pequeno orifício deve ser perfurado no local identificado como o local de injecção. Ser muito suave com a broca, a fim de não causar danos no parênquima cerebral. Quando o osso é muito fina, os vasos sanguíneos sobre a dura-se claro. Neste ponto, cuidadosamente perfurar as bordas da craniotomia com uma agulha (calibre 30), e uma pequena finas (# 5) fórceps para remover o osso remanescente.
- Ajustar o tubo capilar para uma posição apenas da superfície dorsal do cérebro, onde a abertura foi simplesmente perfurado. A agulha deve ser afiado o suficiente para penetrar na dura-máter com facilidade. Em seguida, baixar a agulha para a profundidade desejada, e começar a injecção. Nós injectar vírus a uma taxa de 100 nl / min.
- O procedimento de injeção a este ponto leva cerca de 10 minutos. Após a injecção, a agulha permanece no cérebro durante cerca de sete minutos. Isto é crucial, uma vez que permite a difusão de vírus a partir do local de injecção. Rapidamente remover a forma de agulhas a injection resultados do local em uma eficiência reduzida de infecção no local da injecção, e de infecção ao longo do tracto da agulha.
- A agulha é muito lentamente aumentada a partir do local da injecção, ao longo de um período de cerca de dois minutos. Este é de novo intenção de reduzir a infecção ao longo do tracto da agulha.
- Uma vez removido, a pele é então suturada. Os animais são monitorizados continuamente até se recuperar da anestesia. A buprenorfina (0,05-0,1 mg / kg) é administrada a cada 12 horas durante 2 dias.
4. A colheita de tecidos / Tissue Preparação
- Para colher o tecido de interesse, o momento ideal depende dos objetivos do experimento. Geralmente, VSV propagação transsináptica pode primeiro ser observado por menos de 24 horas após a injecção. No entanto, os tempos de espera mais longos irá resultar em mais spread.
- Para colher a retina, os animais são primeiro submetidos a eutanásia por inalação de dióxido de carbono através de deslocação cervical e é executado. O globo ocular é então removida e colocada num tubo de concontendo formaldeído a 4% em PBS durante 1 h à temperatura ambiente.
- O globo ocular é então colocado num prato de Petri com PBS. A retina é então dissecado a partir de outros tecidos.
- Para a análise de montagem inteira, a retina são cortadas de modo a colocar o plano, colocado sobre uma lâmina de vidro, em seguida, montado com meios prolongar ouro de montagem e coberta com uma lamela de vidro espessura zero. Espaçadores de silicone são colocados entre a lâmina e lamela de minimizar as forças de compressão sobre a retina. Para a análise de secção, a retina é colocado em sacarose 30% em PBS até que as submerge retina. Ele é então colocado dentro de uma mistura de outubro de 50% e 50% de solução de sacarose a 30% durante 3 h. Em seguida, é rapidamente congelados e mantidos a -80 ° C até estar pronto para cortar.
5. Resultados representativos
O vírus que é resgatado a partir de cDNA deve ser capaz de infectar células TVA800, mas não as células 293T (Figura 3). Fornecendo a RABV-G permite a infecção de células T múltiploIPOS, incluindo 293T. No entanto, uma vez que o genoma A RG / é codificado no genoma, se espalhar entre as células ocorre a uma taxa muito mais elevada em células que expressam TVA.
Uma vez que o vírus é concentrado, a gama típica entre os títulos de 10 8 ffu / mL e 10 10 ffu / mL. Estes títulos são adequados para utilização in vivo.
Durante LGN injecção no mouse, não distinguimos LGN dorsal (dLGN) de LGN ventral (vLGN), tanto como normalmente se tornam infectadas. Portanto, vários tipos de RGC tornam rotulado (Figura 4), incluindo os que se projetam para o vLGN, como melanopsina RGCs (Figura 4D) e ON-DSGCs (Figura 4E), e aqueles que se projetam para o dLGN, tais como o pequeno- caramanchão CGR (Figura 4C) e ON-OFF-DSGCs (Figura 4F). Apesar de mais de um tipo de vírus transmitido RGC para SACs, conforme relatado em outro lugar (Beier et al., Em revisão), aqui nos concentramos apenassobre as conexões bem estudadas de ON-OFF-DSGCs às ZEC.
Quando se injectar murganhos com o genótipo de cTVA (+) / ChAT-Cre (-), em que não deve ser expresso TVA, apenas RGCs são rotulados (ou seja, Figura 4). Estes são devidos à absorção inicial do vírus RABV-G pseudotipado pelos RGCs, e não se propagará ocorre. Nenhum RGCs são infectadas a partir de uma infecção de LGN VSVD (A RG /) vírus não pseudotipado com RABV-G, devido à incapacidade destes para viriões transversais dos axónios longos destes CGRs. No entanto, aquando da injecção cTVA (+) / ChATCre (+) (e R26TdT (+)) em ratinhos do LGN, propagação viral ocorre, apenas para os glóbulos vermelhos, as quais expressam o repórter Cre (isto é, a Figura 5). Estas células também co-label com o anticorpo anti-chat, e estratificam apenas nas lâminas ChAT dois, confirmando sua identidade como ZEC (Figuras 5B ', C'). O número de SACs virally marcados por DSGC variou de um a nove.

Figura 1. O nosso sistema de rastreio transsináptica retrógrada comparado com o método originalmente desenvolvido. (A) (i) No método desenvolvido por Wickersham e colaboradores, "células de arranque" são transfectadas com três genes: o receptor TVA, utilizadas para permitir a infecção de células transfectadas especificamente, o RABV-G, usada para complementar o RABV, que se tinha o gene G suprimido e uma proteína fluorescente vermelha para identificar as células transfectadas. (Ii) A RABV pseudotipado com a proteína A RG / TVA infecta células que expressam, o que os torna amarelo. (Iii) a transmissão transsináptica retrógrada ocorre para os neurônios a montante. (B) (i) No nosso método, células que expressam TVA são definidos geneticamente, e são marcadas com um prote vermelho fluorescente condicionalpol (ii) As células "de arranque" são aqueles infectados por um VSV que codifica o gene A RG / no genoma viral. Estas células iniciadoras não expressam o receptor TVA. (Iii) a transmissão transsináptica retrógrada ocorre a TVA-expressando neurônios somente se essas células fornecer entrada sináptica em neurônios iniciais. Clique aqui para ver maior figura .
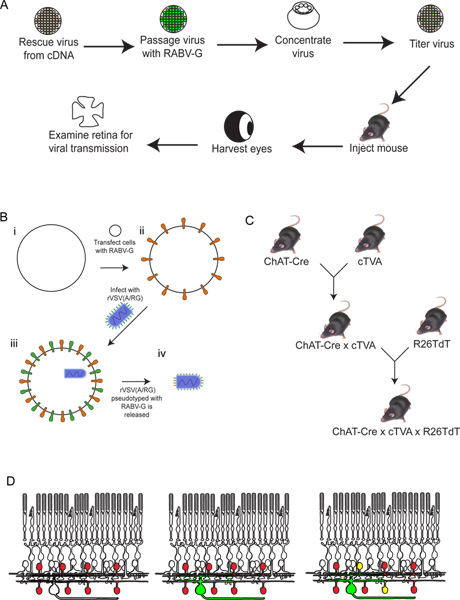
Figura 2. Esquemática do procedimento experimental. (A) Em primeiro lugar, o vírus é resgatado de cDNA. É então repicadas e pseudotipado com RABV-G, e concentrou-se e tituladas. Este vírus é depois injectado no cérebro, onde é deixado a incubar durante o período de tempo desejado. Após estatempo, o olho é colhida, e a retina dissecados e analisados. (B) Esquema de pseudotipagem com o vírus RABV-G. Isto é necessário para a infecção de células ganglionares da retina de uma injecção de cérebro. O gene RABV-G é primeiro transfectados em células de cultura de tecidos que expressam o receptor TVA. Estas células são então infectadas com a VSVD (A RG /) virus. Os viriões libertados terá RABV-G no envelope viral, mas não tem o gene para RABV-G no genoma viral. (C) Um esquema do rato atravessa necessário para triplicar os animais transgénicos. Alelos condicionais TVA e tdTomato são cruzados com um controlador de Cre da escolha, de tal modo que ambos TVA e tdTomato são expressos apenas em células com uma história de expressão de Cre. Neste exemplo, utilizou-se ChAT-Cre. (D) Um esquema da infecção da retina, a fim de traçar DSGC SAC-circuitos. As células são feitas de ChAT a express TVA e tdTomato, como mostrado em (C). RGCs são infectadas a partir de um LGN eminfecção do vírus produzido em (B). Como o vírus expressa GFP, estes CGR será verde. O vírus será então espalhada apenas para TVA-expressando células amácrinas ChAT, se estiverem ligados ao RGC marcadas. Essas células vão ser vermelho e verde ou amarelo. Clique aqui para ver maior figura .
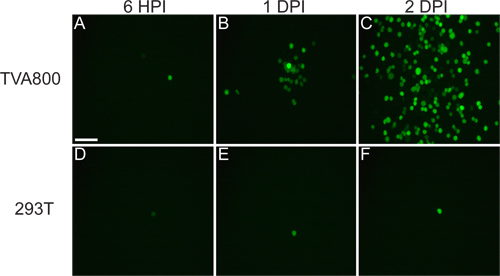
Figura 3. Comportamento de VSVD (A RG /) vírus em células 293T e TVA800. Estas células foram infectadas com um título baixo VSVD (A RG /) pseudotipado com RABV-G. Os vírus se propaga entre TVA-expressando células em questão de horas, como mostrado a 6 horas após a infecção (IPH), 1 e 2 dias após a infecção (DPI). Contudo, a propagação em células 293T, que não expressam o receptor TVA, embora it ocorre, acontece muito mais lento. Barra de escala = 100 pm.
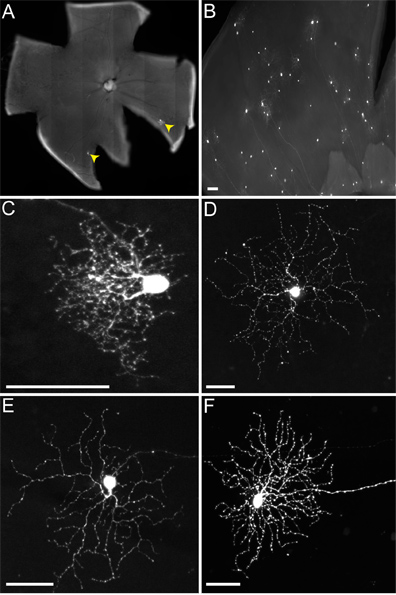
Figura 4. Infecções representativos de RGCs de não-TVA ratinhos que expressam. Os animais foram injectados com o LGN o VSVD (A RG /) vírus pseudotipado com RABV-G, e de tecido colhidas 2 dpi. (A) Sparse (CGRs indicado por setas amarelas) ou (B) infecções densas podem ser obtidos, dependendo do título do vírus e a qualidade da injecção. Muitos tipos diferentes de CGR pode ser identificado com base na morfologia, incluindo (C) pequeno caramanchão CGR, (d) tipo 1 RGCs melanopsina, (E)-DSGCs, e (F) ON-OFF-DSGCs, entre outros. Barra de escala = 50 um.

Figura 5. VSVD (A RG /) a transmissão de ON-OFF-DSGCs a ZEC segue o padrão esperado. (A) ON-OFF-DSGCs (seta branca com preenchimento verde) vírus transmitir aos SACs múltiplas (setas amarelas). (A '). Todas as células que não são verdes da etiqueta DSGC co-Cre com o repórter, o que indica que eles são TVA expressam ZEC. (BC) A DSGC (seta branca com verde preenchimento) e SACs (setas amarelas) estratificar nas camadas ChAT apropriadas da camada plexiforme interna da retina (IPL). As células para que os vírus transmite incluem tanto ON e OFF-sacos. Os números entre os painéis B 'e C' indicam as lâminas IPL. A localização da soma DSGC só é indicado pela seta, mas não mostrado no painel C para destacar as ZEC. Barra de escala = 50 um.
Discussão
O uso de vírus para estudar circuitos neurais são um método de rendimento relativamente elevado de análise de neurónios ligados. No entanto, tanto a geração de viriões de VSV e RABV não é trivial. Embora o protocolo descrito acima, para resgatar o vírus a partir de ADNc é fornecido, é ainda um evento de baixa probabilidade. Os níveis de cada um dos N, P, e L plasmídeos necessitam de ser ajustado com precisão, e muitas tentativas e replica precisa de ser feito para assegurar resgate viral. A formação da...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Nós gostaríamos de agradecer Sean Whelan para assistência com resgate variantes VSV recombinantes, e Didem Goz e Ryan Chrenek para assistência técnica. Este trabalho foi financiado por HHMI (CLC), e # NS068012-01 (KTB).
Materiais
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Referências
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados