A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איתור נגיפי של מעגלים עצביים מוגדרים גנטי
In This Article
Summary
שיטה של התחקות נוירונים הקשורים synaptically מתוארת. אנו משתמשים סגוליים TVA של תא במעלה זרם כדי לבחון אם אוכלוסיית תא של עניין מקבלת קלט סינפטי מסוגי תאים מוגדרים מבחינה גנטית.
Abstract
שיטות קלסיות לחקר מעגלים עצביים הן תפוקה נמוכה למדי. וירוסי Transsynaptic, במיוחד pseudorabies (PRV) ונגיף כלבת (RABV), ולאחרונה שלפוחי וירוס stomatitis (VSV), ללימוד מעגלים, יותר ויותר פופולריים. שיטות תפוקה גבוהות אלה להשתמש וירוסים שמשדרים בין הנוירונים בשני כיווני אנטרוגרדית או מדרדר.
לאחרונה, RABV שונה לאיתור מדרדר monosynaptic פותח. (איור 1 א). בשיטה זו, גליקופרוטאין הגן (G) נמחק מהגנום הנגיפי, והצטייד במצרכים רק בנוירונים ממוקדים. הספציפיות זיהום מושגת על ידי החלפת G chimeric, מורכב מהתחום התאי של ASLV-גליקופרוטאין ותחום cytoplasmic של RABV-G (/ RG), לנורמלי 1 RABV-G. G chimeric זה במיוחד מדביק תאים המבטאים את הקולטן TVA 1. גן קידוד TVA יכול היה דelivered על ידי שיטות שונות 2-8. בעקבות זיהום RABV-G של נוירון TVA מבטא, RABV יכול לשדר לנוירונים אחרים, הקשורות בsynaptically כיוון מדרדר ידי הטבע של G שלו אשר היה השותף נמסר-עם קולט TVA. טכניקה זו מתייגת מספר רב יחסי של תשומות (5-10%) 2 על סוג תא מוגדר, מתן דגימה של כל תשומות על סוג תא תנע מוגדר.
אנחנו שונים לאחרונה בטכניקה זו כדי להשתמש VSV כ9 נותב transsynaptic. VSV יש מספר יתרונות, כולל המהירות של ביטוי גנים. כאן אנחנו פירוט מערכת איתור נגיפית חדשה באמצעות VSV השימושי לחקור microcircuitry עם רזולוציה מוגברת. בעוד אסטרטגיות המקוריות שפורסמו על ידי Wickersham et al. 4 ו אייר et al. תיוג 9 היתר של כל הנוירונים שמשליכים על נגוע, תחילה TVA-להביע תאים, כאן VSV תוכנן לשידור רק לטלביזיהתאים המבטאים-(האיור 1B). וירוס pseudotyped הראשון עם RABV-G להתיר זיהום של מורד הנוירונים של נוירונים המבטאים TVA-. לאחר הדבקת האוכלוסייה ראשונה זה של תאים, הווירוס יכול להדביק תאים שוחרר TVA מבטא בלבד. בגלל ההתפשטות הנגיפית transsynaptic מוגבלת לתאים המבטאים TVA-, נוכחות של העדר קישוריות מסוגי תאים מוגדרים ניתן לחקור ברזולוציה גבוהה. תרשים זרימה ניסיונית של ניסויים אלה מוצג באיור 2. כאן אנו מציגים מודל מעגל, שכיוון של-הסלקטיביות ברשתית העכבר. אנו בודקים את הקישוריות של תאי התפרצות כוכבי amacrine (צקים) לתאי הגנגליון ברשתית (RGCs).
Protocol
1. ביצוע וירוס מcDNA: שחזור של VSV מcDNA באמצעות vaccinia-T7 מערכה 10
- יום לפני ניסוי אחד, לפצל BsrT7 תאים לתוך צלחת 60 מ"מימ המכילה DMEM + 10% FBS. תאי 2E6 זרעים למאכל. BsrT7 תאים נגזרים מBHK21 או כליות אוגר תינוק, תאים.
- PBS החם עם מגנזיום וסידן 1 mM mM 1-37 ° C.
- השג aliquot קטן vTF7-3, וירוס vaccinia להביע פולימראז T7, והפשרה לטמפרטורת חדר. vTF7-3 הם וירוס מדבק vaccinia להביע פולימראז T7 11, ויש להשתמש רק ב 2 הכלת רמת בטיחות הביולוגית. מערכת ביטוי זה משמשת להפקת רמות מקסימליות של התעתיקים הרצויים מפלסמידים transfected בשלב 1.9. מערבולת וירוס למשך 30 שניות במהירות מרבית. Sonicate בsonicator שולחן עבור 2 דקות באמבט מים בטמפרטורת חדר. מערבולת שוב למשך 30 שניות כדי לשבור את גושים ויראליות.
- הסר את המדיה מBSRT7 תאים.
- הוסף 11.7 μl vTF7-3עד 600 PBS μl עם מגנזיום וסידן ולהוסיף תערובת על גבי התאים.
- העבר לצלחות 34 מעלות צלזיוס חממה עם 5% CO 2. צלחות רוק בעדינות, אחרי כל 10 דקות.
- אחרי 45 דקות שחלפו, להתחיל transfection. הוסף 20 μl lipofectamine 2000 עד 1 המ"ל DMEM ומערבב. חכה 5 דקות.
- הוסף 5.25 מיקרוגרם PN, 2.3 מיקרוגרם PP, 1.2 מיקרוגרם pl, 1 מיקרוגרם pCAG RABV-G, ו6 הגנומי VSV מיקרוגרם cDNA עד 500 DMEM μl. PN, PP וpl הם פלסמידים נהיגת ביטוי של גנים נגיפיים VSV תחת אמרגן T7 10, עם הסכומים שנקבעו באופן אמפירי לחילוץ אופטימלי של הנגיף.
- לשלב את שני צינורות ומערבבים. לחכות 15 דקות בטמפרטורת חדר.
- הסר PBS ושוטף את כלי פעם אחת עם 1.5 המ"ל DMEM.
- לשאוב לשטוף תקשורת. הוסף תערובת transfection לצלחת. העבר לצלחות 34 מעלות צלזיוס החממה.
- חכה 5 שעות, ולאחר מכן להסיר את אמצעי תקשורת.
- שינוי תקשורת עד 4 המ"ל DMEM + 2% + 1x פניצילין-סטרפטומיצין + pH FBS 10 mM HEPES 7.4. התוספת של Penicillin-סטרפטומיצין, על מנת למנוע זיהום, וHEPES, כדי לשמור על רמת החומציות של התקשורת, הם מאוד חשובים. תוכן FBS ניתן ירד ל 2%, כפי שהשמידו את התאים בעניין של ימים על ידי הווירוס ולכן לא צריך 10% FBS.
- צלחות מקום ל34 מעלות צלזיוס חממה עבור 48-72 שעות.
- לאסוף תקשורת בשעה 3 ו 6 ימים לאחר transfection, ומייד מזרק דרך מסנן של 0.20 מיקרומטר מסנן. מסנן גודל זה מסיר את וירוס vaccinia, אבל לא VSV.
- מכיוון שאנו רוצים לספק RABV-G למעטפת נגיף, והגנום אינו מקודד גן RABV-G, זה חייב להיות מסופק ללא הרף בטראנס. כדי לעשות זאת, להפוך את צלחת נפרדת של 293T TVA800 (TVA800) תאים. אלה הם תאים המבטאים את הקולטן constitutively המע"מ, המתיר זיהום ויראלי EnvA בתיווך 12. ב 80% confluency, לשנות תקשורת לDMEM בלבד, אז transfect התאים עם 5 מיקרוגרם של חלבון G קידוד פלסמיד (כלומר pCAG RABV-G) לצלחת. אנו משתמשים PEאני מגיב transfection, פולימר polycationic שהוא הרבה יותר זול מאשר בשיטות דומות מבוססות שומנים. עם זאת, lipofectamine יכול לשמש גם ביעילות למטרה זו. PEI האופטימלי: יחס ה-DNA צריך להיקבע באופן אמפירי. לעשות את זה בניסוי נפרד עם כתב ניאון, כלומר pCAG-GFP. אנו משתמשים ב10 PEI μl: 4-DNA מיקרוגרם.
- החל מהשלב 16 supernatant לצלחת של TVA800 transfected תאים.
- ציית לצלחת זה למחרת עדויות לקרינה של fluorophore הביע באופן ויראלי. פלואורסצנטי נגיפי נצפה לראשונה כתא בודד, ובהדרגה מתפשט לאורך זמן (כלומר איור 3). הווירוס צריך להתפשט בתוך כמה שעות.
2. מעבר וריכוז VSV
- פיצול TVA800 תאים לתקשורת המכילה DMEM + 10% FBS כזה שיהיה לך ארבעה לוחות 10-סנטימטר ב ~ 80% confluency למחרת. תאי 293T מבוססים לעבוד גם בשל טראן הגבוה שלהםsfectability, והשימוש בתאים המבטאים TVA-משפרים את המהירות שבה התאים במנה להידבק. שורות תאים transfectable מאוד אחרות עשויות לשרת את המטרה גם כן.
- ב 80% confluency, לשנות תקשורת לDMEM בלבד, אז transfect התאים עם 5 מיקרוגרם של פלסמיד קידוד חלבון G שברצונך להשתמש (כלומר pCAG RABV-G) לצלחת. אנו משתמשים PEI, אבל FUGENE / עבודה Lipofectamine גם כן.
- חכה יום אחד לאחר transfection להצטברות גליקופרוטאין ביטוי / משטח. שינוי בתקשורת (5 מ"ל / צלחת) לDMEM + 10% FBS, אז להדביק עם rVSV (/ RG) וירוס בריבוי של זיהום (משרד פנים) של 0.01
- בדקו את כמות הזיהום 24 שעות מאוחר יותר. אתה צריך לראות את תאים נגועים (שזוהה על ידי GFP פלואורסצנטי), חלקם עם תיקונים המקיפים את התאים נגועים (כלומר איור 3). בדרך כלל זה רק שווה איסוף supernatant אם אתה רואה> 50% מתאים נגועים, אחרת titers הנגיפי obtaineד מריכוז יהיה הכי מוצלח.
- אם> 50%, לאסוף 5 המ"ל של תקשורת / צלחת, ולהחליף עם 5 מ"ל של תקשורת החדשה. אם מעט מדי תאים נגועים, להמתין ל12-24 שעות נוספות, ובדוק שוב. הקפא את supernatants נאסף ב-80 ° C.
- לאסוף כל שעות 24 ואילך במשך 3 ימים, עבור סכום כולל של 4 ימים.
- בסך הכל, אם התחלת עם 4 צלחות, אתה צריך 20 מ"ל של מדיה מכל יום - כך שסך כל 80 מ"ל, או 2 צינורות ultracentrifuge שווי של supernatant. הפשר את supernatants על 37 מעלות צלזיוס ומסנן מעל 0.45 מסנני מיקרומטר על קרח. Aliquot 36 מ"ל של וירוס לתוך צינורות צנטריפוגות Beckman.
- להתרכז (21,000 K בSW28 הרוטור (= 80000 XG) עבור 90 דקות) supernatant ב 4 ° C. למזוג supernatant לתוך מבחנה המכילה אקונומיקת 10%, ואילו הצינור הוא הפוך, השתמש aspirator להסיר כמה תקשורת מהצד של הצינור ככל האפשר.
- אמנם מכוסה. לנער את הצינורות הנגיפיים ב 4 מעלות צלזיוס במשך שעה 1. סטנדרטי שייקר באבולא 120 סל"ד מספיק.
- עדינות triturate גלולה באמצעי התקשורת שנותרה על ידי pipetting בעדינות מעלה ומטה 30 פעמים. היזהר שלא להכניס בועות אוויר. נפח התקשורת שנותר צריך להיות כ 30 μl. Aliquot כרך זה לתוך צינורות מרובים כדי למנוע מחזורי הקפאת הפשרה מרובים עבור כל מניה מסוימת, כמו זה יכול לגרום לירידה בכייל נגיף. aliquots אלה יכול להיות קפוא ב-80 ° C.
- כייל הנגיף. Titering בכ 2 ימים לאחר הפגיעה היא אופטימלי. הדבקה ראשונית ניתן להבחין בעניין של שעות, אבל אתה מקבל ייצוג של כייל אם תחכה רק 1 יום. על מנת לקבל את כייל הנגיף, לבצע ניסוי דילול הגבלה של הנגיף המרוכז על קו התא המתאים (תאי 293T לעבוד היטב) בצלחת 24 היטב, ודלל את הווירוס 10-קיפול 1-1: 1000000. את כייל אנחנו מקבלים הם בדרך כלל בטווח של עד 10 8 -10 10 יחידות מיקוד יוצרים (FFU) / מ"ל.
3. Virהזרקתנו
- אנו משתמשים בעכברים, בדרך כלל בין 6-10 שבועות של גיל, לניסויים אלה. בכל גיל לאחר שהוא הקים מעגלים יספיק. אנו בוחרים את השידור מתאי הגנגליון ברשתית (RGCs) לתאי התפרצות כוכבי amacrine (צקים) כדוגמה. ניסוי זה, כdiagramed באיור 2, דורש בעלי חיים מהונדסים משולשים ורק זריקה אחת של וירוס. (כל הנהלים המוצגים אושרו על ידי IACUC בבית הספר לרפואת הרווארד, והיו בהתאם להנחיות מוסדיות).
- ראשית, בעלי החיים הראויים צריכים להיות שנוצרו. המטרה היא לגרום למע"מ בא לידי ביטוי בסוג התא שאדם רוצה למפות ל, באמצעות וירוס (כלומר adeno הקשורים לוירוס, AAV), או על ידי אלל מהונדס. הספציפיות סוג התא בדרך כלל מתקבלת על ידי ביטוי Cre. כאן, אנחנו גם חצינו באלל TVA ביטוי תנאי 7 לכולין Acetyltransferase (צ'אט)-Cre אלל 13, כזה שבא לידי ביטוי TVAבכל התאים עם היסטורית ביטוי Cre (הצ'קים). אנחנו גם חצינו אלל מותנה ביטוי tdTomato (R26TdT) להדמיה של תאים המבטאים TVA-.
- את הקואורדינטות של מיקום ההזרקה צריכות להיות מזוהות. אלה קואורדינטות של עניין ניתן למצוא במוח האטלס, כלומר פרנקלין וPaxinos עכבר מוח אטלס 14. נקודתי ציון אלה צריכים לציין יחסית לציון שניתן בגולגולת העכבר. אנו משתמשים בגבחת, אבל כל מערכת קואורדינטות היא מספיק.
- הכן את מנגנון stereotaxic. הפעל את בקר microinjector, ולהזיז את הבוכנה ומחזיקה האלקטרודה למקומו. ואחר כך שוב, למלא את המזרק עם שמן מינרלים כדי לספק ממשק עם הווירוס. שים את המחט אז על הבוכנה, ולוודא כי אין בועות אוויר להישאר במחט.
- הפשר את הנגיף, ומניח על קרח כדי למנוע ירידה בכייל נגיף. הגדר microinjector ל" לסגת "ולהזיז את הצינור של וירוס כזה שזה contacting על נימי microinjector. למשוך את הסכום הדרוש של rVSV (/ RG) pseudotyped עם RABV-G לניסוי.
- בעלי חיים מקבלים מינון טרום ניתוחי של עצירות (0.05-0.1 מ"ג / ק"ג) לפני הניתוח מתחיל. למרדים את החיה, או משאיפת isoflurane, או הזרקת intraperitoneal של קטמין (40-80 מ"ג / ק"ג) וxylazine (5-10 מ"ג / ק"ג) תערובת מספיקה. הבחירה של הרדמה תלויה במשתמש. אז קמצוץ בוהן מבוצע כדי להבטיח שבעלי חיים הם מורדמים באופן מלא, אם בעל החיים אינו מגיב, אתה יכול להמשיך עם הליך. הקפד לקבל רישיונות מתאימים לפני השימוש בתרופות אלה.
- בעלי חיים מונחים על כרית מחוממת, שמוחזקת על מעמד מטלטלין למיצוב העכבר. משרידי בעל החיים יש לכל אורך ההליך כירורגי. החל משחת עין כדי למנוע התייבשות של הקרנית ואילו בעלי החיים הם מורדמים.
- ראשו של העכבר ולאחר מכן צריך להיות התייצב בstereotaxicpparatus. השתמש בפסי האוזן על מנגנון stereotaxic כדי להבטיח שהראש הוא יסודיות מאובטח, כך שראשו הוא מקביל לקרקע, ולא לסובב רוחבי. ברגע שזה יסתיים, להתאים את סרגל הביס כדי לעזור לייצב את הראש.
- הפרווה של החיה גלחה באזור החתך בחלק העליון של הראש. אז אזור זה הוא שטף שלוש פעמים עם אתנול, ואחרי שלוש פעמים עם יוד. לאחר מכן מבצעים חתך בעור עם אזמל, חושף את הגולגולת.
- ברגע שהעכבר והתקנת הזרקה מוכן, גבחת צריכה להיות ממוקמת. זהו האזור במרכז הראש שsagittal ושני תפרי עטרה להיפגש. ברגע שאזור זה ממוקם, השעון שבמנגנון stereotaxic ניתן להשתמש כדי להתאים את microinjector לקואורדינטות הנכונות. הנה, אנחנו מזריקים את הגרעין הברכיתי הצדדי (LGN), באמצעות קואורדינטות / P -2.46 מ גבחת, L / מ 2, D / V 2.75.
- ברגע שהקואורדינטות שחויגו ב, התרגיל צריך להרכיב אותו.הנח את המקדח למקדחה, ואז להפעיל על המקדחה. חור קטן כדאי לקדוח לתוך האתר זוהה כאתר הזרקה. להיות מאוד עדין עם האימונים כדי לא לגרום ניזק לparenchyma המוח. כאשר העצם הוא דק מאוד, כלי דם בדורה יתבהרו. בשלב זה, לנקב בזהירות את שולי craniotomy עם מחט קטנה (30 מד) ו( # 5) מלקחיים עדינים כדי להסיר את העצם שנותר.
- התאם את הנימים לתפקיד רק הגבה של משטח המוח, שבו החור בדיוק קידוח. המחט צריכה להיות חדה מספיק כדי לחדור מאטר הדורה בקלות. ואז להוריד את המחט לעומק הרצוי, ולהתחיל בהזרקה. אנו להזריק נגיף בשיעור של 100 nl / דקה.
- הליך ההזרקה לנקודה זו לוקח בערך 10 דקות. לאחר הזרקה, המחט נשארת במוח במשך כשבע דקות. זה חיוני, כפי שהוא מאפשר דיפוזיה של נגיף מאתר ההזרקה. מהירות הסרת צורת מחט injeתוצאות אתר ction ביעילות מופחתת זיהום באתר ההזרקה, וזיהום לאורך דרכי המחט.
- המחט עולה לאט מאוד מאתר ההזרקה, במשך התקופה של כשתי דקות. זה נועד שוב כדי להפחית את הזיהום לאורך דרכי המחט.
- הוסר לאחר, אז העור נתפר. בעלי החיים מנוטרים באופן רציף עד שיתאוששו מהרדמה. עצירות (0.05-0.1 מ"ג / ק"ג) מנוהלות כל 12 שעות למשך 2 ימים.
4. קצירת הכנת רקמות / רקמות
- לקציר הרקמה של עניין, הזמן האופטימלי תלוי במטרות של הניסוי. באופן כללי, התפשטות transsynaptic VSV יכולה להיות ראשונה שנצפתה על ידי פחות מ 24 שעות לאחר ההזרקה. עם זאת, זמני ההמתנה ארוכים יותר תביא להתפשטות יותר.
- כדי לקצור את הרשתית, חיות מורדמות הראשון באמצעות משאיפת פחמן דו חמצני ופריקת צוואר רחם מבוצעת. אז גלגל העין מוסר, ולהציב לתוך הצינור קוןTaining פורמלין 4% ב PBS לשעה 1 בטמפרטורת חדר.
- אז גלגל העין ממוקם לתוך צלחת פטרי עם PBS. אז הרשתית גזורה מרקמות אחרות.
- לניתוח הר שלם, רשתיות העיניים נחתכות כדי שכבו, הונח על גבי זכוכית, לאחר מכן עלה עם תקשורת להאריך זהב הרכבה ומכוסית בזכוכית coverslip אפס עובי. מפרידי סיליקון ממוקמים בין השקופיות וcoverslip כדי למזער את כוחות דחיסה על הרשתית. לניתוח סעיף, הרשתית ממוקמת בסוכרוז 30% ב PBS עד השוקע הרשתית. אז הוא הניח לתערובת של 50% אוקטובר ופתרון סוכרוז 50% 30% עבור 3 שעות. אז הוא יהבהב קפוא, והמשיך ב-80 ° C עד מוכן לחיתוך.
5. נציג תוצאות
הווירוס שחולץ מcDNA צריך להיות מסוגל להדביק תאי TVA800, אך לא 293T תאים (איור 3). אספקת RABV-G היתרי הזיהום של t תאים המרוביםypes, כולל 293T. עם זאת, מאחר הגנום RG / מקודד בגנום, מפוזר בין תאים מתרחש בקצב הרבה יותר גבוה בתאים המבטאים TVA-.
לאחר שהווירוס הוא מגוון מרוכז, כייל טיפוסי בין 10 8 FFU / מ"ל ו 10 10 FFU / מ"ל. כייל אלה מתאימים לשימוש בגוף חי.
במהלך הזרקת LGN לעכבר, שאינם מבחין LGN הגבה (dLGN) מLGN גחון (vLGN), כמו גם להפוך בדרך כלל נגוע. לכן, סוגי RGC מרובים הופכים כותרתו (איור 4), כוללים אלה שהפרויקט vLGN, כגון melanopsin RGCs (האיור 4D) וON-DSGCs (4E איור), ואלה שפרויקט dLGN, כגון קטן הסוכה RGCs (האיור 4C) וON-OFF-DSGCs (4F איור). למרות שיותר מסוג אחד של RGC מועבר נגיף לשקיקים, כפי שדווחו במקום אחר (אייר et al., בביקורת), כאן אנו מתמקדים רק על החיבורים למדו היטב של-DSGCs ב-off לשקיקים.
כאשר אנו מזריקים עכברים של גנוטיפ cTVA (+) / chat-Cre (-), שבו צריך לבוא לידי ביטוי לא מע"מ, רק RGCs מסומן (איור כלומר 4). אלה הם בשל ספיגה ראשונית של נגיף pseudotyped RABV-G על ידי RGCs, ולא התפשטות מתרחשת. אין RGCs נגוע מזיהום LGN של rVSV (/ RG) וירוס לא pseudotyped עם RABV-G, בשל חוסר יכולת של נגיפים אלה להאקסונים הארוכים רוחביים של RGCs אלה. עם זאת, כאשר הזריק cTVA (+) / ChATCre (+) (וR26TdT (+)) עכברים לLGN, התפשטות נגיפית מתרחשת, רק לתאי דם אדומים, שמבטאים את כתב Cre (איור כלומר 5). גם תאים אלה שיתוף תווית עם הנוגדן אנטי צ'אט, ורבד רק ברבדים 2 דברו, המאשר את זהותם כצקים (5B דמויות ', ג'). מספר הצ'קים שכותרתו באופן ויראלי לDSGC נע 1-9.
ge = "תמיד"> 
איור 1. המערכת שלנו המדרדרת transsynaptic מעקב השוואה לשיטה שפותחה במקור. (א) (א) בשיטה שפותחה על ידי Wickersham ועמיתיו, "תאי המתנע" הם transfected עם שלושה גנים: קולט TVA, המשמשים כדי לאפשר זיהום במיוחד של תאי transfected; RABV-G, המשמש כדי להשלים RABV, אשר עצמו היה גן G יימחק; וחלבון פלואורסצנטי אדום כדי לזהות תאי transfected. (Ii) RABV pseudotyped עם חלבון RG / מדביק תאים המבטאים TVA-, מה שהופך אותם צהובים. (ג) העברת transsynaptic מדרדר מתרחשת בתאי עצב במעלה זרם. (ב) (א) בשיטה שלנו, TVA-להביע תאים מוגדרים גנטי, ומסומנים עם prote ניאון אדום מותנהפנימה (ii) "תאי המתנע" הם אלה שנדבקו בVSV קידוד גנטי RG / בהגנום הנגיפי. תאי תנעים אלה אינם מבטאים את הקולטן TVA. (ג) העברת transsynaptic מדרדר מתרחשת בתאי העצב TVA מבטא בלבד אם תאים אלו לספק קלט הסינפטי על הנוירונים המתנע. לחץ כאן לצפייה בדמות גדולה.
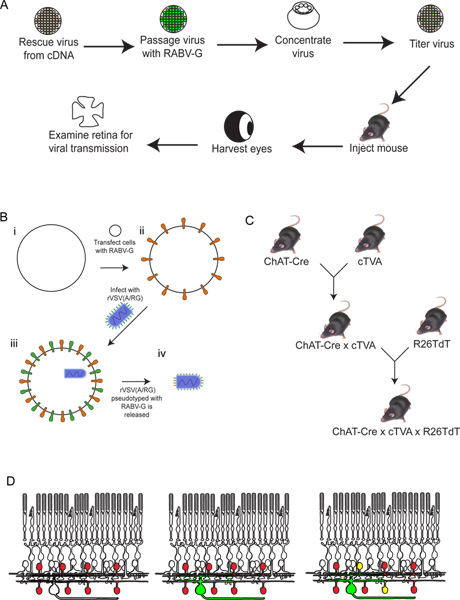
איור 2. סכמטי של ההליך הניסיון. (א) ראשית, הווירוס נצל מcDNA. אז הוא passaged וpseudotyped עם RABV-G, והתרכז וtitered. אז וירוס זה שהוזרק למוח, שם הוא אפשר לדגירה לתקופה הרצויה של זמן. אחרי זהזמן, העין שנקטפה, והרשתית גזורה ונותחה. (ב) סכמטי של pseudotyping הווירוס עם RABV-G. זה הכרחי לזיהום של תאי הגנגליון ברשתית מהזרקת מוח. גן RABV-G הוא transfected הראשון לתוך תאי תרבית רקמה המבטאת את הקולטן TVA. תאים אלה נגועים בrVSV (/ RG) הווירוס. את virions שוחרר יהיה RABV-G במעטפת הנגיף, אך לא יהיה לו גנים לRABV-G בהגנום הנגיפי. (ג) סכמטי של העכבר חוצה הכרחי לחיות מהונדסות משולשות. אללים TVA וtdTomato מותנים חצו לנהג Cre של בחירה, כך שגם המע"מ וtdTomato באים לידי ביטוי רק בתאים עם היסטורית ביטוי Cre. בדוגמה זו, השתמש chat-Cre. (ד) סכמטי של דלקת הרשתית כדי להתחקות מעגלי DSGC-SAC. התאים דברו נעשים המפורש TVA וtdTomato, כפי שמוצגים ב( C). RGCs נגוע מLGN בfection של הנגיף מיוצר ב( B). כווירוס מבטא GFP, RGCs אלה יהיה ירוק. הווירוס התפשט רק לTVA-להביע תאי amacrine דברו אם הם מחוברים לRGC שהכותרת. תאים אלה יהיו גם באדום וירוק, או צהובים. לחצו כאן לצפייה בדמות גדולה.
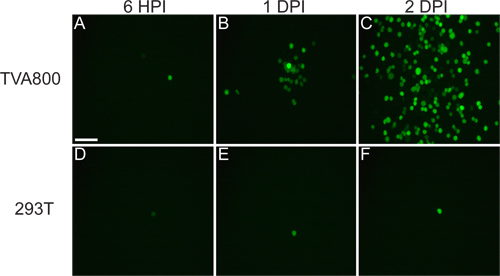
איור 3. התנהגות של rVSV (/ RG) וירוס על 293T וTVA800 תאים. תאים אלה היו נגועים בכייל rVSV נמוך (/ RG) pseudotyped עם RABV-G. מתפשט הנגיף בין TVA-להביע תאים בעניין של שעות, כפי שמוצג בימי זיהום הודעה (HPI), 1 ו 2 (DPI) זיהום שלאחר שעות 6. עם זאת, המרווח על תאי 293T, שאינו מבטאים את הקולטן המע"מ, למרות שאנילא אכן קורים, קורה הרבה יותר לאט. סרגל קנה מידה = 100 מיקרומטר.
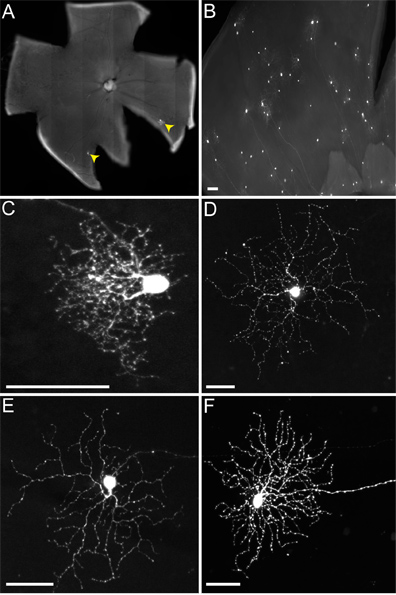
איור 4. זיהומים יציגים של RGCs של הלא TVA עכברים מבטאים. בעלי חיים הוזרקו LGN עם rVSV (/ RG) הווירוס pseudotyped עם RABV-G, ורקמה נקטפה 2 dpi. () הדליל (RGCs מסומן על ידי ראשי חץ צהובים) או (ב) זיהומים צפופים ניתן לקבל, בהתאם לכייל הנוגדנים של נגיף ואיכות של זריקה. סוגים רבים ושונים של RGCs ניתן לזהות מבוססים על מורפולוגיה, כולל (C) הקטן הסוכה RGCs, (ד) 1 RGCs סוג melanopsin, (ה) על DSGCs, ו( F) DSGCs ב-off-, בין יתר. ברי קנה מידה = 50 מיקרומטר.

איור 5. RVSV (/ RG) העברה מ- DSGCs ב-off לשקיקים כדלקמן הדפוס הצפוי. () ב-off-DSGCs (לבן עם ראש החץ ירוק למלא) וירוס לשדר לשקיקים מרובים (ראשי חץ צהובים). ('). כל התאים הירוקים שאינם שותף תווית DSGC עם כתב Cre, המציין כי הם TVA-לבטא צקים. (BC) DSGC (לבן עם ראש החץ ירוק מילוי) והצ'קים (ראשי חץ צהובים) רבד בשכבות דברו המתאימות של השכבה הפנימית plexiform הרשתית (IPL). התאים שמעביר את הווירוס כוללים ברשת ומחוצת מוצא. מספרים בפנלים ב 'וג'' מצביעים רבדי IPL. המיקום של סומה DSGC מצוין רק על ידי ראש החץ, אך לא יוצג בפנל C כדי להדגיש את הצ'קים. ברי קנה מידה = 50 מיקרומטר.
Discussion
שימוש בוירוסים כדי ללמוד מעגלים עצביים הוא שיטת תפוקה גבוהה יחסית של ניתוח נוירונים מקושרים. עם זאת, שהניב גם virions RABV VSV ואינו טריוויאלי. למרות שהפרוטוקול מפורט לעיל להצלת וירוס מcDNA מסופק, זה עדיין אירוע הסתברות נמוכה. הרמות של כל אחד מN, P, ופלסמידים L צריכות להיות מותאמ...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
ברצוננו להודות שון וילן לסיוע בהצלת ריאנטים VSV רקומביננטי, וDidem גוז וריאן Chrenek לסיוע טכני. עבודה זו נתמכה על ידי HHMI (CLC), ו# NS068012-01 (KTB).
Materials
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
References
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved