Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Viral traçage des circuits neuronaux génétiquement déterminées
Dans cet article
Résumé
Procédé de traçage neurones connectés synaptique est décrit. On utilise la spécificité de la TVA une cellule amont pour sonder si une population cellulaire d'intérêt synaptique reçoit une entrée à partir de types de cellules génétiquement déterminées.
Résumé
Les méthodes classiques d'étude des circuits neuronaux débit assez faible. Transsynaptique virus, en particulier la pseudo-rage (PRV) et le virus de la rage (RABV), et plus récemment virus de la stomatite vésiculaire (VSV), pour l'étude des circuits, est de plus en plus populaire. Ces méthodes à utiliser plus les virus qui transmettent entre les neurones, soit la direction antérograde ou rétrograde.
Récemment, un RABV modifié pour monosynaptique rétrograde traçage a été développé. (Figure 1A). Dans cette méthode, la glycoprotéine (G), le gène est supprimé à partir du génome viral, et réapprovisionné seulement dans les neurones cibles. Spécificité infection est obtenue en substituant une chimère G, composé du domaine extracellulaire de la glycoprotéine ASLV-A et le domaine cytoplasmique de la RABV-G (A RG /), pour la normale RABV-G 1. Cette chimère G infecte spécifiquement les cellules exprimant le récepteur TVA 1. Le gène codant pour la TVA peut d étéelivered par diverses méthodes 2-8. Après RABV-G infection d'un neurone TVA exprimant, le RABV peut transmettre à d'autres neurones, synapses connectées dans un sens rétrograde par la nature de son propre G qui était co-délivré avec le récepteur TVA. Cette technique qualifie un nombre relativement important d'entrées (10.05%) 2 sur un type cellulaire défini, la fourniture d'un échantillon de toutes les entrées sur un type cellulaire défini démarreur.
Nous avons récemment modifié cette technique à utiliser VSV comme un traceur transsynaptique 9. VSV a plusieurs avantages, notamment la rapidité de l'expression des gènes. Ici, nous détaillons un nouveau système de suivi à l'aide virale utiles pour sonder les microcircuits avec une résolution accrue VSV. Alors que les stratégies originales publiées par Wickersham et al. 4 et Beier et al. 9 étiquetage de tous les permis de neurones qui projettent sur un premier-infectés TVA exprimant des cellules, ici VSV a été conçu pour transmettre uniquement à la télévisionCellules exprimant A-(figure 1B). Le virus est d'abord pseudotypés avec RABV-G pour permettre l'infection des neurones en aval de TVA exprimant neurones. Après avoir infecté de cette première population de cellules, le virus ne peut infecter publié TVA cellules exprimant. Parce que la propagation virale transsynaptique est limitée à TVA cellules exprimant, la présence de l'absence de connectivité de types de cellules définies peuvent être explorées avec une grande résolution. Un diagramme expérimental de ces expériences est montré dans la figure 2. Ici, nous montrons un circuit modèle, celui de la direction de la sélectivité dans la rétine de la souris. Nous examinons la connectivité des cellules amacrines starburst (ZSC) pour les cellules ganglionnaires de la rétine (CGR).
Protocole
1. Faire virus à partir d'ADNc: Recouvrement de la VSV à partir d'ADNc en utilisant la vaccine-T7 système 10
- Un jour avant l'expérience, divisé en 60 cellules BsrT7 plat mm contenant du DMEM + 10% de FBS. Cellules par boîte de graines 2E6. BsrT7 cellules BHK21 sont dérivées de, ou rein de bébé hamster, cellules.
- PBS tiède avec 1 mM de magnésium et de calcium 1 mM à 37 ° C.
- Procurez-vous une petite aliquote vTF7-3, un virus de la vaccine exprimant la T7 polymérase, et de dégel à la température ambiante. vTF7-3 est un virus de la vaccine infectieux exprimant la polymérase T7 11, et doit être utilisé uniquement dans le niveau 2 de sécurité biologique de confinement. Ce système d'expression est utilisé pour générer les niveaux maximaux de la transcription souhaités à partir des plasmides transfectés dans l'étape 1,9. Vortex virus pendant 30 secondes à la vitesse max. Soniquer dans un sonicateur table pendant 2 min dans un bain d'eau à température ambiante. Vortex à nouveau pendant 30 secondes pour briser les mottes virales.
- Retirez le papier de la BSRT7 cellules.
- Ajouter 11,7 ul vTF7-3à 600 pi de PBS avec du magnésium et du calcium et ajouter le mélange sur les cellules.
- Déplacez les plaques dans un incubateur 34 ° C avec 5% de CO 2. Plaques rocheuses en douceur une fois toutes les 10 min.
- Au bout de 45 min sont écoulées, commencez la transfection. Ajouter 20 ul de lipofectamine 2.000 à 1 ml de DMEM et mélanger. Attendre 5 min.
- Ajouter 5,25 pg, pN 2,3 pg pP, 1,2 pg j, 1 pg pCAG RABV-G, et 6 mg d'ADNc génomique du VSV à 500 ul de DMEM. pN, PP et j sont des plasmides d'entraînement de l'expression des gènes viraux dans le cadre du VSV promoteur T7 10, avec les montants déterminés de façon empirique pour le sauvetage optimale du virus.
- Combiner les deux tubes et mélanger. Attendre 15 min à température ambiante.
- Retirer du PBS et laver les plaques une fois avec 1,5 ml de DMEM.
- Aspirer rincer médias. Ajouter le mélange de transfection à l'assiette. Déplacez plaques en 34 ° C incubateur.
- Attendre 5 heures, puis retirez le support.
- Changer de support à 4 ml de DMEM + 2% de FBS + 1x pénicilline-streptomycine + 10 mM HEPES pH 7,4. L'ajout de Penicillin-streptomycine, pour éviter la contamination, et HEPES, pour maintenir le pH du milieu, sont très importants. Le contenu de FBS peuvent être tombée à 2%, que les cellules seront détruites en quelques jours par le virus et n'ont donc pas besoin de FBS à 10%.
- Placer les plaques en 34 incubateur ° C pendant 48-72 heures.
- Recueillir les médias à 3 et 6 jours après la transfection, et immédiatement seringue filtre à travers un filtre 0,20 um. Ce filtre élimine taille du virus de la vaccine, mais pas le VSV.
- Puisque nous voulons fournir RABV-G à l'enveloppe virale, et le génome ne code pas le gène RABV-G, il doit être alimenté en permanence en trans. Pour ce faire, faites une plaque séparée de 293T TVA800 (TVA800) des cellules. Ce sont des cellules qui expriment le récepteur constitutivement TVA, ce qui permet ENVA médiée par une infection virale 12. À 80% de confluence, changer de support de DMEM seulement, puis transfecter les cellules avec 5 pg de plasmide codant pour la protéine G (c.-à-pCAG RABV G) par plaque. Nous utilisons le PEJe réactif de transfection, un polymère polycationique qui est beaucoup moins cher que comparables à base de lipides méthodes. Cependant, la lipofectamine peut également être utilisé de manière efficace à cette fin. L'optimum PEI: ratio de l'ADN doit être déterminée de manière empirique. Pour ce faire, dans une expérience séparée avec un rapporteur fluorescent, soit pCAG GFP. Nous utilisons 10 pl PEI: 4 ug d'ADN.
- Appliquer le surnageant de l'étape 16 sur la plaque transfecté des cellules TVA800.
- Observez cette plaque le lendemain pour preuve de fluorescence du fluorophore virale exprimée. Fluorescence virale est d'abord observée comme une seule cellule, et se propage peu à peu au fil du temps (c.-à-Figure 3). Le virus se répande dans quelques heures.
2. Passage et la concentration de la VSV
- Diviser TVA800 cellules dans des milieux contenant du FBS DMEM + 10% de sorte que vous aurez quatre plaques de 10 cm à ~ 80% de confluence le jour suivant. 293T cellules à base de bien travailler en raison de leur grande transfectability, et l'utilisation de cellules exprimant TVA augmente la vitesse à laquelle les cellules de la boîte de l'infection. D'autres lignées cellulaires hautement transfectables peut servir l'objectif ainsi.
- À 80% de confluence, changer de support de DMEM seulement, puis transfecter les cellules avec 5 pg de plasmide codant pour la protéine G que vous souhaitez utiliser (c.-à-pCAG RABV G) par plaque. Nous utilisons Prince-Édouard, mais FuGENE / Lipofectamine travail aussi bien.
- Attendre un jour après la transfection pour expression de la glycoprotéine / surface d'accumulation. Modifiez les médias (5 ml / plaque) pour FBS DMEM + 10%, alors infecter avec rVSV (A RG /) du virus à une multiplicité d'infection (MOI) de 0,01
- Vérifiez le taux d'infection 24 heures plus tard. Vous devriez voir les cellules infectées (identifié par fluorescence de la GFP), certains avec des taches autour des cellules infectées (figure soit 3). En général, il ne vaut recueillir le surnageant si vous voyez> 50% des cellules infectées, sinon les titres viraux obtained de la concentration sera optimale.
- Si> 50%, de recueillir les 5 ml de support / plaque, et la remplacer par 5 ml de milieu frais. Si trop peu de cellules sont infectées, attendre un autre h 12-24, et vérifier de nouveau. Geler les surnageants recueillis à -80 ° C.
- Collecter toutes les 24 hr par la suite pendant 3 jours, pour un total de 4 jours.
- Au total, si vous avez commencé avec 4 plaques, vous devriez avoir 20 ml de milieu de chaque jour - donc 80 ml au total, soit 2 tubes ultracentrifugation valeur de surnageant. Décongeler les surnageants à 37 ° C et filtre sur des filtres de 0,45 um sur la glace. Aliquote de 36 ml du virus dans des tubes de centrifugeuse Beckman.
- Concentrer le surnageant (21.000 K dans un rotor SW28 (= 80 000 x g) pendant 90 min) à 4 ° C. Décanter le surnageant dans un bécher contenant l'eau de Javel à 10%, et pendant que le tube est inversée, utiliser un aspirateur pour retirer une feuille aussi bien du côté du tube que possible.
- Bien couvert. Agiter les tubes virales à 4 ° C pendant 1 heure. Un agitateur standard à about 120 tours par minute est suffisante.
- Doucement triturer culot dans les médias reste en pipetant doucement de haut en bas 30 fois. Veillez à ne pas introduire de bulles d'air. Le volume restant des médias devrait être d'environ 30 pi. Aliquote de ce volume dans des tubes multiples afin d'éviter de multiples cycles gel-dégel pour un stock particulier, car cela peut entraîner une diminution du titre viral. Ces aliquotes peuvent être congelées à -80 ° C.
- Titrer le virus. Titrage à environ 2 jours post-infection est optimal. L'infection initiale peut être observée en quelques heures, mais vous obtenez une sous-représentation de titre si vous attendez seulement 1 jour. Afin d'obtenir le titre viral, réaliser une expérience de dilution limite du virus concentré sur la lignée cellulaire appropriée (cellules 293T fonctionne bien) dans une plaque de 24 puits, diluer le virus de 10 fois 1 à 1: 1.000.000. Les titres que nous recevons sont généralement de l'ordre de 10 8 -10 10 unités de discussion de formage (FFU) / ml.
3. VirNous injection
- Nous utilisons des souris, typiquement entre 6-10 semaines d'âge, pour ces expériences. N'importe quel âge après lequel le circuit est établi suffirait. Nous choisirons la transmission des cellules ganglionnaires de la rétine (CGR) pour starburst cellules amacrines (ZSC) comme un exemple. Cette expérience, comme schématisé à la figure 2, nécessite un animal transgénique triple et seulement une seule injection de virus. (Toutes les procédures indiquées ont été approuvés par le IACUC à la Harvard Medical School, et étaient conformes aux directives institutionnelles).
- Tout d'abord, les animaux appropriés doivent être générés. L'objectif est d'avoir exprimé TVA dans le type de cellules que l'on souhaite tracer dans, au moyen d'un virus (par exemple virus adéno-associé, AAV), ou par un allèle transgénique. La spécificité du type cellulaire est généralement obtenue par expression de Cre. Ici, nous avons également croisé dans un allèle TVA expression conditionnelle 7 à une choline acétyltransférase (ChAT)-Cre allèle 13, tels que TVA est expriméedans toutes les cellules ayant des antécédents d'expression Cre (ZSC). Nous avons également franchi une expression conditionnelle allèle tdTomato (R26TdT) pour la visualisation des cellules exprimant TVA.
- Les coordonnées de l'emplacement d'injection doivent être identifiés. Ces coordonnées d'intérêt peuvent être trouvés dans le cerveau atlas, c'est à dire le Franklin et Paxinos cerveau de souris atlas 14. Ces coordonnées doivent être notés par rapport à un repère donné sur le crâne de la souris. Nous utilisons bregma, mais n'importe quel système de coordonnées est suffisante.
- Préparer l'appareil stéréotaxique. Allumez le contrôleur microinjecteur, et déplacer le piston et le porte-électrode en place. Puis de nouveau-remplir l'aiguille d'injection avec de l'huile minérale pour fournir une interface avec le virus. Placez l'aiguille, puis sur le piston, en veillant à ce qu'aucune bulle d'air dans l'aiguille.
- Décongeler le virus, et les placer sur la glace pour éviter une chute du titre viral. Réglez le microinjecteur pour "retirer" et déplacer le tube de virus tel que cela est contacting le capillaire sur le microinjecteur. Prélever la quantité nécessaire de rVSV (A RG /) pseudotypés avec RABV-G pour l'expérience.
- Animaux reçoivent une dose pré-opératoire de la buprénorphine (0,05-0,1 mg / kg) avant la chirurgie commence. Pour anesthésier l'animal, que ce soit par inhalation d'isoflurane ou une injection intrapéritonéale de kétamine un (40-80 mg / kg) et de xylazine (5-10 mg / kg) mélange est suffisante. Choix d'anesthésique dépend de l'utilisateur. Un pincement de l'orteil est ensuite effectuée pour s'assurer que les animaux sont pleinement anesthésiés, si l'animal ne répond pas, vous pouvez passer à la procédure. Soyez sûr d'obtenir les licences adéquates avant d'utiliser ces médicaments.
- Les animaux sont placés sur un tapis chauffant, qui est calé sur un support mobile pour le positionnement de la souris. L'animal y reste pendant toute la durée de l'intervention chirurgicale. Appliquer une pommade oculaire pour éviter le dessèchement de la cornée tandis que l'animal est anesthésié.
- La tête de la souris doit ensuite être stabilisé dans le stéréotaxique d'unppareils. Utiliser les barres d'oreilles sur l'appareil stéréotaxique de sorte que la tête est parfaitement sécurisé, de telle sorte que la tête est parallèle au sol, et ne tourne pas latéralement. Une fois ceci terminé, réglez la barre de morsure pour aider à stabiliser la tête.
- Fourrure de l'animal est rasé au niveau de l'incision sur le dessus de la tête. Cette zone est ensuite lavée trois fois avec de l'éthanol, suivie par trois fois avec de l'iode. Une incision est alors faite dans la peau avec un scalpel, révélant le crâne.
- Une fois la souris et la configuration d'injection sont préparés, bregma doit être situé. Il s'agit de la zone située au centre de la tête que le plan sagittal et deux sutures coronale répondre. Une fois cette zone est située, les molettes de l'appareil stéréotaxique peut être utilisé pour ajuster le micro-injecteur pour les coordonnées correspondant. Ici, on injecte le corps genouillé latéral (CGL), en utilisant des coordonnées A / P -2,46 à partir bregma, L / M 2, D / V 2,75.
- Une fois les coordonnées ont été connectés, la perceuse doit être assemblé.Placer le foret dans le forage, puis allumez la mèche. Un petit trou doit être foré dans le site identifié comme étant le site d'injection. Soyez très doux avec la perceuse afin de ne pas endommager le parenchyme cérébral. Lorsque l'os est très fine, les vaisseaux sanguins de la dure-mère deviennent claires. À ce stade, bien perforer les bords de la craniotomie avec un petit (30 gauge) aiguille et une amende (# 5) pince pour retirer l'os restant.
- Ajuster le capillaire à une position juste au-dorsale de la surface du cerveau, où le trou a été foré juste. L'aiguille doit être suffisamment pointu pour pénétrer la dure-mère avec facilité. Puis abaisser l'aiguille à la profondeur voulue, et pour commencer l'injection. On injecte le virus à un taux de 100 nl / min.
- La procédure d'injection à ce point prend une dizaine de minutes. Après l'injection, l'aiguille reste dans le cerveau pendant environ sept minutes. Ce point est crucial, car il permet la diffusion du virus à partir du site d'injection. Éliminer rapidement la forme d'aiguilles le injection site de résultats dans une efficacité réduite infection au niveau du site d'injection, et l'infection des voies le long d'aiguille.
- L'aiguille est très élevée lentement à partir du site d'injection, sur une période d'environ deux minutes. Ceci est encore destiné à réduire l'infection le long du tractus aiguille.
- Une fois enlevé, la peau est ensuite suturée. Les animaux sont surveillés en permanence jusqu'à leur remettre de l'anesthésie. La buprénorphine (0,05-0,1 mg / kg) est administré toutes les 12 heures pendant 2 jours.
4. La récolte de tissus / Tissue Préparation
- Pour récolter le tissu d'intérêt, le moment optimal dépend des objectifs de l'expérience. En règle générale, la VSV propagation transsynaptique peut d'abord être observé par moins de 24 heures après l'injection. Toutefois, en attendant des temps plus longs se traduira par plus répandues.
- Pour récolter la rétine, les animaux sont d'abord euthanasiés en utilisant l'inhalation de dioxyde de carbone et la dislocation cervicale est effectuée. Le globe oculaire est ensuite retiré et placé dans un tube de concontenant du formaldéhyde à 4% dans du PBS pendant 1 heure à température ambiante.
- Le globe oculaire est ensuite placé dans une boîte de Pétri avec du PBS. La rétine est ensuite disséquée à partir d'autres tissus.
- Pour l'analyse de montage ensemble, les rétines sont découpées de manière à plat, placé sur une lame de verre, puis monté avec les médias prolonger d'or de montage et recouvert d'une lamelle de verre d'épaisseur nulle. Espaceurs en silicone sont placés entre la lame et lamelle pour minimiser les forces de compression sur la rétine. Pour l'analyse de la section, la rétine est placé dans de saccharose à 30% dans du PBS jusqu'à ce que les submerge la rétine. Elle est ensuite placée dans un mélange de 50% PTOM et solution à 50% de saccharose à 30% pendant 3 heures. Il est ensuite congelé à clignoter, et conservé à -80 ° C jusqu'au moment de couper.
5. Les résultats représentatifs
Le virus qui est sauvé d'ADNc doit être capable d'infecter les cellules TVA800, mais pas les cellules 293T (Figure 3). Fournir le RABV-G permet l'infection de cellules T multipleypes, y compris 293T. Toutefois, étant donné que le génome A RG / est encodée dans le génome, répartis entre les cellules se produit à un rythme beaucoup plus élevé dans les cellules exprimant TVA.
Une fois que le virus est concentré, plage typique titres entre 10 8 ffu / ml et 10 10 ffu / ml. Ces titres sont suffisants pour une utilisation in vivo.
Lors de l'injection LGN dans la souris, on ne distingue pas LGN dorsale (dLGN) à partir ventrale LGN (vLGN), à la fois typiquement s'infecter. Par conséquent, plusieurs types RGC deviennent marqués (figure 4), y compris ceux qui projettent vers l'vLGN, comme mélanopsine CGR (figure 4D) et ON-DSGCs (figure 4E), et ceux qui projettent vers l'dLGN, comme le petit- tonnelle CGR (figure 4C) et ON-OFF-DSGCs (Figure 4F). Bien que plus d'un type de RGC virus transmis aux ZSC, tel que rapporté ailleurs (Beier et al., En révision), ici on se concentre uniquementsur les connexions bien étudiées de ON-OFF-DSGCs à ZSC.
Lorsque nous injectons des souris de génotype (+) CTVA / ChAT-Cre (-), où aucune TVA devrait se traduire, seulement CGR sont étiquetées (Figure ie 4). Elles sont dues à l'absorption initiale du virus RABV-G pseudotypés par les CGR et la dissémination se fait pas. Pas de CGR sont infectés par une infection de LGN rVSV (A RG /) virus non pseudotypés avec RABV-G, en raison de l'incapacité de ces virions à transversaux les longs axones de ces CGR. Toutefois, lors de l'injection CTVA (+) / ChATCre (+) (et R26TdT (+)) des souris dans le LGN, la propagation du virus se produit, seulement pour les globules rouges, qui expriment le journaliste Cre (figure soit 5). Ces cellules a également co-étiquette avec l'anticorps anti-Chat, et stratifier seulement dans deux lames ChAT, confirmant leur identité en tant que ZSC (Figures 5B ', C'). Le nombre des ZSC virale marqués par DSGC variait de un à neuf.

Figure 1. Notre système rétrograde transsynaptique traçage par rapport à la méthode développée à l'origine. (A) (i) Dans la méthode développée par Wickersham et ses collègues, «les cellules de démarrage" sont transfectées avec trois gènes: le récepteur TVA, utilisés pour permettre l'infection spécifique de cellules transfectées, la RABV-G, utilisée pour compléter le RABV, qui elle a supprimé le gène G et une protéine fluorescente rouge pour identifier les cellules transfectées. (Ii) Une RABV pseudotypé par la protéine A RG / infecte les cellules exprimant TVA, ce qui les rend jaune. (Iii) la transmission rétrograde transsynaptique se produit pour les neurones en amont. (B) (i) Dans notre méthode, les cellules exprimant TVA sont définies génétiquement, et sont marquées avec un prote conditionnelle rouge fluorescentpo (ii) Les "cellules de démarrage" sont ceux qui sont infectés par un VSV codant pour le gène A RG / dans le génome viral. Ces cellules démarrage n'expriment pas le récepteur TVA. (Iii) la transmission rétrograde transsynaptique se produit à la TVA exprimant neurones que si ces cellules fournissent entrées synaptiques sur les neurones du démarreur. Cliquez ici pour agrandir la figure .
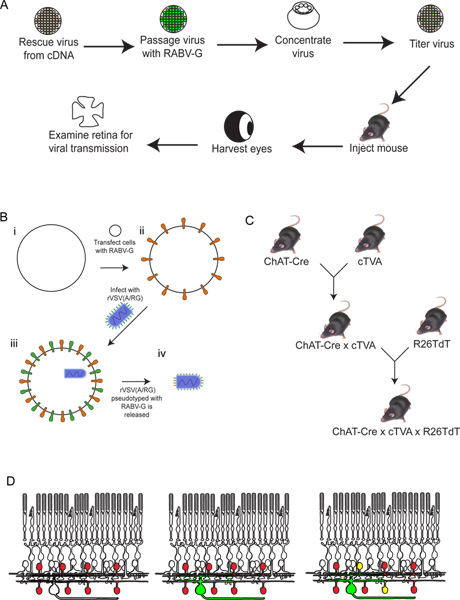
Figure 2. Schéma de la procédure expérimentale. (A) Tout d'abord, le virus est sauvé d'ADNc. Il est ensuite repiquées et pseudotypés avec RABV-G, et concentré et titrés. Ce virus est ensuite injecté dans le cerveau, où il est laissé à incuber pendant la période de temps désirée. Après cettetemps, l'œil est récolté, et la rétine disséqué et analysé. (B) Schéma de pseudotypage le virus avec RABV-G. Cela est nécessaire pour l'infection des cellules ganglionnaires de la rétine d'une injection de cerveau. Le gène RABV-G est d'abord transfecté dans des cellules de culture de tissu exprimant le récepteur de TVA. Ces cellules sont ensuite infectées avec le rVSV (A RG /) virus. Les virions libérés auront RABV-G dans l'enveloppe virale, mais n'auront pas le gène de la RABV-G dans le génome viral. (C) Un schéma de la souris passe nécessaire pour triple animaux transgéniques. Conditionnelles allèles TVA et tdTomato sont croisés à un chauffeur de Cre de choix, tels que TVA et tdTomato sont exprimés uniquement dans les cellules ayant des antécédents d'expression de Cre. Dans cet exemple, nous avons utilisé ChAT-Cre. (D) Un schéma de l'infection rétinienne afin de tracer DSGC-SAC circuits. Les cellules ChAT sont faites pour exprimer TVA et tdTomato, comme indiqué en (C). CGR sont infectés par une LGN dansinfection du virus produit dans (B). Comme le virus exprime la GFP, ces CGR sera vert. Le virus s'est ensuite propagée seulement à TVA exprimant ChAT cellules amacrines s'ils sont connectés à la RGC étiquetés. Ces cellules vont être à la fois rouge et vert, ou jaune. Cliquez ici pour agrandir la figure .
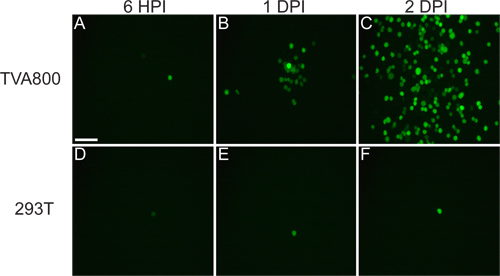
Figure 3. Comportement des rVSV (A RG /) de virus sur les cellules 293T et TVA800. Ces cellules ont été infectées avec un faible rVSV titre (A RG /) pseudotypés avec RABV-G. Le virus se propage entre les cellules exprimant la TVA en quelques heures, comme illustré à 6 heures après l'infection infection (HPI), 1 et 2 jours après (DPI). Cependant, la propagation des cellules 293T, qui n'expriment pas le récepteur TVA, si jet se produit, se produit beaucoup plus lent. Barre d'échelle = 100 um.
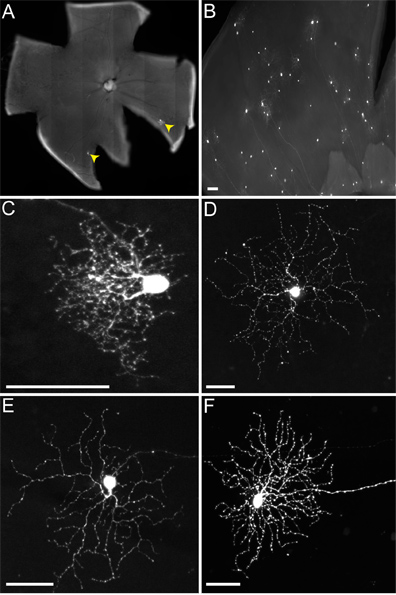
Figure 4. Infections représentatifs de CGR de non-TVA souris exprimant. Les animaux ont été injectés dans le LGN avec le rVSV (A RG /) virus pseudotypés avec RABV-G, et le tissu récolté 2 ppp. (A) dispersé (RGC indiqué par des flèches jaunes) ou (B) les infections denses peuvent être obtenus, selon le titre de virus et de la qualité de l'injection. De nombreux types de CGR peuvent être identifiés en se basant sur la morphologie, y compris (C) CGR petite tonnelle, (D) de type 1 RGC mélanopsine, (E) SUR-DSGCs, et (F) ON-OFF-DSGCs, entre autres. Barres d'échelle = 50 um.

Figure 5. RVSV (A RG /) de transmission de ON-OFF-DSGCs aux ZSC suit le rythme attendu. (A) ON-OFF-DSGCs (tête de flèche blanche avec du vert remplissage) transmettent le virus aux ZSC multiples (flèches jaunes). (A '). Toutes les cellules vertes qui ne sont pas du DSGC co-étiquette avec le journaliste Cre, ce qui indique qu'ils sont TVA exprimant ZSC. (Colombie-Britannique) Le DSGC (tête de flèche blanche avec du vert de remplissage) et ZSC (flèches jaunes) stratifier en couches ChAT appropriés de la couche plexiforme interne rétinienne (IPL). Les cellules à laquelle les transmet virus comprennent à la fois sur et hors ZSC. Les chiffres en panneaux B 'et C' indiquent les lames IPL. L'emplacement du soma DSGC est seulement indiqué par la flèche, mais ne figurent pas dans le panneau C pour mettre en évidence les ZSC. Barres d'échelle = 50 um.
Discussion
Utilisation de virus pour étudier les circuits neuronaux est une méthode débit relativement élevé d'analyser les neurones connectés. Cependant, générer à la fois des virions VSV et RABV n'est pas trivial. Bien que le protocole ci-dessus pour le sauvetage du virus à partir d'ADNc est fourni, il est toujours un événement à faible probabilité. Les niveaux de chacune des N, P et L plasmides doivent être finement ajusté, et de nombreux essais et répétitions doivent être effectuées pour assurer...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à remercier Sean Whelan de l'aide pour sauver variantes VSV recombinants, et Didem Goz et Ryan Chrenek pour l'assistance technique. Ce travail a été soutenu par HHMI (CTC), et n ° NS068012-01 (KTB).
matériels
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Références
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon