Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Genetiği Tanımlı Nöral Devre arasında Tracing Viral
Bu Makalede
Özet
Synaptically bağlı nöronların izleme için bir yöntem tarif edilmektedir. Biz bir ilgi hücre popülasyonu tanımlı genetik hücre tiplerinden sinaptik girdi alıp almadığını soruşturma yönündeki bir hücrenin TVA özgüllüğü kullanın.
Özet
Nöronal devreler eğitimi için klasik yöntemlerle oldukça düşük verim vardır. Transsinaptik virüsler, devreleri çalışmak için özellikle pseudorabies (PRV) ve kuduz virüsü (RABV), ve daha yakın veziküler stomatit virüsü (VSV), giderek daha popüler hale gelmektedir. Bunlar yüksek verim yöntemler ya anterograd veya retrograd yönde nöronlar arasındaki iletimi virüsleri kullanın.
Son zamanlarda, monosinaptik retrograd izleme için bir değiştirilmiş RABV geliştirilmiştir. (Şekil 1A). Bu yöntemde, glikoprotein (G) gen viral genomun silinir, ve hedef nöronları içinde sadece resupplied. Enfeksiyon özgüllüğü, normal RABV-G 1 için ASLV-A glikoprotein ve RABV-G (A / RG) ve sitoplazmik alan hücre dışı domenden oluşan bir kimerik G, ikame edilmesi suretiyle elde edilir. Bu kimerik G özellikle TVA reseptör 1 salgılayan hücrelerin bozar. Gen kodlama TVA d olmuştur edebilirsinizçeşitli yöntemlerle 2-8 ile elivered. Bir TVA-ifade nöronun RABV-G enfeksiyonu takiben RABV TVA reseptörü ile birlikte teslim oldu, kendi G doğanın bir retrograd yönde diğer Synaptically bağlı nöronlara iletebilir. Bu teknik, belli bir başlangıç hücre tipi üzerine girişlerin her bir örnekleme sağlayarak, belirli bir hücre tipi üzerine giriş nispeten büyük sayıda (% 5-10) 2 etiketler.
Biz son zamanlarda bir transsinaptik tracer 9 olarak VSV kullanmak için bu tekniği modifiye. VSV gen ekspresyonunun hız da dahil olmak üzere birçok avantaj sağlar. Burada ayrıntılı artan çözünürlük ile mikrodevreler problama için yararlı VSV kullanarak yeni bir viral izleme sistemi. Ederken Wickersham ve diğerleri tarafından ilk yayınlanmış stratejileri. 4 ve Beier ve ark. Başlangıçta enfekte üzerine proje TVA-hücrelerini ifade eden, burada VSV televizyon için sadece iletmek için tasarlanmış olan herhangi bir nöron 9 izin etiketlemeA-salgılayan hücre (Şekil 1B). Virüs ilk TVA-ifade nöron nöron mansap enfeksiyonu izin RABV-G ile pseudotyped edilir. Hücrelerin bu birinci popülasyon enfekte sonra, virüs sadece TVA-Salgılayan hücrelerin enfekte edebilir çıkardı. Transsinaptik virüs spread TVA-eksprese eden hücreler, hücre tiplerinden tanımlanmış bağlantı olmaması varlığı ile sınırlı olduğu için, yüksek çözünürlüğe sahip keşfedilebilir. Bu deneylerin bir deneysel akış şeması Şekil 2 'de gösterilmiştir. Burada bir model devresi göstermek, fare retinada yön seçiciliği olduğunu. Biz retina ganglion hücrelerinin (RGCs) için starburst amacrine hücrelerinin bağlantısı (SAC) inceleyin.
Protokol
1. CDNA'dan Virüs Yapımı: cDNA'dan VSV Kurtarma Vaccinia-T7 Sistemi kullanarak 10
- Deney öncesinde bir gün, DMEM +% 10 FBS içeren 60 mm çanak içine BsrT7 hücreleri bölme. Tabak başına Tohum 2E6 hücreleri. BsrT7 BHK21 hücreleri, ya da bebek hamster böbrek hücreleri elde edilmiştir.
- 1 mM magnezyum ve 1 mM kalsiyum ile 37 Sıcak PBS ° C.
- Küçük bir alikot vTF7-3, T7 polimeraz ifade eden bir aşı virüsü ve oda sıcaklığına kadar çözülme elde edilir. vTF7-3 T7 polimeraz 11 eksprese eden bir bulaşıcı vaccinia virüsü, ve Biyogüvenlik seviye 2 muhafaza içinde kullanılması gerekir. Bu ifade sistemi adım 1.9 transfekte edilmiş plasmidlerden istenen transkriptlerin azami düzeyde oluşturmak için kullanılır. Maksimum hızda 30 saniye vorteksleyin virüsü. Oda sıcaklığında su banyosunda 2 dakika süreyle masa sonikatör içinde sonikasyon. Vortex yine 30 sn viral clumps kırmak için.
- BSRT7 hücreleri bulunan ortamı çıkarın.
- 11.7 ul vTF7-3 ekle600 ul magnezyum ve kalsiyum ile PBS ve hücreleri üzerine karışımı ekleyin.
- % 5 CO 2 ile 34 ° C inkübatör içine plakaları taşıyın. Yavaşça kez rock plates her 10 dk.
- 45 dakika geçtikten sonra, transfeksiyon başlar. 20 ul lipofektamin 2.000 1 ml DMEM ekleyin ve karıştırın. 5 dakika bekleyin.
- 5.25 mikrogram pN, 2.3 mikrogram pP, 1.2 mikrogram pl, 500 ul DMEM için cDNA 1 mikrogram pCAG RABV-G ve 6 mikrogram VSV genomik ekleyin. pN, pP ve pl plazmid virüs optimum kurtarılması için ampirik olarak belirlenen miktarda, T7 promotor altında 10 VSV viral genlerin ifadesi ilerliyorsunuz.
- Tüpler ve karışımı hem birleştirin. Oda sıcaklığında 15 dakika bekleyin.
- PBS çıkarın ve 1.5 ml DMEM ile bir kez tabakları yıkamak.
- Medya durulayın aspire. Plaka transfeksiyon karışımı ekleyin. 34 ° C inkübatör içine plakaları taşıyın.
- 5 saat bekleyin, ardından ortamı çıkarın.
- 4 ml DMEM +% 2 FBS + 1x Penisilin-Streptomisin + 10 mM Hepes pH 7.4 ortam değiştirin. P ilaveenicillin-Streptomisin, bulaşmayı önlemek için, ve ortam pH'ı korumak için HEPES, çok önemlidir. Hücrelerin virüs ile birkaç gün içinde zarar görür ve bu nedenle% 10 FBS gerekmez olarak FBS içeriği,% 2 bırakılabilir.
- 48-72 saat boyunca 34 ° C inkübatör içine yerleştirin plakaları.
- 3 de medya toplayın ve 6 gün sonrası transfeksiyon ve filtre 0.20 mikron ile filtre hemen şırınga. Bu boyut, filtre VSV vaccinia virüs kaldırır, fakat.
- Biz viral zarf RABV-G arz etmek istiyorum, ve genom RABV-G gen encode etmediğinden, sürekli trans sağlanmalıdır. Bunu yapmak için, 293T TVA800 (TVA800) hücreleri ayrı bir levha sağlamak. Bu yapısal ENVA-kaynaklı viral enfeksiyon 12 müsait, TVA reseptörü eksprese hücrelerdir. 80% konfluent anda, plazmid kodlama G protein (yani pCAG RABV-G) plaka başına 5 mg ile hücreleri transfekte sadece, sonra DMEM ortam değiştirin. Biz PE kullanınBen transfeksiyon reaktif, karşılaştırılabilir lipid tabanlı yöntemlere göre çok daha ucuz bir polikatyonik polimer. Bununla birlikte, lipofektamin da bu amaç için etkin olarak kullanılabilir. Optimum PEI: DNA oranında deneysel olarak tespit edilmesi gerekmektedir. Bir flüoresan raportör, yani pCAG GFP ile ayrı bir deneyde bunu yapın. 4 mikrogram DNA: Biz 10 ul PEI kullanın.
- TVA800 hücrelerin transfekte edilen plaka üzerine adım 16 süpernatant uygulanır.
- Bu plaka viral ifade fluorofor floresans kanıt için ertesi gün gözlemleyin. Viral floresans Önce tek bir hücre olarak gözlenen ve giderek zaman (yani Şekil 3) üzerinde yayılır. Virüs, bir kaç saat içinde yayılması gerekir.
2. Passage ve VSV Konsantrasyon
- Eğer ertesi gün ~ 80% konfluent az dört 10 cm tabak olacak böyle DMEM +% 10 FBS içeren ortama TVA800 hücreleri bölün. 293T tabanlı hücreler yüksek tran nedeniyle işesfectability, ve TVA-salgılayan hücrelerin kullanımı çanak içinde hücrelerin enfekte olma hızını artırır. Diğer çok transfectable hücre hatları gibi bir amaca hizmet edebilir.
- 80% konfluent anda, plazmid kodlama 5 mikrogram (yani pCAG RABV-G) plaka başına kullanmak istediğiniz G protein ile hücreleri transfekte sadece, sonra DMEM ortam değiştirin. Biz de PEI kullanabilirsiniz, ancak FUGENE / lipofektamin iş.
- Glikoprotein ekspresyonu / yüzey birikimi için transfeksiyon bir gün sonra bekleyin. DMEM +% 10 FBS ile (5 ml / plaka) ortam değiştirme, daha sonra 0.01
- 24 saat sonra enfeksiyon miktarını kontrol edin. Sen infekte hücreleri (GFP floresan tarafından tanımlanan), enfekte hücreleri (yani Şekil 3) Çevre yamalar ile bazı görmelisiniz. Eğer obtaine aksi enfekte hücrelerin>% 50, viral titreleri görürseniz Genellikle bu süpernatant toplarken değer sadece bulunuyorkonsantrasyon d suboptimal olacaktır.
- >% 50, medya / plaka 5 ml toplamak ve taze medya 5 ml değiştirin. Çok az hücreler enfekte iseniz, başka bir 12-24 saat bekleyin ve tekrar kontrol edin. -80 Süpernatantlar toplanmış dondurma ° C.
- 4 gün toplam, 3 gün sonra her 24 saat toplayın.
- Eğer 4 plakaları ile başladıysanız Toplamda, her gün medya 20 ml olmalıdır - süpernatant değerinde yani 80 ml total veya 2 ultrasantrifüjdeki tüpleri. 37 süpernatantlar çözülme buz üzerinde 0.45 mikron filtre ° C üzeri ve filtre. Beckman santrifüj tüpleri içine tablet virüs 36 ml.
- 4 de (90 dakika için bir SW28 rotor (= 80,000 xg) içinde 21,000 K) Konsantre süpernatan ° C. % 10 ağartıcı ihtiva eden bir beher içine süpernatant süzün ve tüp tersine çevrildiği zaman, mümkün olduğu kadar borunun yan kadar ortamı çıkarmak için bir aspiratör kullanılır.
- Kapalı iken. 1 saat için 4 ° C de, viral tüpleri çalkalanır. Abou A standart çalkalayıcıt 120 rpm yeterlidir.
- Yavaşça yavaşça 30 kez aşağı yukarı pipetleme ve tarafından kalan medya pelet çiğnemek. Hava kabarcıkları tanıtmak için dikkatli olun. Kalan ortam hacmi yaklaşık 30 ul olmalıdır. Birden tüpler içine tablet bu hacim bu viral titresinde bir azalma neden olabilir gibi, herhangi bir hisse senedi için birden fazla donma-çözülme döngüleri önlemek amacıyla. Bu alikotları -80 donmuş olabilir ° C
- Virüs titresi. Yaklaşık 2 gün sonrası enfeksiyon az titering uygunudur. İlk enfeksiyon birkaç saat gözlenen, ama sadece 1 gün beklersem titrede bir yetersiz temsilinin elde edilebilir. 1.000.000 viral titresi elde etmek için, 1 1-10 kat virüs seyreltilerek, bir 24 oyuklu plaka uygun hücre hattı (293T hücreleri olabilir) üzerine konsantre virüsünün bir sınırlayıcı seyreltme deneyi gerçekleştirmek. Biz almak titreleri 10 8 -10 10 odak oluşturan birim (FFU) / ml aralığında tipik.
3. VirBizi Enjeksiyon
- Biz bu deneyler için, genellikle yaşı 6-10 hafta arasında, fare kullanın. Devresi kurulduktan sonra herhangi bir yaşta yeterli olurdu. Bir örnek olarak starburst amacrine hücreleri (SAC) ile retinal ganglion hücrelerinde (RGCs) gelen transmisyon seçecektir. Şekil 2'de diagramed Bu deney, bir üçlü transgenik hayvan ve virüs sadece tek bir enjeksiyon gerektirir. (Gösterilen tüm prosedürleri Harvard Tıp Okulu'nda IACUC tarafından onaylanmış, ve kurumsal kurallara uygun olarak vardı).
- İlk olarak, uygun hayvanlara konusu olacaktır. Hedef TVA istediği bir virüs (yani, adeno-ilişkili virüs, AAV) vasıtası ile, içine eşlemek için bu hücre tipinde ifade için, ya da bir transgenik allel ile. Hücre tipi özgüllüğü genellikle Cre ifade ile elde edilir. Burada, aynı zamanda, bir kolin asetiltransferaz (ChAT)-Cre allel 13, bir koşullu ifade TVA alel 7 çapraz TVA ifade edilir ki bu türBir Cre ifadesi geçmişi (SAC) ile tüm hücrelerde. Ayrıca TVA-salgılayan hücrelerin görüntülenmesi için bir koşullu ifade tdTomato allel (R26TdT) geçti.
- Enjeksiyon için konum koordinatları tespit edilmesi gerekir. Ilgi Bu koordinatları bir beyin atlası, yani Franklin ve Paxinos fare beyin atlası 14 bulunabilir. Bu koordinatlar fare kafatası ile ilgili belirli bir merkezi nokta ile göreceli not edilmesi gerekir. Bu bregma kullanmak, ama herhangi bir koordinat sistemi yeterlidir.
- Stereotaksik aparat hazırlayın. Mikroenjektör denetleyici açın ve yerine piston ve elektrot tutucu taşıyın. Sonra virüsü ile bir arayüz sağlamak için mineral yağ ile enjeksiyon iğnesi geri doldurun. Hiçbir hava kabarcığı iğne kalır emin, piston sonra üzerine iğne koyun.
- Viral titresi bir düşüş önlemek için buz üzerinde virüs, yer ve çözülme. "Çekmek" ve bu contacti olacak şekilde virüsün tüp hareket ettirmek için mikroenjektör ayarlamang mikroenjektör üzerindeki kılcal. Deneme için RABV-G ile pseudotyped rVSV (A / RG) gerekli miktarda çekin.
- Hayvanlar ameliyattan başlamadan önce buprenorfin (0.05-0.1 mg / kg) bir ameliyat öncesi doz verilmiştir. Hayvan, ya da inhalasyon ya da bir ketamin bir intraperitoneal (40-80 mg / kg) ve ksilazin (mg / kg 5-10) bayıltmadan için karışım yeterlidir. Anestezik seçimi kullanıcıya bağlıdır. Bir ayak tutam sonra hayvanlar tamamen uyuşturulduktan olmasını sağlamak için yapılır; hayvan yanıt vermezse, siz prosedürü ile devam edebilirsiniz. Bu ilaçlar kullanmadan önce uygun lisansları edinmek için emin olun.
- Hayvanlar fare konumlandırılması için hareketli bir stand üzerine yaslanan bir ısıtılmış ped üzerine yerleştirilir. Hayvan cerrahi uygulama süresi boyunca orada kalır. Hayvan anestezi ise korneanın kurumasını önlemek için göz merhemi sürün.
- Fare kafası sonra bir stereotaksik stabilize edilmesi gerekmektedirpparatus. Baş baş yere paralel olacak şekilde, iyice güvenli ve yanal dönmüyor sağlamak için stereotaksik aparat üzerindeki kulak çubuklarını kullanın. Bu tamamlandıktan sonra, kafa istikrara kavuşturmak için lokma çubuğunu ayarlayın.
- Hayvan kürk başının üstüne kesi bölgesinde traş edilir. Bu alan daha sonra etanol ile üç kez yıkanmıştır, iyot ile üç kez izledi. Bir kesi sonra kafatası açığa bistüri ile ciltte yapılır.
- Fare ve enjeksiyon ayar hazırlanır sonra, bregma bulunması gerekir. Bu, iki koronal ve sajital dikiş karşılamak kafasının merkezinde bir alandır. Bu alanda bulunduğu sonra, stereotaksik alet üzerinde çevirir uygun koordinatlara mikroenjektör ayarlamak için kullanılabilir. Burada, L / M 2, D / V 2.75, bregma gelen koordinatları A / P -2.46 kullanarak, lateral genikulat çekirdeği (LGN) enjekte.
- Koordinatlarda aranan edildikten sonra, matkap monte edilmelidir.Matkap matkap ucunu yerleştirin, ardından matkap açın. Küçük bir delik enjeksiyon yeri olarak tanımlanan site içine delinmiş olmalıdır. Beyin parankimi zarar etmemek için matkap ile çok nazik olun. Kemik çok ince olduğunda, dura kan damarları netleşecektir. Bu noktada, dikkatlice geri kalan kemik kaldırmak için, küçük bir (30 ölçü) ve ince bir iğne (# 5) forseps ile craniotomy kenarları delebilir.
- Sadece delik açılmış beyin yüzeyinin sadece dorsal bir pozisyon için kılcal ayarlayın. Iğne kolaylıkla duramater nüfuz için yeterli keskinlikte olmalıdır. Ardından istenilen derinliğe kadar iğne düşürmek ve enjeksiyon başlar. Biz 100 nl / dak hızında virüs enjekte.
- Bu noktaya enjeksiyon prosedürü yaklaşık on dakika sürer. Enjeksiyonu takiben, iğne, yaklaşık yedi dakika için beyinde kalır. Bu enjeksiyon sitesinden virüs difüzyon izin gibi bu, çok önemlidir. Hızla iğne formu inje çıkarmadaniğne yolu boyunca azaltılmış bir enfeksiyon enjeksiyon yerinde verimlilik ve enfeksiyon ction sitesi sonuç.
- İğne çok yavaş yaklaşık iki dakika bir zaman dilimi içinde, enjeksiyon yerinde ortaya çıkar. Bu da yine iğne yolu boyunca enfeksiyonu azaltmaya yöneliktir.
- Bir kez kaldırıldı, ardından cilde sütüre edilir. Onlar anestezi kurtarmak kadar Hayvanlar devamlı olarak izlenmektedir. Buprenorfin (0.05-0.1 mg / kg) 2 gün için her 12 saatte tatbik edilmektedir.
4. Doku / Doku Hazırlama Hasat
- Ilgili doku hasat için en uygun süre deney amaçları bağlıdır. Genellikle, VSV transsinaptik yayılması ilk 24 saat sonrası enjeksiyon daha az tarafından izlenebilmektedir. Bununla birlikte, daha uzun bekleme süreleri daha fazla yayılmasına neden olur.
- Retinanın hasat için, hayvanların ilk karbon dioksit solunması ve servikal dislokasyon yapılır kullanılarak ötenazi uygulanır. Gözün sonra tüp con içine kaldırılır ve yerleştirilirOda sıcaklığında 1 saat için PBS içinde% 4 formaldehit temi.
- Gözün sonra PBS ile bir Petri tabağına yerleştirilir. Retina sonra diğer dokulardan uzak disseke edilir.
- Bütün montaj analizi için, retinae bir cam slayt üzerine yerleştirilir, düz yatıyordu şekilde kesilir, sonra altın montaj medya uzatmak ile monte ve sıfır-kalınlığında cam lamel ile kaplıdır. Silikon tutucular retina üzerine sıkıştırma kuvvetleri en aza indirmek için slayt ve lamel arasına yerleştirilir. Bölüm analizi için, retina retina submerges kadar PBS içerisinde% 30 sakaroz yerleştirilir. Daha sonra, en az% 50, OCT bir karışım içine yerleştirilmiş ve 3 saat boyunca en az% 50% 30 sukroz çözeltisi edilir. Daha sonra, dondurulmuş olarak görüntülenebilir ve kesme ° C'ye kadar -80 hazır tutulur.
5. Temsilcisi Sonuçlar
CDNA kurtarır virüs TVA800 hücreler değil, 293T hücreleri (Şekil 3) enfekte etme yeteneğine sahip olmalıdır. RABV-G temini birçok hücre t enfeksiyonu izin293T içeren Dosya türleri,. A / RG genom genomu içinde kodlanır Bununla beraber, TVA-Salgılayan hücrelerin içinde çok daha yüksek bir oranda görülür hücreler arasında yayılır.
Virüs 10 8 FFU / ml ve 10 10 FFU / ml arasında konsantre, tipik titreleri aralığı kez. Bu titreler, in vivo kullanım için yeterli olmaktadır.
Farenin içine LGN enjeksiyon sırasında, biz de genellikle enfekte olarak, ventral LGN (vLGN) dan dorsal LGN (dLGN) ayrım yapmıyor. Bu nedenle, birden RGC türleri, melanopsin RGCs (Şekil 4D) ve ON-DSGCs (Şekil 4E) olarak vLGN için bu, bu projenin, ve bu bu gibi dLGN proje, küçük-de dahil olmak üzere (Şekil 4) etiketli hale çardak RGCs (Şekil 4C) ve ON-OFF-DSGCs (Şekil 4F). RGC birden fazla türü SAC virüs bulaşan rağmen, her yerde olduğu gibi bildirilmiştir (Beier ve ark., Inceleme), biz burada sadece odaklanmakSAC AÇIK-KAPALI-DSGCs en iyi araştırılan bağlantıları.
(-) Biz genotip cTVA (+) / ChAT-Cre farelere enjekte zaman hiçbir TVA ifade edilmelidir, sadece RGCs (yani Şekil 4) olarak etiketlenmiştir. Bu RGCs ile RABV-G pseudotyped virüs ilk kavrama dolayı, ve hiçbir yayılması meydana gelir. Hayır RGCs bu RGCs enine uzun aksonlar bu virionlar bir yetersizlik nedeniyle rVSV bir LGN enfeksiyon (A / RG) RABV-G ile pseudotyped değil virüs, enfekte olmaktadır. Bununla birlikte, LGN içine cTVA (+) / ChATCre (+) (ve R26TdT (+)) fareler enjekte ederken, virüs yayılması, sadece Cre raportör (yani Şekil 5) ifade kırmızı hücreleri için, meydana gelir. Bu anti-ChAT antikor ile aynı zamanda hücreler eş-etiket, ve SAC (Şekil 5B ', C') olarak kimlik teyit iki ChAT lamina sadece katmanlaştırma. DSGC başına viral etiketli SAC numaralı dokuz arasında değişmekteydi.

Şekil 1. Başlangıçta geliştirilen yönteme göre Bizim retrograd transsinaptik izleme sistemi. (A) (i) Wickersham ve arkadaşları tarafından geliştirilen yöntem olarak, "başlangıç hücre" üç gen ile transfekte edilir: TVA reseptörü, transfekte edilmiş hücrelerin, özellikle enfeksiyon izin vermek için kullanılır; RABV tamamlamak için kullanılabilir RABV-G, hangi kendisi G gen silinmiş olan, ve transfekte edilmiş hücreleri belirlemek için bir kırmızı flöresanlı proteindir. (Ii) A / RG protein ile pseudotyped bir RABV onları sarı hale TVA-Salgılayan hücrelerin bozar. (Iii) Retrograd transsinaptik iletim memba nöronlar oluşur. (B) (I) yöntemi, TVA-Salgılayan hücrelerin genetik olarak tanımlandığı gibidir, ve bir şartlı kırmızı prote floresan ile etiketlenmişin (ii) "başlatıcı hücreleri", bu virüs genomu içinde A / RG gen kodlayan bir VSV ile enfekte edilir. Bu marş hücreler TVA reseptör ifade etmezler. Bu hücrelerin marş nöronlar üzerine sinaptik girdi sağlayan yalnızca (iii) Retrograd transsinaptik iletim TVA salgılayan nöronlar oluşur. büyük bir rakam görmek için buraya tıklayın .
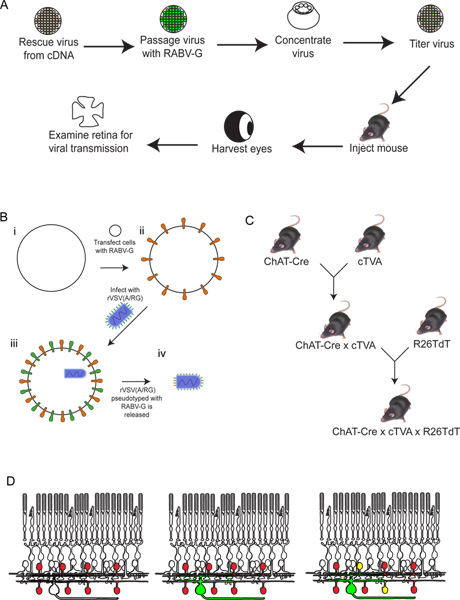
Şekil 2. Deneysel işlemin şematik. (A) İlk olarak, virüs cDNA kurtarır. Daha sonra pasajlandı ve RABV-G ile pseudotyped, ve konsantre edilmiş ve titre edilir. O zaman, istenilen süre boyunca inkübe izin verilmediği durumlarda bu virüs daha sonra, beyin içine enjekte edilir. Bundan sonrazaman, göz hasat edilir, ve retina parçalara ayrıldı ve analiz edilir. RABV-G ile virüs pseudotyping (B) şematik. Bu, bir beyin enjeksiyon retinal ganglion hücre enfeksiyonu için gereklidir. RABV-G geninin ilk TVA reseptörünü eksprese eden doku kültür hücreleri içine transfekte edilir. Bu hücreler daha sonra rVSV (A / RG) virüsü ile enfekte olmaktadır. Serbest virionların viral zarf içinde RABV-G sahip olacak, fakat, virüs genomu içinde RABV-G için gen olmayacaktır. (C) fare şematik bir üçlü transgenik hayvanlar için gerekli geçer. Koşullu TVA ve tdTomato allelleri TVA ve tdTomato hem sadece bir Cre ifadesi geçmişi olan hücrelerde ifade edilir böyle bir seçim Cre sürücüsü, kesilmişlerdir. Bu örnekte, ChAT-Cre kullanılır. (D) için retina enfeksiyonu şematik DSGC-SAC devreleri izlemek için. (C) 'de gösterildiği gibi ChAT hücreler ekspres TVA ve tdTomato yapılır. RGCs bir LGN gelen enfekteVirüsün Infeksiyon (B) olarak üretilir. Virüs GFP ifade gibi, bu RGCs yeşil olacaktır. Virüs daha sonra sadece yayılacak TVA-ifade onlar etiketli RGC bağlıysanız ChAT amacrine hücreleri. Bu hücreler kırmızı ve yeşil veya sarı hem olacaktır. büyük bir rakam görmek için buraya tıklayın .
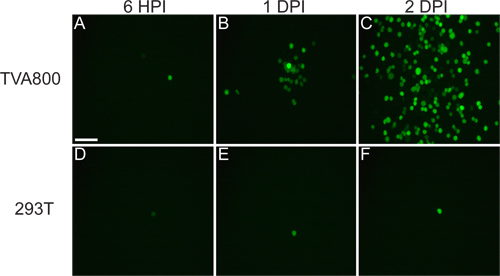
Şekil 3. 293T ve TVA800 hücreleri üzerinde rVSV (A / RG) virüs davranışı. Bu hücreler RABV-G ile pseudotyped düşük titrede rVSV (A / RG) ile enfekte edildi. Arasında virüs spread TVA salgılayan 6 saat sonrası enfeksiyon (HPI), 1 ve 2 gün sonrası enfeksiyon (DPI) 'de gösterildiği gibi, birkaç saat içinde hücreler. Ancak, TVA reseptör ifade etmezler 293T hücreleri üzerine yayılmış olsa it oluşursa, çok daha yavaş olur. Ölçek bar = 100 mikron.
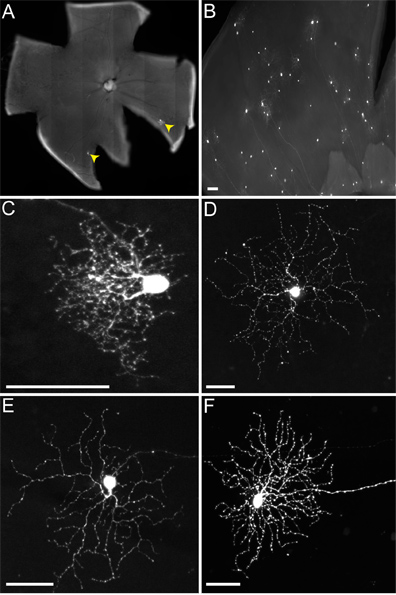
Şekil 4. Non-TVA ifade farelerin RGCs Temsilcisi enfeksiyonları. Hayvanlar RABV-G ile pseudotyped rVSV (A / RG) virüsü ile LGN enjekte ve doku 2 dpi hasat edildi. (A) Seyrek (RGCs sarı ok ucu ile gösterilmektedir) ya da (B) yoğun enjeksiyon virüs enfeksiyonlarının ve kalite titre bağlı olarak, elde edilebilir. RGCs birçok farklı türde (C) küçük çardak RGCs, (D) tipi 1 melanopsin RGCs, (E) ON-DSGCs, ve diğerleri arasında (F) AÇIK-KAPALI-DSGCs dahil morfolojisi esas tespit edilebilir. Ölçek bar = 50 mikron.

Şekil 5. RVSV (A / RG) SAC AÇIK-KAPALI-DSGCs gelen iletim beklenen desen izler. (A) AÇIK-KAPALI-DSGCs birden SAC (sarı ok başları) iletmek virüsü (yeşil dolgu beyaz ok başı). (A '). Tüm yeşil onlar TVA-ifade SAC olduğunu belirten, Cre muhabiri ile birlikte etiket DSGC değildir hücreleri. (BC) DSGC (yeşil dolgu içeren beyaz ok başı) ve SAC (sarı ok başları) retina iç pleksiform tabaka (IPL) uygun ChAT katmanlarında tabakalandırmak. Virüs iletir hem ON ve OFF-SAC eklemek hücreleri. Panel B 've C' Sayılar IPL lamina gösterir. DSGC soma yeri, sadece ok başı ile belirtilen ancak keseler vurgulamak için panel C de gösterilmemiştir. Ölçek bar = 50 mikron.
Tartışmalar
Nöral devrelerin çalışma virüsler kullanma bağlı nöronlar analiz nispeten yüksek verimlilik yöntemdir. Bununla birlikte, VSV ve RABV virionlar her ikisi de elde önemsiz değildir. CDNA'dan virüsü kurtarmak için yukarıda listelenen protokol sunulmasına rağmen, hala düşük bir olasılıkta olaydır. N, P ve L plazmidlerin her birinin seviyeleri ince ayarlanması gerekir, ve pek çok deneme ve çoğaltır viral kurtarma sağlamak için yapılması gerekir. Tam VSV genom RNA içeren ribonukleotid par?...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz rekombinant VSV varyantları kurtarılması için yardım Sean Whelan kabul etmek ister ve teknik yardım için Didem Goz ve Ryan Chrenek olurdu. Bu eser HHMI (CLC) tarafından desteklenen ve # NS068012-01 (KTB) oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Referanslar
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır