このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遺伝的に定義された神経回路のトレースウイルス
要約
シナプス接続されたニューロンをトレースする方法が記載されている。我々は、目的の細胞集団は遺伝的に定義された種類の細胞からシナプス入力を受け取るかどうかを調べるために上流の細胞のTVAの特異性を利用する。
要約
神経回路を研究するための古典的な方法は、かなり低いスループットです。特に経シナプスウイルス、仮性(PRV)と狂犬病ウイルス(RABV)、そして最近では、水疱性口内炎ウイルス(VSV)、回路を研究するために、ますます人気が高まっています。これらのより高いスループット方法は順行性または逆行どちらの方向でもニューロン間の送信、ウイルスを使用しています。
最近では、単シナプス逆行トレースのために修飾されたRABVが開発されました。 ( 図1A)。この方法では、糖タンパク質(G)遺伝子はウイルスゲノムから削除され、標的ニューロンでのみ補給。感染特異性はASLV-糖タンパク質と正常RABV-G1用RABV-G(/ RG)の細胞質ドメインの細胞外ドメインから成るキメラGを代入することによって達成される。このキメラGは具体的にTVAの受容体1を発現している細胞に感染します。をコードする遺伝子TVAはdきできます様々な方法で2月8日 elivered。 TVA発現ニューロンのRABV-Gの感染後、RABVはTVAの受容体との共同配信された、独自のGの性質によって逆方向に他の、シナプス接続されたニューロンに信号を送ることができます。この手法は、定義されたスターター細胞型へのすべての入力のサンプリングを提供し、定義された細胞型への入力の数が比較的多い(5-10%)2にラベルを付けます 。
我々は最近、経シナプストレーサー9としてVSVを使用するには、この手法を変更しました。 VSVのは、遺伝子発現の迅速性など、いくつかの利点があります。ここでは、詳細解像度を上げると超小型回路をプロービングするための有用なVSVを使用して、新しいウイルストレースシステムを。ウィッカーシャムらによるオリジナルの公表戦略。4 Whileとバイエルら TVA発現細胞に感染した当初は上に任意のニューロンと、そのプロジェクトの9許可の標識は、ここにVSVをテレビにのみ送信するように設計されました発現細胞( 図1B)。ウイルスは最初TVA発現ニューロンのニューロンの下流の感染を可能にするためにRABV-Gでシューされています。細胞のこの第一の集団を感染させた後、リリースされたウイルスは、TVA-発現細胞に感染することができます。経シナプスウイルスの拡散がTVA発現細胞に限られているため、定義された種類の細胞からの接続の有無の存在は、高分解能で調べることができます。これらの実験の実験のフローチャートを図2に示します。ここでは、マウス網膜で方向選択性のあること、モデル回路を示しています。我々は、網膜神経節細胞に星形アマクリン細胞(SACの)(のRGC)の接続性を検証する。
プロトコル
1。 cDNAからウイルスを作る:cDNAを用いワク-T7システム10からVSVの回復
- 実験の前にある日、DMEM + 10%FBSを含む60ミリメートル皿にBsrT7セルを分割する。皿当たり種子2E6細胞。 BsrT7細胞はBHK21、またはベビーハムスター腎臓細胞に由来する。
- 1mM塩化マグネシウムと37から1 mMのカルシウム℃で温PBS
- 少量vTF7-3、T7ポリメラーゼを発現するワクシニアウイルス、室温に解凍を取得します。 vTF7-3 T7ポリメラーゼ11を発現している感染ワクシニアウイルスであり、生物学的安全性レベル2の封じ込めにのみ使用する必要があります。この発現系は、ステップ1.9にトランスフェクションしたプラスミドから目的の転写産物の最大レベルを生成するために使用されています。最高速度で30秒間ボルテックスウイルス。室温で水浴中で2分間卓上ソニケーターで超音波洗浄します。 Vortexは再び30秒間は、ウイルス塊を壊したりすることができます。
- BSRT7細胞からメディアを取り出します。
- 11.7μlのvTF7-3を追加マグネシウムとカルシウムと600μlのPBSへと細胞上に混合物を追加します。
- 5%CO 2で34℃のインキュベーターにプレートを移動します。一度優しくロックプレート10分毎。
- 45分が経過した後、トランスフェクションを開始します。 20μlのリポフェクタミン2,000〜1ミリリットルDMEMを加えて混ぜます。 5分待ってください。
- 5.25μgのPN、2.3μgのPP、1.2μgのPL、1μgのpCAG RABV-G、および500μlのDMEMにcDNAを6μgのVSVのゲノムを追加します。 PN、PPとPLはウィルスの最適な救助を経験的に決定された金額で、T7プロモーター10の下にVSVのウイルス遺伝子の発現を駆動するプラスミドである。
- チューブとミックスの両方を兼ね備えています。室温で15分間待ちます。
- PBSを除去し、1.5mlのDMEMで一回プレートを洗浄する。
- メディアをすすぎ吸い取る。プレートへのトランスフェクション混合物を追加します。 34℃のインキュベーターにプレートを移動します。
- 5時間待ってから、メディアを取り出します。
- 4ミリリットルDMEM +2%FBS + 1×ペニシリン - ストレプトマイシン+を10mMのHEPES pH7.4にメディアを変更してください。 Pの添加enicillin - ストレプトマイシンは、培地のpHを維持するために、汚染、およびHEPESを防止するために、非常に重要である。細胞がウイルスによって数日のうちに破壊されるので、10%FBSを必要としないとしてFBS含有量は2%に下げることができます。
- 48から72時間、34℃のインキュベーターに置きプレート。
- 3と6日、トランスフェクション後にメディアを収集し、直ちにフィルター0.20μmのシリンジフィルターを通して。このサイズのフィルターはVSVワクシニアウイルスを削除しますが、ではない。
- 我々は、ウイルスエンベロープにRABV-Gを供給したい、とゲノムがRABV-G遺伝子をコードしていないので、それは継続的にトランスに供給する必要があります。これを行うには、293T TVA800(TVA800)細胞の別々のプレートを作る。これらは恒常EnvA媒介ウイルス感染12を可能にして 、TVAの受容体を発現する細胞である。 80%コンフルエントでは、唯一のDMEMにメディアを変更してから、プレートあたりをコードするプラスミドGタンパク質( すなわち pCAG RABV-G)の5μgの細胞をトランスフェクトする。我々はPEを使用して私はトランスフェクション試薬、匹敵する脂質ベースの方法よりもはるかに安価であるポリカチオン性ポリマー。しかし、リポフェクタミンも、この目的のために効果的に使用することができる。最適PEI:DNA比は、経験的に決定する必要があります。蛍光レポーター、 すなわち pCAG GFPと別の実験でこれを行う。 4μgのDNA:我々は、10μlのPEIを使用しています。
- TVA800細胞のトランスフェクトされたプレートにステップ16からの上清を適用します。
- ウイルス表明フルオロフォアの蛍光の証拠を次の日、このプレートを観察します。ウイルスの蛍光は最初の単一細胞として観察され、徐々に時間( すなわち 図3)に広がっています。ウイルスは数時間以内に広めるべきである。
2。 VSVのパッセージと集中
- あなたは翌日〜80%コンフルエントで4 10cmのプレートを持っていることなどDMEM + 10%FBSを含む培地中にTVA800セルを分割する。 293Tベースの電池は、その高い過渡に起因うまくsfectability、やTVA発現細胞の使用は、皿の中の細胞が感染する速度を向上させます。他の高度にトランスフェ細胞株は、同様の目的を果たすことができる。
- 80%コンフルエントでは、唯一のDMEMにメディアを変更してから、コードするプラスミド5μgのプレートあたり使いたいGタンパク質( すなわち pCAG RABV-G)の細胞をトランスフェクトする。我々は、PEIを使用していますが、FUGENE /リポフェクタミン仕事だけでなく。
- 糖タンパク質発現/表面蓄積のためのトランスフェクション後1日待ちます。 DMEM +10%FBSに(5ミリリットル/プレート)のメディアを変更してから、0.01
- 24時間後に感染の量を確認してください。あなたが感染した細胞(GFP蛍光で識別される)、感染した細胞( すなわち 図3)の周囲のパッチが適用されたいくつかが表示されるはずです。典型的には、これはそうでなければ、唯一のウイルス力価obtaineあなたが感染した細胞の> 50%が表示される場合は上清を回収する価値がある濃度からdは次善となります。
- > 50%の場合、メディア/プレートの5ミリリットルを収集し、新鮮な培地5mlで置き換える。あまりにも少数の細胞が感染している場合は、別の12〜24時間待って、もう一度確認してください。 -80で集めた上清を凍結℃に
- 4日間の合計のため、3日間その後は24時間を収集します。
- 清の価値そう80ミリリットルの合計、または2超遠心管 - あなたは4プレートから開始した場合完全に、あなたは毎日のメディアの20ミリリットルを持つ必要があります。 37℃で上清を解凍し、氷上で0.45μmのフィルター℃以上とフィルタ。ベックマン遠心管へのウイルスのアリコートを、36ミリリットル。
- 4℃(90分間SW28ローター(= 80,000×g)での21000 K)の上清を集中℃に10%の漂白剤を入れたビーカーに上清をデカントし、チューブを反転させながら、できるだけチューブの側面からできるだけ多くのメディアを削除するには、アスピレーターを使用しています。
- 対象となっている。 1時間4℃でウイルスの試験管を振る。アブーで標準シェーカートン120 rpmで十分です。
- 優しく穏やかに30回上下にピペッティングして、残りのメディアでペレットを砕いて粉末にする。気泡を導入しないように注意してください。残りのメディアのボリュームは約30μLである必要があります。これはウイルス力価の低下を招くことができるように、任意の特定の銘柄に対して複数の凍結融解サイクルを防止するようにアリコート複数のチューブにこのボリューム。これらのアリコートを-80℃で凍結することができます
- ウイルス力価を。約2日後の感染力価測定には、最適です。初期感染は時間の問題で見られたが、あなたが1日だけ待っていればあなたは力価の表示不足を入手することができます。 100万:ウイルス力価を得るためには、1 1から10倍のウイルスを希釈し、24ウェルプレート内の適切な細胞株(293T細胞がうまく機能)に濃縮したウイルスの限界希釈実験を行う。我々が得る力価は10 8〜10 10フォーカス形成単位(FFU)/ mlの範囲にある。
3。 VIR私達インジェクション
- 我々は、これらの実験のために、一般的に生後6〜10週の間に、マウスを使用しています。回路が確立された後、どの年齢でも十分でしょう。ここでは、例としてスターバーストアマクリン細胞(SACの)への網膜神経節細胞(のRGC)からの送信を選択します。 図2に図解この実験は、三重トランスジェニック動物およびウイルスの唯一の単回注射が必要になります。 (示されているすべての手順は、ハーバード大学医学部動物実験委員会によって承認され、制度ガイドラインに従ってあった)。
- まず、適切な動物が生成する必要があります。目標は、TVAのは、ウイルスの手段( すなわち 、アデノ随伴ウイルス、AAV)によって、またはトランスジェニック対立遺伝子によって、一つ願いがにマッピングすることを細胞型で発現していることです。細胞型特異性は、通常、Cre発現することによって得られる。ここで、我々はまた、コリンアセチルトランスフェラーゼ(ChATの)-Cre組アレル13日に条件式TVAのアレル7に交差TVAが発現されるようにCre発現履歴(SACの)を持つすべての細胞インチ我々はまた、TVA-発現細胞の可視化のための条件式tdTomato対立遺伝子(R26TdT)を渡った。
- 注入位置の座標が識別される必要があります。興味のあるこれらの座標は、脳アトラス、 つまりフランクリンとPaxinosマウス脳アトラス14で見つけることができます。これらの座標は、マウスの頭蓋骨上の指定されたランドマークを基準に留意する必要があります。我々はブレグマを使用していますが、どのような座標系で十分です。
- 定位固定装置を準備します。マイクロインジェクターコントローラーの電源を入れ、所定の位置にプランジャと電極ホルダーを移動します。その後、ウイルスとのインタフェースを提供するためにミネラルオイルを注射針を戻して埋められます。気泡が針に残っていないことを確認しながら、プランジャーに、針を置く。
- ウイルスを解凍すると、ウイルス力価の低下を防ぐために氷の上に置きます。 "撤退"とcontactiされるようにするウイルスのチューブを移動するマイクロインジェクターを設定ngの微量注入器における毛細管。実験にRABV-GでシューrVSV(/ RG)の必要量を引き出します。
- 手術が始まる前に、動物はブプレノルフィン(0.05 mg / kg)の術前投与量を与えられている。動物、イソフルラン吸入、ケタミンの腹腔内注射(40から80 mg / kg)のいずれかをanaesthetizingおよびキシラジン(5-10 mg / kg)の混合物で十分です。麻酔薬の選択はユーザに依存しています。つま先のピンチは、その後、動物が完全に麻酔をかけていることを確認するために実行され、動物が応答しない場合は、手続きを進めることができます。これらの薬を使用する前に、適切なライセンスを取得してください。
- 動物は、マウスを位置決めするための可動スタンドに立てかけられて加熱されたパッドの上に置かれています。動物は、外科的処置の期間全体が残っている。動物に麻酔をしている間、角膜の乾燥を防ぐために、眼軟膏を適用します。
- マウスの頭はその後定位で安定化する必要がありますpparatus。頭が頭が地面と平行になるように、徹底的に固定され、横方向に回転しないことを保証するために定位固定装置上の耳のバーを使用します。これが完了すると、頭を安定させるのを助けるために一口バーを調整します。
- 動物の毛皮を頭の上に切開の領域に剃られています。この領域は、その後ヨウ素で3回、続いてエタノールで3回洗浄する。切開はその後頭蓋骨を明らかに、メスで皮膚で作られています。
- マウスや注射のセットアップが用意されれば、ブレグマは配置する必要があります。これは、矢状面と2冠状縫合糸が満たしていることを頭の中心にあるエリアです。この領域が見つかったら、定位固定装置上のダイヤルは適切な座標に微量注入器を調整するために使用することができます。ここでは、L / M 2、D / V 2.75、ブレグマから座標をA / P -2.46を使用し、外側膝状体(LGN)を注入。
- 座標がでダイヤルされた後、ドリルを組み立てなければなりません。ドリルにドリルビットを置き、ドリルの電源をオンにします。小さな穴は、注射部位として特定されたサイトに穿孔されるべきである。脳実質に損傷を与えないようにするためにドリルで穴を非常に穏やかである。骨が細い場合には、硬膜上の血管が明らかになった。この時点で、慎重に残りの骨を除去するために小さな(30ゲージ)針と罰金(#5)鉗子で開頭の縁を穿孔。
- 穴が掘削されただけで脳表面のちょうど背の位置にキャピラリーを調整します。針は容易に硬膜を貫通するのに十分なシャープでなければなりません。次に、目的の深さまで針を下げて、注入を開始します。我々は、100 NL / minの速度でウイルスを注入します。
- この時点までの注入手順は、およそ10分かかります。注射後、針が約7分間の脳に残っています。それが注射部位からのウイルスの拡散を可能にするので、これは非常に重要です。急速に針状麟蹄除去針管に沿って注入し、感染部位で低下し、感染効率でctionサイトの結果。
- 針は非常にゆっくりと約2分のスパンで、注射部位から発生します。これは再び針管に沿って感染を減らすことを意図している。
- 一度削除され、肌は、その後縫合される。彼らは麻酔から回復するまでに動物を継続的に監視されています。ブプレノルフィン(0.05 mg / kgの)は2日ごとに12時間に投与される。
4。ティッシュ/ティッシュの準備を収穫
- 目的の組織を採取するために、最適な時間は、実験の目的によって異なります。一般的に、VSVの経シナプススプレッドは最初の24時間後に注射未満で観察することができる。しかし、長い時間を待っていると、より広がりをもたらすでしょう。
- 網膜を収穫するために、動物が最初に二酸化炭素吸入を使って安楽死させると頸椎脱臼が実行されます。眼球を取り除き、チューブ詐欺に配置されます室温で1時間、PBS中の4%ホルムアルデヒドを寧。
- 眼球は、その後、PBSでシャーレに置かれます。網膜は、その後、他の組織から離れて解剖されています。
- ホールマウントの解析では、網膜をガラススライド上に配置され、平らになるようにカットされ、その後、金マウンティングメディアを延長してマウントし、太さ0のカバーガラスで覆われている。シリコーンスペーサーは、網膜上に圧縮力を最小限にするために、スライドとカバーガラスとの間に配置される。セクション分析のために、網膜は網膜submergesまで、PBS中30%スクロースに配置されます。その後3時間は50%と、10月50%30%ショ糖溶液の混合物中に配置されます。その後凍結点滅し、カットする°Cまで準備が-80℃に保たれます。
5。代表的な結果
cDNAから救出されるウイルスはTVA800細胞ではなく、293T細胞( 図3)に感染することができるはずです。 RABV-Gを供給することは、複数のセルトンの感染を可能に293Tを含むypes、。 / RGのゲノムはゲノムにコードされているのでしかし、TVA-発現細胞におけるはるかに高いレートで発生する細胞間に広がった。
いったんウイルスが10 8 FFU / mlおよび10 10 FFU / mlの間に濃縮された、典型的な力価の範囲です。これらの力価は、in vivoでの使用に適しています。
マウスへのLGN注入中に、我々は両方の一般的に感染するように、腹側LGN(vLGN)から背側LGN(dLGN)を区別しません。したがって、複数のRGCの種類は、小として、dLGNにかかるメラノプシンのRGC( 図4D)およびON-DSGCs( 図4E)としてvLGN、およびそれらのそのプロジェクトにこれらのそのプロジェクトを含めて、( 図4)標識になるあずまやのRGC( 図4C)と、ON-OFF-DSGCs( 図4F)。他の場所で報告されているように、RGC複数のタイプが(バイエルら 、レビューで)、SACのにウイルスを送信したが、ここで我々は唯一の焦点ON-OFF-DSGCsのよく研究された接続上のSACへ。
( - )私たちは遺伝子型cTVA(+)/チャット-Creのマウスに注入するときにTVAが発現されるべきではない、唯一のRGC( すなわち、 図 4)のラベルが付いていますこれらは初期のRGCによってRABV-Gシュードウイルスの取り込み、およびno普及発生に起因しています。全くのRGCは、これらのRGCの横長い軸索へのこれらのビリオンの無能に起因rVSVのLGN感染(/ RG)RABV-Gでシューしないウイルスから感染していません。しかし、LGNにcTVA(+)/ ChATCre(+)(とR26TdT(+))マウスに注射するとき、ウイルスの拡散が発生した、唯一のCreレポーター( すなわち、 図5)を発現する赤血球、へ。これらの抗ChATの抗体でも、細胞の共ラベル、SACの( 図5B '、C')としてのアイデンティティを確認し、2チャットラミナのみで階層化する。 DSGC当たりウイルス標識した嚢の数は、1から9の範囲であった。

図1もともと開発された方法に比べて私たち逆行経シナプストレースシステム。 ()は、(i)ウィッカーシャムらによって開発された方法では、 "スターターセルは" 3遺伝子でトランスフェクトされています具体的にトランスフェクトされた細胞の感染を可能にするために使用され、TVAの受容体; RABV-G RABVを補完するために使用され、どの自体は、G遺伝子が削除持っていた。とトランスフェクションされた細胞を同定する赤色蛍光タンパク質。 (II)/ RGのタンパク質で偽RABVはそれら黄色作り、TVA-発現細胞に感染します。 (ⅲ)逆行性経シナプス伝達は、上流のニューロンに発生します。 (b)(i)に我々の手法では、TVAの発現細胞を遺伝的に定義されており、条件付き赤色蛍光proteで標識されているインチ(ⅱ) "スターターセルは"それらのウイルスゲノムに/ RGの遺伝子をコードするVSVに感染している。これらのスターター細胞はTVAの受容体を発現しない。これらの細胞はスターターニューロンにシナプス入力を提供する場合にのみ、(iii)の逆行性経シナプス伝達はTVA発現ニューロンに発生します。 拡大図を表示するには、ここをクリックしてください 。
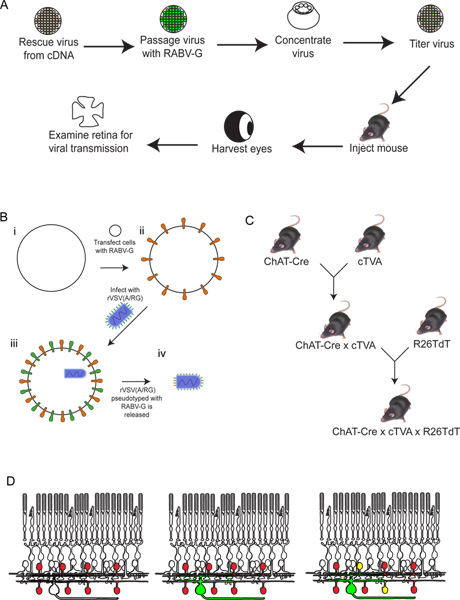
図2実験手順の概略図。 (a)まず、ウイルスをcDNAから救出されています。次いで、これを継代し、RABV-Gでシュー、そして濃縮して、滴定されています。このウイルスは、それが所望の時間インキュベートさせている脳に注入される。この後時間、目を収穫し、網膜を解剖し、分析されます。 RABV-Gでウイルスをpseudotypingの(B)の回路図。これは、脳内注射から網膜神経節細胞の感染に必要である。 RABV-G遺伝子が最初にTVAの受容体を発現している組織培養細胞にトランスフェクトする。次いで、これらの細胞をrVSV(/ RG)がウイルスに感染している。リリースビリオンは、ウイルスエンベロープでRABV-Gを持っていますが、ウイルスゲノムにRABV-Gの遺伝子を持っていないでしょう。 (C)は、マウスの概略はトリプルトランスジェニック動物のために必要な交差しています。条件TVAとtdTomato対立遺伝子が、TVAとtdTomato両方のみCre発現の歴史を持つ細胞で発現されるように、選択肢のCreドライバーに交差している。この例では、チャット·Creを使用しました。 (D)は網膜症の概略DSGC-SAC回路をトレースするため。 (C)に示すようなチャット細胞は、急行TVAとtdTomatoに作られています。のRGCはでLGNから感染している(B)で産生されたウイルスの重複感染。ウイルスがGFPを発現として、これらのRGCは緑色になります。次にウイルスは、それらが標識RGCに接続されている場合はチャットのみアマクリン細胞をTVA発現に広がっていく。これらの細胞は、赤と緑、または黄色の両方になります。 拡大図を表示するには、ここをクリックしてください 。
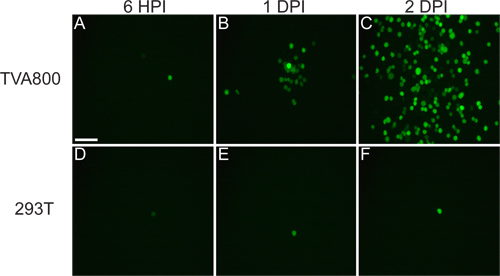
図3 293TとTVA800細胞上rVSV(/ RG)ウイルスの挙動。これらの細胞はRABV-Gでシュー低力価rVSV(/ RG)に感染させた。ウイルスは、感染後日数(DPI)の6時間後の感染(HPI)、1と2に示すように、時間の問題でTVA-発現細胞の間に広がるしかし、TVAの受容体を発現しない293T細胞、上に広がり、しかし私トンが発生した、はるかに遅く起きる。スケールバー=100μmである。
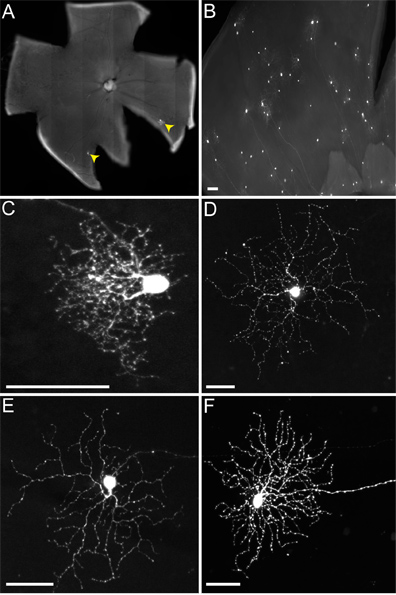
図4非TVA発現マウスのRGCの代表感染。動物はRABV-GでシューrVSV(/ RG)ウイルスとLGN、および2解像度採取された組織に注入した。 (A)は、スパース(RGCは黄色の矢印で示されています)または(B)の密な感染症は、注射のウイルスと品質の力価に応じて、取得することができる。 RGCの多くの異なったタイプの(C)は小さな東屋のRGC(D)タイプ1のメラノプシンのRGC、(E) - DSGCsオン、及び(F)は、ON-OFF-DSGCs、他の人の間を含めて、形態学に基づいて同定することができる。スケールバー=50μmである。

図5 rVSV(/ RG)のSACにON-OFF-DSGCsからの送信は、予想されるパターンに従います。 (A)は、ON-OFF-DSGCs複数のSAC(黄色の矢印)に送信するウイルス(緑の塗りつぶしと白矢頭)。 ( ')。彼らはTVA発現のSACであることを示すに、Creレポーターとの共同ラベルDSGCれていないすべての緑のセル。 (BC)DSGC(緑の塗りつぶしと白矢頭)とのSAC(黄色矢印)網膜内網状層(IPL)の適切なチャット層に階層化する。ウイルス送信の両方がONとOFF-嚢を含むように細胞。パネルB 'およびC'の中の数字は、IPLラミナを示す。 DSGCのソーマの場所は、矢印で示されますが、SACのを強調するためにパネルCに示されていません。スケールバー=50μmである。
ディスカッション
神経回路を研究するためにウイルスを使用すると、接続されたニューロンの分析の比較的ハイスループットな方法である。しかし、VSVとRABVビリオンの両方を生成することは簡単ではありません。 cDNAからウイルスを救出するために、上記のプロトコルが用意されていますが、それはまだ低確率イベントです。 N、P、およびLプラスミドのそれぞれのレベルは細かく調整する必要があり、多くの...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は、技術支援のための組換えVSVの変種を救出の支援のためのショーン·ウィーラン、とDIDEMゴズとライアンChrenekを承認したいと思います。この作品はハワードヒューズ(CLC)、および#NS068012-01(KTB)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
参考文献
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved