Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вирусный отслеживание генетически определенных нервной системы
В этой статье
Резюме
Метод трассировки синаптически связанных нейронов описано. Мы используем TVA специфику вверх клетки, чтобы исследовать, является ли клетка интерес населения получает синаптические вход из генетически определены типы клеток.
Аннотация
Классические методы для изучения нейронных цепей довольно низкой пропускной способностью. Транссинаптических вирусов, в частности, псевдобешенства (PRV) и вирус бешенства (RABV), а в последнее время вирус везикулярного стоматита (VSV), для изучения схемы, становится все более популярным. Эти методы более высокого пропускная способность использовать вирусы, которые передают между нейронами либо в антероградной или обратном направлении.
Недавно измененные RABV для моносинаптических ретроградной трассировка была разработана. (Рис. 1А). В этом методе, гликопротеин (G) гена будет удален из вирусного генома, и снабжение только в целевых нейронов. Инфекция специфики достигается путем замещения химерных G, состоящий из внеклеточного домена ASLV-гликопротеина и цитоплазматический домен RABV-G (A / RG), для нормального RABV-G 1. Это химерных G специально заражает клетки, экспрессирующие рецептор TVA 1. Ген, кодирующий TVA можно было Delivered с помощью различных методов 2-8. После RABV G-инфекции TVA-экспрессирующих нейронов, RABV может передать другим, синаптически связанных нейронов в обратном направлении по природе своей G которая была совместно поставляется с рецептором TVA. Этот метод называет сравнительно большое число входов (5-10%) 2 на определенный тип клеток, обеспечивая выборку всех входов на определенный тип клеток стартера.
Мы недавно измененные эту технику, чтобы использовать VSV как транссинаптических индикатора 9. VSV имеет ряд преимуществ, в том числе скорость экспрессии генов. Здесь мы подробно новых вирусных система отслеживания использования VSV полезно для зондирования микросхемы с повышенным разрешением. Хотя первоначально опубликованных стратегий Wickersham и соавт. 4 и Beier и др. 9. Разрешение маркировки любых нейронов, которые проецируются на первично-инфицированных TVA-выражение-клетки, здесь VSV был разработан для передачи только на ТВ-Экспрессирующие клетки (рис. 1б). Вирус сначала pseudotyped с RABV-G, чтобы позволить инфекции нейронов вниз по течению от TVA-экспрессирующих нейронов. После заражения этой первой популяции клеток, вирус выпущен только заразить TVA-экспрессирующих клеток. Потому что транссинаптических вирусное распространение ограничено TVA-экспрессирующих клеток, наличие или отсутствие подключения от определенных типов клеток могут быть изучены с высоким разрешением. Экспериментальная схема этих экспериментах показано на рисунке 2. Здесь мы покажем модель цепи, что направление селективности в сетчатке мышей. Мы рассматриваем возможность подключения звездообразования клетки амакринные (SAC) в ганглиозных клеток сетчатки (РГК).
протокол
1. Оформление Вирус из кДНК: Восстановление VSV из кДНК с использованием коровьей-T7 системы 10
- За день до эксперимента, разделить BsrT7 клеток в 60 мм блюдо с DMEM + 10% FBS. Семенной 2E6 клеток на чашку. BsrT7 клетки получают из BHK21, или ребенка хомяк почек, клеток.
- Теплый PBS с 1 магний мм и 1 мм кальция до 37 ° C.
- Получить небольшую аликвоту vTF7-3, вирус коровьей оспы выражения T7-полимеразы, и оттепели до комнатной температуры. vTF7-3 является инфекционный вирус коровьей оспы выражения полимеразы T7 11, и должны быть использованы только в области биобезопасности 2-го уровня сдерживания. Это выражение система используется для создания максимальных уровней желаемого стенограммы плазмиды трансфицировали в пункте 1.9. Vortex вируса в течение 30 секунд на максимальной скорости. Разрушать ультразвуком в настольный ультразвуком в течение 2 мин на водяной бане при комнатной температуре. Vortex снова в течение 30 секунд, чтобы разбить вирусных сгустки.
- Удалите носитель из BSRT7 клеток.
- Добавить 11,7 мкл vTF7-3до 600 мкл PBS с магнием и кальцием и добавить смесь на клетки.
- Перемещение плит в 34 ° C инкубаторе с 5% CO 2. Рок пластины аккуратно каждые 10 мин.
- После 45 минут прошло, начинаются трансфекции. Добавить 20 мкл липофектамина 2.000 до 1 мл DMEM и перемешать. Подождите 5 мин.
- Добавить 5,25 мкг пН, 2,3 мкг РР, 1,2 мкг пл, 1 мкг pCAG RABV-G, и 6 мкг геномной ДНК VSV до 500 мкл DMEM. пН, ПП и ЛП плазмид вождения выражение VSV вирусных генов под промотором Т7 10, с суммами, определяется эмпирически для оптимального спасательных вируса.
- Объединить обе трубки и перемешать. Подождите 15 минут при комнатной температуре.
- Удалить PBS и промыть пластины один раз с 1,5 мл DMEM.
- Аспирируйте промыть СМИ. Добавить трансфекции смесь в тарелку. Перемещение пластины на 34 ° C инкубатора.
- Подождите 5 часов, затем удалите СМИ.
- Изменение среды до 4 мл DMEM + 2% FBS + 1x пенициллина-стрептомицина + 10 мМ HEPES рН 7,4. Добавление Penicillin-стрептомицин, для предотвращения загрязнения, и HEPES, для поддержания рН среды, очень важно. FBS содержание может быть снизился до 2%, так как клетки будут уничтожены в течение нескольких дней от вируса и, следовательно, не нужны 10% FBS.
- Место пластины на 34 ° C инкубаторе в течение 48-72 часов.
- Сбор средств массовой информации на 3 и 6 дней после трансфекции, и сразу же шприц фильтр, через 0,20 мкм фильтр. Этот размер фильтр удаляет вирус коровьей оспы, но не VSV.
- Так как мы хотим поставлять RABV-G к вирусной оболочки, а геном не кодирует RABV-G гена, он должен быть постоянно поставляется в транс. Чтобы сделать это, сделать отдельную тарелку 293T TVA800 (TVA800) клеток. Эти клетки, которые конститутивно экспрессируют рецептор TVA, позволяющие EnvA-опосредованной вирусной инфекции 12. На 80% слияния, изменения средств массовой информации DMEM только, то трансфекции клеток с 5 мкг плазмиды, кодирующей белок G (т.е. pCAG RABV-G) на чашку. Мы используем PEЯ трансфекции реагента, поликатионный полимера, который значительно дешевле, чем аналогичные на основе липидов методами. Тем не менее, липофектамина также может быть эффективно использован для этой цели. Оптимальная PEI: ДНК соотношение должно быть определено опытным путем. Делайте это в отдельном эксперименте с люминесцентными репортер, то есть pCAG GFP. Мы используем 10 мкл PEI: 4 мкг ДНК.
- Применить супернатант с шага 16 на трансфицированных пластины TVA800 клеток.
- Соблюдать эту пластину на следующий день для доказательства флуоресценции вирусно выразил флуорофора. Вирусный флуоресценции впервые наблюдали, как одна клетка, и постепенно распространяется в течение долгого времени (например, рисунок 3). Вирус должны распространяться в течение нескольких часов.
2. Прохождение и концентрации VSV
- Сплит TVA800 клеток в среде, содержащей DMEM + 10% FBS, что вы будете иметь четыре 10-см пластины на ~ 80% слияния на следующий день. 293T на основе клеток хорошо работать из-за их высокой переходовsfectability, и использование TVA-экспрессирующих клеток повышает скорость, с которой клетки в чашке заразиться. Другой весьма transfectable клеточных линий может служить цели, а также.
- На 80% слияния, изменения средств массовой информации DMEM только, то трансфекции клеток с 5 мкг плазмиды, кодирующей белок G, что вы хотите использовать (например, pCAG RABV-G) на чашку. Мы используем PEI, но FUGENE / Lipofectamine работы, а также.
- Подождите один день после трансфекции для гликопротеина выражение / поверхности накопления. Изменение средств массовой информации (5 мл / пластина) в DMEM + 10% FBS, а затем заразить rVSV (A / RG) вируса на множественность заражения (МВД) в размере 0,01 <х <0,1.
- Проверьте количество инфекцией 24 час позже. Вы должны увидеть инфицированных клеток (определяется по флуоресценции GFP), некоторые с прилегающими участками инфицированных клеток (т.е. рис. 3). Обычно это стоит только сбором супернатанта, если вы видите,> 50% клеток, инфицированных, в противном случае вирусных титров obtaineD от концентрации будет оптимальным.
- Если> 50%, собираем 5 мл средства массовой информации / пластину, и заменить 5 мл свежей среды. Если слишком мало зараженных клеток, ждать еще 12-24 ч, и проверьте еще раз. Замораживание собранных супернатантов при температуре -80 ° C.
- Соберите все 24 часа после этого в течение 3 дней, в общей сложности 4 дня.
- В общей сложности, если вы начали с 4 пластинами, вы должны иметь 20 мл средства массовой информации от каждого дня, - так 80 мл общем, или 2 трубы ультрацентрифуге стоит супернатанта. Оттепель супернатантов при 37 ° C и фильтруют через 0,45 мкм фильтр на льду. Алиготе 36 мл вируса в пробирки Beckman центрифуги.
- Концентрат супернатант (21.000 K в ЮЗ28 ротора (= 80 000 мкг) в течение 90 мин) при температуре 4 ° C. Слейте надосадочную жидкость в стакан, содержащий 10% отбеливателя, и в то время как трубка инвертируется, используйте аспиратор удалить как можно больше средств массовой информации со стороны трубы насколько это возможно.
- В то время закрыты. встряхнуть вирусных труб при 4 ° С в течение 1 часа. Стандартные шейкере при Абу-т 120 оборотов в минуту достаточно.
- Аккуратно растереть гранул в остальных средствах массовой информации, мягко пипетки вверх и вниз 30 раз. Будьте осторожны, чтобы не вводить пузырьки воздуха. Оставшиеся объемы средств массовой информации должна быть около 30 мкл. Алиготе этот объем в несколько труб, чтобы предотвратить нескольких циклов замораживания-оттаивания для любой конкретной акции, так как это может привести к снижению титра вируса. Эти аликвоты могут быть заморожены при температуре -80 ° C.
- Титр вируса. Titering около 2 дней после заражения является оптимальным. Первичное заражение может наблюдаться в течение нескольких часов, но вы получите недопредставленности титр, если вы ждете всего 1 день. Для того чтобы получить титр вируса, выполнить предельное разведение эксперимент концентрированного вируса на соответствующую линию клеток (клеток 293Т хорошо работать) в 24-луночный планшет, разбавляя вирусом 10-кратного от 1 до 1: 1000000. Титры мы получаем, как правило, в диапазоне 10 8 -10 10 фокус единиц (ФФУ) / мл.
3. Virнам инъекций
- Мы используем мышей, обычно между 6-10 недель, для этих экспериментов. Любой возраст, после которого схема установлено, было бы достаточно. Мы будем выбирать передачи от ганглиозных клеток сетчатки (РГК) к звездообразования амакринных клеток (SAC) в качестве примера. Этот эксперимент, как схематически на рисунке 2, требуется тройное трансгенного животного, и только одну инъекцию вируса. (Все процедуры показаны были утверждены IACUC в Гарвардской медицинской школе, и были в соответствии с руководящими принципами институциональной).
- Во-первых, правильный животные должны быть получены. Цель состоит в том, чтобы иметь TVA выражаются в типе клеток, что кто-то хочет отобразить в, с помощью вируса (например, адено-связанный вирус, AAV), или трансгенных аллеля. Специфика типа клеток, как правило, получены выражения Cre. Здесь мы также перешли в условном выражении TVA аллель 7 до холинацетилтрансферазы (чат)-Cre аллель 13, так, что TVA выражаетсяво всех клетках с историей Cre выражении (ДЗО). Мы также перешли условное выражение tdTomato аллеля (R26TdT) для визуализации TVA-экспрессирующих клеток.
- Координаты места впрыска должны быть определены. Эти координаты интересов может быть найдена в мозге атлас, т. е. Франклин и Paxinos атлас мозга мыши 14. Эти координаты должны быть отметила, относительно данного ориентира на мышь черепа. Мы используем брегмы, но любая система координат является достаточным.
- Подготовка стереотаксического аппарата. Включите контроллер микроинъектор, и переместить поршень и держатель электрода на месте. Потом снова заполнить инъекционной иглой с минеральным маслом для обеспечения интерфейса с вирусом. Введите иглу затем на поршень, убедившись, что нет воздушных пузырей остаются в иглу.
- Оттепель вирус, и место на льду, чтобы предотвратить падение титра вируса. Установить микроинъектор «снять» и переместите трубку вирус такой, что это contactiНГ капиллярных на микроинъектор. Вывод необходимого количества rVSV (A / RG) pseudotyped с RABV-G для эксперимента.
- Животные даны дооперационной дозе бупренорфина (0.05-0.1 мг / кг) до операции начинается. Для обезболивания животных, либо изофлуран ингаляции или внутрибрюшинного введения кетамина (40-80 мг / кг) и ксилазина (5-10 мг / кг) смеси достаточно. Выбор анестезии зависит от пользователя. Ноги щепотку затем выполняется для обеспечения того, чтобы животные полностью под наркозом, если животное не отвечает, вы можете приступить к процедуре. Будьте уверены, чтобы получить соответствующие лицензии, прежде чем использовать эти препараты.
- Животные размещены на площадке с подогревом, который опираясь на подвижную подставку для позиционирования мыши. Животное остается там на протяжении всего хирургического вмешательства. Применение глазной мази для предотвращения высыхания роговицы, в то время как животное находится под наркозом.
- Голова мыши, то должна быть стабилизирована в стереотаксическойpparatus. Используйте ухо баров на стереотаксического аппарата для того, чтобы голова хорошо обеспеченных, так, что голова параллельно земле, а не поворачивать в сторону. Как только это будет завершена, настройки укуса бар, чтобы помочь стабилизировать голову.
- Мех животного побрился в области разреза на верхней части головы. Эта область затем промывают три раза с этанолом, а затем три раза с йодом. Разрез выполняется в кожу с помощью скальпеля, открывая череп.
- После инъекции мыши и настройки готовы, брегмы должен быть расположен. Это область, в центре головы, что сагиттальной и двух корональных швов с концами. Как только эта область находится, набирает на стереотаксической аппарат может быть использован для настройки микроинъектор к соответствующим координатам. Здесь мы вводим латерального коленчатого тела (LGN), используя координаты / P -2,46 из брегмы, L / M 2, D / V 2,75.
- Как только координаты был набран в, сверла должны быть собраны.Поместите сверло в дрель, затем включите дрель. Небольшое отверстие должно быть просверлено на сайт определены как места инъекции. Будьте очень нежны со сверлом, чтобы не привести к повреждению паренхимы мозга. Когда кость очень тонкая, кровеносные сосуды на длительность станет ясно. В этот момент, обязательно проколите края трепанация черепа с небольшой (30 калибра) иглу и штраф (# 5) щипцы для удаления остатков костей.
- Отрегулируйте капиллярного на должность просто спинного мозга поверхность, где отверстие было просто бурения. Игла должна быть достаточно острыми, чтобы проникать в твердую мозговую оболочку с легкостью. Затем опустите иглу на нужную глубину, и начать инъекции. Мы вводят вирус со скоростью 100 нл / мин.
- Процедура инъекции в эту точку занимает примерно десять минут. После инъекции игла остается в мозге в течение семи минут. Это очень важно, так как позволяет распространения вируса из места инъекции. Быстрое удаление иглы форме Injeие сайта приводит к снижению эффективности инфекции в месте инъекции и инфекции вдоль иглы тракта.
- Иглу очень медленно поднял из места инъекции, в течение ряда около двух минут. Это опять же предназначены для снижения инфекции вдоль иглы тракта.
- После удаления кожи, затем зашивают. Животные постоянно контролировать, пока они оправиться от наркоза. Бупренорфин (0.05-0.1 мг / кг) вводят каждые 12 ч в течение 2 дней.
4. Уборочная тканей / Ткани подготовка
- Для уборки ткани интерес, оптимальное время зависит от целей эксперимента. Как правило, VSV транссинаптических распространение может быть сначала наблюдается менее чем за 24 часа после инъекции. Тем не менее, в ожидании более длительное время приведет к увеличению распространения.
- Для уборки сетчатки, животных сначала усыпляют с использованием углеродных вдыхания газа и смещения шейных позвонков выполняется. Глазное яблоко затем удаляют и помещают в пробирку консодержащего 4% формальдегида в PBS в течение 1 часа при комнатной температуре.
- Глазное яблоко помещается в чашку Петри с PBS. Сетчатки, то отсечен от других тканей.
- За весь анализ гору, сетчатки разрезают таким образом, чтобы заложить квартиру, помещают на предметное стекло, затем монтируются с золотом продлить монтаж средств массовой информации и покрыты нулевой толщины стекла покровное. Силиконовые прокладки помещаются между горкой и покровное чтобы свести к минимуму силы сжатия на сетчатке. Для раздел анализа, сетчатка расположена в 30% сахарозы в PBS до сетчатки погружается. Затем помещают в смесь 50% ОСТ и 50% 30% раствор сахарозы в течение 3 часов. Затем заморозки, и выдерживали при -80 ° C до готовности сократить.
5. Представитель Результаты
Вирус, который спас от кДНК должны быть в состоянии заразить TVA800 клеток, но не 293T клетки (рис. 3). Поставка RABV-G позволяет заражения нескольких Т-клетокYpes, в том числе 293Т. Однако, поскольку / RG геноме закодированы в геноме, распространилась среди клеток происходит на гораздо более высокой скорости в TVA-экспрессирующих клеток.
После того как вирус является концентрированным, типичный диапазон титров между ФФУ 10 8 / мл и 10 10 ФФУ / мл. Эти титры являются достаточными для использования в естественных условиях.
Во время LGN инъекции в мышей, мы не будем различать спинной LGN (dLGN) из брюшной LGN (vLGN), и как правило, становятся инфицированными. Таким образом, несколько типов РГК становятся маркировкой (рис. 4), в том числе проект по vLGN, таких как меланопсин РГК (рис. 4D) и ON-DSGCs (рис. 4E), и те, что проект dLGN, такие как малые беседке РГК (рис. 4в) и ON-OFF-DSGCs (рис. 4F). Несмотря на более чем одного типа РГК передается вирус ДЗО, как сообщалось в другом месте (Beier и соавт., В обзоре), здесь мы сосредоточимся толькона хорошо изученных соединений ON-OFF-DSGCs в мешки.
Когда мы вводим мышей генотипа cTVA (+) / Чат-Cre (-), где не TVA должна быть выражена только РГК помечены (например, рисунок 4). Они обусловлены начальной поглощение RABV-G pseudotyped вируса РГК, а не распространение не происходит. Нет РГК заражены от инфекции LGN из rVSV (A / RG) вирус не pseudotyped с RABV-G, в связи с неспособностью этих вирионов в поперечном длинные аксоны этих РГК. Тем не менее, при введении cTVA (+) / ChATCre (+) (и R26TdT (+)) мышей в LGN, распространение вируса происходит, только эритроциты, которые выражают репортер Cre (т.е. рис. 5). Эти клетки также со-метки с анти-ХАТ антитела, и стратифицировать только в двух пластинок чат, подтверждающих их личность, как ДЗО (рис. 5B ', C'). Число вирусно помечены ДЗО в DSGC варьировалась от одного до девяти.

Рисунок 1. Наша ретроградной транссинаптических система отслеживания по сравнению с первоначально разработанного метода. (A) (Я) в метод, разработанный Wickersham и коллег, "стартер клетки" трансфицируют с тремя генами: рецептор TVA, используется для разрешения инфекции специально трансфицированных клеток; RABV-G, используемого в дополнение к RABV, которые сам был удален ген G, и красного флуоресцентного белка для выявления трансфицированных клеток. (II) RABV pseudotyped с белком / RG заражает TVA-экспрессирующих клеток, делая их желтыми. (III) Ретроградная транссинаптических передача происходит выше по течению нейронов. (B) (I) В нашем методе, TVA-экспрессирующих клеток определяется генетически, и помечены с условным красного флуоресцентного PROTEдюйм (II) "стартер ячейки" зараженных VSV кодирующие / RG гена в геном вируса. Эти начальные клетки не экспрессируют рецептор TVA. (III) Ретроградная транссинаптических передач происходит с TVA-экспрессирующих нейронов, только если эти клетки обеспечивают синаптических входа на стартер нейронов. Нажмите, чтобы увеличить показатель .
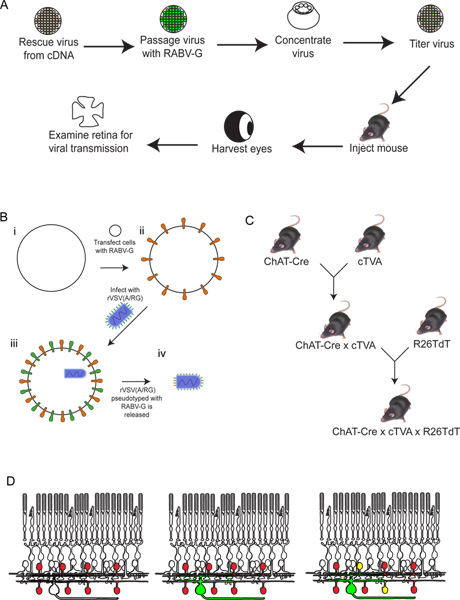
Рисунок 2. Схема экспериментальной процедуры. (A) Во-первых, вирус спас от кДНК. Затем пассировать и pseudotyped с RABV-G, и концентрируется и титруют. Этот вирус затем вводили в мозг, где она инкубируют в течение необходимого периода времени. После этогоВремя, глаза собирают, а сетчатка расчлененных и проанализированы. (B) Схема pseudotyping вируса с RABV-G. Это необходимо для заражения ганглиозных клеток сетчатки в мозг инъекцию. RABV-G гена сначала трансфекции в клетки тканевой культуры, экспрессирующие рецептор TVA. Эти клетки затем инфицированных rVSV (A / RG) вируса. Вирионов выпустили будет иметь RABV-G в вирусную оболочку, но не будет иметь ген RABV-G в вирусном геноме. (C) схема мышь пересекает необходимые для тройного трансгенных животных. Условные аллелей TVA и tdTomato пересекаются с водителем Cre выбора, такие, что TVA и tdTomato выражаются только в клетках с историей выражения Cre. В этом примере мы использовали чат-Cre. (D) Схема сетчатки инфекции для того, чтобы проследить DSGC-SAC схемы. ChAT клетки сделаны, чтобы выразить TVA и tdTomato, как показано на (C). РГК заражены от LGN винфекцией вируса производится в (B). Как вирус выражает GFP, эти РГК будет зеленым. Вирус будет распространяться только на TVA-выражения ChAT амакринных клеток, если они связаны с меченым RGC. Эти клетки будут как красный и зеленый или желтый. Нажмите, чтобы увеличить показатель .
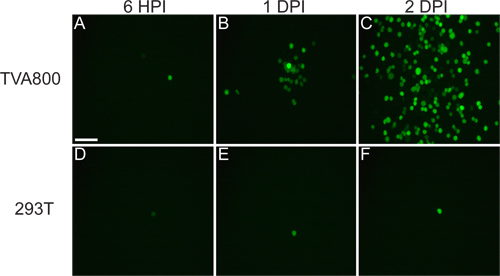
Рисунок 3. Поведение rVSV (A / RG) вируса на 293T и TVA800 клеток. Эти клетки были инфицированы с низким титром rVSV (A / RG) pseudotyped с RABV-G. Вирус распространяется между TVA-экспрессирующие клетки в течение нескольких часов, как показано на рисунке 6 часов после заражения (HPI), 1 и 2 дней после заражения (DPI). Тем не менее, распространение на 293T клетках, которые не экспрессируют рецептор TVA, хотя ят имеет место, происходит гораздо медленнее. Шкала бар = 100 мкм.
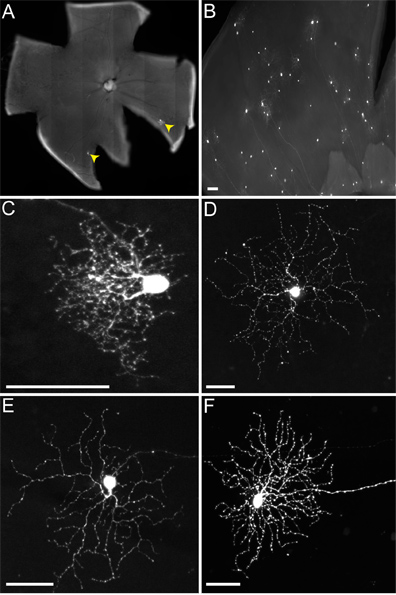
Рисунок 4. Представитель инфекций РГК не-TVA выражения мышей. Животным вводили в LGN с rVSV (A / RG) вируса pseudotyped с RABV-G, и ткань собрано 2 точек на дюйм. (A) Редкие (РГК указано желтыми стрелками) или (B) плотное инфекции могут быть получены, в зависимости от титра вируса и качества инъекции. Много различных типов РГК могут быть определены на основе морфологии, в том числе (C) небольшая беседка РГК, (D) 1-го типа меланопсин РГК, (E) ON-DSGCs, и (F) ON-OFF-DSGCs, среди других. Шкала баров = 50 мкм.

Рисунок 5. RVSV (A / RG) передачи от ON-OFF-DSGCs к ДЗО следует ожидаемого характера. (А) ON-OFF-DSGCs (белая стрелка с зеленым заливку) передавать вирус на несколько мешочков (желтые стрелки). (A '). Все зеленые клетки, которые не являются DSGC совместно этикетку с корреспондентом Cre, указав, что они являются выражением TVA-мешков. (BC) DSGC (белая стрелка с зеленым заливку) и ДЗО (желтые стрелки) стратифицировать в соответствующие слои ChAT сетчатки внутренний слой плексиформные (IPL). Клетки, к которым вирус передает включают в себя как ВКЛ и ВЫКЛ-мешков. Числа в панели B 'и C' указывают на IPL пластинок. Расположение сома DSGC только указывает стрелка, но не показаны в панели C, чтобы выделить мешков. Шкала баров = 50 мкм.
Обсуждение
Использование вирусов для изучения нейронных цепей является относительно высокая пропускная способность метод анализа связной нейронов. Однако, создавая как VSV и RABV вирионы не является тривиальной. Хотя протокол, перечисленные выше для спасения вируса из ДНК, то она по-прежнему низко?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы поблагодарить Шон Уилан за помощь в спасении рекомбинантные варианты VSV, и Didem Гоз и Райан Chrenek для оказания технической помощи. Эта работа была поддержана HHMI (CLC), и # NS068012-01 (КТБ).
Материалы
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
Ссылки
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены