JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유 전적으로 정의 된 신경 회로의 추적 바이러스
요약
synaptically 연결 뉴런을 추적하는 방법이 설명되어 있습니다. 우리는 관심의 세포 인구가 유전자 정의 셀 유형에서 시냅스 입력을 받고 있는지 여부를 조사하기 위해 상류 세포의 TVA의 특이성을 사용합니다.
초록
neuronal 회로를 공부 클래식 방법은 매우 낮은 처리량 있습니다. Transsynaptic 바이러스, 회로를 공부 특히 pseudorabies (PRV)와 광견병 바이러스 (RABV), 그리고 더 최근의 기공을 갖는 구염 바이러스 (VSV)는, 점점 더 인기를 끌고있다. 이러한 높은 처리량 방법 중 하나 anterograde 또는 역행 방향으로 뉴런 사이의 전송 바이러스를 사용합니다.
최근 monosynaptic 역행 추적에 대한 수정 RABV가 개발되었습니다. (그림 1A). 이 방법에서, 당 단백질 (G) 유전자는 바이러스 게놈에서 삭제되고, 대상 뉴런에서만 resupplied. 감염 특이성은 일반 RABV-G 1 ASLV-A 당 단백질과 RABV-G (A / RG)의 세포질 도메인의 세포 도메인으로 구성된 키메라 G를, 대체에 의해 달성된다. 이 키메라 G는 특히 TVA 수용체 1을 표현 세포를 감염. 유전자 인코딩 TVA는 D되어 있습니다다양한 방법 2-8으로 elivered. TVA - 표현 뉴런의 RABV-G 감염 후, RABV는 TVA 수용체와 공동 배달 된 자신의 G의 성격에 의해 역행 방향으로 다른 synaptically 연결 뉴런에 전송할 수 있습니다. 이 기술은 정의 된 스타터 세포 유형로 입력의 모든 샘플링을 제공 정의 된 셀 타입에 입력의 상대적으로 많은 수의 (5-10 %) 2 레이블.
우리는 최근 transsynaptic 추적 9로 VSV을 사용하려면이 기술을 수정했습니다. VSV는 유전자 표현의 급속 등 여러 장점을 갖추고 있습니다. 다음은 상세 증가 해상도 microcircuitry을 탐색하는 데 유용합니다 VSV를 사용하여 새 바이러스 추적 시스템을. 동안 Wickersham 외하여 원래의 출판 전략. 4 Beier 외. 처음에 감염된로 프로젝트가 TVA--세포를 표현, 여기를 VSV는 TV 만 전송하도록 설계되었습니다있는 뉴런의 9 허가 라벨A-표현 세포 (그림 1B). 바이러스가 처음 TVA - 표현 뉴런의 뉴런 하류의 감염을 허용하는 RABV-G와 pseudotyped 있습니다. 셀의 첫 번째 인구 감염 후 바이러스는 TVA-표현 세포를 감염시킬 수 있습니다 발표했다. transsynaptic 바이러스 확산이 TVA - 표현 세포, 정의 셀 유형에서 연결의 부재의 존재로 제한되어 있기 때문에 높은 해상도로보실 수 있습니다. 이 실험의 실험 플로우 차트는 그림 2에 표시됩니다. 여기 모델 회로를 보여, 마우스 망막에 방향 선택성의. 우리는 망막 신경절 세포 (RGCs)에 항성 amacrine 세포의 연결 (주머니)를 검사합니다.
프로토콜
1. cDNA에서 바이러스를 만들기 : cDNA의 VSV의 복구가 우두-T7 시스템 (10)을 사용하여
- 실험 전에 어느 날, DMEM + 10% FBS를 포함하는 60mm 요리에 BsrT7 세포를 분리. 요리 당 종자 2E6 세포. BsrT7 세포는 BHK21, 또는 아기 햄스터 신장 세포에서 파생됩니다.
- 1 ㎜의 마그네슘과 1 밀리미터 칼슘과 37 따뜻한 PBS는 ° C.
- 작은 나누어지는 vTF7-3, T7의 효소를 표현 우두 바이러스 및 실내 온도에 해동를 구합니다. vTF7-3 T7의 효소 11 표현 전염성 우두 바이러스이며, 바이오 레벨 2 억제에만 사용되어야합니다. 이 표현 시스템은 단계 1.9에서 transfected plasmids에서 원하는 성적 최대 수준을 생성하는 데 사용됩니다. 최대 속도에서 30 초에 소용돌이 바이러스를. 상온에서 물 목욕 2 분 동안 탁상 sonicator에 Sonicate. 소용돌이가 다시 30에 초는 바이러스 clumps을 깰 수 있습니다.
- BSRT7 세포에서 미디어를 제거합니다.
- 11.7 μl vTF7-3을 추가600 μl 마그네슘 및 칼슘과 PBS하고 세포에 혼합물을 추가 할 수 있습니다.
- 5% CO 2와 34 ° C 배양기에 플레이트를 이동합니다. 부드럽게 한 번 락 판 매 10 분.
- 45 분 경과 한 후 transfection을 시작합니다. 20 μl lipofectamine 2000 1 ML DMEM과 혼합을 추가합니다. 5 분 동안 기다리십시오.
- 5.25 μg PN 2.3 μg PP, 1.2 μg PL, 500 μl DMEM으로 cDNA 1 μg pCAG RABV-G, 6 μg의 VSV의 게놈을 추가합니다. PN, PP 및 PL은 plasmids은 바이러스의 최적 구조에 대한 경험적 결정 금액으로, T7 프로모터 10 세 미만 VSV 바이러스 유전자의 표현을 유도하고 있습니다.
- 튜브와 혼합 모두 조화를 이루고 있습니다. 실온에서 15 분 정도 기다립니다.
- PBS를 제거하고 1.5 ML DMEM으로 한 번 번호판을 씻는다.
- 미디어를 씻어 대기음. 판에 transfection 믹스를 추가합니다. 34 ° C 배양기에 플레이트를 이동합니다.
- 5 시간을 기다린 후 미디어를 제거합니다.
- 4 ML DMEM + 2% FBS + 1X 페니실린 - 스트렙토 마이신 + 10 밀리미터 HEPES의 pH를 7.4로 미디어를 변경합니다. P의 추가enicillin - 스트렙토 마이신, 오염을 방지하기 위해, 그리고 미디어의 pH를 유지하는 HEPES은 매우 중요합니다. 세포가 바이러스에 의해 며칠 만에 파괴되고 따라서 10% FBS가 필요하지 않는 한 FBS 내용은, 2 %로 감소 할 수 있습니다.
- 48-72 시간에 34 ° C 배양기에 장소 판.
- 3시에 미디어를 수집 6 일 후 transfection, 및 필터 0.20 μm 필터를 통해 즉시 주사기. 이 크기의 필터는 VSV 우두 바이러스를 제거하지만.
- 우리가 바이러스 봉투에 RABV-G를 제공하려는 게놈 RABV-G 유전자를 인코딩하지 않기 때문에, 그것은 지속적으로 횡단으로 공급해야합니다. 이 작업을 수행하려면 293T TVA800 (TVA800) 세포의 별도의 플레이트를합니다. 이러한 constitutively EnvA로 인한 바이러스 감염 12 허용, TVA 수용체를 표현하는 세포입니다. 80% confluency에서 플라스미드 인코딩 G 단백질 (예 pCAG RABV-G) 판 당 5 μg으로 세포를 transfect 만 다음 DMEM으로 미디어를 변경합니다. 우리는 PE를 사용하여I transfection 시약, 유사한 지질 기반의 방법보다 훨씬 저렴 polycationic 폴리머. 그러나, lipofectamine도이 목적을 위해 효율적으로 사용할 수 있습니다. 최적의 PEI는 : DNA 비율은 경험적으로 결정해야합니다. 형광 기자, 즉 pCAG GFP를 갖춘 별도의 실험에서이 작업을 수행합니다. 4 μg의 DNA : 우리는 10 μl PEI를 사용합니다.
- TVA800 세포의 transfected 판 올라서 16 일부터 표면에 뜨는을 적용합니다.
- 이 판에게 급속도로 이루어질 표현 형광의 형광에 대한 증거에 대한 다음 일을 관찰합니다. 바이러스 형광 먼저 하나의 세포로 관찰하고, 점차 시간 (즉, 그림 3)를 통해 확산된다. 바이러스는 몇 시간 내에 확산해야합니다.
2. 통로 및 VSV의 농도
- 당신이 다음 날 ~ 80 % confluency에는 네 10 cm 플레이트를해야합니다 있도록 DMEM + 10% FBS를 포함하는 미디어에 TVA800 셀을 분할. 293T 기반의 전지는 높은 트란으로 인해 잘 작동sfectability, 그리고 TVA - 표현 세포의 사용은 접시에있는 세포가 감염되는 속도를 향상시킵니다. 기타 높은 transfectable 셀 라인뿐만 아니라 목적을 제공 할 수 있습니다.
- 80% confluency에서 플라스미드 인코딩 5 μg 당신이 (예 pCAG RABV-G) 판 당 사용할 G 단백질과 세포를 transfect 만 다음 DMEM으로 미디어를 변경합니다. 우리는뿐만 아니라 PEI를 사용하지만, FUGENE / Lipofectamine 작동합니다.
- 당 단백질의 발현 / 표면 축적에 transfection 후 하루 기다리십시오. DMEM + 10% FBS에 (5 ML / 판) 미디어를 변경 한 후 0.01
- 24 시간 후 감염의 양을 확인합니다. 당신은 감염된 세포 (GFP 형광에 의해 식별), 감염된 세포 (예를 들면 그림 3)의 주변 패치와 일부를 볼 수 있습니다. 당신이 obtaine 달리 감염된 세포의> 50 %, 바이러스 titers을 볼 경우 일반적으로는 표면에 뜨는를 수집 가치가 오로지농도에서 d는 차선 될 것입니다.
- > 50 %, 미디어 / 접시의 5 ML을 수집하고, 신선한 미디어의 5 ML로 교체합니다. 너무 적은 세포를 감염하는 경우, 다른 12-24 시간 기다린 후 다시 확인합니다. -80에서 수집 supernatants를 고정 ° C.
- 4 일 총 3 일 동안 이후 모든 24 시간을 수집합니다.
- 당신이 4 판을 시작하면 전체적으로, 당신이 매일에서 미디어 20 ML이 있어야합니다 - 표면에 뜨는의 가치 때문에 80 ML 총, 또는 2 ultracentrifuge 튜브를. 37 supernatants을 녹여 얼음에 0.45 μm 필터를 통해 ° C 및 필터. Beckman의 원심 분리기 튜브로 나누어지는 바이러스의 36 ML 있습니다.
- 4에 (90 분 동안 SW28 로터 (= 80,000 XG)에서 21,000 K) 표면에 뜨는을 집중 ° C. 10 %의 표백제가 들어있는 비커에 표면에 뜨는을 가만히 따르다, 그리고 튜브가 반전되는 동안 가능한 한 관의 측면에서 많은 미디어를 제거 할 수 흡인기를 사용합니다.
- 적용하는 동안. 1 시간에 대해 4 ° C에서 바이러스 튜브를 흔들. 이란게에서 표준 쉐이커t 120 RPM은 충분합니다.
- 부드럽게 부드럽게 30 번 아래로 pipetting과이 남아있는 미디어에서 펠렛을 씹다. 공기 거품을 소개하지 않도록주의하십시오. 나머지 미디어 볼륨이 약 30 μl해야합니다. 여러 튜브로 나누어지는이 볼륨이 바이러스 titer의 감소 될 수 있으므로, 특정 주식에 대한 여러 냉동 해동 사이클을 방지하기 위해 같은하도록합니다. 이 aliquots는 -80에서 냉동 할 수 있습니다 ° C.
- 바이러스를 Titer. 약 2 일 후 감염에 Titering는 최적입니다. 초기 감염이 시간에 관찰 있지만, 단 1 하루 종일해도 titer의 underrepresentation을 할 수 있습니다. 1,000,000 : 바이러스 titer를 얻기 위해, 1 1-10 배 바이러스를 diluting, 24 잘 판에서 해당 셀 라인 (293T 세포가 잘 작동)에 집중 바이러스의 제한 희석 실험을 수행합니다. 우리가 얻을 titers는 10 8 -10 10 초점 성형 단위 (공조 방식) / ML의 범위에 일반적으로있다.
3. 비르우리가 사출
- 우리는이 실험을 위해 일반적으로 세 6-10주 사이에 마우스를 사용합니다. 회로가 설립 된 이후 모든 연령은 충분합니다. 우리는 예를 들어 같은 항성 amacrine 세포 (주머니)에 망막 신경절 세포 (RGCs)에서 전송을 선택합니다. 그림 2에 diagramed이 실험은, 트리플 유전자 변형 동물과 바이러스의 단일 주사를 필요로합니다. (표시된 모든 절차는 하버드 의과 대학에서 IACUC의 승인을, 그리고 제도적 지침에 따라 있었다).
- 첫째, 적절한 동물 생성해야합니다. 목표는 TVA 한 소원이 바이러스 (예 adeno - 관련 바이러스, AAV)에 의해로 매핑하는 셀 형식으로 표현하는 것입니다, 또는 유전자 변형 allele에 의해. 셀 타입 특이성은 보통 Cre 식에 의해 얻어진다. 여기, 우리는 또한 아세틸 콜린 (채팅) - Cre의 allele 13에 조건식 TVA의 allele 7 교차 TVA가 표현되는 이러한Cre 표현의 역사 (주머니)와 모든 셀 인치 우리는 또한 TVA - 표현 세포의 시각화를위한 조건식 tdTomato의 allele (R26TdT)를 넘어.
- 주입 위치에 대한 좌표를 확인해야합니다. 관심이 좌표는 뇌지도 책, 즉 프랭클린과 Paxinos 마우스 뇌 아틀라스 14에서 찾을 수 있습니다. 이 좌표는 마우스 두개골의 특정 랜드 마크에 비해 주목해야합니다. 우리는 bregma를 사용하지만, 좌표 시스템은 충분합니다.
- stereotaxic 장치를 준비합니다. microinjector 컨트롤러를 켜고 장소에 플런저와 전극 홀더를 이동합니다. 그런 다음 바이러스와 인터페이스를 제공하기 위해 미네랄 오일과 함께 주입 바늘을 다시 - 입력하십시오. 기포는 바늘에 남아 없다는 것을 확인하는, 플런저에 다음 찔러 넣는다.
- 바이러스 titer의 드롭을 방지하기 위해 얼음에 바이러스 및 장소를 해동. "철수"와 그 contacti되도록 바이러스의 관을 이동 microinjector를 설정NG microinjector에 모세관. 실험 RABV-G와 pseudotyped rVSV (A / RG)의 필요한 양을 철회 할 수 있습니다.
- 수술이 시작되기 전에 동물 buprenorphine (0.05-0.1 밀리그램 / kg)의 사전 수술 복용량을 받게됩니다. 동물, 하나 isoflurane 흡입하거나, 케타민의 intraperitoneal 주사 (40-80 밀리그램 / kg)과 xylazine을 (MG / kg 5-10) anaesthetizing를 들어 혼합물은 충분합니다. 마취의 선택은 사용자에 따라 달라집니다. 발가락 핀치 그런 다음 동물이 완전히 anesthetized 있는지 확인하기 위해 수행됩니다, 동물이 응답하지 않는 경우, 당신은 절차를 진행할 수 있습니다. 이 약을 사용하기 전에 적절한 라이센스를 취득해야합니다.
- 동물은 마우스를 위치에 이동식 스탠드에 누워있다 온수 패드에 배치됩니다. 동물 수술 절차의 기간에 걸쳐이 남아있다. 동물이 anesthetized 중에 각막의 건조를 방지하기 위해 눈 연고를 적용합니다.
- 마우스의 머리는 stereotaxic에 안정이 필요합니다pparatus. 머리가 머리가 땅에 평행되도록 철저하게 보안이며, 옆으로 회전하지 않도록 stereotaxic 장치에 귀 막대를 사용하십시오. 이것이 완료되면 머리를 안정화하는 데 도움이 물린 줄을 조정합니다.
- 동물의 털은 머리 꼭대기에 절개의 지역에 면도 있습니다. 이 지역은 다음 에탄올로 세 번 씻어 있으며, 요오드와 세 번이 나타납니다. 절개는 다음 두개골을 드러내고, 메스로 피부에 구성되어 있습니다.
- 마우스 및 사출 설치를 준비되면, bregma가 위치해야합니다. 이 시상 두 코로나 봉합이 만나는 것을 머리의 중심에있는 지역입니다. 이 지역이 위치한되면, stereotaxic 장치의 다이얼은 적절한 좌표에 microinjector을 조정하는 데 사용할 수 있습니다. 여기, 우리는 L / M 2, D / V 2.75, bregma에서 좌표에게 A / P -2.46를 사용하여 측면 geniculate 핵 (LGN)를 주입.
- 좌표가 완벽 할 한 후 훈련을 조립해야합니다.드릴에 드릴 비트를 옮긴 다음 드릴을 설정합니다. 작은 구멍은 주입 사이트로 식별 사이트에 교련해야합니다. 뇌 실질에 손상을 줄 수 없습니다하기 위해 드릴 매우 부드러운합니다. 뼈가 매우 얇은 경우, 경질의 혈관은 명확됩니다. 이 시점에서주의 깊게 남아있는 뼈를 제거하는 작은 (30 게이지) 바늘과 고급 (# 5) 집게로 craniotomy의 가장자리를 구멍.
- 구멍이 단지 교련 된 뇌 표면의 단지 등쪽 위치에 모세관을 조정합니다. 바늘이 쉽게 경질 한 학교에 침투 할 수있을만큼 날카해야합니다. 그런 다음 원하는 깊이로 바늘을 절감하고, 주사를 시작합니다. 우리는 100 NL / 분의 속도로 바이러스를 주입.
- 이 시점에 분사 절차는 약 10 분이 걸리지. 주입 후, 바늘은 약 7 분 동안 뇌에 남아 있습니다. 가 주입 사이트에서 바이러스의 확산을 허용으로 이것은 매우 중요합니다. 신속하게 바늘 형태 인제를 제거바늘 기관 따라 감소 감염 분사의 사이트에서 효율성 및 감염의 ction 사이트 결과입니다.
- 바늘이 매우 느리게 2 분 정도의 기간 동안 주입 사이트에서 발생합니다. 이것은 다시 바늘 기관 따라 감염을 감소하기위한 것입니다.
- 일단 제거, 피부 그 다음 봉합합니다. 사람들이 마취에서 회복 될 때까지 동물을 지속적으로 모니터링하고 있습니다. Buprenorphine (0.05-0.1 밀리그램 / kg)이 2 일간 매 12 시간을 관리합니다.
4. 조직 / 조직 준비를 수확
- 관심 조직을 수확를 들어, 최적의 시간은 실험의 목표에 따라 달라집니다. 일반적으로, VSV transsynaptic 확산은 첫 24 시간 후 분사 미만으로 관찰 할 수 있습니다. 그러나, 더 이상 대기 시간이 더 확산 될 것입니다.
- 망막을 수확하기 위해 동물이 먼저 이산화탄소 흡입과 자궁 전위가 수행됩니다를 사용하여 euthanized 있습니다. 안구는 다음 관 사기꾼으로 제거 및 위치상온에서 1 시간을 위해 PBS에 4 % 포름 알데히드를 taining.
- 안구 그런 다음 PBS와 페트리 접시에 배치됩니다. 망막 그런 다음 다른 조직에서 떨어져 해부 있습니다.
- 전체 마운트 분석을 위해, retinae은 유리 슬라이드에 배치, 평면 레이아웃 할만큼 절단 한 후 금 장착 미디어를 연장으로 장착하고 제로 두께 유리 coverslip으로 덮여. 실리콘 스페이서는 망막에 압축 힘을 최소화 할 수있는 슬라이드와 coverslip 사이에 위치하게된다. 섹션 분석을 위해, 망막은 망막 submerges까지 PBS의 30 % 자당에 배치되어 있습니다. 그런 다음 50% 10월의 혼합으로 배치하고 3 시간 50 % 30 % 자당 솔루션입니다. 그런 다음 냉동 플래시 및 절단 할 ° C까지 준비 -80에 보관됩니다.
5. 대표 결과
cDNA의 구조되는 바이러스는 TVA800 세포하지만, 293T 세포를 (그림 3) 감염 할 수 있어야합니다. RABV-G를 제공하는 것은 여러 셀 t의 감염을 허용293T 포함 ypes. A / RG의 게놈은 게놈에 인코딩되어 있기 때문에, TVA - 표현 세포에서 훨씬 더 높은 비율로 발생하는 세포 사이에 확산.
바이러스는 10 8 공조 방식 / ML 및 10 10 공조 방식 / ML 사이에 집중, 전형적인 titers 범위되면. 이 titers은 생체에서 사용하기에 적합합니다.
마우스로 LGN 분사 동안, 우리는 모두 일반적으로 감염 될 때, 복부 LGN (vLGN)에서 등쪽 LGN (dLGN)를 구별하지 않습니다. 따라서, 여러 RGC 유형은 melanopsin RGCs (그림 4D)와 ON-DSGCs (그림 4E)과 같은 vLGN에있는이 프로젝트, 그리고 그 그 같은 dLGN에 프로젝트, 작은을 포함, (그림 4) 표시된다 아버 RGCs (그림 4C)와 ON-OFF-DSGCs (그림 4 층). RGC 이상의 종류가 주머니에 바이러스를 전송하지만, 같은 다른보고 (Beier 외., 리뷰), 여기에 우리는 초점을주머니에 ON-OFF-DSGCs의 잘 공부 연결에.
(-) 우리는 유전자형 cTVA (+) / 채팅 - Cre의 쥐를 삽입 할 때 더 TVA는 표현되지 않을 것입니다, 단지 RGCs는 (즉, 그림 4) 표시됩니다. 다음은 RGCs으로 RABV-G pseudotyped 바이러스의 초기 이해로 인해이며, 더 확산이 발생하지 않습니다. 더 RGCs은 이러한 RGCs의 횡 방향의 긴 axons에 이러한 virions의 무능력으로 인해 rVSV의 LGN 감염 (A / RG) RABV-G와 pseudotyped하지 바이러스에서 감염되지 않습니다. 그러나, LGN에 cTVA (+) / ChATCre (+) (및 R26TdT (+)) 쥐를 주입 할 때 바이러스 확산은 Cre 기자 (즉, 그림 5)을 표현하는 빨간색 셀에 발생 않습니다. 이러한 반 채팅 항체와도 세포 공동 레이블 및 주머니 (인물 5B ', C')로 자신의 신원을 확인,이 두 채팅 laminae 만 계 충화하다. DSGC 당 급속도로 이루어질 분류 주머니의 수는 하나에서 아홉 나와 있습니다.

그림 1. 처음 개발 된 방법에 비해 우리의 역행 transsynaptic 추적 시스템. (A)은 (i) Wickersham 및 동료에 의해 개발 된 방법에서 "시작 셀은"세가지 유전자 transfected 있습니다 : TVA 수용체, transfected 세포의 특정 감염을 허용하는 데 사용, RABV를 보완하는 데 사용되는 RABV-G,, 그 자체가 G 유전자가 삭제했다, 그리고 transfected 세포를 식별 할 수있는 적색 형광 단백질. (ii) 해당 A / RG 단백질과 pseudotyped RABV 그들 노란색 만드는 TVA - 표현 세포를 감염. (III) 퇴행성 transsynaptic 전송 상류 뉴런에 발생합니다. (B)은 (i) 우리의 방법에서, TVA - 표현 세포는 유전자 정의하고 있으며, 조건부 붉은 형광 prote으로 분류됩니다인치 (II) "시작 셀"은 그 바이러스 게놈에있는 A / RG 유전자를 인코딩 VSV에 감염되어 있습니다. 이 시작 셀은 TVA 수용체를 표현하지 않습니다. 이러한 세포는 초보자 뉴런에 신경 입력을 제공하는 경우에만 (III) 퇴행성 transsynaptic 전송 TVA - 표현 뉴런에 발생합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
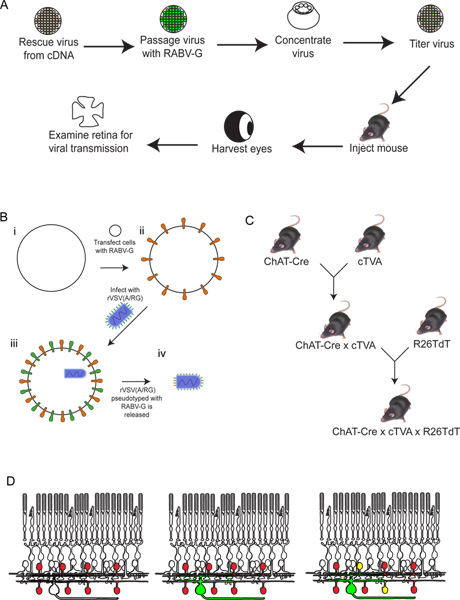
그림 2. 실험 절차의 도식. (A) 첫째, 바이러스 cDNA에서 구출되어 있습니다. 그런 다음 passaged와 RABV-G와 pseudotyped하고, 집중하고 titered 있습니다. 이 시간의 원하는 기간 동안 배양 할 수있는 곳이 바이러스는 다음 뇌에 주입되어 있습니다. 금후시간, 눈은 수확하고, 망막은 해부하고 분석합니다. RABV-G와 바이러스를 pseudotyping의 (B) 도식. 이 뇌 주사의 망막 신경절 세포의 감염 필요합니다. RABV-G 유전자가 처음 TVA 수용체를 표현하는 조직 문화 셀에 transfected 수 있습니다. 이러한 세포는 다음 rVSV (A / RG) 바이러스에 감염되어 있습니다. 출시 virions는 바이러스 봉투에 RABV-G가되지만 바이러스 게놈에 RABV-G에 대한 유전자가 없습니다. (C) 마우스의 개략도 트리플 유전자 변형 동물에 필요한 경계에 있습니다. 조건부 TVA와 tdTomato 대립 유전자는 TVA와 tdTomato 모두 만 Cre 표현의 역사를 세포로 표현하는 등 선택의 Cre 드라이버에 교차하고 있습니다. 이 예제에서, 우리는 채팅 - Cre를 사용했습니다. (D) 순으로 망막 감염의 개략도 DSGC-SAC 회로를 추적합니다. (C)와 같이 채팅 세포는 명시 적 TVA와 tdTomato에 만들어집니다. RGCs는의 LGN에서 감염바이러스의 fection은 (B)에서 생산. 바이러스가 GFP를 표현으로,이 RGCs는 녹색이됩니다. 바이러스는 만 확산 될 TVA - 표현들이 표시 RGC에 연결되어있는 경우 채팅 amacrine 세포를. 이러한 세포는 빨간색과 녹색, 또는 노란색 모두 될 것이다. 큰 그림을 보려면 여기를 클릭하십시오 .
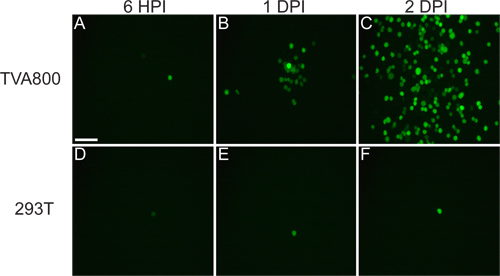
그림 3. 293T와 TVA800 세포에 rVSV (A / RG) 바이러스의 행동. 이러한 세포는 RABV-G와 pseudotyped 낮은 titer rVSV (A / RG)에 감염되었습니다. 사이의 바이러스 확산 TVA-표현 6시간 게시물 감염 (HPI), 1, 2 일 후 감염 (DPI)에 도시 된 바와 같이, 시간에 따라 셀을. 그러나, TVA 수용체를 표현하지 않는 293T 세포에 확산,하지만 전t이 발생, 많은 느린 발생합니다. 스케일 바 = 100 μm.
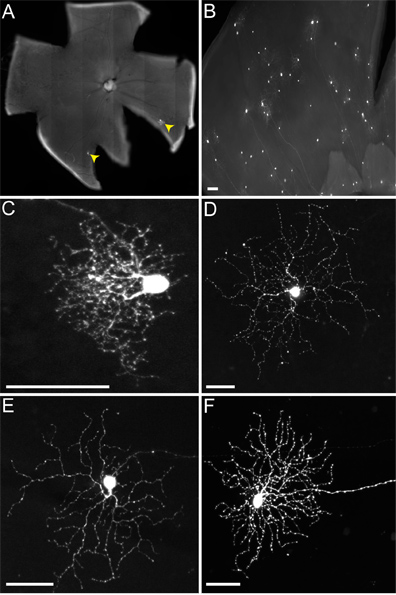
그림 4. 비 TVA 표현 마우스 RGCs 대표 감염. 동물 RABV-G와 pseudotyped rVSV (A / RG) 바이러스에 LGN에 주입하고, 조직은 2 개의 DPI를 수확했다. (A) 스파 스 (RGCs는 노란색 화살촉으로 표시) 또는 (B) 조밀 감염은 주입 바이러스 및 품질 titer에 따라 얻을 수 있습니다. RGCs의 많은 다른 유형은 (C) 작은 아버 RGCs, (D)에 1을 입력합니다 melanopsin의 RGCs, (E) ON-DSGCs, 다른 중 (F) ON-OFF-DSGCs 등의 형태를 기반으로 식별 할 수 있습니다. 스케일 바 = 50 μm.

그림 5. rVSV (A / RG) 주머니에 ON-OFF-DSGCs에서 전송 예상 패턴을 따른다. (A) ON-OFF-DSGCs 여러 주머니 (노랑 화살촉)에 전송 바이러스 (녹색 작성 흰색과 화살촉). (A '). 모든 녹색는 TVA-표현 주머니 것을 나타내는 Cre 기자와 공동 레이블 DSGC하지 않습니다 세포. (BC) DSGC (녹색 채우기 흰색과 화살촉)와 주머니는 (노란색 화살촉) 망막 내부 plexiform 계층 (IPL)의 적절한 채팅 레이어에 계 충화하다. 바이러스 송신 모두 ON과 OFF-주머니를 포함하는 세포. 패널 B '와 C'의 번호는 IPL laminae을 나타냅니다. DSGC의 소마의 위치는 화살촉으로 표시하지만 주머니를 강조하기 위해 패널 C에 표시되지 않습니다. 스케일 바 = 50 μm.
토론
신경 회로를 공부하고 바이러스를 사용하면 연결된 뉴런을 분석의 상대적으로 높은 처리량 방법입니다. 그러나, VSV 및 RABV의 virions 모두를 생성하는 것은 사소한되지 않습니다. cDNA에서 바이러스를 구해준 것에 대해 위에 나열된 프로토콜이 제공되고 있지만, 아직 낮은 확률 이벤트입니다. N, P 및 L의 plasmids 각각의 수준은 잘게 조정해야하고, 많은 시련과 복제는 바이러스 구조를 보장하기 위해 ?...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는 재조합 VSV 변종을 구출에 도움 션 Whelan을 인정하고, 기술 지원 Didem Goz와 라이언 Chrenek 것입니다. 이 작품은 HHMI (CLC)에서 지원하고, # NS068012-01 (KTB)되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Tissue Culture | |||
| Baby Hamster Kidney (BSRT7) cells | available upon request | ||
| vaccinia (vTF7-3) | available upon request | ||
| pN, pP, pl plasmids | available upon request | ||
| Calcium Chloride | Sigma | C1016 | |
| Magnesium Chloride | Sigma | M8266 | |
| HEK 293T cells | Open Biosystems | HCL4517 | |
| 60 mm TC-Treated Culture Dish | Corning | 430166 | |
| 75 cm2 Rectangular Canted Neck Cell Culture Flask with Vent Cap | Corning | 430641 | |
| Media : DMEM (Dulbecco's Modified Eagle Medium) | Invitrogen | 12491-015 | |
| 1 M HEPES pH 7.4 | Gibo | 15630-080 | |
| FBS: Fetal Bovine Serum | Gibco | 10437-028 | |
| PKS | Invitrogen | 15140-163 | |
| Lipofectamine 2,000 Transfection Reagent | Invitrogen | 11668-019 | |
| Syringe: 5 ml Luer-Lock syringe | Sigma | Z248010-1PAK | |
| Syringe Filters | Nalgene | 190-2520 | |
| PEI: High Potency Linear PEI | Polysciences | 23966 | |
| Viral Centrifugation | |||
| Corning 150 ml Tube Top Vacuum Filter System, 0.45 μm Pore | Corning | 430314 | |
| Thinwall, Ultra-Clear, 38.5 ml, 25 x 89 mm ultracentrifuge tubes | Beckman-Coulter | 344058 | |
| Ultracentrifuge | Beckman-Coulter | optima XL-80K | |
| SW28 Ultracentrifuge rotor | Beckman-Coulter | 342207 | |
| Mouse Injection | |||
| Capillary micropipets | Drummond | 5-000-2005 | |
| Stereotax | Narishige | SR-5M | |
| Micromanipulator | Narishige | SM-15 | |
| Ump injector | World Precision Instruments | Sys-Micro4 | |
| Four channel microcontroller | World Precision Instruments | UMP3 | |
| M.TXB Bench Motor with C.EMX-1 Dial Control, 115 Volt | Foredom | M.TXB-EM | |
| H.10 Handpiece, Quick Change | Foredom | H.10 | |
| Step Drill, 0.5 mm | Foredom | A-58005P | |
| Micr–lectrode holder | World Precision Instruments | MEH2S | |
| Ketamine | Henry Schein | 995-2949 | |
| Xylazine | Henry Schein | 4015809TV | |
| Buprenorphine | Henry Schein | 1118217 | |
| 1 ml syringe | Becton-Dickinson | 309628 | |
| 30 gauge injection needle | Becton-Dickinson | 305106 | |
| Protective Ophthalmic Ointment | Doctors Foster and Smith | 9N-014748 | |
| Ethanol | Sigma | 493511 | |
| Iodine | Sigma | PVP1 | |
| Surgery and Dissection tools | |||
| Scissors | Fine Science Tools | 91402-12 | |
| Standard Forceps | Fine Science Tools | 11000-12 | |
| Fine Forceps | Fine Science Tools | 11255-20 | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10015-00 | |
| Sutures | Robbins Instruments | 20.SK640 | |
| Dissection and antibody staining | |||
| paraformaldehyde | Sigma | P6148 | |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Triton X-100 | Sigma | T9284 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| Antibodies | |||
| Antibodies | millipore | AB144P | |
| Anti-gfp | Abcam | ab13970 | |
| Donkey anti-chicken Dylight 488 | Jackson immunoresearch | 703-545-155 | |
| Donkey anti-chicken Alexa Fluor 647 | Jackson immunoresearch | 705-605-147 | |
| DAPI | Invitrogen | D1306 | |
| Tissue mounting | |||
| Superfrost plus microscope slides | Fisher | 12-550-100 | |
| Cover glass 22 x 22, 0 thickness | Electron Microscopy Sciences | 72198-10 | |
| Silicone elastomer | Rogers Corp | HT-6220 | |
| Clear nail polish | Electron Microscopy Sciences | 72180 | |
| Prolong Gold antifade reagent | Invitrogen | P36930 | |
| |||
참고문헌
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Marshel, J. H., Mori, T., Nielsen, K. J., Callaway, E. M. Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron. 67, 562-574 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. U.S.A. 107, 21848-21853 (2010).
- Wickersham, I. R. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53, 639-647 (2007).
- Yonehara, K. Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature. 469, 407-410 (2011).
- Stepien, A. E., Tripodi, M., Arber, S. Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron. 68, 456-472 (2010).
- Beier, K. T., Samson, M. E. S., Matsuda, T., Cepko, C. L. Conditional expression of the TVA receptor allows clonal analysis of descendents from Cre-expressing progenitor cells. Dev. Biol. 353, 309-320 (2011).
- Seidler, B. A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors. Proc. Natl. Acad. Sci. U.S.A. 105, 10137-10142 (2008).
- Beier, K. T. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors. Proc. Natl. Acad. Sci. U.S.A. 108, 15414-15419 (2011).
- Whelan, S. P., Ball, L. A., Barr, J. N., Wertz, G. T. Efficient recovery of infectious vesicular stomatitis virus entirely from cDNA clones. Proc. Natl. Acad. Sci. U.S.A. 92, 8388-8392 (1995).
- Fuerst, T. R., Niles, E. G., Studier, F. W., Moss, B. Eukaryotic Transient-Expression System Based on Recombinant Vaccinia Virus That Synthesizes Bacteriophage T7 RNA Polymerase. PNAS. 83, 8122-8126 (1986).
- Young, J. A., Bates, P., Varmus, H. E. Isolation of a chicken gene that confers susceptibility to infection by subgroup A avian leukosis and sarcoma viruses. J. Virol. 67, 1811-1816 (1993).
- Madisen, L. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13, 133-140 (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
- van den Pol, A. N. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression. J. Comp. Neurol. 516, 456-481 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유