A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
على الموصل العصبي العضلي: قياس المشبك الحجم، التغييرات تجزئة ومتشابك الكثافة البروتين عن طريق متحد البؤر مضان المجهر
In This Article
Summary
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Abstract
الوصل العصبي العضلي (NMJ) هو كبير، والتتابع الكوليني المشبك من خلالها الخلايا العصبية الحركية الثدييات تتحكم تقلص العضلات الطوعية. التغييرات الهيكلية في NMJ يمكن أن يؤدي إلى فشل العصبي، مما يؤدي إلى ضعف، وضمور وحتى الموت من الألياف العضلية. حققت العديد من الدراسات كيف تعديلات وراثية أو أمراض يمكن أن يغير هيكل NMJ الماوس. لسوء الحظ، يمكن أن يكون من الصعب مقارنة النتائج مباشرة من هذه الدراسات لأنها غالبا ما تستخدم معايير مختلفة وأساليب التحليلية. وصفت ثلاثة بروتوكولات هنا. أول يستخدم أقصى الإسقاط كثافة الصور مبائر لقياس مجال أستيل مستقبلات (الاستشاري لحقوق الإنسان) الغنية المجالات الغشاء بعد المشبكي في endplate ومنطقة متشابك حويصلة تلطيخ في المغطي الأعصاب الطرفية قبل المشبكي. بروتوكول الثاني يقارن كثافة نسبية للالمناعية للبروتينات متشابك في الغشاء بعد المشبكي. العلاقات العامة الثالثةotocol يستخدم نقل الإسفار الرنين الطاقة (الحنق) للكشف عن تغيرات في التعبئة من مركز عمان بعد المشبكي في endplate. وقد تم تطوير البروتوكولات وصقلها خلال سلسلة من الدراسات. وتناقش العوامل التي تؤثر على جودة واتساق النتائج ويتم توفير البيانات المعيارية للل NMJs في صحية الفئران الشباب البالغين.
Introduction
الوصل العصبي العضلي (NMJ) هو المشبك تتابع الأهمية بمكان أن يتوسط التواصل بين الجهاز العصبي والعضلات والهيكل العظمي. هو مطلوب منها لجميع الحركات الإرادية. منذ فترة طويلة تستخدم مضان المجهر لدراسة آثار الجينات المحورة على الماوس NMJ 1-3 أو لمقارنة آثار السن، والنظام الغذائي وممارسة الرياضة والمرض على لل NMJs القوارض 4-11. لقد علمتنا هذه الدراسات لنا الكثير عن علم وظائف الأعضاء والفيزيولوجيا المرضية من NMJ، ولكن ذكرت المعلمات المتنوعة (على سبيل المثال، منطقة الاستشاري لحقوق الإنسان، منطقة endplate، وطول محيط، مؤشرات تجزئة) غالبا ما تجعل من الصعب مقارنة النتائج التي توصلت إليها هذه الدراسات. وهناك توقعات متزايدة للباحثين ما قبل السريرية لتكون قادرة على إثبات استنساخ، لا سيما في الدراسات مع نماذج القوارض من المرض 12. تم تنقيح البروتوكولات المذكورة هنا من خلال سلسلة من الدراسات التي حققت الفصل التنموي، الفسيولوجية والمرضية في جسم المريضفي نفس الفئة إلى NMJ. وتتطلب مثل هذه الدراسات قياس مجال التخصصات متشابك في endplate الماوس السيارات والكثافة النسبية من التعبئة والتغليف من البروتينات متشابك ضمن التخصصات بعد المشبكي 13-15.
وتتجلى فائدة هذه الأساليب التي كتبها الدراسات الحديثة في نموذج الفأر المضادة للالمسك الوهن العضلي الوبيل. حقن يومية من مفتش من الوهن العضلي مكافحة المسك إيجابية الوهن تسبب المرضى إلى فئران بالغة لهم أن يصبحوا ضعيفة في حدود 2 أسابيع 16. وكشفت الصور الأقصى الإسقاط مبائر من أقسام العضلات التي وصفت نقرا مزدوجا لsynaptophysin (في النهايات العصبية) ومركز عمان بعد المشبكي في الانخفاض التدريجي في مجال الاستشاري لحقوق الإنسان تلطيخ كما تغير الابتدائي. كان الأهم معدل الانخفاض كافية لشرح انخفاضات مماثلة في السعة من إمكانات متشابك، فشل انتقال متشابك وضعف العضلات 17،18. نوعيا تم الإبلاغ عن نتائج مماثلة من قبل مجموعات بحثية أخرى10،19. ومنذ ذلك الحين تم استخدام طرق القياس NMJ نفسها لتقييم تأثير ثلاثة عقاقير لعلاج مضاد للالمسك الوهن العضلي الوبيل في هذا النموذج الماوس 20،21.
الشيخوخة المستقرة يمكن أن يؤدي إلى فقدان الاتصالات العصبية والعضلية. وقد كشفت البروتوكولات الموصوفة هنا تراجع المرتبط بالعمر في مجال الأعصاب الطرفية synaptophysin في endplates السيارات مع تقدم الفئران في سن الشيخوخة. كشفت الأساليب نفسها التي يمكن أن يمنع ممارسة الطوعية إلى حد كبير في الحد من العصبية قبل المشبكي منطقة محطة 22، بما يتفق مع الأعمال السابقة من قبل مجموعات أخرى 4. فقدان اتصالات العصبية والعضلية يحدث أيضا في نموذج SOD1G93A الماوس من التصلب الجانبي الضموري 9،23.
وتظهر الدراسات المذكورة أعلاه أن مجموعة متنوعة من الظروف الصحية قد يؤدي إلى تخفيضات في مجال التخصصات إما قبل أو بعد متشابك في NMJ. هذا قد يؤدي إلى متعة متشابك ضعفction أو قد تبشر خسارة كاملة للاتصال العصبي العضلي. ووصف ثلاثة بروتوكولات الكميات التي تسمح للمنطقة وكثافة التخصصات متشابك. الغرض من البروتوكول الأول هو توفير قدر عملي وقابلة للتكرار للمناطق قبل والتخصصات ما بعد متشابك واتساقها في لل NMJs الثدييات، وذلك باستخدام المجهر مضان. يستخدم ثنائي الأبعاد القصوى الصور الإسقاط متحد البؤر وتحليل الصور مع المعاهد الوطنية للصحة يماغيج للكشف عن تغيرات في مجال synaptophysin تلطيخ (الحويصلات متشابك)، مركز عمان بعد المشبكي ومنطقة تداخل متشابك. هي الأمثل المعلمات مبائر التصوير (الربح وتعويض المستوى) لكل NMJ وذلك لتحقيق أقصى قدر من المعلومات البصرية تستخدم لتمييز مجال التخصص متشابك. يمكن فشل العصبي العضلي أيضا نتيجة من التغيرات في كثافة الاستشاري لحقوق الإنسان بعد المشبكي و / أو البروتينات متشابك الأخرى. ويمكن تطبيق البروتوكول الثاني للكشف عن تغيرات في الكثافة النسبية للبروتينات بعد المشبكي هذهكما المسك، rapsyn، dystroglycan، فسفرته SRC كيناز وفسفرته الاستشاري لحقوق الإنسان 18،21.
في الوهن العضلي الوبيل، كثافة انخفاض الاستشاري لحقوق الإنسان داخل الغشاء بعد المشبكي هي السبب المباشر لفشل متشابك وضعف العضلات. ويصف البروتوكول الثالث طريقة نقل الإسفار الرنين الطاقة (الحنق) لتقييم التغيرات في المناطق القريبة من مركز عمان المجاورة داخل الأغشية بعد المشبكي 14،15. هذه الطريقة بالكشف عن نقل الطاقة بين مركز عمان المجاورة المسمى مع فلوري-α-بنغاروتوكسين (BGT). الحنق يحدث فقط عندما يكون تحقيقات الفلورسنت المانحة ومتقبل أقل من 10 نانومتر إربا. هذا يمكن أن تكشف (دون المجهرية) التغيرات في ضيق من التعبئة الاستشاري لحقوق الإنسان التي قد تتصل مباشرة إلى السعة من إمكانات متشابك.
هذه البروتوكولات الثلاثة، والمكرر على مدى العقد الماضي، توفر تدابير تكميلية النزاهة NMJ بطريقة متسقة وقابلة للتكرار. استخدام بروتوكولات موحدة ليجب المعلمات ND تسهيل المقارنة بين تأثيرات الجينات والتدخلات البيئية على NMJ الثدييات.
Protocol
ملاحظة: التصميم والتنفيذ والإبلاغ من التجارب على الحيوانات يجب أن تأخذ في الاعتبار المبادئ التوجيهية الحالية 24. يجب الموافقة على مثل هذا العمل مقدما من قبل السلطة الرفق بالحيوان المحلية (في حالتنا لجنة الأخلاقيات الحيوان في جامعة سيدني).
1. القتل الرحيم للحيوان وتشريح العضلات
- نقل الماوس من غرفة الاحتجاز إلى غرفة منفصلة حيث الموت الرحيم مع حقنة داخل الصفاق من حل بنتوباربيتون (30 ملغ / كلغ) باستخدام طريقة التعامل مع الماوس مفصل من قبل شيميزو 25. ضع الماوس مرة أخرى في قفصه.
- وبمجرد أن توقف التنفس من الفأرة لأكثر من 1 دقيقة، واختبار رد الفعل القدم الانسحاب عن طريق معسر بلطف القدم، ومنعكس القرنية عن طريق تنظيف الأسنان بالفرشاة برفق القرنية. فقط عندما الردود رد الفعل غائبة يمكن إعداد الماوس للتشريح.
- استشارة أطلس التشريح القوارض مثل جاسون 26 و / أو السعي للحصول على مساعدة من بتجاربالتشريح دائرة الهندسة المدنية قبل محاولة تشريح العضلات من الفائدة. في كل حالة إزالة الشعر من الجلد المغطي باستخدام ماكينة حلاقة كهربائية صغيرة قبل فتح الجلد لفضح العضلات.
ملاحظة: إن تشريح تختلف عن كل العضلات تشريحيا-متميزة. - باستخدام ملقط حادة تحرير العضلات من المغطي الأغشية والأنسجة المحيطة بها. فهم وقطع وتر البعيدة لفصل العضلات من الإدراج لها.
- ندف بلطف وقص عضلة خالية من الأنسجة المحيطة الحق في العودة إلى أصله. وضع لفترة وجيزة عضلة تشريح حديثا إلى 0.1 M الفوسفات مخزنة المالحة (PBS) حل أو حلول رينغر قبل مزيد من المعالجة.
2. إعداد العضلات لCryosectioning
ملاحظة: الحفاظ الهيكلي الأمثل يمكن تحقيقه عن طريق نضح الحيوان كله كما هو مفصل في وقت سابق 27، أو تثبيت الغمر (للعضلات الصغيرة) كما هو موضح في الخطوة اختيارية 2.1. ومع ذلك،4٪ بارافورمالدهيد التثبيت يمكن أن يضعف تلطيخ لاحقة مع العديد من الأجسام المضادة وتحقيقات مع فلوري-BGT. غلوتارالدهيد بشكل خاص يجب تجنبها. إذا لم تكن لتكون ثابتة العضلات التي يجب على الفور المفاجئة المجمدة (المضي قدما إلى 2.3).
- اختياري الغمر التثبيت: دبوس العضلات لالشمع في طبق بيتري في طول يستريح. تغطية العضلات مع 2٪ ث / ت امتصاص العرق (المنحل حديثا في PBS) لمدة 2 ساعة على RT. يغسل مع 3 تغييرات PBS أكثر من 30 دقيقة (3 × 10 دقيقة) ثم استبدال برنامج تلفزيوني مع 30٪ ث / ت السكروز في برنامج تلفزيوني واحتضان O / N عند 4 درجات مئوية.
- جعل قوالب ('قوارب') في وقت مبكر عن طريق للطي 2 سم × 1.5 سم قطعة من رقائق الألومنيوم كما هو مبين في الشكل (1). ضع قطعة من غشاء النيتروسليلوز في الجزء السفلي من القارب. صب بلطف ناظم البرد تضمين المصفوفة (الجدول المواد) في قارب إلى عمق 2 مم، مع الحرص على تجنب فقاعات الهواء. وضع العضلات في القارب، تماشيه مع خطوط القلم الكرة نقطة علىالنيتروسليلوز. إضافة المزيد من مصفوفة التضمين وذلك لتغطية تماما العضلات (الشكل 1).
- أنابيب البولي بروبلين قبل التسمية مع علامة لا تمحى. وضع قطرة من الماء في كل أنبوب وبردت أنبوب في النيتروجين السائل.
ملاحظة: يحتفظ قطرة الماء المجمدة ضغط البخار ويمنع جفاف خلال فترات طويلة -80 ° C التخزين - باستخدام درع الوجه، وقفازات واقية سميكة وزوج كبير من الملقط حادة، وانخفاض جزئيا كوب معدني صغير (3 سم القطر، 8 سم العميق) التي تحتوي على 2 سم عمق isopentane في وعاء من النيتروجين السائل لمدة 30 ثانية. إزالة كوب ووضعه على رأس مقاعد البدلاء. باستخدام زوج أصغر من الملقط حادة وضع القالب الذي يحتوي على العضلات وتضمينها مصفوفة في isopentane المبردة. الحرص على تجنب خلط النيتروجين السائل مع isopentane.
- سماح 2 دقيقة لكتلة لتجميد تماما قبل استخدام الملقط حادة لرفع كتلة المجمدة خارج وختم ذلك في العلاقات العامة الصحيحةالمسمى الإلكترونية وأنبوب قبل المبردة (الخطوة 2.3).
- تخزين أنابيب مؤقتا في النيتروجين السائل قبل نقلها إلى -80 ° C. تسجيل جميع العينات في جدول المحتويات الفريزر.
3. Cryosectioning والإسفار تلطيخ للأون الوجه صور لل NMJs
- قشر بعيدا قالب الألومنيوم. ضمن -20 درجة مئوية غرفة ناظم البرد إرفاق كتلة المجمدة إلى تشاك ناظم البرد وذلك لخفض 20 ميكرون cryosections موازية للمحور طويل من الألياف العضلية (الشكل 1). التقاط المقاطع على بولي-L-يسين أو الجيلاتين المغلفة شرائح المجهر.
- ملاحظة: حذفت هذه الخطوة إذا تم إصلاح الأنسجة قبل تجميدها. بعد السماح 30 دقيقة للأقسام لتجف على الشرائح، واصلاحها عن طريق وضع قطرة من بارافورمالدهيد 2٪ في برنامج تلفزيوني على كل قسم لمدة 15 دقيقة في RT.
- غسل الشرائح 3 × 10 دقيقة في برنامج تلفزيوني في جرة Coplin، ومن ثم تزج الشرائح في برنامج تلفزيوني يحتوي على 0.1 M جليكاين لمدة 30 دقيقة لمنع مجموعات ألدهيد المتبقية.
- تغسل الشرائح لمدة 10 دقيقة في برنامج تلفزيوني، ثم تزج في الميثانول (المبردة إلى -20 درجة مئوية) لمدة 7 دقائق. هذه الخطوة permeabilization هي جزءا روتينيا من وضع العلامات مزدوج مع فلوري-BGT ومكافحة synaptophysin لكنها قد تؤثر سلبا المناعية لبعض البروتينات الأخرى.
- غسل الشرائح 2 × 10 دقيقة في برنامج تلفزيوني ثم وضع كل شريحة في غرفة ترطيب مستقرة وجهها. تغطية كل قسم مع 20 ميكرولتر من عرقلة الحل فورا (0.2٪ تريتون X-100، 2٪ ألبومين المصل البقري (BSA) في PBS) لمدة 1 ساعة على RT. يجب عدم السماح للأقسام لتجف في أي مرحلة من مراحل العملية المناعية.
- تنفيذ الحضانة الأولية: أخذ شريحة واحدة في وقت وإزالة بعناية عرقلة الحل الزائد من أكثر من كل قسم واستبدالها مع 20 ميكرولتر من أرنب مكافحة synaptophysin (المخفف 1: 200 في عرقلة الحل).
- تشمل شريحة السيطرة السلبية التي سيتم المحتضنة مع عرقلة الحل فقط. هذا 'لا الأولية السيطرة الأجسام المضادة"أمر ضروري في كل شوط المناعية.
- مع الحرص على أن يبقى الأجسام المضادة الأولية في مكان وعلى كل قسم، إغلاق غرفة ترطيب واحتضان لمدة 1-2 أيام عند 4 درجة مئوية.
- تفقد كل قسم للتأكد من أن الأجسام المضادة الأولية لا تزال في مكانها. استخدام ماصة باستور لشطف بلطف كل شريحة مع برنامج تلفزيوني ووضعه في وعاء Coplin. غسل كافة الشرائح 3 × 10 دقيقة في برنامج تلفزيوني.
- تنفيذ حضانة الثانوية. أخذ شريحة واحدة في وقت واحد، وإزالة بعناية PBS الزائدة، وضعه في غرفة ترطيب وتغطية كل قسم مع 20 ميكرولتر من مزيج يحتوي على FITC مترافق مفتش حمار المضادة للأرنب وBGT مترافق إلى ميثيل رودامين أو fluorophor أحمر آخر (TRITC- / redBGT (5)؛ ز / مل) مخففة في عرقلة الحل. في احتضان RT لمدة 2 ساعة.
- غسل الشرائح 3 × 10 دقيقة في برنامج تلفزيوني في الجرار Coplin.
- أخذ شريحة واحدة في وقت واحد، وإزالة بعناية PBS الزائدة وجبل مع ساترة باستخدام حجم الحد الأدنى من، glyceroالقائم لتر، وتصاعد المتوسطة مقاومة تتلاشى. ختم حواف لل coverslips واضح مع طلاء الأظافر. اتركه حتى يجف الثابت.
- تخزين الشرائح في الظلام في 4 درجة مئوية لمدة تصل إلى أسبوع واحد، أو في -20 درجة مئوية لفترات أطول تخزين (تصل إلى عدة أشهر).
4. متحيز أخذ العينات والتصوير أون وجه موتور Endplates
- أعمى الشرائح التي وصفها كل شريحة مع قانون رقم العشوائية التي لا تزال معروفة فقط لباحث الثاني (لم يشارك في التحليل). ونتيجة لذلك يبقى المشغل أعمى لمجموعات العلاج حتى الكميات من المعلمات NMJ كاملة لجميع العينات.
- ضع الشريحة على المسرح المجهر ومشاهدته تحت إضاءة حقل واسع مع مجموعة مرشح TRITC (63X النفط 1.3 الهدف NA). الانتقال تدريجيا (حقل من الحقول) من اليسار إلى اليمين ومرة أخرى حتى تظهر endplate في الميدان (الشكل 2A).
ملاحظة: أخذ العينات المعيار: كل هيكل الاستشاري لحقوق الإنسان الملون والذي هو نسبياشقة ويواجه الهدف (أي، ويمتد <15 م في ض البعد) يعتبر endplate وتصويرها للتحليل (أهلة الاستشاري لحقوق الإنسان تلطيخ تمثل المقاطع العرضية من خلال endplates وبالتالي مستبعد). - مع مجموعة الثقب مبائر إلى 1.0 وحدة إيري وانخفاض قوة الليزر تحسين الربح وتعويض مستويات لTRITC / أحمر-BGT (532 نانومتر ليزر) في endplate التي سيتم تصويرها. الأمثل المقبل FITC / مضان synaptophysin باستخدام الليزر 488 نانومتر. جمع ض المكدس من endplate مع فاصل زمني 0.7 ميكرون بين كل شريحة البصرية. حفظ الصور مع اسم ملف يتضمن تاريخ الدورة والتصوير، والاسم الرمزي من الشريحة وعدد من endplate.
ملاحظة: المسح الضوئي باستخدام نانومتر 488 و 532 نانومتر ليزر (FITC وTRITC) ينبغي جمع بالتسلسل (وليس في وقت واحد) لتجنب تلوث القناة FITC من قبل مضان من fluorophore الأحمر والعكس بالعكس (ينزف من خلال). - تكرار أخذ العينات لالثانية تصوير الخطوات التي تم جمعها 4،2-4،3 حتى 20 endplates من الشريحة / عينة.
- تغيير إلى الشريحة مشفرة المقبلة وكرر 4،2-4،4. كرر ذلك لكل من الشرائح مشفرة.
- جمع بعض الصور من endplates من الشريحة التحكم (لا الأولية السيطرة الضد) باستخدام إعدادات متحد البؤر التي تم العثور عليها الأمثل لالشرائح التجريبية (يجب أن تظهر القناة مضان FITC غامق).
- في نهاية نقل جلسة متحد البؤر ملفات الصور إلى جهاز كمبيوتر آخر وعمل نسخة احتياطية من الملفات الأصلية على محرك أقراص خارجي أو الخادم.
5. قياس مساحة متشابك التخصصات في الوجه أون صور
- استخدام NIH يماغيج مجانية (http://imagej.nih.gov/ij/) لإعداد الأقصى الإسقاط (MIP) وصور من كل ض المكدس. حفظها كملفات شجار (الشكل 2A & B). وينبغي أن تتضمن أسماء من تاريخ الجلسة صورة، نموذج التعليمات البرمجية، عدد endplate وقناة الفلورسنت (على سبيل المثال، 060414_5723_7_FITC.tiff).
- فتح الصورة ض الإسقاط في يماغيج. حدد أستيل مستقبلات صورة قناة (الشكل 3A) وحدد: صورة> اكتب> 8 بت لتحويل 24 بت RGB صورة ملونة إلى ثلاثة الصور الرمادية 8 بت على الشاشة.
- باستخدام أداة المضلع يماغيج رسم الخطوط العريضة الخام حول endplate من الاهتمام في redBGT الملون (ACHR) القناة بحيث تشمل جميع المناطق الملون واضحة من endplate فرد معين، في حين استبعاد أي تلطيخ التي لا تنشأ من endplate الفائدة ( الشكل 3C).
- تطبيق عتبة كثافة الحد الأدنى للصورة عن طريق اختيار: صورة> ضبط> العتبة (الشكل 3E والصور يماغيج المرتبطة بها).
- ضبط مستوى عتبة وذلك لعزل أجزاء الاستشاري لحقوق الإنسان الملون مع استبعاد المحيطة إشارة الخلفية كما عتبة الفرعية (الشكل 3E). فتح الرياح الثانيآه مع النسخة الأصلية (مستمر لهجة) صورة مباشرة بجوار نافذة للمقارنة، لتسهيل قرار حول قيمة العتبة. تسجيل قيمة العتبة لاستخدامها لاحقا في colocalization يحلل.
- الإبقاء على مخطط المضلع حول endplate تحديد: تحليل> تحليل الجزيئات. في القائمة المنبثقة تحديد مجموعة من الأحجام على النحو التالي: 50 إلى ما لا نهاية بكسل (وهذا يزيل القطع الأثرية الصغيرة الناجمة عن الضجيج الكهربائي في مضخم).
- تحليل الجسيمات الأمر بإنشاء نافذة مع قائمة المناطق فوق عتبة منفصلة وقيمهم كثافة مضان مرقمة كما تظهر في الصورة الثنائية (الشكل 3G وما يرتبط بها من يماغيج الصورة). نسخ هذه البيانات في جدول بيانات المسمى.
- قياس المساحة الإجمالية endplate (منطقة داخل المضلع) عن طريق اختيار: تحليل> قياس. هذا ينتج منطقة endplate الإجمالية. نسخ ولصق البيانات للمناطق الاستشاري لحقوق الإنسان وشدة فيجدول بيانات مع التأكد من تسمية الأعمدة بشكل مناسب، سيتم استخدام الصفوف لendplates الفردية للشرائح محددة.
- التبديل إلى قناة مضان مكافحة synaptophysin وكرر الخطوات من 5،1-5،5، ولكن لقناة FITC (الشكل 3B، D و F). والهدف من ذلك هو لضبط عتبة بحيث يخلق صورة ثنائية، قدر الإمكان، يتطابق مع حدود تلطيخ كما يراها العين. تسجيل قيمة العتبة.
- قياس مجال التداخل من خلال تطبيق الخطوات التالية: افتح الملف الأصلي تحتوي على اثنين من الصور قناة وتقسيمه إلى صورتين منفصلتين عن طريق اختيار: صورة> الأكوام> كومة من الصور.
- باستخدام البرنامج المساعد Colocalization (تحميلها وتثبيتها من صفحة ويب يماغيج) حدد: Pluggin> Colocalization وإدخال القيم عتبة سجلت سابقا للقنوات الاستشاري لحقوق الإنسان والعصبية في الاستعلام قناة منهما بثور. هذا وسوف تسفر صورة التداخل في بكسل البيضاء (الشكل 3H والصور يماغيج المرتبطة بها).
- تحويل الصورة التداخل التي أنشئت حديثا إلى تنسيق الرمادي وتطبيق الحد الأدنى لقيمة الحد الأقصى. فإن أقصى عتبة فقط تحديد بكسل البيضاء، والمقابلة لمنطقة تداخل اثنين من القنوات السابقة. سجل في جدول بيانات القيمة الناتجة من منطقة "colocalization"، الذي يمثل منطقة التداخل في بكسل.
- إعداد جدول وسائل عينة البيانات، وحساب ورسم الانحرافات المعيارية والأخطاء القياسية على النحو رسوم بيانية أو scatterplots 20،22. لاحظ أن قيمة ن يمثل عادة عدد من الفئران في كل مجموعة عينة لأغراض إحصائية.
- مؤامرة endplate المناطق الاستشاري لحقوق الإنسان كما scatterplots أو رسوم بيانية تردد لتحديد ما إذا كان يتم توزيع البيانات عادة قبل إجراء الاختبار الإحصائي (الشكل 6).
6. تلطيخ النسبيشدة مقارنة باستخدام المقاطع البصرية عرضية
ملاحظة: للحصول على هذه العملية بروتوكول جميع العينات العضلات معا وصورة في جلسة متحد البؤر واحدة. في التخطيط لتجربة السماح تصل الى 30 دقيقة وقت التصوير في عينة العضلات.
- قطع 15 ميكرون cryosections عرضية إلى المحور الطويل للألياف العضلات وجمع على الشرائح كما هو موضح في الخطوة 3.1.
- تنفيذ مضان تلطيخ كما هو موضح في الخطوات 3،2-3،13.
- كود الشرائح ملطخة حتى يتم تنفيذ ذلك التصوير والتحليلات مع المكفوفين مشغل لمجموعة العلاج، كما هو موضح في الخطوة 4.1.
- باستخدام الهدف مضان 40X (NA 0.75) مسح لفترة وجيزة على قسم من كل شريحة لتحديد مكسب واحد وتعويض إعداد مستوى لالاستشاري لحقوق الإنسان من شأنها أن تكون مناسبة لجميع endplates عبر كافة الشرائح العينة. ألمع endplate ثم ينبغي أن يكون أقل بقليل من 256 اللون الرمادي على نطاق واسع. وينبغي أن يتم هذا التحسين بشكل منفصل لfluorescenc الثانيةالخدمات الإلكترونية (التي تم جمعها على التوالي). تسجيل مكاسب الثابتة وتعويض إعدادات مستوى وليس تغييرها طوال الدورة التصوير.
- جمع الصور من شريحة القياسية مضان (على سبيل المثال، وعدم التبييض الخرز الفلورسنت)، وذلك باستخدام نفس المعلمات، في بداية ونهاية الدورة مبائر للكشف عن أي تقلب محتمل في كثافة الليزر.
- استخدام قناة الاستشاري لحقوق الإنسان لمسح الشريحة تدريجيا لتحديد موقع endplates.
- التركيز للعثور على الطائرة قسم البصرية واحدة في كل حقل المجهر الذي يحتوي على أكبر عدد من endplates الاستشاري لحقوق الإنسان الملون.
- مسح هذا القسم بصري واحد مرتين، وحفظ الصورة المتوسط (الشكل 4G).
- الحفاظ على نفس الطائرة التبديل البؤري لقناة مضان الثانية (بروتين من الفائدة) وجمع الصورة كما في الخطوة 6.8. حفظ ملف الصورة، بما في ذلك في اسم الملف: تاريخ جلسة التصوير، ونموذج التعليمات البرمجية، رقم الصورة ورمزا للدلالة على قناة الفلورسنت. الشكل 4A - F يظهر أمثلة على توزيع endplate من الاستشاري لحقوق الإنسان مقارنة rapsyn والمسك أو -dystroglycan (-DG).
- نقل مرحلة إلى الحقل التالي الذي يحتوي على واحد أو أكثر endplates وكرر الخطوة 6،8-6،9. كرر هذا حتى يتم تصوير ما مجموعه 60 endplates.
- في نهاية نقل دورة التصوير جميع الملفات على جهاز كمبيوتر آخر وعمل نسخ احتياطية منهم.
- فتح كل ملف الصورة الأصلية وأثناء عرض القناة الاستشاري لحقوق الإنسان، اختر: صورة> الأكوام> كومة من الصور، لتقسيم القنوات.
- اختر: صورة> نوع> من 8bit لتحويل إلى تنسيق الرمادي 8 بت على الشاشة. هل هذا لكلا القنوات مضان.
- اختر: صورة> الأكوام> الصور إلى المكدس. فتح كومة جديدة من اثنين من فصل سابقا صور 8-بت. يمكن للمرء ثم التبديل بسهولة بين القنوات مضان اثنين ضمن إطار واحد.
- استخدام أداة المضلع لرسم لينالبريد بإحكام حول حدود تلطيخ الاستشاري لحقوق الإنسان (الشكل 4I).
- اختر: تحليل> قياس لقياس متوسط كثافة بيكسل للالاستشاري لحقوق الإنسان داخل المنطقة المغلقة (لاحظ أهمية رسم خط بإحكام). نسخ هذه القيمة في جدول المسمى.
- الإبقاء على نفس الخطوط العريضة المضلع (لتحديد المنطقة المراد قياسها)، والتحول إلى القناة الثانية الفلورسنت (على سبيل المثال، الشكل 4B، D، F) وحدد: تحليل> التدبير. هذا وسوف تسفر عن متوسط كثافة تلطيخ للبروتين من الفائدة داخل منطقة متشابك حددها الاستشاري لحقوق الإنسان تلطيخ.
- اختيار المنطقة بعيدا عن مرئية endplate تلطيخ ثم حدد: تحليل> قياس لقياس متوسط كثافة مضان الخلفية. كرر هذا للآخرين قناة مضان / ث ونسخ القيم الأساسية في جدول البيانات من القيم مضان.
- الفرعيةالمسالك القيم الأساسية متوسط من القيم endplate للحصول على كثافة تصحيح لالاستشاري لحقوق الإنسان والبروتين من الفائدة في كل endplate.
- تقسيم endplate قيم الكثافة تصحيح للبروتين من الفائدة من شدة BGT مضان تصحيح لانتاج نسب كثافة مضان 14،21
7. وبمقارنة الكثافة بعد المشبكي غشاء الاستشاري لحقوق الإنسان عن طريق الحنق
ملاحظة: هذا البروتوكول يقيم مدى معبأة بشكل وثيق مركز عمان (<10 نانومتر تباعد) في الغشاء بعد المشبكي. مزيج المانحة وfluorophore متقبل الدقيق أمر بالغ الأهمية لهذا الحنق الفحص. يتم إعطاء أسماء وتفاصيل عن fluorophores في الجدول المواد. الخصائص الطيفية، وفيما يتعلق الحنق، وتناقش في منطقتنا الأوراق السابقة 14،15.
- إعداد cryosections عرضية ثابت كما هو موضح في القسم 6.1. يجب أن تتم معالجة جميع الفئات عينة معا وصورةد في نفس الجلسة مبائر.
- مزيج دقيق 2.5 غرام / مل الأحمر BGT (الحنق المانحة) مع 10 غرام / مل بعيدا الحمراء BGT (الحنق متقبل) مع عرقلة الحل في أنبوب صغير من البلاستيك قبل pipetting صعودا وهبوطا 12 مرة. هذا 1: خليط الضرس 4 يزيد من كفاءة الحنق 14.
- وضع كل شريحة في غرفة ترطيب، وتغطي بعناية كل قسم مع انخفاض (12 ميكرولتر) من الخليط المذكور أعلاه واحتضان لمدة 1.5 ساعة على RT.
- أقسام التحكم: تغطي أعداد صغيرة من المقاطع مع 2.5 غرام / مل الأحمر BGT (المانحة فقط؛ الضوابط C1 المسمى)، وأيضا بعض المقاطع مع 10 غرام / مل النطاق الأحمر BGT (متقبل فقط؛ الضوابط C2 المسمى). احتضان هذه الضوابط كما في الخطوة 7.3.
- غسل الشرائح 3 × 10 دقيقة في برنامج تلفزيوني وجبل في القائم على الجلسرين، وتصاعد المتوسطة (راجع الخطوة 3.12) مقاومة تتلاشى.
- أداء عينات من endplates كما في الخطوة 6.7. وينبغي أن يكون مضان من الجهة المانحة ومتقبل تماما شارك المترجمة في endplates بسبب الربط العشوائي للجزيئات فلوري-BGT.
- الصور التحكم: عن طريق الهدف 40X وانخفاض الليزر الأمثل قوة مكاسب redBGT وتعويض إعدادات مستوى لendplates من C1 السيطرة الشريحة. تحسين بعيدة redBGT الربح وتعويض مستويات لendplates من C2 السيطرة الشريحة. تأكيد غياب أي مضان تنزف من خلال.
- دون تغيير قوة الليزر، واكتساب أو إعدادات على مستوى تعويض انتقال إلى الشرائح التجريبية وجمع الصور (قبل photobleach) لكل القنوات مضان.
- photobleach انتقائي الحمراء بعيدة BGT على جزء من endplate واحدة عن طريق التكبير في منطقة المسح الضوئي ثم مسح 10 مرات مع ليزر 633 نانومتر في السلطة 100٪. وينبغي أن تصبح مضان في المنطقة الممسوحة ضوئيا قاتمة.
- إعادة تعيين قوة الليزر والتكبير وجمع الصور بعد التبييض على كل القنوات الفلورسنت باستخدام الإعدادات مبائر التي أنشئت في 7.7.
- حساب الكفاءة الحنق (E) من نسبة الزيادة في المانحة (الأحمر-BGT) مضان بعد photobleach من متقبل (النطاق الأحمر-BGT) وفقا للمعادلة التالية *:
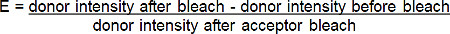
* وبالنسبة لجميع الحالات التي يكون فيها مضان من الجهات المانحة يزيد بعد photobleaching من المتقبلة.
النتائج
قياس المساحة متشابك في NMJ
يعتمد أي تقدير للمنطقة على رسم حدود لتحديد مدى التخصصات متشابك. في عضلات صحية الشباب البالغين يجب عرض الصور NMJ حدود واضحة المعالم لكلا الاستشاري لحقوق الإنسان وتلطيخ synaptophysin (الشكل 2A وباء).
Discussion
وقد مكنت البروتوكولات الموصوفة هنا لنا لقياس بشكل موثوق وقياس التغيرات في خصائص NMJ عبر مجموعة من الشروط، بما في ذلك الشيخوخة والمرض الدول العادية. الطرق الموضحة للأون تواجه والصور NMJ تسمح للباحثين لمقارنة مجال التخصصات قبل وبعد المشبكي ومنطقة متشابك التداخل / المحاذ...
Disclosures
The authors declare they have no competing financial interests.
Acknowledgements
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materials
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
References
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved