需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
神经肌肉接头处:测量突触大小,碎片和改变突触蛋白密度利用共聚焦荧光显微镜
摘要
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
摘要
神经肌肉接头(NMJ)为大,胆碱能突触继电器通过哺乳动物运动神经元控制随意肌收缩。结构变化在NMJ可导致神经传导故障,导致无力,萎缩,甚至死亡的肌纤维。许多研究已经调查了遗传修饰或疾病如何改变鼠标NMJ的结构。不幸的是,它可以是难以直接从这些研究中,因为他们经常使用不同的参数和分析方法比较结果。三个协议描述。第一种使用最大强度投影共焦图象以测量乙酰胆碱受体(AChR的)的区域富含突触后膜结构域在端板和突触小泡染色上覆突触前神经末端的区域。所述第二协议进行比较的免疫染色在突触后膜突触蛋白的相对强度。第三公关otocol使用荧光共振能量转移(FRET)来检测改变突触后乙酰胆碱受体的终板包装。该协议已经制定和完善了一系列的研究。影响的质量和结果的一致性的因素进行了讨论,并提供了用于在健康的年轻成年小鼠NMJs标准数据。
引言
神经肌肉接头(NMJ)是临界中继突触介导的神经系统和骨骼肌之间的通信。它是必需的所有随意运动。荧光显微镜长期以来被用于研究转基因的作用,对小鼠NMJ 1-3或之上啮齿类NMJs 4-11进行比较的年龄,饮食,运动和疾病的影响。这样的研究已经告诉我们很多关于NMJ的生理与病理生理学,但不同的参数报告( 如,乙酰胆碱受体区,终板面积,周长,碎片指数)往往让人很难比较这些研究结果。有越来越多的期望的临床前研究人员能够证明再现性,特别是与疾病12的啮齿动物模型的研究。这里描述的方案通过一系列的研究,研究的发展,生理和病理CH进行了细化安格斯的NMJ。这样的研究需要突触专业的鼠标运动终板的面积和突触蛋白的填料的突触后特13-15内的相对密度的测定。
这些方法的效用是由最近的研究中的抗麝香重症肌无力的小鼠模型中示出。 IgG抗体从抗麝香阳性重症每日注射肌无力患者到成年小鼠造成他们2周16内变弱。肌肉切片是被双重标示突触(神经 - 终端)和突触后乙酰胆碱受体共聚焦最大投影图像揭示了乙酰胆碱受体染色作为主要变化领域逐渐下降。下降重要率为足以解释可比下降突触电位,突触传递和肌肉无力17,18的故障的幅度。定性类似的发现报告了其他研究小组10,19。同样NMJ测量方法,至今已用于评估治疗抗麝香重症三种药物的影响肌无力这种小鼠模型20,21。
久坐老化可导致神经肌肉连接的损失。这里所描述的协议已经透露,目前运动终板的年龄相关下降神经末梢突触的面积小鼠进展到老年。同样的方法发现,志愿工作可以在很大程度上防止减少突触前神经末端区域22,与以前的工作由其他组4保持一致。神经肌肉连接的损失也发生在肌萎缩侧索硬化症9,23的SOD1G93A小鼠模型。
上述研究表明,各种健康状况可能导致减少前或突触后专业在NMJ的面积。这可能会导致受损突触乐趣ction或可能预示着神经肌肉连接的完全丧失。三种协议的描述,使该地区和突触专业的密度定量。第一协议的目的是提供前和突触后专业并且在哺乳动物NMJs其对准的区域的实际和可重复的措施,使用荧光显微镜。二维最大投影共焦图象和图象分析与美国国立卫生研究院的ImageJ用于检测变化的突触染色(突触小泡),突触后乙酰胆碱受体和突触的重叠区域的面积。共焦成像参数(增益和偏移电平)为每个NMJ优化以便最大化用于辨别突触专业化的区域中的可视信息。神经肌肉故障也可导致改变突触后乙酰胆碱受体和/或其他突触蛋白的密度。第二协议可应用到检测变化后突触蛋白例如相对密度麝香,rapsyn,Dystroglycan基因,磷酸化Src激酶和磷酸乙酰胆碱受体18,21。
在重症肌无力,乙酰胆碱受体的突触后膜中的密度降低是突触失效和肌肉无力的直接原因。第三协议描述了一种荧光共振能量转移(FRET)的方法来评估的变化在邻近乙酰胆碱受体的突触后膜14,15内的接近。此方法检测标记荧光-α银环蛇毒素(BGT)相邻乙酰胆碱受体之间的能量转移。当荧光供体和受体探针小于10nm相距FRET只发生。这可以揭示(亚显微)变化乙酰胆碱受体的包装的密封性,可能直接涉及突触电位的振幅。
这三个协议,细化在过去十年中,提供了完整的NMJ以一致的和可重复的方式补充措施。采用标准化协议的第二参数应促进在哺乳动物NMJ基因和环境干预的影响比较。
研究方案
注:动物实验的设计,实施和报告应采取的现行准则24账户。这样的工作必须由当地动物福利机构(在我们的例子悉尼大学的动物伦理委员会)事先批准。
1.安乐死的动物和肌肉的解剖
- 传送鼠标从保持室以一个单独的房间,其中它被安乐死与腹膜内注射戊巴比妥溶液 (30毫克/千克)使用由清水25详述的小鼠的处理方式。将鼠标放回笼子。
- 一旦鼠标的呼吸停止时间超过1分钟,由轻轻刷洗角膜轻轻捏脚,角膜反射测试脚撤回反射。只有当反射性反应是可以缺席鼠标来解剖准备。
- 咨询啮齿动物解剖这样的图谱作为Chiasson 26和/或寻求experien的帮助试图感兴趣的肌肉解剖前CED解剖学家。在每种情况下使用小的电动剃须刀打开皮肤暴露肌肉之前,从上覆皮肤去除毛发。
注:夹层将各不相同解剖分明的肌肉。 - 使用钝钳摆脱覆膜和周围组织肌肉。把握和削减远端肌腱肌肉从其插入分开。
- 轻轻的挑逗,并剪断不受周围组织马上回原点的肌肉。简要地放置新解剖肌肉成的0.1M磷酸盐缓冲盐水(PBS)溶液或林格氏液之前进一步处理。
2.准备肌肉的Cryosectioning
注:最佳结构保存可以通过整体动物灌注可以实现在可选步骤2.1描述为前面介绍27,或浸泡固定(对于小肌肉)。然而,4%多聚甲醛固定会影响后续的染色与许多抗体探针和荧光BGT。尤其应该避免戊二醛。如果肌肉不被固定它们必须立即快速冷冻(前进到2.3)。
- 可选浸没固定:引脚肌肉蜡在培养皿中,在静息的长度。覆盖用2%w / v的多聚甲醛(新鲜溶解在PBS中)处理2小时,在室温下的肌肉。它用PBS中在30分钟(3×10分钟)3次更换冲洗然后用30%w / v的蔗糖代替PBS PBS中孵育O / N在4℃。
- 通过折叠2厘米×1.5厘米的片铝箔如图1使模具('船') 预先放置一个片硝酸纤维素膜在船的底部。轻轻倒入低温恒温器嵌入矩阵( 材料表)到船2毫米的深度,同时注意避免气泡。将肌肉上了船,用圆珠笔线条对准它硝酸纤维素。添加更多的包埋基质,以便完全覆盖肌( 图1)。
- 预标签聚丙烯管不可磨灭的标记。放置在每个管一滴水和冷却该管在液氮中。
注:将冷冻的水滴保持着的蒸气压,并防止在延长-80℃贮存干燥 - 用面罩,厚的保护手套和一个大对钝镊子,部分降低含有异戊烷2厘米深度入液氮的容器,持续30秒的小金属烧杯(直径为3厘米,八厘米深)。取下烧杯中,将其放在板凳之上。使用较小的一双钝镊子将装有肌肉和嵌入基质进入冷冻异戊烷的模具。注意避免液氮混合的异戊烷。
- 允许2分钟的块用钝钳解除冻结块出来,密封在正确的公关之前完全冻结电子标签和预冷冻管(步骤2.3)。
- 临时存储管中转移到-80℃之前的液态氮。记录所有样品的冷藏物品的电子表格。
3. Cryosectioning和荧光染色的NMJs恩人脸图像
- 剥离的铝模。内的-20℃的低温恒温室连接的冻结块到低温恒温器卡盘以便切割为20μm冷冻切片平行于肌纤维的长轴( 图1)。拿起在聚L-赖氨酸或明胶涂布的显微镜载玻片的章节。
- 注意:省略此步骤的组织冷冻前的固定。允许30分钟为区段上至干载玻片后,通过放置在PBS一滴2%的多聚甲醛在每个部分为15分钟,在室温固定。
- 洗涤滑动的科普林缸在PBS 3×10分钟,然后将其浸入载玻片在PBS中含0.1M甘氨酸30分钟,以阻断残余的醛基。
- 为在PBS中10分钟洗玻片,然后沉浸在甲醇(冷却至-20℃)为7分钟。此透步骤是双标记荧光-BGT和抗突触的常规部分,但它可能的免疫染色对一些其他蛋白质产生不利的影响。
- 洗涤滑动2×10分钟的PBS,然后将每个载玻片在一个稳定和平整加湿室中。立即覆盖每个部分与20μl封闭溶液(0.2%的Triton X-100,2%牛血清白蛋白(BSA)的PBS)中1小时,在室温。段必须不被允许干燥的免疫染色过程的任何阶段。
- 进行主培养:以一个滑动一次小心地从以上各部分除去过量的封闭溶液,并用20微升的兔抗突触泡的替换(稀释1:在封闭溶液200)。
- 包括将与唯一的封闭液孵育阴性对照载玻片。这种"无一抗控制"在每一个免疫组化运行至关重要。
- 小心不使第一抗体保持在适当位置在每个部分中,关闭该加湿室孵育1-2天,在4ºC。
- 检查每个部分以确认第一抗体保持在原位。用巴斯德吸管轻轻冲洗每张幻灯片与PBS并将其放置在一个罐子科普林。洗所有的幻灯片在PBS 3×10分钟。
- 开展二次孵化。以一个幻灯片的时间,仔细去除多余的PBS,把它在潮湿的室内覆盖和每节20微升含FITC标记的驴抗兔IgG和BGT结合,以四甲基罗丹明或其他红色荧光体的混合物(TRITC- / redBGT 5微克/毫升)稀释在封闭溶液中。在室温下孵育2小时。
- 洗涤滑动在PBS 3×10分钟的科普林罐子。
- 以一个幻灯片的时间,仔细去除多余的PBS和使用,甘油的最小体积盖玻片安装l为本,褪色,耐封固剂。封明确指甲油盖玻片的边缘。允许它干硬。
- 储存在黑暗中的幻灯片,在4ºC长达一周,或在-20 C更长的贮存期(达数个月)。
4.偏采样和运动终板的连接面成像
- 通过标记每个幻灯片与保持唯一已知的第二研究者(不参与分析)一个随机码号盲幻灯片。其结果是,操作员保持盲目治疗组直到NMJ参数定量完成对所有样品。
- 放在显微镜阶段的幻灯片,并查看它在与TRITC过滤器组(63X油1.3 NA目标)宽视场照明。 (由场场),左到右,后,直到终板出现在现场( 图2A)将逐步。
注:采样标准:每乙酰胆碱受体染色结构相对平面和朝向目标( 即,延伸<在z维度15米)被认为是一个端板和被成像进行分析(乙酰胆碱受体染色的新月形通过端板代表的横截面,并因此被排除)。 - 用共焦针孔设定为1.0艾里单元和低的激光功率优化增益和偏移对TRITC /红BGT(532 nm激光)的水平,在所述端板是将被成像。下一步优化FITC /使用488 nm激光突触荧光。收集的z堆端板的各光学片之间的0.7微米的间隔。保存与包括所述成像会话的日期,幻灯片的代号和端板的数目的文件名的图像。
注意:在使用488纳米的扫描和532纳米激光器(FITC和TRITC)应该按顺序(非同时),以避免在FITC通道的污染由荧光从红色荧光团,反之亦然(放气通)搜集。 - 重复采样一第二步骤的成像4.2-4.3直至20的端板是从所述滑动/样品收集。
- 切换到下一个幻灯片编码,重复4.2-4.4。重复此为每个编码的幻灯片。
- 使用中发现最适合实验的幻灯片(FITC的荧光通道应该会出现暗)的共聚焦设置控制幻灯片(无一抗控制)收集终板的一些图片。
- 在共焦会话转移的图像文件至另一台计算机和备份的外部驱动器或服务器上的原始文件的末尾。
5.测量突触专业化的面积恩人脸图像
- 使用NIH ImageJ的免费软件(http://imagej.nih.gov/ij/),以从每一Z堆叠制备最大值投影(MIP)的图像。将其保存为TIFF文件( 图2A和B)。文件名 应包括图像会议日期,示例代码,终板数量和荧光通道( 例如,060414_5723_7_FITC.tiff)。
- 打开ImageJ的Z轴投影图像。选择的乙酰胆碱受体通道图像( 图3A),并选择: 图像>类型> 8位到24位RGB彩色图像转换成屏幕上的三个8位灰度图像。
- 使用ImageJ的多边形工具周围绘制的染色(ACHR)信道的redBGT兴趣端板一个粗糙的轮廓,以便包括特定个体端板的所有表观染色的区域,而不含任何染色不从感兴趣的终板发出( 图3C)。
- 通过选择适用的最低强度阈值的图像: 图像>调整>阈值 ( 图3E和相关ImageJ的截图)。
- 调整阈值电平,从而分离乙酰胆碱受体染色的部分,同时排除周围的背景信号,作为亚阈值( 图3E)。打开第二个风与原始(连续色调)图象立即OW窗口旁边作比较,以方便对所述阈值的决定。记录的阈值对于在共定位以后使用的分析。
- 保留周围的终板多边形轮廓选择: 分析>分析颗粒 。在弹出菜单中指定的尺寸为的范围:50到无穷大的像素(这消除了电噪声中的光电倍增管产生的微小的工件)。
- 分析颗粒命令生成一个窗口的离散超阈值的区域的列表和它们的荧光强度值编号为它们出现在二进制图像( 图3G和相关ImageJ的屏幕截图)。此数据复制到一个标记电子表格。
- 通过选择测量总面积终板(多边形内的区域): 分析>测量 。这就产生了总面积终板。复制和粘贴的乙酰胆碱受体的区域和强度到数据电子表格确保适当标记列,行将用于特定幻灯片个别终板。
- 切换到抗突触荧光通道,并重复步骤5.1 - 5.5,但对于在FITC通道( 图3B,D和F)。这样做的目的是使之产生一个二进制图象,尽可能紧密地,所认为的眼睛匹配染色的边界来调整阈值。记录的阈值。
- 通过应用下面的步骤测量重叠面积:打开含有两个通道的图像的原始文件,并将其通过选择分裂成两个单独的图像: 图像>栈>栈图像 。
- 使用共定位插件(下载并安装从ImageJ的网页)选择: 撑着>共定位和以前记录输入的阈值的乙酰胆碱受体和神经通道进入各自的渠道查询B牛。这将产生白色像素( 图3H和相关ImageJ的截图)重叠的图像。
- 新创建的重叠图像转换成灰度格式和应用的阈值的最大值。最大阈值将只选择白色像素中,对应于前两个通道的重叠区域。记录在电子表格"共定位'的所得面积值,其表示重叠的像素的区域。
- 准备数据样本均值的电子表格,计算并绘制标准偏差和标准误差为直方图或散点图20,22。注意,n的值通常表示每样本组小鼠用于统计目的的数量。
- 情节端板乙酰胆碱受体领域散点图或频率直方图,以确定是否该数据的统计测试( 图6)之前正态分布。
6.相对染色强度比采用横向光学切片
注:在本协议过程中所有的肌肉样本一起和图像在一个单一的共聚焦会议。在规划一个实验允许高达每肌肉样品30分钟成像时间。
- 横向切割15微米的冰冻切片的肌纤维的长轴和收集到幻灯片的步骤3.1描述。
- 进行荧光染色如步骤3.2-3.13说明。
- 码的染色的载玻片,使成像和分析是进行与操作者盲治疗组,如在步骤4.1中所述。
- 使用40X物镜荧光(NA 0.75)简要地调查从每张幻灯片的截面,以确定单一的增益和偏移电平设定为乙酰胆碱受体,就可以适用于所有的样品载玻片所有端板。那么聪明的终板应略低于256级灰度的规模。这种优化应分别为第二fluorescenc进行E通道(先后收集)。记录固定增益和偏置电平设置和整个成像会议不会改变他们。
- 收集荧光标准的幻灯片( 例如,非漂白荧光珠)的图像,使用相同的参数,在开始和共焦会话的结束,以检测激光强度的任何可能的波动。
- 使用乙酰胆碱受体通道扫描幻灯片逐渐找到终板。
- 重点查找在包含数量最多的乙酰胆碱受体染色终板的每一个显微镜领域的单一光学剖面。
- 扫描该单个光学部分两次并保存平均化图像( 图4G)。
- 保持相同的焦平面切换到第二荧光通道(感兴趣蛋白质),并收集图像作为在步骤6.8。保存图像文件,其中包括在文件名:成像会议日期,示例代码,图象序号和符号来表示的荧光通道。 图4A - F显示相比,rapsyn,麝香或-dystroglycan(-DG)乙酰胆碱受体的终板分布的例子。
- 移动阶段到下一个字段,它包含一个或多个端板,并重复步骤6.8-6.9。重复该步骤直至总共60端板成像。
- 在成像会话转移结束的所有文件到另一台计算机,并对其进行备份。
- 打开每个原始图像文件,并查看乙酰胆碱受体通道,选择: 图像>栈>堆栈图片 ,分裂的渠道。
- 选择: 图像>类型> 8位转换为8位灰度格式在屏幕上。做到这一点的两种荧光通道。
- 选择: 图像>栈>图片到堆栈 。从两个先前分离的8位图像打开一个新的堆栈。人们可以方便地在两个荧光通道之间的单个窗口内,则进行切换。
- 使用多边形工具绘制一个林Ë紧紧围绕乙酰胆碱受体染色( 图4I)的边界。
- 选择: 分析>测量来测量所述封闭区域内的平均像素强度为乙酰胆碱受体(注意紧紧画线的重要性)。此值复制到一个标记的电子表格。
- 保持相同的多边形轮廓(以定义区域被测量),切换到第二个荧光通道( 例如, 图4B中,D,F)和选择: 分析>措施 。这将产生的平均染色强度为通过乙酰胆碱受体染色定义的突触区域内的感兴趣的蛋白质。
- 选择一个地区远离可见终板染色,然后选择: 分析>测量 , 测量平均背景荧光强度。重复此为其他荧光通道/ s,将背景值复制到荧光值的电子表格。
- 子从端板的值道中的平均背景值,以获得校正后的强度为乙酰胆碱受体和在每个端板感兴趣的蛋白质。
- 通过矫正BGT荧光强度划分为感兴趣的蛋白质的校正端板的强度值以得到的荧光强度比14,21
7.比较突触后膜乙酰胆碱受体密度使用FRET
注:此协议评估在突触后膜乙酰胆碱受体哪些是紧密排列的程度(<10纳米的间隔)。精确的供体和受体荧光团的组合是本FRET测定的关键。名称和荧光团的细节给出在材料表中。它们的光谱特性,相对于FRET,在我们以前的文章中讨论14,15。
- 如第6.1节所述准备固定的横向冰冻切片。所有样品组必须一起和图像处理d。在相同的共聚焦会议。
- 调匀为2.5g / ml的红色BGT(FRET供体)和10微克/毫升远红BGT(FRET受体)用封闭在一个小塑料管溶液通过移液器上下吹吸12次。这个1:4摩尔混合物最大化FRET 14的效率。
- 将每个载玻片在潮湿的室中,仔细地覆盖各部分与上述混合物的压降(12微升)并孵育1.5小时,在室温。
- 控制部分:包括少量部分用2.5克/毫升的红BGT(仅捐助;标记C1控制),也有些路段用10克/毫升远红BGT(只接受;标C2控制)。孵育这些控件步骤7.3。
- 洗涤滑动在PBS 3×10分钟,并在装入甘油为基础的,不褪色,耐封固剂(见步骤3.12)。
- 执行终板取样如在步骤6.7。从供体和受体荧光应该是完全共定位在端板由于无规结合的荧光BGT分子。
- 控制图像:使用40倍物镜和低激光功率优化redBGT增益和偏移从控制幻灯片C1终板级设置。优化远redBGT增益和偏移水平从控制幻灯片C2终板。确认没有任何荧光渗出通过。
- 不改变激光功率,增益或偏移级设置移动到实验幻灯片和采集图像(预光漂白)两个荧光通道。
- 选择性地通过放大在扫描区域然后扫描10次,以100%功率的633nm的激光光漂白的远红BGT在单个端板的一部分上。在扫描区域的荧光应该变得暗淡。
- 重置激光功率和放大,并使用7.7建立的共聚焦设置两种荧光渠道搜集后漂白的图像。
- 从增加的百分比计算的FRET效率(E)的供体(红 - BGT)荧光下列受体(远红-B的光漂白根据下列公式* GT):
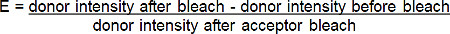
*对于所有的情况下,供体的荧光漂白受体后增加。
结果
突触面积的测量在NMJ
区域的任何估计依赖的边界的绘制时以限定突触专业化的程度。在健康的年轻成年肌肉NMJ图像应显示良好定义的边界为乙酰胆碱受体和突触素染色( 图2A和B)。荧光强度为乙酰胆碱受体和突触素在电机板( 图5A'和B')的周围突触和突触部之间的边界处急剧上升。对于这样的图像的最小阈值(正上?...
讨论
这里所述的协议,使我们能够可靠地测量和在一系列条件,包括正常的老化和疾病状态量化变化NMJ的属性。用于连接所描述的方法面临NMJ图像将允许研究来比较前和突触后专业领域和突触重叠和/对齐的区域。比较前和突触后的蛋白质的第二协议,它使用横向光学切片的相对强度,是优选的。第三个协议专门用于测试的变化乙酰胆碱受体的包装在突触后膜的接近。
特异性控制?...
披露声明
The authors declare they have no competing financial interests.
致谢
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
材料
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
参考文献
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。