Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Der neuromuskulären Synapse: Mess Synapse Größe, Fragmentierung und Veränderungen der synaptischen Protein Dichte Mit der konfokalen Fluoreszenzmikroskopie
In diesem Artikel
Zusammenfassung
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Zusammenfassung
Die neuromuskulären Synapse (NMJ) ist die große, cholinergen Synapse Relais durch die Säugetiermotoneuronen steuern freiwilligen Muskelkontraktion. Bauliche Veränderungen an der NMJ kann bei der Neurotransmission Versagen führen, was zu Schwäche, Atrophie und sogar zum Tod der Muskelfaser. Viele Studien haben untersucht, wie genetische Veränderungen oder Krankheit kann die Struktur der Maus NMJ ändern. Leider kann es schwierig sein, direkt Erkenntnisse aus diesen Studien zu vergleichen, weil sie oft verwendet verschiedene Parameter und analytische Methoden. Drei Protokolle werden hier beschrieben. Der erste verwendet Maximum Intensity Projection konfokalen Bildern, die Fläche der Acetylcholin-Rezeptor (AChR) -reichen messen postsynaptischen Membran-Domänen an der Endplatte und der Fläche der synaptischen Vesikel-Färbung in der darüberliegenden präsynaptischen Nervenende. Das zweite Protokoll vergleicht die relativen Intensitäten der Immunfärbung für synaptische Proteine in der postsynaptischen Membran. Die dritte protocol verwendet Fluorescence Resonance Energy Transfer (FRET), um Veränderungen in der Packung der postsynaptischen AChR an der Endplatte zu detektieren. Die Protokolle sind entwickelt worden, und über eine Reihe von Studien verfeinert. Faktoren, die die Qualität und Konsistenz der Ergebnisse beeinflussen werden diskutiert und normative Daten für NMJs bei gesunden jungen erwachsenen Mäusen zur Verfügung gestellt.
Einleitung
Die neuromuskuläre Verbindung (NMJ) ist die kritische Relais Synapse, die eine Kommunikation zwischen dem Nervensystem und im Skelettmuskel vermittelt. Es wird für alle willkürlichen Bewegungen erforderlich. Die Fluoreszenzmikroskopie ist seit langem verwendet, um die Auswirkungen von Transgenen auf der Maus NMJ 1-3 studieren oder um die Auswirkungen von Alter, Ernährung, Bewegung und Krankheit auf Nagetier NMJs 4-11 vergleichen. Solche Studien haben uns viel über die Physiologie und Pathophysiologie der NMJ gelehrt, aber die verschiedenen Parameter angegeben (zB AChR Bereich Endplatte Fläche, Umfang Länge, Fragmentierung Indizes) machen es oft schwierig, die Ergebnisse dieser Studien zu vergleichen. Es gibt eine steigende Erwartung für die präklinische Forscher in der Lage, um die Reproduzierbarkeit zu demonstrieren, insbesondere in Studien mit Tiermodellen der Krankheit 12 sein. Die hier beschriebenen Protokolle wurden durch eine Reihe von Studien, die entwicklungsbedingten, physiologischen und pathophysiologischen ch sucht verfeinertanges auf die NMJ. Erfordern solche Untersuchungen Messung der Fläche von synaptischen Spezialisierungen an der Maus motorischen Endplatte und die relative Packungsdichte der synaptischen Proteinen innerhalb postsynaptischen Spezialisierungen 13-15.
Die Nützlichkeit dieser Verfahren wird durch jüngste Studien in einem Mausmodell von anti-MuSK Myasthenia gravis dargestellt. Tägliche Injektionen von IgG von Anti-Moschus positive Myasthenia gravis Patienten in erwachsenen Mäusen veranlasste sie, innerhalb von 2 Wochen 16 schwach werden. Die konfokale maximale Projektionsbilder von Muskelpartien, die doppelt markierten wurden Synaptophysin (in Nerven Terminals) und postsynaptischen AChRs ergab einen allmählichen Rückgang im Bereich der AChR-Färbung als primäre Veränderung. Wichtig ist der Rückgang war ausreichend, um vergleichbare Rückgänge in der Amplitude des synaptischen Potentiale, Versagen der synaptischen Übertragung und Muskelschwäche 17,18 erklären. Qualitativ ähnliche Ergebnisse wurden von anderen Arbeitsgruppen berichtet10,19. Die gleichen NMJ Meßmethoden seit verwendet worden, um die Auswirkungen der drei Medikamente zur Behandlung von anti-MuSK Myasthenia gravis Beurteilung in diesem Mausmodell 20,21.
Sitzende Alterung können zum Verlust der neuromuskulären Verbindungen führen. Die hier beschriebenen Protokolle haben eine altersbedingte Rückgang im Bereich der Nervenendigung Synaptophysin bei motorischen Endplatten zeigte Mäuse Fortschritt ins hohe Alter. Die gleichen Methoden ergab, dass freiwillige Übung konnte weitgehend verhindern, dass die Reduzierung der präsynaptischen Nervenende Bereich 22, im Einklang mit früheren Arbeiten anderer Gruppen 4. Der Verlust der neuromuskulären Verbindungen kommt auch in der SOD1G93A Mausmodell für Amyotrophe Lateralsklerose 9,23.
Die genannten Studien zeigen, dass eine Vielzahl von gesundheitlichen Bedingungen kann zu Kürzungen im Bereich der entweder vor oder nach der synaptischen Spezialisierungen an der NMJ führen. Dies kann zu einer Beeinträchtigung der synaptischen Spaß führenction oder vollständigen Verlust der neuromuskulären Verbindung ankündigen. Drei Protokolle beschrieben, die Quantifizierung der Fläche und der Dichte der synaptischen Spezialisierungen ermöglichen. Der Zweck des ersten Protokolls besteht darin, eine praktische und reproduzierbare Bestimmung der Flächen der prä- und postsynaptischen Spezialisierungen und deren Ausrichtung in Säuger NMJs bereitzustellen, unter Verwendung von Fluoreszenzmikroskopie. Zweidimensionale maximale Projektions konfokalen Bildern und Bildanalyse mit NIH ImageJ wird verwendet, um Änderungen im Bereich des Synaptophysin-Färbung (synaptische Vesikel) postsynaptischen AChR und synaptische Überlappungsbereich zu detektieren. Konfokales Abbildungsparameter (Verstärkung und Offset-Pegel) werden für jede NMJ optimiert, um die visuellen Informationen verwendet werden, um den Bereich der synaptischen Spezialisierung erkennen maximieren. Neuromuscular Ausfall kann auch von Änderungen der Dichte des postsynaptischen AChR und / oder andere synaptische Proteine zur Folge haben. Das zweite Protokoll kann angewandt, um Änderungen in der relativen Dichte der postsynaptischen Proteine, nachzuweisenwie Moschus, Rapsyn, dystroglycan, phosphoryliert Src-Kinase phosphoryliert und AChR 18,21.
In Myasthenia gravis, ist eine reduzierte Dichte von AChR in der postsynaptischen Membran die unmittelbare Ursache der synaptischen Versagen und Muskelschwäche. Das dritte Protokoll beschreibt ein Fluoreszenz-Resonanz-Energie-Transfer (FRET), um die Veränderungen in der Nähe der benachbarten AChR innerhalb postsynaptischen Membranen 14,15 beurteilen. Diese Methode erkennt Energietransfer zwischen benachbarten AChRs mit fluoreszenz α -Bungarotoxin (BGT) gekennzeichnet. FRET tritt auf, wenn die fluoreszierenden Donor und Akzeptor-Sonden sind weniger als 10 nm auseinander liegen. Dies kann (submikroskopische) Veränderungen in der Dichtheit der AChR Verpackung, die direkt auf die Amplitude der synaptischen Potentiale beziehen können offenbaren.
Diese drei Protokolle, in der letzten Dekade raffiniert, bieten ergänzende Maßnahmen der NMJ Integrität in einer konsistenten und reproduzierbar. Verwendung standardisierter Protokolle einnd Parameter sollten Vergleich der Wirkungen von Genen und Umweltmaßnahmen auf die Säugetier NMJ erleichtern.
Protokoll
HINWEIS: Design, Durchführung und Berichterstattung von Tierversuchen zu berücksichtigen, aktuellen Leitlinien 24 zu nehmen. Diese Arbeit ist im Voraus durch die lokale Tierschutzbehörde (in unserem Fall die Tierethikkommission der Universität Sydney) genehmigt werden.
1. Euthanasie der Tiere und Muscle Dissection
- Übertragen Sie die Maus von der Halteraum an einem separaten Raum, wo sie mit einer intraperitonealen Injektion von Pentobarbital-Lösung (30 mg / kg) mit der Maus Behandlungsmethode von Shimizu 25 detaillierte euthanasiert. Platzieren Sie die Maus wieder in seinen Käfig.
- Sobald die Atmung der Maus ist seit mehr als 1 min gestoppt, testen Sie die Fuß-Rückzugreflex durch leichtes Zusammendrücken des Fußes und der Hornhautreflex durch leichtes Streichen Sie die Hornhaut. Nur wenn Reflexe fehlen kann die Maus für die Präparation vorbereitet werden.
- Wenden Sie sich an einen Atlas von Nagetier Anatomie wie Chiasson 26 und / oder suchen die Hilfe eines experienced Anatom, bevor Dissektion der Muskeln von Interesse. Jeweils entfernen Haare von der Haut unter Verwendung eines kleinen elektrischen Rasierers vor dem Öffnen der Haut, um den Muskel freizulegen.
HINWEIS: Die Präparation wird für jede anatomisch ausgeprägte Muskel abweichen. - Mit stumpfen Pinzette befreien den Muskel vom darüberliegenden Membranen und das umgebende Gewebe. Fassen Sie und schneiden Sie die distale Sehne um den Muskel von seinem Ansatz zu trennen.
- Sanft zu necken und schneiden den Muskel frei von umgebenden Gewebe gleich wieder zu seinem Ursprung. Kurz gesagt stellen die neu präpariert Muskel in 0,1 M phosphatgepufferter Salzlösung (PBS) oder Ringerlösung vor der weiteren Verarbeitung.
2. Vorbereiten der Muskel für Kryoschneiden
HINWEIS: Die optimale strukturelle Haltbarkeit lässt sich durch ganze Tier Perfusion erzielt wie zuvor beschrieben 27, oder Tauchfixierung (für kleine Muskeln), wie in optionalen Schritt 2.1 beschrieben werden. Jedoch4% Paraformaldehyd Fixierung anschließender Färbung mit vielen Antikörpersonden mit fluoreszierend BGT beeinträchtigen. Glutaraldehyd sollte insbesondere vermieden werden. Wenn Muskeln nicht behoben werden, müssen sie sofort eingefroren werden schnappt (fahren Sie mit 2.3).
- Optional Tauch Fixierung: Pin der Muskel zu Wachs in einer Petrischale bei Ruhelänge. Decken den Muskel mit 2% w / v Paraformaldehyd (frisch gelöst in PBS) für 2 h bei RT. Waschen Sie es mit 3 Änderungen von PBS über 30 Minuten (3 x 10 min) und setzen Sie die PBS mit 30% w / v Sucrose in PBS und Inkubation O / N bei 4 ° C.
- Stellen Formen ("Booten") vorab durch Falten von 2 cm x 1,5 cm große Stücke aus Aluminiumfolie, wie sie in 1 gezeigt ist. Ein Stück Nitrocellulose-Membran in dem Boden des Bootes. Gießen Sie vorsichtig Kryostat Einbettung Matrix (Material Tabelle) ins Boot zu einer Tiefe von 2 mm, die Pflege, um Luftblasen zu vermeiden. Setzen Sie den Muskel in das Boot, dass es in die Kugelschreiber Linien aufdie Nitrocellulose. Noch ein Einbetten Matrix, um die Muskel (Abbildung 1) vollständig bedecken.
- Pre-Label Polypropylen-Röhrchen mit einer unauslöschlichen Markierung. Geben Sie einen Tropfen Wasser in jedes Röhrchen und Chill das Röhrchen in flüssigem Stickstoff.
HINWEIS: Die gefrorenen Wassertropfen hält den Dampfdruck und verhindert Austrocknen bei längerer Lagerung -80 ° C - Mit einem Gesichtsschutz, dicke Schutzhandschuhe und ein großes Paar stumpfen Pinzette, teilweise senken eine kleine Metallbecher (3 cm Durchmesser, 8 cm tief), die 2 cm Tiefe von Isopentan in einen Behälter mit flüssigem Stickstoff für 30 Sekunden. Das Becherglas und legen Sie sie auf der Tischplatte. Mit einem kleineren Paar stumpfen Pinzette legen Sie die Form, die die Muskeln und die Einbettung in die Matrix gekühlt Isopentan. Achten Sie darauf, flüssigem Stickstoff Vermischung mit dem Isopentan zu vermeiden.
- Lassen Sie 2 Minuten für den Block, um vollständig, bevor Sie stumpfen Pinzette, um den gefrorenen Block herausheben und verschließen Sie diese in der richtigen pr einfrierene-markierte und vorgekühlte Rohr (Schritt 2.3).
- Die Röhrchen speichern vorübergehend in der flüssigen Stickstoff vor bis -80ºC übertragen. Melden Sie alle Proben in einer Tabelle der Inhalt Gefrierschrank.
3. Kryoschneiden und Fluoreszenzfärbung für En Face Bilder NMJs
- Abziehen der Aluminiumform. Im -20ºC Kryostatkammer befestigen Eisblocks am Kryostaten Futter so geschnitten, um 20 & mgr; m Kryoschnitte parallel zu der langen Achse der Muskelfasern (Abbildung 1). Pick-up die Abschnitte von Poly-L-Lysin oder Gelatine beschichteten Objektträgern.
- HINWEIS: Lassen Sie diesen Schritt aus, wenn das Gewebe vor dem Einfrieren fixiert. Nachdem man 30 Minuten für Abschnitte, um auf die Objektträger trocknen, beheben Sie diese mit einem Tropfen von 2% Paraformaldehyd in PBS über jedem Abschnitt für 15 min bei RT.
- Wäsche gleitet 3 x 10 min in PBS in einer Coplin-Gefäß und dann tauchen die Objektträger in PBS mit 0,1 M Glycin für 30 Minuten, um restliche Aldehydgruppen zu blockieren.
- Für 10 min in PBS waschen gleitet, dann Eintauchen in Methanol für 7 min (bis -20 ° C gekühlt). Diese Permeabilisierung Schritt ist eine Routine Teil Doppelmarkierung mit Fluoreszenz-BGT und Anti-Synaptophysin aber es kann sich negativ auf die Immunfärbung für einige andere Proteine.
- Wäsche gleitet 2 x 10 min in PBS dann legen Sie jede Folie in einer stabilen und nivelliert feuchten Kammer. Jeder Abschnitt mit 20 ul Blockierungslösung sofort Bedeckung (0,2% Triton X-100, 2% Rinderserumalbumin (BSA) in PBS) für 1 h bei RT. Schnitte dürfen in jeder Phase der Immunprozess austrocknen.
- Führen Sie die primären Inkubation: Unter einem Objektträger vorsichtig die überschüssige Blockierungslösung aus über jeden Abschnitt und ersetzen sie durch 20 ul Kaninchen-anti-Synaptophysin (1: 200 verdünnt in Blockierungslösung).
- Fügen Sie eine Untersteuerschieber, die mit Sperr einzige Lösung inkubiert wird. Diese "nicht-primären Antikörper Steuer'Ist wichtig, in jedem Immunfärbung laufen.
- Darauf achten, dass der primäre Antikörper bleibt an Ort und Stelle über jeden Abschnitt, schließen Sie das befeuchtete Kammer und Inkubation für 1-2 Tage bei 4 ° C.
- Überprüfen Sie jeden Abschnitt, um zu bestätigen, dass der primäre Antikörper an Ort und Stelle bleibt. Verwenden Sie eine Pasteurpipette vorsichtig spülen jede Folie mit PBS und legen Sie sie in einem Coplin-Gefäß. Alle Folien 3 x 10 min in PBS waschen.
- Führen Sie sekundäre Inkubation. Unter einem Objektträger, entfernen Sie vorsichtig überschüssiges PBS, legen Sie sie in der feuchten Kammer und können daher auf jedes Teil mit 20 ul einer Mischung, die FITC-konjugiertem Esel-Anti-Kaninchen-IgG und BGT konjugiert mit Rhodamin Tetramethyl oder einen anderen roten Fluorophor (TRITC- / redBGT; 5 g / ml) in Blockierlösung verdünnt. Inkubiere bei Raumtemperatur für 2 Std.
- Wäsche gleitet 3 x 10 min in PBS in Coplin-Glaszylinder.
- Unter einem Objektträger, entfernen Sie vorsichtig überschüssiges PBS und montieren mit einem Deckglas mit einem minimalen Volumen, glycerol-basierte, verblassen-Wider Eindeckmedium. Dichten Sie die Ränder der Deckgläser mit klarem Nagellack. Lassen Sie es schwer zu trocknen.
- Bewahren Sie die Folien im Dunkeln bei 4 ° C für bis zu einer Woche, oder bei -20 ° C für längere Lagerung (bis zu mehreren Monaten).
4. Unvoreingenommene Probenahme und En Face Imaging der motorischen Endplatten
- Blenden Sie die Folien durch die Kennzeichnung jedes Dia mit einem zufälligen Code-Nummer, die nur zu einem zweiten Forscher (nicht in die Analyse einbezogen) bekannt bleibt. Als Ergebnis der Bediener blind bleibt Behandlungsgruppen bis Quantifizierung NMJ Parameter vollständig für alle Proben ist.
- Stellen Sie den Schieber auf dem Mikroskoptisch, und zeigen Sie unter Weitfeldbeleuchtung mit TRITC-Filtersatz (63X Öl 1,3 NA-Objektiv). Bewegen Sie schrittweise (Feld für Feld) von links nach rechts und wieder zurück, bis eine Endplatte im Bereich (2A) wird angezeigt.
HINWEIS: Sampling Kriterium: Jede AChR-gefärbten Struktur, die relativ istflach und steht das Ziel (dh erstreckt <15 m in der z-Dimension) wird als eine Endplatte und für die Analyse abgebildet (Sicheln AChR Färbung darstellen Querschnitte durch Endplatten und werden deshalb ausgeschlossen). - Mit der konfokale Blende auf 1,0 Airy-Einheit und niedriger Laserleistung die Optimierung der Verstärkung und Offsetwerte für TRITC / red-BGT (532-nm-Laser) an der Endplatte, die abgebildet werden soll. Nächste optimieren FITC / Synaptophysin Fluoreszenz mit dem 488 nm-Laser. Sammeln Sie eine Z-Stapel der Endplatte mit einem 0,7 um Intervall zwischen den einzelnen optischen Scheibe. Speichern Sie die Bilder mit einem Dateinamen, die das Datum des Imaging-Sitzung, den Codenamen des Schlittens und die Anzahl der Endplatte umfasst.
HINWEIS: Die Scans unter Verwendung der 488 nm und 532 nm-Laser (FITC und TRITC) sollten gesammelt nacheinander (nicht gleichzeitig), um eine Kontamination des Kanals durch FITC Fluoreszenz von dem roten Fluoreszenzfarbstoff und umgekehrt (Durchbluten) zu vermeiden. - Wiederholen Sie die Probennahme einnd Abbildung von Schritten von 4,2 bis 4,3, bis 20 Endplatten werden aus der Folie / Probe gesammelt.
- Wechseln Sie in den nächsten codierten Rutsche und wiederholen 4,2-4,4. Wiederholen Sie dies für jedes der kodierten Objektträger.
- Sammeln Sie ein paar Bilder der Endplatten von der Steuerschieber (nicht-primären Antikörper Steuerung) mittels konfokaler Einstellungen, die optimal für die experimentellen Rutschen (die FITC-Fluoreszenz-Kanal sollte dunkel erscheinen) gefunden wurden.
- Am Ende des konfokalen Sitzungsübertragung die Bilddateien auf einen anderen Computer und eine Sicherungskopie der Originaldateien auf einer externen Festplatte oder einem Server.
5. Messung der Fläche der synaptischen Spezialisierungen in En Face Bilder
- Verwenden NIH ImageJ Freeware (http://imagej.nih.gov/ij/), um eine maximale Projektion (MIP) Bilder von jedem Z-Stapel vorzubereiten. Speichern Sie sie als TIFF-Dateien (2A & B). Dateinamen sollten das Bild Sitzungsdatum, Beispielcode Endplatte Anzahl und Fluoreszenzkanal (zB 060414_57 gehören23_7_FITC.tiff).
- Öffnen Sie die z-Projektionsbild in ImageJ. Wählen Sie den Acetylcholin-Rezeptor-Bildkanal (3A), und wählen Sie Bild> Typ> 8-Bit, um die 24-Bit-RGB-Farbbild in drei 8-Bit-Graustufenbilder auf dem Bildschirm zu konvertieren.
- Mit dem ImageJ Polygon-Werkzeug zeichnen Sie eine grobe Skizze auf der Endplatte des Interesses an der redBGT gefärbt (ACHR) Kanal Damit Sie alle offensichtlich Bunt Regionen des jeweiligen Einzel Endplatte, während unter Ausschluss jeglicher Färbung, die nicht von der Endplatte von Interesse stammt, zu schließen ( 3C).
- Tragen Sie eine minimale Intensitätsschwelle auf das Bild, indem Sie Bild> Anpassen> Schwellenwert (3E und zugehörige ImageJ Screenshots).
- Stellen Sie den Schwellenwert, um die AChR-gefärbten Teile zu isolieren, während ohne umgebenden Hintergrundsignal als Untergrenze (3E). Öffnen Sie eine zweite Window mit dem Original (Halbton-) Bild direkt neben dem Fenster für den Vergleich, um die Entscheidung über den Schwellenwert zu erleichtern. Notieren Sie den Schwellenwert für die spätere Verwendung in Kolokalisationsanalysen.
- Beibehaltung der Polygonumrisslinie um die Endplatte aus: Analysieren> Analysieren Partikel. Im Popup-Menü geben Sie die Auswahl von Größen wie: 50 bis unendlich Pixel (dies beseitigt kleine Artefakte aus elektrisches Rauschen im Photomultiplier).
- Analysieren Partikel Befehl erzeugt ein Fenster mit einer Liste von diskreten supra Schwelle Bereiche und deren Fluoreszenzintensität Werte gezählt, wie sie in dem binären Bild (Abbildung 3G und zugehörige ImageJ Screenshot) angezeigt. Kopieren Sie diese Daten in einer markierten Tabelle.
- Messen Sie die Gesamt Endplatte Bereich (Bereich innerhalb des Polygons), indem Sie: Analysieren> Messen. Daraus ergibt sich die Gesamt Endplatte Bereich. Kopieren Sie die Daten für AChR Bereichen und Intensitäten ineine Tabellenkalkulation und achten Sie auf Spalten entsprechend zu kennzeichnen, werden Zeilen für einzelne Endplatten für bestimmte Folien verwendet werden.
- Wechseln Sie auf die anti-Synaptophysin Fluoreszenzkanal und wiederholen Sie die Schritte 5,1 bis 5,5, aber für die FITC-Kanal (3B, D und F). Das Ziel ist, den Schwellenwert so einzustellen, daß es ein binäres Bild, das so eng wie möglich, mit den Begrenzungen der Färbung von Augen wahrgenommen schafft. Notieren Sie den Schwellenwert.
- Messen Sie den Überlappungsbereich durch die Anwendung wie folgt vor: Öffnen Sie die Originaldatei mit den beiden Kanal Bilder und teilen Sie es in zwei separate Bilder durch: Bild> Stapel> Stapel zu Bildern.
- Mit der Kolokalisation Plugin (heruntergeladen und aus dem ImageJ Webseite installiert) Wählen Sie: pluggin> Kolokalisation und geben die Schwellenwerte zuvor für die AChR und Nervenbahnen in den jeweiligen Kanal Abfrage b aufgezeichnetOchse. Dies wird eine Überlappung Bild in weiße Pixel (3H und zugehörige ImageJ Screenshots) zu erhalten.
- Konvertieren Sie die neu erstellte Bildüberlappung in ein Graustufenformat und Anwendung einer Schwelle auf den Maximalwert. Der maximale Schwellenwert wählt nur die weißen Pixel, die dem Überlappungsbereich der zwei vorherigen Kanälen. Nehmen Sie in der Tabelle der resultierende Bereich Wert von 'Co-Lokalisation ", die den Überlappungsbereich in Pixel darstellt.
- Bereiten Sie eine Tabelle der Datenprobe Mittel, Berechnung und Darstellung Standardabweichungen und Standardfehler als Histogramme oder Streudiagramme 20,22. Man beachte, dass der Wert von n in der Regel die Anzahl der Mäuse pro Testgruppe für statistische Zwecke.
- Plot Endplatte AChR Bereichen Streudiagramme oder Frequenzhistogramme, um zu bestimmen, ob die Daten in der Regel vor der statistischen Tests (6) verteilt sind.
6. Relative FärbungIntensitäten im Vergleich Mit Quer optische Schnitte
HINWEIS: Für dieses Protokoll verarbeiten alle Muskelproben zusammen und Bild in einem konfokalen Sitzung. Bei der Planung eines Experiments kann bis zu 30 Minuten Aufnahmezeit pro Muskelprobe.
- Schneiden 15 um Kryoschnitte quer zu der langen Achse der Muskelfasern und sammeln auf Objektträger, wie in Schritt 3.1 beschrieben.
- Führen Fluoreszenzfärbung wie in Schritten von 3,2 bis 3,13 beschrieben.
- Code die gefärbten Folien, dass die Bildgebung und Analysen werden mit dem Betreiber blind Behandlungsgruppe durchgeführt, wie in Schritt 4.1 beschrieben.
- Mit einem 40-fach-Fluoreszenz Ziel (NA 0,75) einen Abschnitt von jedem Objektträger kurz überblicken, um einen einzelnen Gewinn bestimmen und Offset-Einstellungsebene für AChR, die sich für alle die Endplatten in allen Proben Folien sein wird. Der hellste Endplatte sollte dann knapp unter 256 Grau auf der Skala sein. Diese Optimierung sollten getrennt für das zweite fluorescenc erfolgenE-Kanal (sukzessive gesammelt). Notieren Sie sich die festgelegten Verstärkungs- und Offset-Level-Einstellungen und nicht in der gesamten Imaging-Sitzung ändern sie.
- Sammeln von Bildern einer Fluoreszenzstandard Schieber (zB nicht-Bleich fluoreszierenden Perlen), mit den gleichen Parametern, zu Beginn und am Ende des konfokalen Sitzung, um mögliche Schwankungen in der Laserintensität zu erfassen.
- Verwenden Sie die AChR Kanal, um die Folie schrittweise zu scannen, um Endplatten zu lokalisieren.
- Konzentrieren Sie sich auf das einzige optische Schnittebene in jedem Mikroskop Feld, das die größte Anzahl von AChR-gefärbten Endplatten enthält zu finden.
- Fotografiere diesen einzigen optischen Abschnitt zweimal und speichern Sie die gemittelten Bild (4G).
- Mit der selben Brennebene Schalter zum zweiten Fluoreszenzkanal (Protein von Interesse) und sammeln Sie das Bild wie in Schritt 6.8. Speichern Sie die Bilddatei, einschließlich des Dateinamens: Datum der Imaging-Sitzung, Beispielcode, Bildnummer und ein Symbol, um die Leuchtstoffkanal anzuzeigen. 4A - F zeigt Beispiele der Endplatte Verteilung von AChR Vergleich zu Rapsyn, Moschus oder -dystroglycan (-DG).
- Bewegen Sie die Stufe zur nächsten Feld, das einen oder mehrere Endplatten enthält und wiederholen Sie Schritt 6,8 bis 6,9. Wiederholen Sie diesen Vorgang, bis insgesamt 60 Endplatten abgebildet werden.
- Am Ende des Bildgebungssitzung Übertragung aller Dateien auf einen anderen Computer und sichern Sie sie.
- Öffnen Sie jede Original-Bilddatei und beim Betrachten des AChR Kanal, wählen Sie Bild> Stapel> Stapel auf Bilder, um die Kanäle aufgeteilt.
- Wählen Sie Bild> Typ> 8bit bis zu 8-Bit-Graustufen-Format auf dem Bildschirm zu konvertieren. Tun Sie dies für beide Fluoreszenzkanäle.
- Wählen Sie Bild> Stapel> Bilder zu stapeln. Öffnen Sie ein neues Stapel von zwei bisher getrennten 8-Bit-Bilder. Man kann dann bequem wechseln zwischen den beiden Fluoreszenzkanäle innerhalb der einzelnen Fenster.
- Verwenden Sie das Polygon-Werkzeug, um einen lin ziehene eng um den Rand des AChR Färbung (Figur 4E).
- Wählen Sie: Analysieren> Messen Sie um die durchschnittliche Pixelintensität für AChR im geschlossenen Bereich zu messen (beachten Sie die Bedeutung Zeichnen der Linie fest). Kopieren Sie diesen Wert in einer markierten Tabelle.
- Beibehaltung der gleichen Polygon-Umrisslinie (zur Definition der Fläche gemessen werden soll), auf die zweite Leuchtstoffkanals (beispielsweise 4B, D, F) zu wechseln und wählen Sie: Analysieren> Maßnahme. Dadurch wird die durchschnittliche Intensität der Färbung, die das Protein von Interesse in dem durch AChR Anfärbung definierten synaptischen Bereich ergeben.
- Wählen Sie einen Bereich von sichtbaren Endplatte Färbung wählen: Analysieren> Messen Sie die durchschnittliche Hintergrundfluoreszenzintensität zu messen. Wiederholen Sie diesen Vorgang für die andere Fluoreszenzkanal / s und kopieren Sie die Hintergrundwerte in die Tabelle der Fluoreszenzwerte.
- UnterTrakts des durchschnittlichen Hintergrundwerte aus Endplatte Werte, um die korrigierten Intensitäten für AChR und das Protein von Interesse in jeder Endplatte zu erhalten.
- Dividieren der korrigierten Endplatte Intensitätswerte für das Protein von Interesse durch den korrigierten BGT Fluoreszenzintensität, um die Fluoreszenzintensitätsverhältnisse 14,21 Ausbeute
7. Vergleich der postsynaptischen Membran AChR Dichte Mit FRET
Hinweis: Dieses Protokoll bewertet, inwieweit die AChR sind eng gepackt (<10 nm Abstand) in der postsynaptischen Membran. Die genaue Donor und Akzeptor-Fluorophor Kombination kritisch ist dieser FRET Assay. Namen und Details der Fluorophore sind in der Tabelle angegebenen Materialien. Ihre spektralen Eigenschaften in Bezug auf FRET, werden in unseren früheren Arbeiten 14,15 diskutiert.
- Bereiten festen Quergefrierschnitten, wie in Abschnitt 6.1 beschrieben. Alle Probengruppen müssen zusammen und Bild verarbeitet werdend in der gleichen konfokalen Sitzung.
- Gut mischen 2,5 g / ml Rote-BGT (FRET-Donor) mit 10 g / ml bis rot-BGT (FRET-Akzeptor) mit Blockierlösung in einem kleinen Plastikschlauch durch Auf- und Abpipettieren 12 mal. Dieses 1: 4 molare Mischung maximiert die Effizienz des FRET 14.
- Platzieren Sie jede Folie in einer feuchten Kammer, sorgfältig auf jedes Kapitel mit einem Tropfen (12 ul) der obigen Mischung und Inkubation für 1,5 Stunden bei Raumtemperatur.
- Kontrollschnitte: decken eine kleine Anzahl von Abschnitten mit 2,5 g / ml Rote-BGT (Donor nur, beschriftet C1 Kontrollen), und auch einige Abschnitte mit 10 g / ml dunkelrotes BGT (nur Akzeptor; bezeichnet C2 Kontrollen). Diese Kontrollen Inkubieren wie in Schritt 7.3.
- Wäsche gleitet 3 x 10 min in PBS und -halter Glycerinbasis, lichtbeständige Eindeckmedium (siehe Schritt 3.12).
- Führen Probenahme von Endplatten, wie in Schritt 6.7. Fluoreszenz von der Donor und Akzeptor sollte zumin Endplatten perfekt kolokalisiert aufgrund der zufälligen Bindung der Fluoreszenzmoleküle BGT.
- Steuer Bilder: Mit dem 40X-Objektiv und niedrige Laserleistung optimieren redBGT Verstärkungs- und Offset-Level-Einstellungen für Endplatten aus einem Steuerschieber C1. Optimieren weit redBGT Verstärkungs- und Offset-Ebenen für Endplatten von Steuerschieber C2. Bestätigen Sie das Fehlen einer Fluoreszenz Durchschlagen.
- Ohne Änderung der Laserleistung, Gain oder Offset-Level-Einstellungen zu bewegen, um den experimentellen Folien und sammeln Bilder (pre-Photobleich) für beide Fluoreszenzkanäle.
- Selektiv photobleach die dunkelrotes BGT über einen Teil eines einzigen Endplatte durch das Zoomen in der Scanbereich der Scanvorgang 10 mal mit dem 633-nm-Laser bei 100% Leistung. Die Fluoreszenz im gescannten Bereich sollte blass.
- Setzen Sie die Laserleistung und zu vergrößern und sammeln nach Bleich Bilder auf beiden Fluoreszenzkanäle mit den in 7.7 fest konfokalen Einstellungen.
- Berechnen Sie die FRET-Effizienz (E) aus der prozentualen Zunahme der Spender (rot-BGT) Fluoreszenz nach Photobleich der Akzeptor (dunkelrotes BGT) nach der folgenden Formel *:
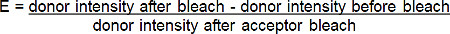
* Für alle Fälle, in denen die Fluoreszenz des Donor-after photo Acceptors zunimmt.
Ergebnisse
Messung von Synaptic Umgebung am NMJ
Jede Schätzung Bereich stützt sich auf die Zeichnung einer Grenz um das Ausmaß der synaptischen Spezialisierungen definieren. Bei gesunden jungen Erwachsenen Muskeln sollten NMJ Bilder gut definierten Grenzen sowohl für AChR und Synaptophysin-Färbung (2A und B) angezeigt werden sollen. Fluoreszenzintensität sowohl für AChR und Synaptophysin steigt scharf an der Grenze zwischen dem peri-synaptischen...
Diskussion
Die hier beschriebenen Protokolle konnten wir zuverlässig messen und zu quantifizieren Veränderungen in den Eigenschaften der NMJ in einer Reihe von Bedingungen, einschließlich der normalen Alterung und Krankheitszuständen. Die für en beschriebenen Methoden stellen NMJ Bilder wird es den Forschern ermöglichen, den Bereich der prä- und postsynaptischen Spezialisierungen und den Bereich der synaptischen Überlappung / Ausrichtung zu vergleichen. Um die relative Intensität der prä- und postsynaptischen Proteine ?...
Offenlegungen
The authors declare they have no competing financial interests.
Danksagungen
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materialien
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Referenzen
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten