É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Junção Neuromuscular: Synapse Medir o tamanho, Mudanças de fragmentação e em Synaptic Density proteína utilizando microscopia de fluorescência confocal
Neste Artigo
Resumo
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Resumo
A junção neuromuscular (JNM) é o grande, sinapse relé colinérgicos através do qual os neurônios motores mamíferos controlar a contração muscular voluntária. As mudanças estruturais na JNM pode resultar em falha da neurotransmissão, resultando em fraqueza, atrofia e até mesmo a morte da fibra muscular. Muitos estudos têm investigado como modificações genéticas ou doença pode alterar a estrutura do JNM rato. Infelizmente, pode ser difícil comparar os resultados directamente a partir destes estudos, uma vez que eles frequentemente utilizados diferentes parâmetros e métodos analíticos. Três protocolos estão descritos aqui. O primeiro utiliza projecção de intensidade máxima imagens confocais para medir a área de receptor de acetilcolina (AChR) da membrana pós-sinápticos domínios ricos em na placa terminal e a área de coloração das vesículas sinápticas no terminal do nervo pré-sináptico sobrejacente. O segundo protocolo compara as intensidades relativas de imunocoloração para proteínas sinápticas na membrana pós-sináptica. O terceiro protocol usa Transferência de Fluorescência de Ressonância Energia (FRET) para detectar alterações na embalagem de AChRs pós-sinápticos na placa motora. Os protocolos foram desenvolvidos e aperfeiçoados ao longo de uma série de estudos. Fatores que influenciam a qualidade e consistência dos resultados são discutidos e dados normativos são fornecidos para NMJs em ratos adultos jovens e saudáveis.
Introdução
A junção neuromuscular (JNM) é a sinapse relé crítico que medeia a comunicação entre o sistema nervoso e no músculo esquelético. Ela é necessária para todo o movimento voluntário. A microscopia de fluorescência tem sido utilizada para estudar os efeitos de transgenes no rato JNM 1-3 ou para comparar os efeitos da idade, dieta, exercício e doença agravada por NMJs roedor 4-11. Tais estudos têm nos ensinado muito sobre a fisiologia e fisiopatologia da JNM, mas os diversos parâmetros relatados (por exemplo, a área AChR, área de placa motora, comprimento perímetro, os índices de fragmentação), muitas vezes tornam difícil comparar os resultados desses estudos. Existe a expectativa de aumentar para os investigadores pré-clínicos para ser capaz de demonstrar a reprodutibilidade, particularmente em estudos com modelos de roedores de doença 12. Os protocolos descritos aqui foram refinados através de uma série de estudos que investigaram ch desenvolvimento, fisiológico e fisiopatológicoanges ao JNM. Tais estudos exigem medição da área de especializações sinápticas na placa motora do mouse, a densidade relativa de embalagem de proteínas sinápticas dentro especializações pós-sinápticos 13-15.
A utilidade destes métodos é ilustrada por estudos recentes em um modelo de rato anti-almíscares miastenia gravis. Injeções diárias de IgG de miastenia anti-Musk-positivo gravis pacientes em camundongos adultos fez com que eles se tornam fracos dentro de 2 semanas 16. Imagens de projecção máxima das secções confocais musculares que foram duplamente marcadas para a sinaptofisina (a-terminais nervosas) e pós-sinápticos AChRs revelou um declínio progressivo na área de coloração AChR como a principal alteração. É importante salientar a taxa de declínio foi suficiente para explicar declínios comparáveis na amplitude dos potenciais sinápticos, falha da transmissão sináptica e fraqueza muscular 17,18. Qualitativamente achados semelhantes foram relatados por outros grupos de pesquisa10,19. Os mesmos métodos de medição JNM já foram utilizadas para avaliar o impacto de três fármacos para o tratamento anti-almíscares miastenia gravis neste modelo de ratinho 20,21.
Envelhecimento sedentário pode levar à perda de conexões neuromusculares. Os protocolos descritos aqui revelaram um declínio associado à idade na área do terminal nervoso synaptophysin em placas motoras como ratos progredir na velhice. Os mesmos métodos revelou que o exercício voluntário poderia, em grande parte impedir a redução da área terminal do nervo pré-sináptico 22, de acordo com o trabalho anterior por outros grupos de quatro. Perda de conexões neuromusculares também ocorre no modelo de rato SOD1G93A esclerose lateral amiotrófica 9,23.
Os estudos citados demonstram que uma variedade de condições de saúde pode levar a reduções na área de uma das especializações pré ou pós-sinápticos no NMJ. Isso pode resultar em diversão sináptica prejudicadacção ou podem anunciar perda completa da ligação neuromuscular. Três protocolos estão descritos que permitem a quantificação da área e densidade de especializações sinápticos. O objectivo do primeiro protocolo é o de proporcionar uma medida prática e reprodutível das áreas de pré- e pós-sinápticos especializações e o seu alinhamento em NMJs de mamífero, utilizando microscopia de fluorescência. Bidimensionais imagens máximos projeção confocal e análise de imagem com NIH ImageJ é usado para detectar mudanças na área de coloração synaptophysin (vesículas sinápticas), AChRs pós-sinápticos e área de sobreposição sináptica. Parâmetros confocal de imagem (ganho e nível de deslocamento) são optimizados para cada NMJ de modo a maximizar a informação visual usado para discernir a área de especialização sináptica. Falha neuromuscular também pode resultar de alterações na densidade do RACh pós-sináptico e / ou outras proteínas sinápticas. O segundo protocolo pode ser aplicado para detectar alterações na densidade relativa de proteínas pós-sinápticos taiscomo almíscares, rapsyn, distroglicana, fosforilado Src quinase e fosforilado AChR 18,21.
Em pacientes com miastenia gravis, uma densidade reduzida de AChR dentro da membrana pós-sináptica é a causa imediata da falha sináptica e fraqueza muscular. O terceiro protocolo descreve um método de transferência de Fluorescência de Ressonância Energia (FRET) para avaliar mudanças na proximidade do AChRs adjacentes dentro das membranas pós-sinápticos 14,15. Este método detecta transferência de energia entre AChRs vizinhos marcados com fluorescência-α-bungarotoxina (BGT). FRET ocorre apenas quando os doadores e aceitadores de sondas fluorescentes estão a menos de 10 nm de intervalo. Isso pode revelar alterações submicroscópicas () no aperto de embalagem AChR que podem se relacionam diretamente com a amplitude dos potenciais sinápticos.
Estes três protocolos, refinados ao longo da última década, fornecer medidas complementares a integridade NMJ de uma forma consistente e reproduzível. A utilização de protocolos padronizados dend parâmetros deve facilitar a comparação dos efeitos dos genes e intervenções ambientais sobre a JNM mamíferos.
Protocolo
NOTA: concepção, realização e divulgação de experiências com animais devem ter em conta as diretrizes atuais 24. Esse trabalho deve ser previamente aprovado pela autoridade de bem-estar animal local (no nosso caso, o Comité de Ética Animal da Universidade de Sydney).
1. A eutanásia do animal e Dissection Muscle
- Transferir o rato da sala de exploração para uma sala separada onde é sacrificado com uma injeção intraperitoneal de solução de pentobarbital (30 mg / kg), utilizando o método de manuseio do mouse detalhado por Shimizu 25. Posicione o mouse de volta para sua gaiola.
- Uma vez que a respiração do rato parou por mais de 1 min, testar o reflexo de pé-de retirada por beliscar suavemente a pé, e do reflexo corneal por escovando levemente a córnea. Só quando as respostas reflexas estão ausentes pode o mouse esteja preparado para dissecção.
- Consulte um atlas de anatomia roedor como Chiasson 26 e / ou procurar a ajuda de um experienanatomista ced antes de tentar dissecção do músculo de interesse. Em cada caso, remover os pêlos da pele que recobre usando uma pequena máquina de barbear eléctrica antes da abertura da pele para expor o músculo.
NOTA: A dissecção será diferente para cada músculo anatomicamente distintos. - Utilizando uma pinça sem corte liberar o músculo que recobre as membranas e tecidos circundantes. Agarrar e cortar o tendão distai do músculo para separar a partir da sua inserção.
- Delicadamente, provocar e cortar o músculo livre de tecido circundante de volta à sua origem. Resumidamente colocar o músculo recentemente dissecados em solução 0,1 M de solução salina de fosfato tamponada (PBS) ou solução de Ringer, antes de posterior processamento.
2. Preparar o músculo por cryosectioning
NOTA: preservação estrutural óptima pode ser conseguida por toda a perfusão dos animais tal como anteriormente descrito 27, ou imersão fixação (para pequenos músculos) como descrito no passo opcional 2.1. No entanto,4% de paraformaldeído fixação pode prejudicar a coloração subsequente com muitas sondas de anticorpo fluorescente com e-BGT. Glutaraldeído particularmente deve ser evitada. Se os músculos não são para ser fixa devem ser imediatamente congeladas rapidamente (proceder a 2,3).
- Fixação imersão Opcional: Pin o músculo a cera em uma placa de Petri com comprimento de repouso. Cobrir o músculo com 2% w / v de paraformaldeído (dissolvida de fresco em PBS) durante 2 horas à temperatura ambiente. Lavar com 3 mudas de PBS durante 30 min (3 x 10 minutos) e depois substituir o PBS com 30% w / v de sacarose em PBS e incubar O / N a 4 ° C.
- Adicione moldes ("barcos") com antecedência por dobragem dois centímetros x 1.5 cm pedaços de folha de alumínio, como mostrado na Figura 1. Colocar um pedaço de membrana de nitrocelulose na parte inferior do barco. Suavemente para cryostat incorporação matriz (tabela de materiais) para o barco a uma profundidade de 2 mm, tendo o cuidado de evitar bolhas de ar. Coloque o músculo para o barco, alinhando-o com as linhas de caneta esferográfica sobrea nitrocelulose. Adicionar mais matriz de incorporação, de modo a cobrir completamente o músculo (Figura 1).
- Tubos de polipropileno pré-label com um marcador indelével. Colocar uma gota de água em cada tubo e relaxar o tubo em azoto líquido.
NOTA: A gota de água congelada mantém a pressão de vapor e impede a dessecação durante prolongada -80 ° C de armazenamento - Usando uma máscara para o rosto, luvas grossas e um grande par de fórceps sem corte, reduzir parcialmente um pequeno balão de metal (3 cm de diâmetro, 8 cm de profundidade) contendo 2 cm de profundidade de isopentano em um recipiente de nitrogênio líquido por 30 s. Retirar o copo e coloque-o na bancada. Utilizando um par de pinças menor rombas colocar o molde contendo o músculo e a incorporação da matriz no isopentano arrefecido. Tome cuidado para evitar a mistura de nitrogênio líquido com o isopentano.
- Permitir 2 min para o bloco de congelar completamente antes de usar uma pinça sem corte para levantar o bloco congelado para fora e feche-o na pr corretarotulado-e e tubo de pré-arrefecida (passo 2.3).
- Armazenar temporariamente os tubos em azoto líquido antes da transferência para -80 ° C. Registra todas as amostras em uma planilha de conteúdos congelador.
3. cryosectioning e fluorescência de coloração para en face Imagens de NMJs
- Descascar o molde de alumínio. Dentro da câmara de -20 ° C criostato anexar o bloco congelado para o mandril criostato, de modo a cortar 20 mm criocortes paralelas ao eixo longo das fibras musculares (Figura 1). Pegue as seções sobre poli-L-lisina ou gelatina revestido lâminas de microscópio.
- NOTA: Ignore essa etapa se o tecido é fixado antes do congelamento. Depois de 30 min para permitir secções para secar nas lâminas, corrigi-los, colocando uma gota de 2% de paraformaldeído em PBS, sobre cada secção durante 15 min à TA.
- Lave as lâminas 3 x 10 min em PBS num frasco Coplin, e, em seguida, mergulhar as lâminas em PBS contendo 0,1 M de glicina durante 30 min para bloquear grupos aldeído residual.
- Lavar as lâminas durante 10 minutos em PBS, em seguida, imersas em metanol (arrefecida a -20 ° C) durante 7 min. Esta etapa permeabilização é parte da rotina de marcação dupla com fluorescente-BGT e anti-synaptophysin mas pode afetar adversamente imunomarcação para algumas outras proteínas.
- Lavagem das lâminas 2 x 10 min em PBS, em seguida, colocar cada slide em uma câmara úmida estável e nivelada. Imediatamente cobrir cada secção com 20 ul de solução de bloqueio (0,2% de Triton X-100, 2% de albumina sérica bovina (BSA) em PBS) durante 1 h à TA. Cortes não devem ser autorizados a secar em qualquer fase do processo immunostaining.
- Realizar a primeira incubação: Tomando um slide de cada vez retire cuidadosamente a solução de bloqueio excesso de mais de cada seção e substituí-lo com 20 l de coelho anti-synaptophysin (diluído 1: 200 na solução de bloqueio).
- Incluir um slide-controle negativo que serão incubadas apenas com solução de bloqueio. Este "não-primário controle anticorpo"É essencial em cada corrida imunomarcação.
- Tomando cuidado para que o anticorpo primário permanece no local sobre cada seção, feche a câmara úmida e incubar por 1-2 dias a 4 ºC.
- Inspecione cada seção para confirmar que o anticorpo primário continua em vigor. Use uma pipeta Pasteur para lavar cuidadosamente cada slide com PBS e colocá-lo em um frasco Coplin. Lavar todos os diapositivos 3 x 10 min em PBS.
- Realizar incubação secundário. Tomando uma lâmina de cada tempo, retire cuidadosamente o excesso de PBS, colocá-lo na câmara úmida e cobrir cada seção com 20 l de uma mistura contendo FITC conjugado IgG de burro anti-coelho e BGT conjugado com tetrametilrodamina ou outro fluoróforo vermelho (TRITC- / redBGT; 5 g / ml) diluídas em solução de bloqueio. Incubar à temperatura ambiente durante 2 horas.
- Lavagem das lâminas 3 x 10 min em PBS em frascos Coplin.
- Tomando uma lâmina de cada tempo, retire cuidadosamente o excesso de PBS e montar com uma lamela usando um volume mínimo de, gliccroà base de l, fade-resistindo meio de montagem. Sele as bordas das lamelas com clara verniz. Deixe-o secar duro.
- Guarde os slides no escuro a 4 ºC por até uma semana, ou a -20 ºC por períodos mais longos de armazenamento (até vários meses).
4. Imparcial Amostragem e En Face Imagem de Motor endplates
- Cegar os slides, rotulando cada slide com um número de código aleatório que permanece conhecido apenas por um segundo pesquisador (que não estão envolvidos na análise). Como resultado, o operador permanece cego para os grupos de tratamento até a quantificação dos parâmetros JNM está completa para todas as amostras.
- Coloque o slide no palco microscópio e visualizá-lo sob iluminação de campo de largura, com o conjunto de filtros TRITC (63X óleo 1.3 NA objetivo). Mova progressivamente (campo por campo) da esquerda para a direita e para trás até que uma placa terminal aparece no campo (Figura 2A).
Critério de amostragem:: NOTA Toda estrutura AChR manchadas de que é relativamenteplano e enfrenta o objetivo (ou seja, se estende <15 m de dimensão z) é considerada uma placa terminal e é fotografada para análise (crescentes de coloração AChR representam secções transversais através de placas finais e, portanto, estão excluídos). - Com o conjunto de pinhole confocal a 1,0 unidade de Airy e baixa potência do laser otimizar o ganho e offset níveis para TRITC / red-BGT (laser de 532 nm) na placa terminal que está a ser trabalhada. Próximo optimize FITC / fluorescência synaptophysin utilizando o laser de 488 nm. Colete um z-stack da placa terminal com um intervalo de 0,7 mm entre cada fatia óptica. Salve as imagens com um nome de arquivo que inclui a data da sessão de imagem, o nome de código do slide e o número da placa motora.
NOTA: As digitalizações usando a 488 nm e 532 nm lasers (ITCF e TRITC) devem ser recolhidas sequencialmente (não simultaneamente) para evitar a contaminação do canal FITC por fluorescência do fluoróforo vermelho e vice-versa (sangrar-through). - Repetir a uma amostragemnd imagens de passos 4,2-4,3 até 20 de placas terminais são recolhidos a partir do slide / amostra.
- Mude para o próximo slide codificados e repetir 4,2-4,4. Repita esse procedimento para cada uma das lâminas codificadas.
- Coletar algumas imagens de placas terminais da lâmina de controlo (sem-primário controle anticorpo) usando as configurações confocal que foram encontrados óptima para os slides experimentais (o canal de fluorescência FITC deve aparecer escuro).
- No final da sessão de transferência confocal os arquivos de imagem para outro computador e faça backup dos arquivos originais em uma unidade ou servidor externo.
5. Medição da Área de Synaptic Especializações em en face Images
- Use NIH ImageJ gratuito (http://imagej.nih.gov/ij/) para preparar projeção máxima (MIP) as imagens de cada pilha z. Salvá-los como arquivos TIFF (Figura 2A e B). Os nomes de arquivo deve incluir a data da sessão de imagem, código de exemplo, número de placa terminal e do canal fluorescente (por exemplo, 060414_5723_7_FITC.tiff).
- Abra a imagem z-projeção no ImageJ. Selecione a imagem do canal receptor de acetilcolina (Figura 3A) e selecione: Imagem> Tipo> 8-bit para converter a imagem de cor RGB de 24 bits em três imagens em escala de cinza de 8 bits na tela.
- Usando a ferramenta polígono ImageJ desenhar um esboço em torno da placa terminal de interesse no redBGT manchado (CADH) canal de modo a incluir todas as regiões manchadas aparentes de placa terminal indivíduo em particular, excluindo qualquer coloração que não se originam a partir da placa terminal de interesse ( Figura 3C).
- Aplicar um limite mínimo de intensidade para a imagem selecionando: Image> Adjust> Threshold (Figura 3E e screenshots ImageJ associados).
- Ajuste o nível de limiar, de modo a isolar as porções AChR coradas enquanto excluindo circundante sinal de fundo como sub-limite (Figura 3E). Abra um segundo fôlegoow com a imagem original (de tom contínuo) imediatamente ao lado da janela para comparação, para facilitar a decisão sobre o valor de limiar. Grave o valor limite para utilização posterior em co-localização analisa.
- Mantendo o esboço polígono ao redor da placa terminal selecione: Analisar> Analisar Partículas. No menu pop-up especificar o intervalo de tamanhos como: 50 a infinidade pixels (isso elimina minúsculos artefatos decorrentes do ruído elétrico no photomultiplier).
- Analisar Partículas comando gera uma janela com uma lista de áreas supralimiares discretos e seus valores de intensidade de fluorescência numerados como eles aparecem na imagem binária (Figura 3G e tela ImageJ associado). Copie este dados em uma planilha rotulados.
- Medir a área placa terminal Total (área dentro do polígono) selecionando: Analisar> Medida. Isto produz a área total da placa terminal. Copiar e colar os dados para as áreas RACh e intensidades emuma planilha certificando-se de rotular as colunas de forma adequada, as linhas serão utilizadas para placas finais individuais para slides específicos.
- Mudar para o canal de fluorescência anti-sinaptofisina e repetir os passos 5,1-5,5, mas para o canal FITC (Figura 3B, D e F). O objetivo é ajustar o limite para que ele cria uma imagem binária que, tanto quanto possível, coincide com os limites da coloração percebida pelo olho. Grave o valor limite.
- Medir a área de sobreposição, aplicando as seguintes etapas: Abra o arquivo original que contenha as duas imagens dos canais e dividi-lo em duas imagens separadas, selecionando: Imagem> Pilhas> pilha para Images.
- Usando o plugin co-localização (baixado e instalado a partir da página web ImageJ) Selecione: Pluggin> co-localização de entrada e os valores limite previamente gravada para os canais RACh e nervosas no respectivo canal de consulta bboi. O resultado será uma imagem sobreposição de pixels brancos (Figura 3H e screenshots ImageJ associados).
- Converter a imagem sobreposição recém-criado em um formato em tons de cinza e aplicar um limite para o valor máximo. O limite máximo só seleccionará os pixels brancos, correspondendo a zona de sobreposição dos dois canais anteriores. Ficha na folha de cálculo o valor da área resultante de "co-localização ', o que representa a área de sobreposição de pixels.
- Prepare uma folha de cálculo de médias das amostras de dados, calcular e definir os desvios-padrão e os erros padrão como histogramas ou scatterplots 20,22. Note-se que o valor de n representa geralmente o número de murganhos por grupo de amostras para fins estatísticos.
- Lote placa terminal em áreas RACh como diagramas de dispersão ou histogramas de frequência para determinar se os dados são distribuídos normalmente antes do teste estatístico (Figura 6).
6. Coloração RelativaIntensidades comparadas usando transversais secções ópticas
NOTA: Para este processo do protocolo de todas as amostras de músculo juntos e imagem em uma única sessão confocal. No planejamento de um experimento permitem até tempo de imagem 30 min por amostra muscular.
- Cortar 15 mm criocortes transversal ao eixo longo das fibras musculares e recolher em lâminas tal como descrito no passo 3.1.
- Realizar a coloração de fluorescência como descrito nos passos 3,2-3,13.
- Código lâminas coradas de modo que as imagens e as análises são realizadas com o operador cego para o grupo de tratamento, tal como descrito na etapa 4.1.
- Usando um objetivo fluorescência 40X (NA 0,75) examinar brevemente uma seção de cada slide para determinar um único ganho e offset definição do nível de AChR que será adequado para todas as placas terminais em todas as lâminas de amostra. A placa terminal mais brilhante deve, então, ser um pouco abaixo de 256 cinza na escala. Esta optimização deve ser realizado separadamente para a segundo fluorescence canal (recolhidos sucessivamente). Grave o ganho fixo e compensar as definições de nível e não alterá-los durante toda a sessão de imagem.
- Recolhe imagens de um slide padrão de fluorescência (por exemplo, não-esferas fluorescentes de branqueamento), utilizando os mesmos parâmetros, no início e no fim da sessão confocal para detectar qualquer possível variação na intensidade do laser.
- Use o canal AChR para digitalizar o slide progressivamente para localizar placas terminais.
- Concentre-se para encontrar o plano de corte óptico único em cada campo do microscópio que contém o maior número de placas terminais AChR coradas.
- Digitalizar esta seção óptico único duas vezes e salvar a imagem em média (Figura 4G).
- Mantendo a mesma opção de plano focal para o segundo canal de fluorescência (proteína de interesse) e recolher a imagem como no passo 6.8. Salve o arquivo de imagem, incluindo o nome do arquivo: data de sessão de imagem, código de exemplo, o número de imagem e um símbolo para indicar o canal fluorescente. Figura 4A - F mostra exemplos da distribuição de placa terminal de AChR comparação com rapsyn, almíscar ou -dystroglycan (-DG).
- Mova o estágio para o próximo campo que contém um ou mais placas terminais e repita o passo 6,8-6,9. Repita este procedimento até um total de 60 placas terminais são gravadas.
- No final da transferência sessão de imagens de todos os arquivos para outro computador e apoiá-los.
- Abra cada arquivo de imagem original e durante a exibição do canal AChR, selecione: Imagem> Pilhas> pilha para Images, para dividir os canais.
- Selecione: Imagem> Tipo> 8bit para converter para o formato em tons de cinza de 8 bits na tela. Faça isso para ambos os canais de fluorescência.
- Selecione: Imagem> Pilhas> Imagens de pilha. Abra uma nova pilha de duas imagens de 8 bits previamente separados. Pode-se então convenientemente alternar entre os dois canais de fluorescência dentro da janela única.
- Use a ferramenta polígono para desenhar uma line firmemente em torno do perímetro do RACh coloração (Figura 4I).
- Selecione: Analisar> Medir para medir a intensidade média dos pixels para AChR na zona delimitada (observe a importância do desenho da linha firmemente). Copie esse valor em uma planilha rotulados.
- Mantendo o mesmo esquema polígono (para definir a área a ser medido), mude para o segundo canal fluorescente (por exemplo, a Figura 4B, D, F) e selecione: Analisar> medida. Isto vai produzir a intensidade média de coloração para a proteína de interesse dentro da área definida pela coloração sináptica AChR.
- Escolha uma área longe de coloração visível placa terminal em seguida, selecione: Analisar> Medir para medir a intensidade média de fundo de fluorescência. Repita esse procedimento para o outro canal de fluorescência / s e copiar os valores de fundo para a planilha de valores de fluorescência.
- Submarinotrato os valores médios a partir do fundo da placa terminal para se obter os valores das intensidades corrigidos para AChR e a proteína de interesse em cada placa terminal.
- Dividir os valores de intensidade de placa terminal corrigidos para a proteína de interesse, a intensidade de fluorescência corrigida BGT para se obter os rácios de intensidade de fluorescência 14,21
7. A comparação da densidade da membrana pós-sináptico AChR Usando FRET
NOTA: Este protocolo avalia o grau ao qual estão intimamente AChRs embalado (<10 nm espaçamento) na membrana pós-sináptica. A combinação precisa fluoróforo dador e o aceitador é crítico para este ensaio de FRET. Nomes e detalhes dos fluoróforos são dadas na tabela de Materiais. Suas propriedades espectrais, em relação a FRET, são discutidos em nossos trabalhos anteriores 14,15.
- Prepare criosecções transversais fixos como descrito na seção 6.1. Todos os grupos de amostras devem ser processadas em conjunto e imagemd na mesma sessão confocal.
- Misture bem 2,5 g / ml-BGT vermelho (FRET doador) com 10 g / ml vermelha extrema-BGT (FRET aceitante) com a solução em um pequeno tubo de plástico bloqueio por pipetagem cima e para baixo 12 vezes. Esta mistura 1: 4 molar maximiza a eficiência da TERF 14.
- Colocar cada lâmina numa câmara humidificada, cobrir cuidadosamente cada secção com uma gota (12 ul) da mistura acima e incubar durante 1,5 horas à temperatura ambiente.
- Seções de controle: cobrir um pequeno número de seções com 2,5 g / ml red-BGT (único doador; controles C1 marcados), e também algumas seções com 10 g / ml far-red-BGT (único receptor; controles C2 marcados). Incubar esses controles como no passo 7.3.
- Lavagem das lâminas 3 x 10 min em PBS e montar em baseado em glicerol, fade-resistindo meio de montagem (veja o passo 3.12).
- Obtenção de amostras de placas terminais como no passo 6.7. A fluorescência do dador e aceitador deve ser perfeitamente co-localizado no placas terminais devido à ligação aleatória de moléculas fluorescentes-BGT.
- Imagens de Controle: Usando a objetiva de 40X e laser de baixa potência otimizar ganho redBGT e compensar as definições de nível para endplates de um C1 controle slide. Otimizar ganho far-redBGT e compensar os níveis de placas terminais de controle de deslizamento C2. Confirmar a ausência de qualquer fluorescência através de sangria.
- Sem alterar a potência do laser, ganhar ou configurações de nível de compensar passar para os slides experimentais e recolher imagens (pré-photobleach) para ambos os canais de fluorescência.
- Seletivamente photobleach a extrema-vermelho-BGT sobre uma porção de uma única placa terminal fazendo zoom na área de digitalização, em seguida, a digitalização de 10 vezes com o laser de 633 nm a 100% de energia. A fluorescência na área digitalizada deve tornar-se fraca.
- Repor a potência do laser e zoom e coletar imagens de pós-branqueamento em ambos os canais fluorescentes usando as configurações confocal estabelecidos em 7,7.
- Calcule a eficiência FRET (E) a partir do aumento percentual de doadores (red-BGT) fluorescência seguinte photobleach do aceitante (far-red-BGT) de acordo com a seguinte fórmula *:
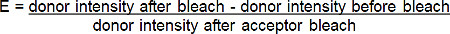
* Para todas as situações em que a fluorescência do dador aumenta após fotobranqueamento do aceitador.
Resultados
Medição do Synaptic Area no NMJ
Qualquer estimativa de área depende do desenho de um limite para definir a extensão de especializações sinápticas. Em músculos adultos jovens saudáveis imagens JNM deve exibir limites bem definidos para ambos AChR e coloração sinaptofisina (Figura 2A e B). A intensidade da fluorescência para ambos AChR e sinaptofisina aumenta acentuadamente no limite entre a parte de peri-sináptica e sinápt...
Discussão
Os protocolos descritos aqui nos permitiram medir de forma confiável e quantificar mudanças nas propriedades do NMJ através de uma série de condições, incluindo estados normais de envelhecimento e doenças. Os métodos descritos para en enfrentar imagens JNM vai permitir aos pesquisadores comparar a área de especializações pré e pós-sinápticos e da área de sináptica sobreposição / alinhamento. Para comparar a intensidade relativa de proteínas pré e pós-sinápticos O segundo protocolo, que usa cortes ?...
Divulgações
The authors declare they have no competing financial interests.
Agradecimentos
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materiais
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Referências
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados