このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経筋接合部:測定シナプスサイズ、断片化および共焦点蛍光顕微鏡を用いてシナプスタンパク質の密度の変化
要約
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
要約
神経筋接合部(NMJ)は、哺乳動物、運動ニューロンは、自発的な筋収縮を制御を通じて大、コリン作動性シナプスのリレーです。 NMJでの構造変化は、弱さ、萎縮と筋線維の死で、その結果、神経伝達障害が発生することができます。多くの研究は、遺伝子改変または疾患マウスNMJの構造を変化させることができる方法を検討した。残念ながら、それは直接、彼らはしばしば、異なるパラメータおよび分析方法を採用しているため、これらの研究からの知見を比較することは困難であることができる。 3つのプロトコルは、ここで説明されている。最初は、アセチルコリン受容体(AChRの)の面積を測定するために最大値投影共焦点画像を使用して終板とその上のシナプス前神経終末におけるシナプス小胞の染色の領域におけるリッチシナプス後膜ドメイン。第二のプロトコルは、シナプス後膜におけるシナプス蛋白質の免疫染色の相対強度を比較します。第三のPRotocolはエンドプレートでのシナプス後性AChRのパッキングの変化を検出するために蛍光共鳴エネルギー移動(FRET)を使用します。プロトコルが開発され、一連の研究の上に洗練されてきた。品質と結果の一貫性に影響を与える要因を議論すると基準データは健康な若い成体マウスのNMJで提供される。
概要
神経筋接合部(NMJ)は、神経系および骨格筋との間の通信を仲介する重要な中継シナプスである。これは、すべての自発的な運動のために必要とされる。蛍光顕微鏡は、長いNMJ 1-3マウスの導入遺伝子の影響を研究するために、またはげっ歯類のNMJ 4-11時の年齢、食事、運動、および疾患の影響を比較するために使用されてきた。このような研究は私たちにNMJの生理学および病態生理学について多くを教えてきましたが、( 例えば、AChRのエリア、終板面積、周囲長、断片化指数)が報告多様なパラメータは、しばしば、それが難しいこれらの研究の調査結果を比較することにする。前臨床研究者が特に疾患12の齧歯類モデルを用いた研究では、再現性を発揮できるようにするための増加期待があります。ここで説明するプロトコルは、発達生理学的および病態生理学的CHを調査の一連の研究を通して洗練されたNMJにアンジェス。このような研究は、マウスの運動終板と後シナプスの専門分野13-15内のシナプスタンパク質のパッキングの相対密度でシナプスの専門分野の面積の測定を必要とする。
これらの方法の有用性は、重症筋無力症、抗MuSKのマウスモデルにおける最近の研究によって示されている。抗MuSKの陽性重症筋からのIgGの毎日の注射は成体マウスに、患者は彼らが2週間以内に16弱になった原因無力。 (神経端末で)シナプトフィジンのための二重標識された筋肉切片の共焦点最大投影画像とシナプス後性AChRは、一次変化としてのAChR染色の分野で進行性の低下を明らかにした。重要なことには減少率は、同等のシナプス電位の振幅の減少、シナプス伝達の障害及び筋衰弱17,18を説明するのに十分であった。定性的に類似の所見は他の研究グループにより報告された10,19。同じNMJ測定方法ので、このマウスモデル20,21に無力抗MuSKの重症筋を治療するための3種の薬物の影響を評価するために使用されている。
座りがちな高齢化は、神経筋の接続の損失につながることができます。マウスは古い時代に進行としてここに記載されているプロトコルは、モータのエンドプレートでの神経終末シナプトフィジンのエリアの加齢に伴う減少を明らかにした。同じ方法は、自発的な運動は、主に他のグループ4による以前の研究と一致して、シナプス前神経末端領域22の低下を防ぐことができることを明らかにした。神経接続の損失はまた、筋萎縮性側索硬化症9,23のSOD1G93Aマウスモデルにおいて発生する。
上記の研究では、健康状態の様々なNMJでの前または後シナプスの専門分野のいずれかの面積の削減につながる可能性があることを示している。これは損なわれ、シナプス楽しいことがありctionまたは神経筋の接続の完全な喪失を告げることがあります。 3つのプロトコルは、シナプスの専門分野の面積と密度の定量化を可能にすることが記載されている。第一のプロトコルの目的は、蛍光顕微鏡を用いて、シナプス前および後の専門および哺乳類のNMJでのその配列の領域の実用的かつ再現可能な測定を提供することにある。二次元の最大投影共焦点画像およびNIH ImageJを用いて画像解析をシナプトフィジン染色(シナプス小胞)、シナプス後性AChRおよびシナプス重なり領域の面積の変化を検出するために使用される。シナプスの専門分野を識別するために使用される視覚情報が最大となるように共焦点撮像パラメータ(ゲイン、オフセット·レベル)は、各NMJのために最適化される。神経筋障害はまた、シナプス後のAChRおよび/または他のシナプスタンパク質の密度の変化に起因することができます。第二のプロトコルは、シナプス後のタンパク質の相対密度の変化を検出するために適用することができるムスク、rapsyn、ジストログリカン、リン酸化されたSrcキナーゼおよびリン酸化のAChR 18,21-として。
重症筋無力症では、シナプス後膜内のAChRの減少密度は、シナプス障害や筋力低下の直接の原因である。第三のプロトコルは、シナプス後膜14,15内の隣接性AChRの近接性の変化を評価するための蛍光共鳴エネルギー移動(FRET)法が記載されている。この方法は、蛍光αブンガロトキシン(BGT)で標識された隣接性AChRの間のエネルギー移動を検出する。 FRETは、蛍光ドナーとアクセプタープローブが離れて10nm未満である場合にのみ発生します。これは、直接シナプス電位の振幅に関連することができるのAChRパッキングの気密性で(超顕微鏡)の変化を明らかにすることができます。
過去10年間で洗練されたこれらの3つのプロトコルは、一貫して再現可能な方法で、NMJ整合性の補完的な対策を提供する。標準化されたプロトコルを使用してA番目のパラメータは、哺乳類のNMJの際の遺伝子と環境介入の効果の比較を容易にするはずである。
プロトコル
注:動物実験の設計、行為および報告は、現在のガイドライン24を考慮すべきである。このような作業は地元の動物福祉局(シドニー大学の我々の場合動物倫理委員会)によって事前に承認されなければならない。
動物と筋解離の1安楽死
- それは清水25による詳細なマウス操作法を用いて、ペントバルビトン溶液(30 mg / kgを)の腹腔内注射で安楽死された別の部屋に保持部屋からマウスを転送します。そのケージに戻ってマウスを置きます。
- マウスの呼吸以上1分間停止したら、軽く角膜をブラッシングにより穏やかに足をつまんで足-引っ込め反射、および角膜反射をテストします。反射反応が存在しないときだけマウスを解剖するために調製することができる。
- そのようなChiasson 26などのげっ歯類解剖学のアトラスに相談する、および/ またはの体験の助けを求める興味のある筋肉の解剖を試みる前にCED解剖学者。それぞれのケースで筋肉を露出するために皮膚を開く前に、小型電気シェーバーを使用して覆う皮膚から毛を取り除く。
注:解剖は、各解剖学的に、個別の筋肉のために異なります。 - 鈍鉗子を使用すると、膜の上に位置し、周辺組織からの筋肉を解放する。つかみ、その挿入から筋肉を分離するための遠位腱を切った。
- ゆっくりと右バックその原点に周囲の組織から自由な筋肉をいじめるとスニップ。簡単に言えば、さらに処理する前に、0.1Mリン酸緩衝生理食塩水(PBS)溶液またはリンゲル液中に新たに解剖筋肉を置く。
2.凍結切片化のための筋肉の準備
注:オプションのステップ2.1で説明したように最適な構造的な保存が(小さ な筋肉のために)全体以前に詳細な27のような動物の灌流、または浸漬固定することによって達成することができる。しかし、4%パラホルムアルデヒド固定は、多くの抗体プローブを用いて、蛍光-BGTとその後の染色を損なうことができます。グルタルアルデヒドは特に避けるべきである。筋肉が、彼らはすぐにスナップ凍結されなければならない固定されていない場合には(2.3に進む)。
- オプションの浸漬固定:ピン静止長でペトリ皿中のワックスの筋肉。 RTで2時間(新たにPBSに溶解)のVパラホルムアルデヒド/ wの2%の筋肉をカバーしています。その後、PBS中の30%W / Vのスクロースを含むPBSを交換し、4℃でO / Nインキュベート30分(3×10分)以上のPBSを3回交換でそれを洗ってください。
- 図1に示すように、アルミ箔2cmの×1.5センチメートルの部分を折り曲げることにより、予め金型(「ボート」)を作る。ボートの底にニトロセルロース膜片を置き。穏やかに気泡を避けるように注意しながら、2mmの深さまでボートにクライオスタット埋め込 みマトリックス( 材料テーブル )を注ぐ。上のボールペンラインでそれを合わせて、ボートに筋肉を置きニトロセルロース。完全に筋( 図1)を覆うように、より埋め込 みマトリックスを追加する。
- 消えないマーカーを用いたプレラベルポリプロピレンチューブ。各管中の水滴を置き、液体窒素中でチューブを冷却。
注:凍結水滴は、蒸気圧を維持し、長期の-80℃の貯蔵中に乾燥を防ぎ - フェイスシールド、厚い保護手袋と鈍い鉗子の大ペアを使用して、部分的に30秒間液体窒素の容器にイソペンタンの2cmの深さを含む小さな金属ビーカー(8センチメートル深い直径3cmを、)を下げる。ビーカーを取り外し、作業台の上に置きます。鈍鉗子の小さいペアを使用すると、金型の筋肉を含有し、冷やしたイソペンタンに行列を埋め込むを置く。イソペンタンとの混合液体窒素を避けるように注意してください。
- ブロックの2分が出て凍結されたブロックを持ち上げて鈍鉗子を使用する前に、完全にフリーズして、正しいPRにそれをシールすることを許可する電子ラベルとあらかじめ冷却チューブ(ステップ2.3)。
- C -80℃に移す前に液体窒素中で一時的に管を保管してください。冷凍庫内容のスプレッドシートにすべてのサンプルをログに記録します。
3.凍結切片化し、蛍光染色のNMJのエン顔画像のために
- アルミニウム金型をはがす。 20μmの凍結切片は、筋線維の長軸( 図1)に平行に切断するように-20℃の低温保持チャンバ内クライオスタットチャックに凍結されたブロックを添付。ポリ-L-リジンまたはゼラチンコーティングされた顕微鏡スライド上のセクションをピックアップ。
- 注:組織は凍結前に固定されている場合は、この手順を省略します。の項では、スライド上に乾燥するために30分をさせた後、室温で15分間、各セクションの上にPBS中の2%パラホルムアルデヒドの低下を置くことによって、それらを修正。
- 洗浄は、コプリンジャーPBSで3×10分スライドし、次に、残留アルデヒド基をブロックするために30分間、0.1Mグリシンを含むPBS中でスライドを浸す。
- 洗浄はPBS中で10分間にスライドし、7分間(-20ºCに冷却)をメタノール中に浸す。この透過処理ステップは、蛍光-BGTと抗シナプトフィジンとの二重標識のルーチンの一部ですが、それは悪影響をいくつかの他のタンパク質の免疫染色に影響する場合があります。
- ウォッシュをPBS中で2×10分をスライドその後安定した平ら加湿チャンバー内で各スライドを配置。すぐに室温で1時間ブロッキング溶液を20μl(0.2%トリトンX-100、PBS中の2%ウシ血清アルブミン(BSA))を用いて、各セクションをカバーする。切片は、免疫染色プロセスの任意の段階で乾燥させてはいけません。
- 主なインキュベーションを行ってください:一度に一つのスライドを取ることに慎重各セクションの上から余分なブロッキング溶液を除去し、ウサギ抗シナプトフィジン20μlのと交換してください(:200をブロッキング溶液中で1希釈)。
- 唯一のブロッキング溶液とインキュベートされるネガティブコントロールスライドを含めます。この「無一次抗体コントロール「すべての免疫染色ランで不可欠です。
- 一次抗体は、各セクション上の所定の位置に残っていることに注意しながら、加湿チャンバーを閉じて、4ºCで1〜2日間インキュベートする。
- 一次抗体が所定の位置に残っていることを確認するために、各セクションを点検。優しくPBSで各スライドをすすぎ、コプリンジャーに入れてパスツールピペットを使用してください。すべてのスライドをPBS中で3×10分を洗う。
- 二次インキュベーションを行ってください。一度に一つのスライドを撮影、慎重に、過剰のPBSを削除加湿チャンバー内に置き、FITC結合ロバ抗ウサギIgGとBGTローダミンテトラメチルに結合または別の赤の蛍光体を含有する混合物20μlを各セクション(TRITC-をカバー/ redBGT; 5グラム/ ml)をブロッキング溶液中に希釈した。室温で2時間インキュベートする。
- ウォッシュは、コプリンジャーにPBS中で3×10分をスライド。
- 一度に一つのスライドを撮影、慎重に過剰のPBSを除去して、グリセロの最小限のボリュームを使用してカバーガラスでマウントLベース、フェード耐封入。明確なマニキュアでカバースリップの端をシール。それはハード乾燥することができます。
- より長い保存期間(数ヶ月まで)のために1週間まで、または-20ºCための4ºCで暗所でスライドを保管してください。
4.公平サンプリングとモーターエンドプレートのエンフェイスイメージング
- のみ(分析に関与していない)は、第2の研究者に知られたままランダムコード番号で各スライドを標識することによりスライドをブラインド。 NMJのパラメータの定量はすべてのサンプルについて完了するまでは、操作者は、処置群に対して盲検化残る。
- 顕微鏡ステージ上にスライドを置き、TRITCフィルターセット(63X油1.3のNA対物レンズ)と広い視野照明の下でそれを表示します。右へと戻ってエンドプレートは、フィールド( 図2A)に表示されるまで左(フィールドごとに)徐々に移動します。
注:サンプリング基準:比較的あるすべてのAChR染色した構造フラットと対物レンズ( すなわち、次元における15メートルを拡張)に臨むが、終板とみなされ、(AChRの染色の三日月形の終板を介して断面積を表し、したがって、除外されている)分析のために結像される。 - 1.0エアリーユニットと低レーザパワーに焦点ピンホール設定するとゲインを最適化し、画像化されるべきであるエンドプレートでTRITC /赤-BGT(532nmレーザー)のためのレベルを相殺した。次に488nmのレーザーを用いてFITC /シナプトフィジン蛍光を最適化する。各光学スライスの間に0.7μmの間隔で終板のzスタックを収集します。撮像セッションの日付、スライドのコード名とエンドプレートの番号を含むファイル名で画像を保存します。
注:488 nmのを使用してスキャンし、532nmのレーザ(FITCおよびTRITC)は(ブリードスルー)赤蛍光団およびその逆からの蛍光によってFITCチャンネルの汚染を避けるために(しない同時に)を順次収集する必要があります。 - サンプリングAを繰り返しますNDステップのイメージング4.2から4.3まで、20のエンドプレートは、スライド/サンプルから収集されます。
- 次のコード化されたスライドに変更し、4.2から4.4を繰り返します。コード化されたスライドのそれぞれについて、これを繰り返します。
- 実験的なスライド(FITC蛍光チャンネルは暗く表示されます)のための最適な発見された共焦点設定を使用して制御スライド(無一次抗体コントロール)からのエンドプレートのいくつかの画像を収集します。
- 別のコンピュータへの共焦点セッション転送画像ファイルの最後に、外部ドライブ、またはサーバー上の元のファイルをバックアップする。
5.エン顔画像におけるシナプスのSpecializationの面積を測定する
- 各zスタックから最大投影(MIP)画像を用意するために、NIH ImageJのフリーウェア(http://imagej.nih.gov/ij/)を使用します。 TIFFファイル( 図2A&B)として保存する。ファイル名は、画像セッションの日付、サンプル·コード、エンドプレート番号と蛍光チャネル( 例えば、060414_57を含むべきである23_7_FITC.tiff)。
- ImageJの中のz投影画像を開きます。アセチルコリン受容体画像チャンネル( 図3A)を選択し、[選択]: 画像を>画面上の3つの8ビットグレースケール画像に24ビットRGBカラー画像に変換するために> 8ビットを入力します 。
- 特定の個人のエンドプレートのすべての見かけの染色領域を含むようにImageJのポリゴンツールは関心のエンドプレート(由来しない任意の染色を除く一方で、redBGT染色(ACHR)チャンネルに興味のあるエンドプレートの周りにラフアウトラインを描く使い方図3C)。
- 選択することで、画像の最小強度閾値を適用します。 画像>調整>しきい値 ( 図3Eおよび関連ImageJのスクリーンショット)。
- サブスレッショルド( 図3E)のような周囲のバックグラウンド信号を除外したAChR染色された部分を分離するようにしきい値レベルを調整します。第二の風を開く閾値についての決定を容易にするために、比較のために、ウィンドウの横にすぐに元の(連続階調)の画像とOW。共局在化に後で使用するための閾値を解析し、記録する。
- エンドプレートの周りにポリゴンのアウトラインを保持することを選択: 分析>パーティクルを分析します 。 (これは光電子増倍管で電気的ノイズに起因する小さなアーティファクトを排除)無限ピクセルに50:ポップアップメニューのようにサイズの範囲を指定します。
- 分析粒子のコマンドは、個別の閾値上の領域のリストを持つウィンドウを作成し、彼らは二値画像( 図3Gおよび関連ImageJのスクリーンショット)に表示されるようにそれらの蛍光強度値は番号。ラベルスプレッドシートにこのデータをコピーします。
- >メジャーを分析 :選択して、総エンドプレート面積(ポリゴン内の面積)を測定します。これは全体の終板面積が得られます。 AChRのエリアや強度にするためのコピー&ペーストしたデータ適切に、列にラベルを付けて確認してスプレッドシートには、行は特定のスライドのための個々のエンドプレートに使用されます。
- 抗シナプトフィジン蛍光チャネルに切り替え、繰り返し5.1手順- 5.5が、FITCチャネル( 図3B、DおよびF)のために。目的は、目によって知覚される、可能な限り厳密に、染色の境界に一致する二値画像を作成するように閾値を調整することである。しきい値を記録します。
- 画像スタック>画像>スタックの次の手順を適用することにより、重なりの面積を測定します。2チャンネル画像を含むオリジナルのファイルを開き、選択することによって、2つの別々の画像に分割。
- 共局在のプラグインを使用して、(ImageJのWebページからダウンロードしてインストール)を選択します:Pluggin>共局在し、入力を以前のAChRのために記録のしきい値と神経チャネルはそれぞれのチャネルクエリーbにOX。これは白画素( 図3Hおよび関連ImageJのスクリーンショット)でのオーバーラップ画像が得られます。
- 新しく作成されたオーバーラップ画像は、グレースケール形式に変換し、最大値にしきい値を適用する。最大閾値は、前の2つのチャネルの重複領域に対応し、白画素を選択する。スプレッドシートのレコードをピクセル単位での重なり部分の面積を表して「共局在化」の結果の面積値、。
- データサンプル手段のスプレッドシートを準備し、ヒストグラムや散布図20,22のような標準偏差と標準誤差を計算し、プロットします。 nの値は、一般的に、統計目的のためのサンプル群あたりのマウスの数を表している。
- 散布図または頻度ヒストグラムとしてプロット終板のAChR領域は、データが正常に統計的検定( 図6)の前に分散されているかどうかを判断する。
6.相対染色強度は、横光学切片を用いて比較
注:このプロトコル処理のためのすべての筋肉のサンプルを一緒と画像シングル共焦点セッションで。実験の計画では、筋肉のサンプルあたり30分の撮影時間まで許可する。
- 筋線維の長軸に対して横方向に15μmの凍結切片をカットし、ステップ3.1で説明したようにスライド上に集める。
- ステップ3.2から3.13に記載されているように蛍光染色を行ってください。
- コードステップ4.1で説明したように、そのイメージングおよび分析ので染色したスライドを、治療群にオペレータブラインドで行われている。
- 簡単に各スライドからセクションを調査40X蛍光対物レンズ(NA 0.75)を使用すると、単一の利得を決定し、すべての試料スライド上のすべてのエンドプレートに適してAChRのためのレベル設定を相殺する。明るいエンドプレートは、ちょうどスケールで256階調以下でなければならない。この最適化は、第二fluorescencで別々に行われるべきである電子チャネル(逐次収集)。固定ゲインを記録し、レベルの設定をオフセットし、撮像セッションを通して、それらを変更しない。
- レーザー強度の任意の可能な変動を検出するために、共焦点セッションの開始時と終了時に、同じパラメータを使用して、蛍光標準スライド( 例えば、非漂白蛍光ビーズ)の画像を収集する。
- エンドプレートを見つけるために徐々にスライドをスキャンするのAChRチャネルを使用してください。
- AChRの染色されたエンドプレートのほとんどの数を含む各顕微鏡の視野内の単一の光切断面を見つけるにフォーカス。
- この単一の光学部は二回スキャンし、平均した画像( 図4G)を保存。
- 第2の蛍光チャネルに対して同じ焦点面スイッチ(関心対象のタンパク質)を維持し、ステップ6.8において、画像を収集する。撮像セッションの日付、サンプル·コード、画像番号と蛍光チャネルを示す記号:ファイル名を含め、画像ファイルを保存します。 図4Aは、 - Fは rapsyn、ムスクやα-ジストログリカン(-dg)と比較したのAChRの終板分布の例を示している。
- 1つ以上のエンドプレートを含む次のフィールドに、ステージを移動し、ステップ6.8から6.9を繰り返します。 60のエンドプレートの合計が画像化されるまで、これを繰り返します。
- イメージングセッション転送の終了時に、すべてのファイルを別のコンピュータに、それらをバックアップします。
- 各元の画像ファイルを開き、AChRのチャンネルを見ながら、選択します。 画像>スタック>スタックイメージに 、チャンネルを分割する。
- 選択してください: 画像>タイプ> 8ビットが画面に8ビットグレースケール形式に変換する。両方の蛍光チャネルのためにこれを行います。
- 選択してください: 画像>スタック>イメージをスタックに 。 2以前に分離8ビット画像から新しいスタックを開きます。一つは、単一のウィンドウ内の2つの蛍光チャネルの間で便利に切り替えることができます。
- LINを描画するポリゴンツールを使用して、EしっかりAChRの染色( 図4I)の境界付近。
- 選択:囲まれた領域内のAChRの平均ピクセル強度を測定するために測定>分析 (しっかりと線を描画することの重要性を注意してください)。ラベルスプレッドシートには、この値をコピーします。
- 分析>対策 :同じポリゴンのアウトラインを(測定すべき領域を定義するために)、第二の蛍光チャネル( 例えば、 図4B、D、F)に切り替えて、選択し保持。これは、AChRの染色によって定義シナプス領域内の関心のあるタンパク質の平均染色強度が得られる。
- 選択し離れて見えるの端板染色から地域を選択: 分析>平均バックグラウンドの蛍光強度を測定するために測定します 。他の蛍光チャネル/ sのためにこれを繰り返し、蛍光値のスプレッドシートにバックグラウンド値をコピーします。
- サブ性AChRに対する補正強度と各エンドプレートでの目的のタンパク質を得るために、エンドプレート値から平均バックグラウンド値をトラクト。
- 蛍光強度比14,21を生成するために修正さBGT蛍光強度により、目的のタンパク質に対する補正終板の強度値を分割
7. FRETを使用して、シナプス後膜のAChR密度を比較すると、
注:このプロトコルは、シナプス後膜に性AChRが密接にパックされている程度(<10nmの間隔)を評価する。正確なドナーおよびアクセプターフルオロフォアの組み合わせは、このFRETアッセイのために重要である。名前およびフルオロフォアの詳細は材料の表に示す。彼らのスペクトル特性は、FRETに関連して、私たちの前の論文14,15で説明します。
- 6.1節で説明したように固定された横方向の凍結切片を準備します。すべてのサンプルグループは一緒にして画像処理しなければならない同じ共焦点セッションでD。
- 徹底的に10グラムと2.5グラム/ mlの赤-BGT(FRETドナー)をミックス/ mlの遠赤色-BGT(アクセプターをFRET)を12回ピペッティングにより小さなプラスチックチューブ内の溶液をブロッキング。この1:4のモル混合物は、FRET 14の効率を最大化します。
- 加湿チャンバー内の各スライドを置き、慎重に上記の混合物の滴(12μL)との各セクションをカバーし、室温で1.5時間インキュベートする。
- コントロールセクション:(のみドナーラベル付きC1コントロール)2.5グラム/ mlの赤-BGTとセクションの小さな数字をカバーし、10グラム/ mlの遠赤-BGTともいくつかのセクション(;ラベルC2のコントロールのみアクセプター)。ステップ7.3でのように、これらのコントロールをインキュベートする。
- ウォッシュは、PBS中で3×10分をスライドして(ステップ3.12参照)グリセロールベース、フェードに抵抗を封入剤でマウントします。
- ステップ6.7のように、エンドプレートのサンプリングを行います。ドナーとアクセプターからの蛍光は完全に蛍光BGT分子のランダム結合のためにエンドプレートで共局在するべきである。
- 制御画像:対物レンズ40倍と低レーザパワー最適化redBGTゲインを使用し、コントロールスライドC1からエンドプレートのためのレベル設定をオフセット。遠redBGTゲインを最適化し、制御スライドC2からエンドプレートのためのレベルを相殺した。すべての蛍光ブリードスルーがないことを確認してください。
- レーザパワーを変化させずに、ゲインやオフセット·レベルの設定は、実験のスライドに移動し、両方の蛍光チャネル用の画像(プリ光退色)を収集する。
- 選択的に遠赤-BGTは、100%のパワーで633nmのレーザーで10回スキャンし、スキャン領域にズームことにより、単一の端板の部分の上に光退色。スキャンされたエリア内の蛍光は薄暗いなるはずである。
- レーザーパワーをリセットし、ズームや7.7で確立された共焦点の設定を使用して、両方の蛍光チャネルでポスト漂白画像を収集。
- アクセプターの光退色(遠赤-B以下のドナーの増加率(赤-BGT)蛍光からFRET効率(E)を計算次の式*によるGT):
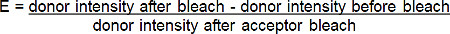
*ドナーの蛍光がアクセプターを光退色後に増加させ、すべての状況では。
結果
NMJでのシナプス面積の測定
エリアの任意の推定値は、シナプスの専門分野の範囲を定義するために、境界の描画に依存している。健康な若い成人の筋肉のNMJの画像がのAChRとシナプトフィジン染色( 図2AおよびB)の両方のために明確に定義された境界線を表示する必要があります。 AChRの及びシナプトフィジンの両方の蛍光強度は、...
ディスカッション
ここで説明するプロトコルは、確実に測定し、正常な老化と疾病状態を含む条件の範囲にわたって、NMJの特性の変化を定量化するために私たちを有効にしている。顔NMJ画像専用のために記載された方法は、研究者が前と後シナプスの専門分野の面積とシナプス重なり/位置合わせの面積を比較することができるようになります。前およびシナプス後のタンパク質の相対的強度を比較するために...
開示事項
The authors declare they have no competing financial interests.
謝辞
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
資料
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
参考文献
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved