Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La jonction neuromusculaire: Synapse mesurer la taille, fragmentation et les changements dans Synaptic Protein densité en utilisant microscopie de fluorescence confocale
Dans cet article
Résumé
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Résumé
La jonction neuromusculaire (JNM) est le grand, le relais synapse cholinergique par lequel les neurones moteurs de mammifères contrôlent contraction des muscles volontaires. Les changements structurels au NMJ peuvent entraîner l'échec de la neurotransmission, résultant dans la faiblesse, l'atrophie et même la mort de la fibre musculaire. De nombreuses études ont étudié comment les modifications génétiques ou de maladies peuvent modifier la structure de la jonction neuromusculaire de la souris. Malheureusement, il peut être difficile de comparer directement les résultats de ces études parce qu'ils travaillent souvent différents paramètres et les méthodes analytiques. Trois protocoles sont décrits ici. La première utilise la projection d'intensité maximale images confocales pour mesurer la surface des récepteurs de l'acétylcholine (RACh) riche domaines membranaires post-synaptiques à la plaque d'extrémité et la surface de la vésicule synaptique coloration dans la terminaison nerveuse présynaptique sus-jacente. Le deuxième protocole compare les intensités relatives des immunocoloration des protéines synaptiques dans la membrane post-synaptique. La troisième protocole utilise Fluorescence Resonance Energy Transfer (FRET) pour détecter les changements dans l'emballage d'AChR post-synaptiques à la plaque d'extrémité. Les protocoles ont été développé et affiné au cours d'une série d'études. Les facteurs qui influencent la qualité et la cohérence des résultats sont discutés et données normatives sont fournis pour NMJs chez les jeunes souris adultes en bonne santé.
Introduction
La jonction neuromusculaire (JNM) est la synapse de relais essentiel qui médie la communication entre le système nerveux et le muscle squelettique. Il est nécessaire pour tout mouvement volontaire. La microscopie à fluorescence a longtemps été utilisé pour étudier les effets des transgènes sur la souris NMJ 1-3 ou de comparer les effets de l'âge, l'alimentation, l'exercice et la maladie sur NMJs de rongeurs 4-11. Ces études nous ont beaucoup appris sur la physiologie et la physiopathologie de la NMJ, mais les divers paramètres déclarés (par exemple, la zone AChR, zone flasque, longueur du périmètre, indices de fragmentation) font qu'il est souvent difficile de comparer les résultats de ces études. Il ya une attente de plus en plus pour les chercheurs précliniques pour pouvoir démontrer la reproductibilité, en particulier dans les études avec des modèles de rongeurs de la maladie 12. Les protocoles décrits ici ont été affinées par une série d'études qui a enquêté ch développement, physiologique et physiopathologiqueAnges à l'NMJ. Ces études nécessitent la mesure de la zone de spécialisations synaptiques à la plaque motrice de la souris et de la densité relative de l'emballage de protéines synaptiques dans les spécialisations post-synaptiques 13-15.
L'utilité de ces méthodes est illustrée par des études récentes dans un modèle de souris de l'anti-MuSK myasthénie. Injections quotidiennes d'IgG de myasthénie anti-MuSK positif gravis patients dans des souris adultes causés à devenir faible dans les deux semaines 16. Confocale images maximale de projection de sections musculaires qui ont été doublement marquée pour la synaptophysine (en nerveuses terminaux) et post-synaptiques AChR révélé un déclin progressif dans le domaine de AChR coloration que le principal changement. Surtout le taux de déclin était suffisante pour expliquer les baisses comparables dans l'amplitude des potentiels synaptiques, l'échec de la transmission synaptique et une faiblesse musculaire 17,18. Qualitativement résultats similaires ont été rapportés par d'autres groupes de recherche10,19. Les mêmes méthodes de mesure NMJ ont depuis été utilisés pour évaluer l'impact de trois médicaments pour le traitement anti-MuSK myasthénie grave dans ce modèle de souris 20,21.
Vieillissement sédentaire peut conduire à la perte de connexions neuromusculaires. Les protocoles décrits ici ont révélé une baisse liée à l'âge dans le domaine de terminaison nerveuse synaptophysine à plaques motrices que les souris progressent dans la vieillesse. Les mêmes méthodes ont révélé que l'exercice volontaire pourrait largement éviter la réduction de nerf présynaptique zone de la borne 22, en accord avec les travaux antérieurs par d'autres groupes 4. Perte de connexions neuromusculaires se produit également dans le modèle de la souris SOD1G93A de la sclérose latérale amyotrophique 9,23.
Les études mentionnées ci-dessus démontrent que une variété de conditions de santé peut conduire à des réductions dans le domaine de spécialisation soit pré- ou post-synaptiques au NMJ. Cela peut entraîner dans l'amusement synaptique altéréection ou peut annoncer une perte complète de la connexion neuromusculaire. Trois protocoles sont décrits qui permettent la quantification de la superficie et de la densité de spécialisations synaptiques. Le but du premier protocole est de fournir une mesure pratique et reproductible des zones de pré et post-synaptiques spécialisations et leur alignement au NMJs mammifères, en utilisant la microscopie de fluorescence. Images bidimensionnelles projection confocale maximales et analyse d'image avec les NIH ImageJ est utilisé pour détecter des changements dans le domaine de la coloration (synaptophysine des vésicules synaptiques), AChR post-synaptiques et de la zone de chevauchement synaptique. Paramètres d'imagerie confocale (gain et décalage de niveau) sont optimisés pour chaque NMJ de façon à maximiser l'information visuelle utilisée pour discerner le domaine de spécialisation synaptique. Insuffisance neuromusculaire peut également résulter de changements dans la densité post-synaptique du CCRS et / ou d'autres protéines synaptiques. Le deuxième protocole peut être appliqué à détecter les changements dans la densité relative de ces protéines postsynaptiquesque le musc, rapsyne, dystroglycane, phosphorylée kinase Src et phosphorylée AChR 18,21.
Dans la myasthénie grave, une densité réduite de AChR dans la membrane post-synaptique est la cause immédiate de l'insuffisance synaptique et une faiblesse musculaire. Le troisième protocole décrit une méthode Fluorescence Resonance Energy Transfer (FRET) pour évaluer les changements dans la proximité de AChR adjacentes dans des membranes post-synaptiques 14,15. Cette méthode détecte transfert d'énergie entre AChR voisins marqués par fluorescence-α-bungarotoxine (BGT). FRET se produit uniquement lorsque les sondes fluorescentes donneur et accepteur sont à moins de 10 nm de l'autre. Cela peut révéler (microscopiques) des changements dans l'étanchéité de AChR emballage qui peuvent être directement liés à l'amplitude des potentiels synaptiques.
Ces trois protocoles, raffinés au cours de la dernière décennie, fournissent des mesures complémentaires d'intégrité NMJ d'une manière cohérente et reproductible. Utilisation de protocoles normalisés unend paramètres devraient faciliter la comparaison des effets des gènes et des interventions environnementales sur le NMJ mammifères.
Protocole
REMARQUE: Conception, réalisation et l'enregistrement de l'expérimentation animale devraient tenir compte des lignes directrices actuelles 24. Ce travail doit être approuvée à l'avance par l'autorité de protection des animaux locale (dans notre cas, le Comité d'éthique animale de l'Université de Sydney).
1. L'euthanasie de l'animal et Muscle Dissection
- Transférer la souris à partir de la salle d'attente dans une salle séparée où il est euthanasié par une injection intrapéritonéale de solution de pentobarbital (30 mg / kg) en utilisant la méthode de manipulation de la souris détaillé par Shimizu 25. Placez la souris de nouveau dans sa cage.
- Une fois que la respiration de la souris se est arrêté pendant plus de 1 min, tester le réflexe pieds retrait en pinçant doucement le pied, et le réflexe de la cornée en effleurant la cornée. Seulement lorsque les réponses réflexes sont absents de la souris peut être préparé pour la dissection.
- Consultez un atlas de l'anatomie rongeurs tels que Chiasson 26 et / ou demander l'aide d'un experienanatomiste ced avant de tenter la dissection du muscle d'intérêt. Dans chaque cas, enlever les poils de la peau recouvrant aide d'un petit rasoir électrique avant d'ouvrir la peau pour exposer le muscle.
NOTE: La dissection sera différent pour chaque muscle anatomiquement distincts. - En utilisant des pinces contondants libérer le muscle de membranes recouvrant et les tissus environnants. Saisir et couper le tendon distal de séparer le muscle de son insertion.
- Taquiner doucement et coupez le muscle libre du tissu environnant de retour à son origine. Placer brièvement le muscle nouvellement disséqué dans 0,1 M de tampon phosphate salin (PBS) ou la solution de Ringer avant tout autre traitement.
2. Préparation de la Muscle pour Cryosectioning
REMARQUE: conservation structurelle optimale peut être obtenue par perfusion de l'animal entier comme précédemment détaillé 27, ou la fixation de l'immersion (par petits muscles) comme décrit à l'étape 2.1 en option. Cependant,4% de paraformaldéhyde fixation peut nuire coloration subséquente avec de nombreuses sondes anticorps et fluorescente-BGT. Le glutaraldéhyde en particulier doit être évitée. Si les muscles ne sont pas à fixer, ils doivent être immédiatement congelés rapidement (passer à 2,3).
- Facultatif fixation d'immersion: Pin le muscle à la cire dans un boîte de Petri à longueur de repos. Couvrir le muscle avec 2% p / v de paraformaldehyde (fraîchement dissous dans du PBS) pendant 2 heures à température ambiante. Laver avec trois changements de PBS plus de 30 min (3 x 10 min), puis remplacer le PBS avec 30% p / v de saccharose dans du PBS et incuber O / N à 4 ° C.
- Fabriquer des moules ('bateaux') à l'avance par pliage 2 cm x 1,5 cm morceaux de feuille d'aluminium, comme illustré à la figure 1. Placer un morceau de membrane de nitrocellulose dans le fond du bateau. Verser délicatement cryostat intégration matrice (de table Matériaux) dans le bateau à une profondeur de 2 mm, en prenant soin d'éviter les bulles d'air. Placez le muscle dans le bateau, l'alignant sur les lignes de stylo à bille surla nitrocellulose. Ajouter plus matrice intégrant de façon à couvrir complètement le muscle (Figure 1).
- Pré-étiquette en polypropylène tubes avec un marqueur indélébile. Placez une goutte d'eau dans chaque tube et le tube refroidir dans de l'azote liquide.
REMARQUE: La chute de l'eau gelée maintient la pression de vapeur et empêche la dessiccation pendant prolongé stockage -80 ° C - L'utilisation d'un masque de protection, gants de protection épais et une grande paire de pince émoussée, abaisser partiellement un petit gobelet métallique (3 cm de diamètre, 8 cm de profondeur) contenant 2 cm de profondeur d'isopentane dans un récipient d'azote liquide pendant 30 sec. Retirer le bécher et le placer sur la paillasse. En utilisant une petite paire de pinces émoussés placez le moule contenant le muscle et l'incorporation dans la matrice isopentane refroidi. Prenez soin d'éviter le mélange d'azote liquide avec l'isopentane.
- Autoriser 2 min pour le bloc de geler complètement avant d'utiliser le forceps émoussé pour soulever le bloc congelé sur et le sceller dans le bon pre-étiquetés et tube pré-réfrigéré (étape 2.3).
- Stocker temporairement les tubes dans de l'azote liquide avant le transfert à -80 ° C. Connectez-vous tous les échantillons dans un tableur du contenu des congélateurs.
3. Cryosectioning et coloration fluorescente pour en Face Images de NMJs
- Décoller le moule en aluminium. Au sein de la chambre à -20 ° C cryostat fixer le bloc congelé de la pince de cryostat de façon à découper 20 um cryosections parallèles à l'axe long des fibres musculaires (figure 1). Ramassez les sections sur les poly-L-lysine ou des lames de microscope de gélatine enduit.
- REMARQUE: omettre cette étape si le tissu est fixé avant la congélation. Après avoir laissé 30 min pour les sections de sécher sur les lames, les fixer en plaçant une baisse de 2% de paraformaldehyde dans PBS sur chaque section pendant 15 min à température ambiante.
- Laver les lames 3 x 10 min dans du PBS dans une jarre de Coplin, puis plonger les lames dans du PBS contenant 0,1 M de glycine pendant 30 min pour bloquer des groupes aldéhyde résiduels.
- Laver les lames pendant 10 min dans du PBS, puis plonger dans le méthanol (refroidi à -20 ° C) pendant 7 min. Cette étape de perméabilisation est une partie de la routine d'un double marquage fluorescent avec BGT et anti-synaptophysine mais il peut nuire immunocoloration pour d'autres protéines.
- Laver les lames 2 x 10 min dans du PBS, puis placer chaque diapositive dans une chambre humidifiée stable et nivelé. Couvrir immédiatement chaque section avec 20 ul de solution de blocage (0,2% de Triton X-100, 2% d'albumine de sérum bovin (BSA) dans du PBS) pendant 1 heure à température ambiante. Les articles ne doivent pas être autorisés à sécher à toute étape du processus d'immunocoloration.
- Effectuer la première incubation: Prendre une diapositive à la fois retirer soigneusement la solution de blocage en excès de plus de chaque section et le remplacer par 20 pi de lapin anti-synaptophysine (dilué à 1: 200 dans la solution de blocage).
- Inclure une lame témoin négatif qui sera incubé avec une solution de blocage seulement. Cette «non-contrôle de l'anticorps primaire'Est essentiel dans chaque course immunocoloration.
- Prendre soin que l'anticorps primaire reste en place sur chaque section, fermer la chambre humidifié et incuber pendant 1-2 jours à 4 ºC.
- Inspectez chaque section pour confirmer que l'anticorps primaire reste en place. Utiliser une pipette Pasteur pour rincer délicatement chaque diapositive avec du PBS et le placer dans une jarre de Coplin. Lavez toutes les diapositives 3 x 10 min dans du PBS.
- Effectuer incubation secondaire. Prenant une diapositive à la fois, retirez soigneusement excès de PBS, posez-le dans la chambre humide et couvrir chaque section avec 20 pi d'un mélange contenant FITC conjugué IgG d'âne anti-lapin et BGT conjugué à tétraméthyl rhodamine ou d'une autre fluorophore rouge (TRITC- / redBGT; 5 g / ml) dilué dans une solution de blocage. Incuber à température ambiante pendant 2 h.
- Laver les lames 3 x 10 min dans du PBS dans des bocaux de Coplin.
- Prenant une diapositive à la fois, retirez soigneusement excès de PBS et monter avec une lamelle en utilisant un volume minimal de, glycérobase l, fade-résistant milieu de montage. Sceller les bords des lamelles avec vernis à ongles transparent. Laisser sécher dur.
- Conserver les diapositives dans l'obscurité à 4 ° C pendant jusqu'à une semaine, ou à -20 ° C pour des périodes de stockage plus longues (jusqu'à plusieurs mois).
4. impartiale échantillonnage et d'En Face Imaging Motor Plaques de fond
- Aveugler les diapositives par marquage de chaque lame avec un numéro de code aléatoire qui reste connu que d'un second chercheur (non impliqué dans l'analyse). En conséquence, l'opérateur reste aveugle pour les groupes de traitement jusqu'à ce que la quantification des paramètres NMJ est terminée pour tous les échantillons.
- Placez la lame sur la platine du microscope et voir sous large éclairage sur le terrain avec l'ensemble de filtre TRITC (63X huile 1,3 objectif NA). Déplacez progressivement (champ par champ) de gauche à droite et en arrière jusqu'à une plaque d'extrémité apparaît dans le champ (figure 2A).
critère d'échantillonnage: NOTA: Toute structure AChR teinté qui est relativementplat et fait face à l'objectif (ce est à dire, se étend <15 m dans la dimension z) est considéré comme une plaque d'extrémité et est imagée pour l'analyse (croissants de AChR coloration représentent des sections transversales à travers plateaux et sont donc exclus). - Avec l'ensemble sténopé confocal à 1,0 unité d'Airy et la puissance laser de faible optimiser le gain et le décalage de niveaux TRITC / rouge-BGT (laser de 532 nm) à la plaque d'extrémité qui est à imager. Suivant optimiser FITC / fluorescence synaptophysine en utilisant le laser de 488 nm. Recueillir un z-pile de la plaque d'extrémité avec un intervalle de 0,7 um entre chaque tranche optique. Enregistrez les images avec un nom de fichier qui comprend la date de la session d'imagerie, le nom de code de la diapositive et le numéro de la plaque d'extrémité.
REMARQUE: Les balayages utilisant le 488 nm et 532 nm lasers (FITC et TRITC) doivent être prélevés de manière séquentielle (pas simultanément) pour éviter la contamination du canal FITC par fluorescence du fluorophore rouge et vice-versa (transpercement). - Répétez l'échantillonnage d'une imagerie d'étapes 4.2 à 4.3 jusqu'à 20 plateaux sont collectées de la diapositive / échantillon.
- Changer à la diapositive codé suivant et répétez 04/02 au 04/04. Répétez cette opération pour chacune des lames codées.
- Recueillir quelques images de plateaux de la lame de contrôle (sans primaire contrôle de l'anticorps) en utilisant les paramètres de confocale qui ont été trouvés optimale pour les diapositives expérimentales (le canal de fluorescence FITC devrait apparaître sombre).
- À la fin du transfert de session confocale les fichiers d'image à un autre ordinateur et de sauvegarder les fichiers originaux sur un disque dur externe ou un serveur.
5. Mesurer la zone synaptiques Spécialisations en en Face Images
- Utilisez NIH ImageJ freeware (http://imagej.nih.gov/ij/) pour préparer la projection maximale (MIP) des images de chaque z-stack. Enregistrez-les sous forme de fichiers TIFF (Figure 2A et B). Les noms de fichiers doivent inclure la date de la session de l'image, des exemples de code, le numéro de plaque d'extrémité et le canal fluorescent (par exemple, 060414_5723_7_FITC.tiff).
- Ouvrez l'image z-projection dans ImageJ. Sélectionnez l'image canal de récepteur de l'acétylcholine (figure 3A) et sélectionnez: Image> Type> 8-bit pour convertir l'image RVB 24 bits couleur en trois huit bits images en niveaux de gris sur l'écran.
- Utilisation de l'outil polygone ImageJ dessiner une esquisse autour de la plaque d'extrémité d'intérêt dans le redBGT teinté (CADH) canal de manière à inclure toutes les régions colorées apparents de la plaque d'extrémité individu en particulier, tout en excluant tout coloration qui ne proviennent pas de la plaque d'extrémité d'intérêt ( Figure 3C).
- Appliquer un seuil minimal d'intensité de l'image en sélectionnant: Image> Réglages> Seuil (Figure 3E et captures d'écran de ImageJ associés).
- Ajustez le niveau de seuil de façon à isoler les parties AChR colorés tout en excluant entourant signal de fond en tant que sous-seuil (Figure 3E). Ouvrez un second souffleow avec l'image originale (ton continu) immédiatement à côté de la fenêtre de comparaison, afin de faciliter la décision quant à la valeur de seuil. Notez la valeur de seuil pour une utilisation ultérieure dans colocalisation analyse.
- Conserver le polygone contour autour de la plaque d'extrémité sélectionnez: Analyse> Analyser particules. Dans le menu pop-up spécifier la gamme de tailles que: 50 à l'infini pixels (ce qui élimine les artefacts minuscules dus au bruit électrique dans le photomultiplicateur).
- Analyser commande particules génère une fenêtre avec une liste de domaines supra-seuil discrètes et leurs valeurs d'intensité de fluorescence numérotée comme ils apparaissent dans l'image binaire (Figure 3G et associé ImageJ capture d'écran). Copiez ces données dans un tableur marqué.
- Mesurer la surface de flasque total (de la zone dans le polygone) en sélectionnant: Analyse> Mesure. Cela donne la zone de flasque totale. Copiez et collez les données pour les régions et l'intensité dans AChRune feuille de calcul en veillant à étiqueter correctement colonnes, rangées sera utilisé pour plateaux individuels pour des diapositives spécifiques.
- Commuter sur le canal de fluorescence anti-synaptophysine et répétez les étapes 5.1 à 5.5, mais pour le canal FITC (figure 3B, D et F). Le but est d'ajuster le seuil afin qu'il crée une image binaire qui, aussi étroitement que possible, correspondant aux limites de coloration telle que perçue par l'œil. Notez la valeur de seuil.
- Mesurer la zone de chevauchement en appliquant les étapes suivantes: Ouvrez le fichier original contenant les deux images canal et le diviser en deux images séparées en sélectionnant: Image> Piles> Empiler aux images.
- Utiliser le plugin de colocalisation (téléchargé et installé à partir de la page Web ImageJ) Sélectionner: Pluggin> colocalisation et d'entrée les valeurs de seuil précédemment enregistrés pour les canaux RACh et nerveuses dans le canal respective requête bbœuf. Cela donnera une image de chevauchement en pixels blancs (Figure 3H et captures d'écran de ImageJ associés).
- Convertir l'image de chevauchement nouvellement créé dans un format en niveaux de gris et d'appliquer un seuil à la valeur maximale. Le seuil maximum ne sélectionner les pixels blancs correspondant à la zone de recouvrement des deux voies précédentes. La fiche dans la feuille de calcul de la valeur de la surface résultant de la «co-localisation», qui représente la zone de chevauchement en pixels.
- Préparer une feuille de calcul des moyennes des échantillons de données, calculer et tracer les écarts-types et les erreurs standard que les histogrammes ou des diagrammes de dispersion 20,22. A noter que la valeur de n représente généralement le nombre de souris par groupe d'échantillons à des fins statistiques.
- Terrain plateaux vertébraux zones AChR que des nuages de points ou histogrammes de fréquence pour déterminer si les données sont normalement distribué avant le test statistique (Figure 6).
6. coloration RelativeIntensités comparées en utilisant des sections optiques transversales
REMARQUE: Pour que ce processus tous les échantillons musculaires ensemble de protocole et de l'image en une seule séance confocale. En planifiant une expérience permettre jusqu'à 30 min Temps d'imagerie par échantillon musculaire.
- Couper 15 um cryosections transversal à l'axe longitudinal des fibres musculaires et de recueillir sur des lames comme décrit à l'étape 3.1.
- Effectuer la coloration fluorescente comme décrit dans les étapes 3.2 à 3.13.
- Code, les Les lames colorées sorte que l'imagerie et analyses sont menées avec les aveugles de l'opérateur pour le groupe de traitement, comme décrit dans l'étape 4.1.
- En utilisant un objectif de fluorescence 40X (NA 0,75) brièvement en revue une section de chaque diapositive pour déterminer un seul gain et offset réglage de niveau pour AChR qui sera adapté pour tous les plateaux à travers toutes les diapositives de l'échantillon. La plus brillante flasque devrait alors être juste en dessous de 256 sur l'échelle de gris. Cette optimisation devrait être effectuée séparément pour la deuxième fluorescence canal (recueillies successivement). Enregistrez le gain fixe et le décalage réglages de niveau et ne les modifie pas pendant toute la session d'imagerie.
- Recueillir des images d'une lame standard de fluorescence (par exemple, non-blanchiment billes fluorescentes), en utilisant les mêmes paramètres, au début et à la fin de la session confocale pour détecter toute variation possible de l'intensité du laser.
- Utilisez le canal AChR pour numériser la diapositive progressivement pour localiser plateaux.
- Concentrer pour trouver le plan de coupe optique unique dans chaque champ microscopique qui contient le plus grand nombre de plateaux AChR colorées.
- Scannez cette section optique unique deux fois et enregistrer l'image moyenne (figure 4G).
- Garder la même focale plan de commutation au second canal de fluorescence (protéine d'intérêt) et de recueillir l'image comme à l'étape 6.8. Enregistrez le fichier d'image, y compris dans le nom de fichier: date de la séance d'imagerie, des exemples de code, numéro de l'image et un symbole pour indiquer le canal fluorescent. Figure 4A - F montre des exemples de la distribution de la plaque d'extrémité de AChR rapport à rapsyne, de musc ou -dystroglycan (-DG).
- Déplacez la scène pour le champ suivant qui contient un ou plusieurs plateaux et répétez l'étape 6.8 à 6.9. Répétez jusqu'à ce que un total de 60 plateaux sont imagés.
- A la fin du transfert de la session d'imagerie tous les fichiers vers un autre ordinateur et de les sauvegarder.
- Ouvrez chaque fichier image d'origine et tout en regardant le canal AChR, sélectionnez: Image> Piles> Empiler aux images, de diviser les canaux.
- Sélectionner: Image> Type de> 8bit pour convertir à 8 bits en niveaux de gris le format sur l'écran. Faites cela pour deux canaux de fluorescence.
- Sélectionner: Image> Piles> les images à pile. Ouvrez une nouvelle pile de deux précédemment séparés images 8-bits. On peut ensuite passer facilement entre les deux canaux de fluorescence dans le guichet unique.
- Utilisez l'outil de polygone pour dessiner un line étroitement autour de la limite de la coloration AChR (figure 4E).
- Sélectionnez: Analyse> Mesure pour mesurer l'intensité de pixel moyenne pour AChR dans la zone délimitée (noter l'importance de tirer la ligne serrée). Copiez cette valeur dans un tableur marqué.
- En conservant le même contour du polygone (pour définir la zone à mesurer), passer sur la deuxième chaîne fluorescent (par exemple, la figure 4B, D, F) et sélectionnez: Analyse> mesure. Cela donnera l'intensité de coloration moyenne pour la protéine d'intérêt à l'intérieur de la zone définie par synaptique AChR coloration.
- Choisissez une zone éloignée de coloration de plaque d'extrémité visible puis sélectionnez: Analyse> Mesure pour mesurer l'intensité moyenne de fluorescence de fond. Répétez cette opération pour l'autre canal de fluorescence / s et copier les valeurs de fond dans le chiffrier de valeurs de fluorescence.
- Soustracter les valeurs de fond moyennes à partir des valeurs des plateaux vertébraux pour obtenir les intensités corrigées pour AChR et la protéine d'intérêt à chaque flasque.
- Divisez les valeurs d'intensité des plateaux vertébraux corrigées pour la protéine d'intérêt par l'intensité de fluorescence de BGT corrigée pour donner les ratios d'intensité de fluorescence 14,21
7. comparant la densité post-synaptique Membrane AChR utilisant FRET
NOTE: Ce protocole évalue la mesure dans laquelle AChR sont étroitement emballés (<10 nm espacement) dans la membrane post-synaptique. La combinaison de donneur et accepteur fluorophore précise est critique à cette analyse FRET. Les noms et détails des fluorophores sont donnés dans le tableau des matériaux. Leurs propriétés spectrales, par rapport à FRET, sont discutées dans nos articles précédents 14,15.
- Préparer cryosections transversales fixes comme décrit dans la section 6.1. Tous les groupes d'échantillons doivent être traités ensemble et de l'imaged dans la même session confocale.
- Bien mélanger 2,5 g / ml rouge-BGT (donneur de FRET) avec 10 g / ml rouge lointain-BGT (FRET accepteur) avec une solution de blocage dans un petit tube en plastique par pipetage de haut en bas 12 fois. Ce mélange 1: 4 molaire maximise l'efficacité de FRET 14.
- Placer chaque lame dans une chambre humidifiée, couvrir soigneusement chaque section avec une goutte (12 ul) du mélange ci-dessus et on incube pendant 1,5 heure à température ambiante.
- sections de contrôle: couvrent un petit nombre de sections avec 2,5 g / ml rouge-BGT (donneur seulement; contrôles C1 marqués), et aussi quelques sections avec 10 g / ml rouge lointain-BGT (accepteur seulement; contrôles C2 marqués). Incuber ces contrôles comme à l'étape 7.3.
- Laver les lames 3 x 10 min dans du PBS et monter en base de glycérol, fade résistant milieu de montage (voir l'étape 3.12).
- Effectuer l'échantillonnage des plateaux comme dans l'étape 6.7. Fluorescence du donneur et accepteur doit être parfaitement co-localisée à plateaux en raison de la liaison aléatoire des molécules fluorescentes-BGT.
- images de contrôle: Utilisation de l'objectif 40X et de faible puissance optimiser le gain de redBGT laser et offset réglages de niveau de plateaux d'un tiroir de commande C1. Optimiser le gain extrême redBGT et de compenser les niveaux pour les plateaux de lame de contrôle C2. Confirmer l'absence de toute fluorescence purge travers.
- Sans changer la puissance du laser, gagnent ou réglages de niveau offset se déplacent vers les diapositives expérimentales et de recueillir des images (pré-photoblanchiment) pour les deux canaux de fluorescence.
- Photobleach sélectivement l'extrême-rouge-BGT sur une partie d'un seul flasque en zoomant la zone de numérisation numérisation puis 10 fois avec le laser de 633 nm à 100% de la puissance. La fluorescence dans la zone balayée devrait devenir dim.
- Réinitialiser la puissance du laser et de zoom et de recueillir des images post-blanchiment sur les deux canaux fluorescents en utilisant les paramètres confocale établies à 7,7.
- Calculer l'efficacité de FRET (E) de l'augmentation en pourcentage de donateurs (rouge-BGT) fluorescence suivante photoblanchiment de l'accepteur (à l'extrême-rouge-BGT) selon la formule suivante *:
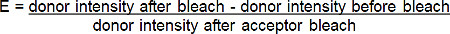
* Pour toutes les situations où la fluorescence du donneur augmente après photoblanchiment de l'accepteur.
Résultats
Mesure de Synaptic zone au NMJ
Toute estimation de la zone repose sur le dessin d'une frontière à définir l'étendue de spécialisations synaptiques. Chez les jeunes adultes en bonne santé muscles images NMJ devraient afficher limites bien définies à la fois pour AChR et synaptophysine coloration (figure 2A et B). L'intensité de fluorescence à la fois pour la synaptophysine AChR et augmente brusquement à la limite entre ...
Discussion
Les protocoles décrits ici nous ont permis de mesurer de manière fiable et quantifier les changements dans les propriétés de la NMJ toute une gamme de conditions, notamment le vieillissement et les maladies états normaux. Les méthodes décrites pour en Face images NMJ permettront aux chercheurs de comparer le domaine des spécialisations pré- et post-synaptiques et la région synaptique de chevauchement / alignement. Pour comparer l'intensité relative des protéines pré- et post-synaptiques le deuxième pro...
Déclarations de divulgation
The authors declare they have no competing financial interests.
Remerciements
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
matériels
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Références
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon