Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La unión neuromuscular: Medición Synapse Tamaño, fragmentación y los cambios en la densidad de proteína sináptica Uso confocal microscopía de fluorescencia
En este artículo
Resumen
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Resumen
La unión neuromuscular (UNM) es la sinapsis relé grande, colinérgica a través del cual las neuronas motoras de mamíferos controlan la contracción muscular voluntaria. Los cambios estructurales en la UNM pueden resultar en el fracaso de la neurotransmisión, resultando en debilidad, atrofia e incluso la muerte de la fibra muscular. Muchos estudios han investigado cómo las modificaciones genéticas o enfermedades pueden alterar la estructura de la UNM ratón. Desafortunadamente, puede ser difícil comparar directamente los resultados de estos estudios ya que a menudo emplean diferentes parámetros y métodos analíticos. Tres protocolos se describen aquí. El primero utiliza la proyección de intensidad máxima imágenes confocal para medir el área de receptor de acetilcolina (AChR) ricos en dominios de la membrana postsináptica en la placa terminal y el área de tinción de las vesículas sinápticas en la terminal nerviosa presináptica suprayacente. El segundo protocolo se comparan las intensidades relativas de inmunotinción para proteínas sinápticas en la membrana postsináptica. La tercera protocol utiliza la transferencia de energía de fluorescencia por resonancia (FRET) para detectar cambios en el embalaje de AChR postsinápticos en la placa terminal. Los protocolos se han desarrollado y perfeccionado a lo largo de una serie de estudios. Los factores que influyen en la calidad y la consistencia de los resultados se discuten y datos normativos se proporcionan para NMJs en ratones adultos jóvenes sanos.
Introducción
La unión neuromuscular (NMJ) es la sinapsis relé crítico que media la comunicación entre el sistema nervioso y músculo esquelético. Se requiere para todo el movimiento voluntario. La microscopía de fluorescencia se ha utilizado para estudiar los efectos de los transgenes en el ratón NMJ 1-3 o para comparar los efectos de la edad, la dieta, el ejercicio y la enfermedad en roedores NMJs 4-11. Tales estudios han enseñado mucho acerca de la fisiología y la fisiopatología de la UNM, pero los diversos parámetros informado (por ejemplo, área AChR, área de placa terminal, longitud del perímetro, los índices de fragmentación) a menudo hacen que sea difícil comparar los resultados de estos estudios. Hay una expectativa creciente de investigadores pre-clínicos para ser capaces de demostrar la reproducibilidad, en particular en estudios con modelos de roedores de enfermedad 12. Los protocolos descritos aquí fueron refinados a través de una serie de estudios que investigaron ch desarrollo, fisiológico y fisiopatológicoanges de la UNM. Tales estudios requieren la medición de la zona de especializaciones sinápticas en la placa motora terminal del ratón y la densidad relativa de embalaje de las proteínas sinápticas dentro de especializaciones postsinápticos 13-15.
La utilidad de estos métodos se ilustra por estudios recientes en un modelo de ratón de anti-MuSK miastenia gravis. Las inyecciones diarias de IgG de miastenia anti-MuSK positivos gravis pacientes en ratones adultos causó que se vuelven débiles dentro de 2 semanas 16. Imágenes de máxima proyección confocal de secciones musculares que fueron etiquetados doble para sinaptofisina (en terminales nerviosas) y AChR postsinápticos revelaron una disminución progresiva en el área de tinción AChR como el principal cambio. Es importante destacar que la tasa de disminución fue suficiente para explicar la disminución comparables en la amplitud de los potenciales sinápticos, fracaso de la transmisión sináptica y debilidad muscular 17,18. Cualitativamente hallazgos similares fueron reportados por otros grupos de investigación10,19. Los mismos métodos de medición NMJ ya se han utilizado para evaluar el impacto de tres fármacos para el tratamiento de la miastenia gravis anti-MuSK en este modelo de ratón 20,21.
Envejecimiento sedentario puede llevar a la pérdida de las conexiones neuromusculares. Los protocolos descritos aquí han revelado una disminución asociada a la edad en la zona de sinaptofisina terminación nerviosa en placas motoras como ratones progresan en la vejez. Los mismos métodos revelaron que el ejercicio voluntario podría evitar en gran medida la reducción de la zona de la terminal nerviosa presináptica 22, en consonancia con el trabajo previo de otros grupos 4. La pérdida de las conexiones neuromusculares también se produce en el modelo de ratón SOD1G93A de la esclerosis lateral amiotrófica 9,23.
Los estudios mencionados anteriormente demuestran que una variedad de condiciones de salud puede conducir a la reducción de la superficie de cualquiera de las especialidades pre o post-sináptica en la UNM. Esto puede producir problemas para la diversión sinápticacción o puede anunciar la pérdida completa de la conexión neuromuscular. Tres protocolos se describen que permiten la cuantificación de la zona y la densidad de especializaciones sinápticas. El propósito de la primera protocolo es proporcionar una medida práctica y reproducible de las áreas de pre y post-sinápticas especializaciones y su alineación en NMJs de mamíferos, usando microscopía de fluorescencia. Confocal de imágenes de proyección máximo de dos dimensiones y análisis de imagen con NIH ImageJ se utiliza para detectar cambios en el área de tinción sinaptofisina (vesículas sinápticas), AChR postsinápticos y área de superposición sináptica. Parámetros confocal de imágenes (ganancia y nivel de compensación) se han optimizado para cada NMJ a fin de maximizar la información visual utilizado para discernir el área de especialización sináptica. Insuficiencia neuromuscular también puede resultar de los cambios en la densidad de AChR postsináptica y / o otras proteínas sinápticas. El segundo protocolo se puede aplicar para detectar cambios en la densidad relativa de las proteínas postsinápticos talescomo el almizcle, RapSyn, distroglicano, fosforilada quinasa Src y fosforilada AChR 18,21.
En la miastenia gravis, una densidad reducida de AChR dentro de la membrana postsináptica es la causa inmediata del fracaso sináptica y la debilidad muscular. El tercer protocolo describe un método de fluorescencia la transferencia de energía de resonancia (FRET) para evaluar los cambios en la proximidad de AChR adyacentes dentro de las membranas postsinápticas 14,15. Este método detecta la transferencia de energía entre AChR vecinos marcados con fluorescente-α-bungarotoxina (BGT). FRET se produce sólo cuando el donante y aceptor de sondas fluorescentes son de menos de 10 nm de distancia. Esto puede revelar cambios (submicroscópicas) en la estanqueidad de embalaje AChR que pueden relacionarse directamente a la amplitud de los potenciales sinápticos.
Estos tres protocolos, refinados durante la última década, proporcionan medidas complementarias de integridad NMJ de una manera consistente y reproducible. El uso de protocolos estandarizados unaparámetros nd deben facilitar la comparación de los efectos de los genes y las intervenciones ambientales sobre los mamíferos NMJ.
Protocolo
NOTA: El diseño, la realización y presentación de informes de los experimentos con animales deben tener en cuenta las directrices actuales 24. Este tipo de trabajo debe ser aprobado previamente por la autoridad local de protección de los animales (en nuestro caso, el Comité de Ética Animal de la Universidad de Sydney).
1. La eutanasia del animal y la disección muscular
- Transferir el ratón desde la sala de espera a una habitación separada donde se practicó la eutanasia con una inyección intraperitoneal de solución de pentobarbital (30 mg / kg), utilizando el método de manejo del ratón detallado por Shimizu 25. Coloca el ratón de nuevo en su jaula.
- Una vez que la respiración del ratón se ha detenido durante más de 1 minuto, probar el reflejo pies retirada pellizcando suavemente el pie, y el reflejo corneal por la ligera el cepillado de la córnea. Sólo cuando las respuestas reflejas están ausentes se puede preparar el ratón para la disección.
- Consulte con un atlas de anatomía roedor tal como Chiasson 26 y / o buscar la ayuda de una experienanatomista ced antes de intentar la disección del músculo de interés. En cada caso eliminar el vello de la piel que recubre el uso de una pequeña máquina de afeitar eléctrica antes de abrir la piel para exponer el músculo.
NOTA: La disección será diferente para cada músculo anatómicamente distinta. - Con unas pinzas romas liberar el músculo desde que recubre las membranas y los tejidos circundantes. Agarrar y cortar el tendón distal para separar el músculo de su inserción.
- Embromar suavemente y recortar el músculo libre del tejido circundante de vuelta a su origen. Brevemente colocar el músculo recién diseccionado en 0,1 M tampón fosfato salino (PBS) solución o solución de Ringer antes del procesamiento adicional.
2. Preparación del músculo por cryosectioning
NOTA: la conservación estructural óptima se puede lograr por perfusión animal completo como se detalla anteriormente 27, o la fijación de inmersión (para los músculos pequeños) como se describe en el paso opcional de 2,1. Sin embargo,4% de paraformaldehído fijación puede perjudicar la posterior tinción con muchas sondas de anticuerpos y con fluorescente-BGT. El glutaraldehído en particular debe ser evitado. Si los músculos no han de ser fijados deben ser inmediatamente se congelaron rápidamente (proceder a 2,3).
- Fijación de inmersión Opcional: Pin del músculo a la cera en una placa de Petri en longitud de reposo. Cubrir el músculo con 2% w / v de paraformaldehído (recién disuelto en PBS) durante 2 horas a RT. Lavar con 3 cambios de PBS más de 30 min (3 x 10 min) y luego reemplace el PBS con 30% w / v de sacarosa en PBS e incubar O / N a 4 ° C.
- Hacer moldes ('') barcos de antemano por plegado de 2 cm x 1,5 cm trozos de papel de aluminio como se muestra en la Figura 1. Coloque un trozo de membrana de nitrocelulosa en la parte inferior de la embarcación. Vierta suavemente criostato incrustar matriz (tabla Materiales) en el barco hasta una profundidad de 2 mm, teniendo cuidado de evitar las burbujas de aire. Coloque el músculo en la barca, alineándola con las bolígrafo líneas enla nitrocelulosa. Añadir matriz de la incrustación de más de manera que cubra completamente el músculo (Figura 1).
- Tubos de polipropileno Pre-etiqueta con un marcador indeleble. Coloque una gota de agua en cada tubo y enfriar el tubo en nitrógeno líquido.
NOTA: La gota de agua congelada mantiene la presión de vapor y evita la desecación durante prolongada -80 ° C de almacenamiento - El uso de un protector de cara, gruesos guantes de protección y un gran par de fórceps romos, reducir parcialmente un vaso de precipitados de metal pequeño (3 cm de diámetro, 8 cm de profundidad) que contiene 2 cm profundidad de isopentano en un recipiente de nitrógeno líquido durante 30 seg. Retirar el vaso y lo coloca en la parte superior del banco. El uso de un par más pequeño de fórceps romos colocar el molde que contiene el músculo y la incrustación de la matriz en el isopentano enfriado. Tenga cuidado para evitar la mezcla de nitrógeno líquido con el isopentano.
- Permitir 2 min para el bloque de congelar completamente antes de usar fórceps romos para levantar el bloque congelado y sellarlo en el pr correctae-etiquetados y tubo de pre-enfriado (paso 2.3).
- Guarde los tubos temporalmente en el nitrógeno líquido antes de la transferencia a -80 ° C. Registrar todas las muestras en una hoja de cálculo de los contenidos del congelador.
3. cryosectioning y fluorescencia de tinción para En Face Imágenes de NMJs
- Despegar el molde de aluminio. Dentro de la -20 ° C cámara del criostato fijar el bloque congelado al mandril criostato de manera que corte 20 micras cryosections paralelos al eje largo de las fibras musculares (Figura 1). Recoge las secciones sobre poli-L-lisina o recubiertos con gelatina portaobjetos de microscopio.
- NOTA: Omita este paso si el tejido se fija antes de la congelación. Después de dejar 30 min para las secciones se sequen sobre los portaobjetos, fijarlos mediante la colocación de una gota de 2% de paraformaldehído en PBS sobre cada sección durante 15 minutos a RT.
- Lavar los portaobjetos 3 x 10 min en PBS en una jarra Coplin, y luego sumergir los portaobjetos en PBS que contiene glicina 0,1 M durante 30 min para bloquear los grupos aldehído residuales.
- Lavado de los portaobjetos durante 10 min en PBS, a continuación, sumergir en metanol (enfriada a -20 ºC) durante 7 min. Este paso permeabilización es una parte rutinaria de doble etiquetado con fluorescente-BGT y anti-sinaptofisina pero puede afectar negativamente a la inmunotinción para algunas otras proteínas.
- Lavar los portaobjetos 2 x 10 min en PBS luego colocar cada diapositiva en una cámara húmeda estable y nivelada. Inmediatamente cubrir cada sección con 20 l de solución de bloqueo (0,2% Triton X-100, 2% de albúmina de suero bovino (BSA) en PBS) durante 1 hora a RT. Secciones no se debe permitir que se seque en cualquier etapa del proceso de inmunotinción.
- Llevar a cabo la incubación primaria: Tomar una diapositiva a la vez retire con cuidado el exceso de solución de bloqueo de más de cada sección y reemplazarlo con 20 l de conejo anti-sinaptofisina (diluido 1: 200 en la solución de bloqueo).
- Incluir un portaobjetos de control negativo que se incubó con solución de bloqueo solamente. Este "control de anticuerpos no-primaria"Es esencial en cada carrera inmunotinción.
- Cuidar que el anticuerpo primario se mantiene en su lugar sobre cada sección, cierre la cámara húmeda e incubar durante 1-2 días a 4 ºC.
- Inspeccionar cada sección para confirmar que el anticuerpo primario permanece en su lugar. Utilice una pipeta Pasteur para enjuagar suavemente cada portaobjetos con PBS y colocarlo en un frasco Coplin. Lave todas las diapositivas 3 x 10 min en PBS.
- Llevar a cabo la incubación secundaria. Tomando una diapositiva a la vez, retire con cuidado el exceso de PBS, lo pondré en la cámara húmeda y cubrir cada sección con 20 l de una mezcla que contiene FITC-conjugado IgG de burro anti-conejo y BGT conjugado con tetrametil rodamina u otro fluoróforo rojo (TRITC- / redBGT; 5 g / ml) diluido en solución de bloqueo. Incubar a temperatura ambiente durante 2 hr.
- Lavar los portaobjetos 3 x 10 min en PBS en frascos Coplin.
- Tomando una diapositiva a la vez, retire con cuidado el exceso de PBS y montar con un cubreobjetos utilizando un volumen mínimo de, glicerobasado en l, se desvanecen-resistencia medio de montaje. Selle los bordes de los cubreobjetos con barniz de uñas transparente. Deje que se seque duro.
- Guarde las diapositivas de la oscuridad a 4 ° C durante un máximo de una semana, oa -20 ° C durante largos períodos de almacenamiento (hasta varios meses).
4. imparcial Muestreo y En Face Imaging de Motor Placas de extremo
- Blind las diapositivas mediante el etiquetado de cada diapositiva con un número de código aleatorio que permanece conocida sólo por un segundo investigador (que no participe en el análisis). Como resultado, el operador permanece ciego a los grupos de tratamiento hasta que la cuantificación de parámetros NMJ es completa para todas las muestras.
- Posicionar el cursor en la platina del microscopio y ver debajo amplia iluminación de campo con el conjunto filtro TRITC (63X aceite 1,3 objetivo NA). Mueva progresivamente (campo por campo) de izquierda a derecha y de regreso hasta que una placa terminal aparece en el campo (Figura 2).
Criterio de muestreo:: NOTA Cada estructura manchado-AChR que es relativamenteplana y se enfrenta el objetivo (es decir, se extiende <15 m en la dimensión z) se considera una placa terminal y se forma la imagen para el análisis (medias lunas de tinción AChR representan secciones transversales a través de las placas terminales y por lo tanto están excluidos). - Con el conjunto pinhole confocal a 1,0 unidad de Airy y láser de baja potencia optimizar la ganancia y el offset niveles para TRITC / rojo-BGT (láser 532 nm) en la placa terminal que va a ser fotografiado. Siguiente optimizar FITC / fluorescencia sinaptofisina usando el láser de 488 nm. Se recoge una z-pila de la placa terminal con un intervalo de 0,7 m entre cada rebanada óptica. Guarde las imágenes con un nombre de archivo que incluye la fecha de la sesión de imágenes, el nombre en clave de la diapositiva y el número de la placa terminal.
NOTA: Las exploraciones utilizando el 488 nm y 532 nm láseres (FITC y TRITC) deben recoger secuencialmente (no al mismo tiempo) para evitar la contaminación del canal FITC por fluorescencia del fluoróforo rojo y viceversa (sangrar a través). - Repetir el muestreo de unnd obtención de imágenes de los pasos 4.2 a 4.3 hasta 20 placas terminales se recogen de la corredera / muestra.
- Cambie a la diapositiva siguiente código y repetir 04.02 a 04.04. Repita esto para cada uno de los portaobjetos codificados.
- Recoge unas cuantas imágenes de placas terminales de la corredera de control (no-primaria control del anticuerpo) mediante la configuración confocal que se encontraron óptimo para las diapositivas experimentales (el canal de fluorescencia FITC debe aparecer oscuro).
- Al final de la sesión de transferencia de los archivos de imagen confocal a otro ordenador y una copia de seguridad de los archivos originales en una unidad o un servidor externo.
5. Medir el Área de Synaptic Especializaciones en Imágenes en face
- Utilice NIH ImageJ software gratuito (http://imagej.nih.gov/ij/) para preparar las imágenes de proyección máxima (MIP) de cada z-stack. Guardarlas como archivos TIFF (Figura 2A y B). Los nombres de archivo deben incluir la fecha de la sesión de imágenes, código de ejemplo, el número de placa de extremo y el canal fluorescente (por ejemplo, 060414_5723_7_FITC.tiff).
- Abra la imagen z-proyección en ImageJ. Seleccione la imagen del canal receptor de acetilcolina (Figura 3A) y seleccione: Imagen> Tipo> 8 bits para convertir la imagen de color RGB de 24 bits en tres imágenes en escala de grises de 8 bits en la pantalla.
- Con la herramienta polígono ImageJ dibujar un esbozo en torno a la placa terminal de interés en el redBGT manchado (CADH) canal a fin de incluir todas las regiones manchadas aparentes de la placa terminal individuo en particular, mientras que excluyendo cualquier tinción que no se originan en la placa terminal de interés ( Figura 3C).
- Aplique un umbral mínimo de intensidad de la imagen seleccionando: Imagen> Ajustar> Umbral (Figura 3E y capturas de pantalla ImageJ asociados).
- Ajuste el nivel de umbral para aislar las partes teñidas con AChR excluyendo rodea señal de fondo como sub-umbral (Figura 3E). Abra un segundo aireow con la imagen del original (tono continuo) inmediatamente junto a la ventana para la comparación, para facilitar la decisión sobre el valor de umbral. Registrar el valor umbral para análisis posterior uso en colocalización.
- Conservando el contorno del polígono alrededor de la placa terminal seleccione: Analizar> Analizar Partículas. En el menú emergente especificar el rango de tamaños como: 50 a infinito píxeles (esto elimina artefactos diminutos que surgen de ruido eléctrico en el fotomultiplicador).
- Analizar comando partículas genera una ventana con una lista de áreas supra-umbral discretos y sus valores de intensidad de fluorescencia numeradas que aparecen en la imagen binaria (Figura 3G y asociado ImageJ captura de pantalla). Copie estos datos en una hoja de cálculo de etiquetado.
- Medir la superficie total placa terminal (área dentro del polígono) seleccionando: Analizar> Medida. Esto produce el área total de la placa terminal. Copiar y pegar los datos para áreas AChR e intensidades enuna hoja de cálculo asegurándose de etiquetar apropiadamente columnas, las filas se utilizará para placas terminales individuales para diapositivas específicas.
- Cambia al canal de fluorescencia anti-sinaptofisina y repita los pasos 5.1 hasta 5.5, pero para el canal FITC (Figura 3B, D y F). El objetivo es ajustar el umbral de manera que crea una imagen binaria que, tan estrechamente como sea posible, coincide con los límites de tinción según lo percibido por el ojo. Registre el valor umbral.
- Mida el área de superposición mediante la aplicación de los siguientes pasos: Abra el archivo original que contiene las dos imágenes del canal, que se dividió en dos imágenes separadas seleccionando: Imagen> Pilas> Pila a las imágenes.
- Utilizando el plugin Colocalización (descargado e instalado desde la página web ImageJ) Seleccionar: Pluggin> Colocalización y de entrada los valores umbral registrados previamente para los canales CADH y nerviosas en el respectivo canal de consulta bbuey. Esto dará lugar a una imagen de superposición en píxeles blancos (Figura 3H y capturas de pantalla ImageJ asociados).
- Convertir la imagen de superposición recién creado en un formato de escala de grises y aplicar un umbral para el valor máximo. El umbral máximo sólo seleccionará los píxeles blancos, correspondiente a la zona de superposición de los dos canales anteriores. Registro en la hoja de cálculo el valor del área resultante de 'colocalización ", que representa el área de superposición de píxeles.
- Prepare una hoja de cálculo de medias de la muestra de datos, calcular y representar gráficamente las desviaciones estándar y los errores estándar como histogramas o diagramas de dispersión 20,22. Tenga en cuenta que el valor de n generalmente representa el número de ratones por grupo de muestra para fines estadísticos.
- Placa terminal Parcela áreas AChR como diagramas de dispersión o histogramas de frecuencia para determinar si los datos se distribuyen normalmente antes de la prueba estadística (Figura 6).
6. La tinción relativaIntensidades compararon mediante secciones transversales ópticas
NOTA: Para este proceso todas las muestras de músculo junto protocolo e imagen en una sola sesión confocal. En la planificación de un experimento permitirá hasta 30 minutos de tiempo de formación de imágenes por muestra muscular.
- Cortar 15 micras cryosections transversal al eje largo de las fibras musculares y recoger en portaobjetos como se ha descrito en el paso 3.1.
- Llevar a cabo la tinción de fluorescencia como se describe en los pasos 3.2 a 3.13.
- Código los portaobjetos teñidos de modo que las imágenes y los análisis se llevan a cabo con los ciegos operador al grupo de tratamiento, tal como se describe en el paso 4.1.
- Utilizando un objetivo de 40X de fluorescencia (NA 0.75) examinar brevemente una sección de cada diapositiva para determinar un único aumento y compensación ajuste del nivel de AChR que será adecuado para todas las placas terminales en todas las diapositivas de muestra. La placa terminal más brillante debe entonces estar justo por debajo de 256 en la escala de grises. Esta optimización se debe hacer por separado para el segundo fluorescenccanal e (recogido sucesivamente). Anote la ganancia fija y compensar ajustes de nivel y no alteran ellos durante toda la sesión de imágenes.
- Recoger imágenes de una diapositiva estándar de fluorescencia (por ejemplo, perlas fluorescentes no blanqueantes), utilizando los mismos parámetros, al principio y al final de la sesión confocal para detectar cualquier posible fluctuación en la intensidad del láser.
- Utilice el canal AChR para escanear la diapositiva progresivamente para localizar placas terminales.
- Enfoque de encontrar el plano de sección óptica individual en cada campo microscópico que contiene el mayor número de placas terminales teñidos con AChR.
- Analiza esta sección óptica solo dos veces y guardar la imagen en promedio (Figura 4G).
- Manteniendo el mismo interruptor de plano focal para el segundo canal de fluorescencia (proteína de interés) y recoger la imagen como en el paso 6.8. Guarde el archivo de imagen, incluso en el nombre de archivo: fecha de la sesión de imágenes, código de ejemplo, el número de la imagen y un símbolo para indicar el canal fluorescente. Figura 4A - F muestra ejemplos de la distribución de rodete de AChR en comparación con RapSyn, almizcle o -dystroglycan (-DG).
- Mueva la etapa a la siguiente campo que contiene una o más placas de extremo y repita el paso 6.8 hasta 6.9. Repita este procedimiento hasta un total de 60 placas terminales se va a ver.
- Al final de la sesión de imágenes de transferencia de todos los archivos a otro ordenador y los respaldan.
- Abra cada archivo de imagen original y mientras ve el canal CADH, seleccionar: Imagen> Pilas> Pila de Imágenes, para dividir los canales.
- Seleccionar: Imagen> Tipo> 8 bits para convertir al formato de escala de grises de 8 bits en la pantalla. Haga esto por dos canales de fluorescencia.
- Seleccionar: Imagen> Pilas> Imágenes de pila. Abra una nueva pila de dos imágenes de 8 bits previamente separados. Entonces se puede cambiar convenientemente entre los dos canales de fluorescencia dentro de la ventanilla única.
- Utilice la herramienta de polígono para dibujar un line firmemente alrededor de la frontera de la tinción AChR (Figura 4I).
- Seleccionar: Analizar> Medir para medir la intensidad media de píxeles para AChR en la zona delimitada (tenga en cuenta la importancia de la elaboración de la línea de fuerza). Copia este valor en una hoja de cálculo de etiquetado.
- Conservando el mismo esquema polígono (para definir el área a medir), cambiar a la segunda cadena fluorescente (por ejemplo, la Figura 4B, D, F) y seleccione: Analizar> medida. Esto dará lugar a la intensidad media de la tinción de la proteína de interés en la zona sináptica definido por tinción AChR.
- Elija un área lejos de tinción placa terminal visible a continuación, seleccione: Analizar> Medir para medir la intensidad media de fluorescencia de fondo. Repita esto para el otro canal de fluorescencia / s y copiar los valores de fondo en la hoja de cálculo de los valores de fluorescencia.
- SubTracto los valores promedio de los valores de fondo de placa terminal para obtener las intensidades corregidas para CADH y la proteína de interés en cada placa terminal.
- Divide los valores de intensidad de placa terminal corregidos de la proteína de interés por la intensidad de la fluorescencia BGT corregido para dar los ratios de intensidad de fluorescencia 14,21
7. La comparación de la densidad postsináptica Membrana AChR Usando FRET
NOTA: Este protocolo evalúa el grado en que AChR están estrechamente empaquetados (<10 nm espaciamiento) en la membrana postsináptica. La combinación de los donantes y fluoróforo aceptor precisa es crítico para este ensayo FRET. Los nombres y detalles de los fluoróforos se dan en la tabla de Materiales. Sus propiedades espectrales, en relación con FRET, se discuten en nuestros trabajos anteriores 14,15.
- Preparar cryosections transversales fijas como se describe en la sección 6.1. Todos los grupos de la muestra deben ser procesados juntos e imagend en el mismo período de sesiones confocal.
- Mezclar bien 2,5 g / ml-BGT rojo (FRET donante) con 10 g / ml rojo lejano-BGT (FRET aceptor) con solución de bloqueo en un pequeño tubo de plástico pipeteando arriba y abajo 12 veces. Esta mezcla 1: 4 molar maximiza la eficiencia de FRET 14.
- Coloque cada portaobjetos en una cámara humidificada, cubrir cuidadosamente cada sección con una gota (12 l) de la mezcla anterior y se incuba durante 1,5 horas a RT.
- Control de las secciones: cubren un pequeño número de secciones con 2,5 g / ml rojo-BGT (sólo donante; controles C1 etiquetados), y también algunas secciones con 10 g / ml rojo lejano-BGT (sólo aceptor; controles C2 marcados). Incubar estos controles como en el paso 7.3.
- Lavar los portaobjetos 3 x 10 min en PBS y montaje en basado en glicerol, fade-resistiendo medio de montaje (consulte el paso 3.12).
- Tomar muestras de placas terminales como en el paso 6.7. La fluorescencia del donante y aceptor debe ser perfectamente co-localiza en placas terminales debido a la aleatoria de unión de las moléculas fluorescentes-BGT.
- Imágenes de control: Usando el objetivo de 40X y láser de baja potencia optimizar la ganancia redBGT y compensar los ajustes de nivel para placas terminales de un C1 corredera de control. Optimizar la ganancia extrema redBGT y los niveles de desplazamiento de las placas terminales de corredera de control C2. Confirme la ausencia de fluorescencia de purga a través.
- Sin cambiar la potencia del láser, ganan o configuración de nivel de desplazamiento se mueven a las diapositivas experimentales y recogen imágenes (pre-fotoblanquear) para ambos canales de fluorescencia.
- Selectivamente photobleach el rojo lejano-BGT sobre una porción de una sola placa de extremo por el zoom en el área de escaneo y luego escanear 10 veces con el láser de 633 nm a 100% de potencia. La fluorescencia en la zona escaneada debe convertirse tenue.
- Restablecer la potencia del láser y zoom y recoger imágenes post-blanqueador en ambos canales fluorescentes utilizando la configuración confocal establecidos en 7.7.
- Calcular la eficiencia de FRET (E) del porcentaje de aumento de los donantes (rojo-BGT) fluorescencia siguiente fotoblanqueador del aceptor (rojo lejano-BGT) de acuerdo con la siguiente fórmula *:
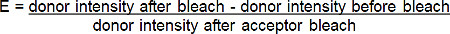
* Para todas las situaciones en las que la fluorescencia del donante aumenta después de photobleaching aceptor.
Resultados
Medición de Synaptic Área en la UNM
Cualquier estimación del área se basa en el dibujo de un límite para definir la extensión de especializaciones sinápticas. En los músculos adultos jóvenes sanos imágenes NMJ deben mostrar los límites bien definidos, tanto para AChR y tinción sinaptofisina (Figura 2 A y B). La intensidad de fluorescencia para ambos AChR y sinaptofisina aumenta de forma pronunciada en el límite entre la porción...
Discusión
Los protocolos descritos aquí nos han permitido medir y cuantificar los cambios en las propiedades de la UNM en toda una serie de condiciones, incluyendo los estados normales de envejecimiento y la enfermedad. Los métodos descritos para en face imágenes NMJ permitirán a los investigadores comparan el área de especialidades pre y postsinápticos y el área de superposición sináptica / alineación. Para comparar la intensidad relativa de las proteínas pre y postsinápticos el segundo protocolo, que utiliza seccion...
Divulgaciones
The authors declare they have no competing financial interests.
Agradecimientos
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materiales
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Referencias
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados