A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Neuromuscular צומת: גודל סינפסה מדידה, שינויי פיצול ובצפיפות חלבון Synaptic שימוש Confocal מיקרוסקופ פלואורסצנטי
In This Article
Summary
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Abstract
הצומת העצבית-שהרירית (NMJ) היא סינפסה הגדולה, כולינרגית הממסר שדרכו הנוירונים מוטוריים יונקים לשלוט התכווצות שרירים מרצון. שינויים מבניים בNMJ יכולים לגרום לכישלון עצבית, וכתוצאה מכך חולשה, ניוון ואף למוות של סיבי השריר. מחקרים רבים בחנו כיצד שינויים או מחלה גנטיים יכולים לשנות את המבנה של NMJ העכבר. למרבה הצער, זה יכול להיות קשה כדי להשוות ישירות ממצאים ממחקרים אלה כי לעתים קרובות הם מועסקים פרמטרים שונים ושיטות אנליטיות. שלושה פרוטוקולים מתוארים כאן. הראשון משתמש בתמונות confocal הקרנת עוצמה מקסימלית כדי למדוד את השטח של קולטן האצטילכולין (AChR) -rich תחומים קרום postsynaptic בendplate והאזור של מכתים שלפוחית הסינפטית במסוף עצב presynaptic שמעליה. הפרוטוקול השני משווה את העוצמות היחסית של immunostaining לחלבונים סינפטיים בקרום postsynaptic. יחסי הציבור השלישיotocol משתמש העברת הקרינה תהודה אנרגיה (סריג) כדי לזהות שינויים באריזה של AChRs postsynaptic בendplate. הפרוטוקולים פותחו ושוכללו על סדרה של מחקרים. גורמים המשפיעים על האיכות ועקביות של תוצאות נדונים ונתונים נורמטיביים מסופקים NMJs בעכברים צעירים למבוגרים בריאים.
Introduction
הצומת העצבית-שהרירית (NMJ) היא סינפסה הממסר הקריטית שמתווכת תקשורת בין מערכת העצבים ושרירי שלד. היא נדרשת לכל התנועה רצונית. מיקרוסקופ פלואורסצנטי משמש כבר זמן רב כדי לחקור את ההשפעות של transgenes על העכבר NMJ 1-3 או להשוות את ההשפעות של גיל, תזונה, פעילות גופנית ומחלות על NMJs מכרסמים 4-11. מחקרים מסוג זה לימדו אותנו הרבה על הפיסיולוגיה ופתופיזיולוגיה של NMJ, אבל הפרמטרים המגוונים דיווחו (למשל, אזור AChR, אזור endplate, אורך היקפי, מדדי פיצול) לעתים קרובות לעשות את זה קשה להשוות את הממצאים של מחקרים אלה. יש ציפייה גוברת לחוקרים פרה-קליניים כדי להיות מסוגלים להפגין שחזור, במיוחד במחקרים עם מודלים של מכרסמים של מחלה 12. הפרוטוקולים שתוארו כאן היו מעודנים באמצעות סדרה של מחקרים שחקרה ch התפתחותית, פיסיולוגי וpathophysiologicalAnges לNMJ. מחקרים מסוג זה דורשים מדידה של השטח של התמחויות הסינפטי בendplate מנוע עכבר והצפיפות היחסית של אריזה של חלבונים סינפטיים בתוך התמחויות postsynaptic 13-15.
השירות של שיטות אלה בא לידי ביטוי במחקרים שנעשה לאחרונה במודל של עכברים של אנטי-מושק מיאסטניה גרביס. זריקות יומיות של IgG ממיאסטניה אנטי-מושק חיובית גרביס חולים לעכברים בוגרים שנגרמו להם להיות חלשים בתוך 2 שבועות 16. תמונות מרבי הקרנת Confocal סעיפים שריר שכפול שכותרתו עבור synaptophysin (בעצבי מסופים) וAChRs postsynaptic הציגו ירידה הדרגתית באזור של מכתים AChR כשינוי היסודי. חשוב לציין את קצב הירידה היה די כדי להסביר ירידות דומות במשרעת של פוטנציאלים סינפטיים, כישלון של העברת הסינפטית וחולשת השרירים 17,18. איכותי ממצאים דומים דווחו על ידי קבוצות מחקר אחרות10,19. באותן שיטות מדידת NMJ ומאז נהגו להעריך את ההשפעה של שלוש תרופות לטיפול במיאסטניה גרביס אנטי-המושק ב20,21 מודל העכבר הזה.
הזדקנות כרוך בישיבה יכולה להוביל לאובדן של קשרים עצביים-שרירית. הפרוטוקולים שתוארו כאן חשפו ירידת גיל הקשורים בתחום synaptophysin מסוף העצב בendplates המוטורי כמו עכברים להתקדם בגיל מבוגר. באותן השיטות גילו כי פעילות גופנית במידה רבה מרצון יכולה למנוע את הירידה בשטח מסוף עצב presynaptic 22, עולה בקנה אחד עם מחקרים קודמים על ידי קבוצות אחרות 4. אובדן של קשרים עצביים-שרירית מתרחש גם במודל עכבר SOD1G93A של טרשת לרוחב amyotrophic 9,23.
המחקרים שהוזכרו לעיל מראים כי מגוון רחב של מצבים בריאותיים עלול להוביל לירידה בשטח של שני התמחויות לפני או אחרי-סינפטי בNMJ. הדבר עלול לגרום כיף הסינפטי לקויction או עשוי לבשר אובדן הקשר העצבי-שהרירית מלא. שלושה פרוטוקולים מתוארים המאפשרים לכמת את האזור והצפיפות של התמחויות הסינפטי. המטרה של הפרוטוקול הראשון היא לספק מידה מעשית ושחזור של התחומים לפני והתמחויות פוסט-סינפטי ויישורם בNMJs היונקים, באמצעות מיקרוסקופ פלואורסצנטי. תמונות דו-ממדיות המרביות confocal ההקרנה וניתוח תמונה עם NIH ImageJ משמש כדי לזהות שינויים באזור של מכתים synaptophysin (שלפוחית סינפטית), AChRs postsynaptic ואזור חפיפה הסינפטי. פרמטרים Confocal הדמיה (רווח לקזז רמה) מותאמים לכל NMJ על מנת למקסם את המידע החזותי המשמש להבחין תחום התמחות הסינפטי. כישלון Neuromuscular יכול לנבוע גם משינויים בצפיפות של AChR postsynaptic ו / או חלבונים סינפטיים אחרים. הפרוטוקול השני ניתן ליישם כדי לזהות שינויים בצפיפות היחסית של חלבוני postsynaptic כזהכמושק, rapsyn, dystroglycan, קינאז Src phosphorylated וAChR phosphorylated 18,21.
במיאסטניה גרביס, צפיפות מופחתת של AChR בתוך הקרום postsynaptic היא הגורם המיידי לכישלון הסינפטי וחולשת שרירים. הפרוטוקול השלישי מתאר שיטת העברת הקרינה תהודה אנרגיה (סריג) כדי להעריך את השינויים בקרבת AChRs הסמוך בתוך ממברנות postsynaptic 14,15. שיטה זו מזהה העברת אנרגיה בין AChRs השכן שכותרתו עם הניאון-α-bungarotoxin (BGT). סריג מתרחש רק כאשר בדיקות תורם acceptor ניאון בנפרד פחות מ -10 ננומטר. זה יכול לגלות שינויים (תת-מיקרוסקופים) באטימות של אריזת AChR שעשוי להיות קשור ישירות להמשרעת של פוטנציאל הסינפטי.
שלושת פרוטוקולים אלה, מעודנים בעשור האחרון, מספקים אמצעי משלימים של יושרת NMJ באופן עקבי לשחזור. שימוש בפרוטוקולים סטנדרטייםפרמטרים nd צריכים לאפשר השוואה של ההשפעות של גנים והתערבויות סביבתיות על NMJ של היונקים.
Protocol
הערה: עיצוב, התנהגות ודיווח של ניסויים בבעלי חיים צריכה לקחת בחשבון את ההנחיות הנוכחיות 24. עבודה כזו חייבת להיות מאושרת מראש על ידי הרשות המקומית לרווחת בעלי החיים (במקרה שלנו לועדת האתיקה בבעלי חיים מאוניברסיטת סידני).
1. המתת חסד של החיה וDissection השריר
- העבר את העכבר מחדר ההמתנה לחדר נפרד שבו הוא מורדמים עם זריקת intraperitoneal של פתרון pentobarbitone (30 מ"ג / קילוגרם) תוך שימוש בשיטת טיפול עכבר מפורט על ידי שימיזו 25. מניחים את העכבר חזרה לכלוב שלה.
- ברגע שהנשימה של העכבר הפסיקה דקות יותר מ 1, לבדוק את רפלקס רגל-הנסיגה בעדינות על ידי צובט את הרגל, ורפלקס מצמוץ על ידי מלטפת קלה את הקרנית. רק כאשר תגובות הרפלקס נעדרות יכול העכבר להיות מוכן לנתיחה.
- התייעץ עם אטלס של האנטומיה של מכרסמים כגון Chiasson 26 ו / או לבקש את עזרתו של experienאנטומיה CED לפני שתנסה לנתיחה של השריר של עניין. בכל מקרה להסיר שיער מהעור המכסה באמצעות מכונת גילוח חשמלי קטנה לפני שפתחת את העור כדי לחשוף את השרירים.
הערה: לנתיחה תהיה שונה לכל שריר אנטומית-מובחן. - בעזרת מלקחיים בוטים לשחרר את השרירים שממעל הקרומים ורקמות הסובבים. לתפוס ולחתוך את הגיד הדיסטלי להפריד את השריר מההכנסה שלה.
- בעדינות להקניט ולגזור את השריר חופשי מרקמות זכות חזרה למקורו. בקצרה למקם את השרירים גזורים החדש לפתרון 0.1 M פוספט שנאגרו מלוח (PBS) או תמיסת רינגר לפני עיבוד נוסף.
2. הכנת השריר לCryosectioning
הערה: שימור מבני אופטימלי יכולה להיות מושגת על ידי זלוף בעלי החיים שלם כמפורט בעבר 27, או קיבעון טבילה (לשרירים קטנים) כמתואר בשלב אופציונאלי 2.1. עם זאת,4% קיבעון paraformaldehyde יכול לפגוע בצביעה לאחר מכן עם הרבה בדיקות נוגדנים ועם ניאון BGT. Glutaraldehyde במיוחד יש להימנע. אם שרירים לא להיות קבועים הם חייבים להיות מייד צמד קפוא (המשך 2.3).
- קיבעון טבילה אופציונאלי: Pin שריר השעווה בצלחת פטרי באורך מנוחה. מכסה את השריר עם 2% w / v paraformaldehyde (טרי מומס בPBS) לשעה 2 ב RT. לשטוף אותו עם 3 שינויים של PBS על 30 דקות (3 x 10 דקות) ולאחר מכן להחליף את PBS עם 30% w / v סוכרוז ב PBS ו דגירה O / N ב 4 ° C.
- להפוך את תבניות ("סירות") מראש על ידי קיפול 2 סנטימטרים X 1.5 חתיכות של נייר אלומיניום סנטימטר כפי שמוצג באיור 1. מניחים פיסת קרום nitrocellulose בקרקעית הסירה. בעדינות יוצק מטריצת cryostat הטבעה (שולחן חומרים) לסירה עד לעומק של 2 מ"מ, לטפל כדי למנוע בועות אוויר. הנח את השריר לתוך הסירה, יישורו עם קווי העט הכדוריים עלnitrocellulose. להוסיף מטריצת הטבעה יותר כדי לכסות את השריר (איור 1) לחלוטין.
- צינורות פוליפרופילן מראש תווית עם סמן בל יימחה. מניחים ירידה של מים בצינור אחד ומקרר את הצינור בחנקן נוזלי.
הערה: טיפת המים הקפואה שומרת על לחץ האדים ומונעת התייבשות במהלך ממושך -80 ° C אחסון - שימוש במגן פנים, כפפות מגן עבות וזוג גדול של מלקחיים בוטים, באופן חלקי להפחית כוס קטנה מתכת (קוטר 3 סנטימטר, 8 סנטימטר עמוק) המכילה 2 סנטימטר עומק של איזופנטאן לתוך מיכל של חנקן נוזלי למשך 30 שניות. הסר את הכוס ומניח אותו על גבי הספסל. בעזרת זוג קטן של מלקחיים בוטים למקם את התבנית המכילה את השריר והטבעת מטריצה לאיזופנטאן המצונן. תשמור על עצמך כדי למנוע ערבוב חנקן נוזלי עם איזופנטאן.
- לאפשר 2 דקות לבלוק להקפיא לחלוטין לפני שימוש מלקחיים בוטים להרים את הגוש הקפוא בחוץ ולאטום אותו ביחסי הציבור הנכוניםכותרת דואר וצינור מראש צונן (שלב 2.3).
- אחסן את הצינורות באופן זמני בחנקן הנוזלי לפני העברה ל-80 ° C. רשום את כל הדגימות בגיליון אלקטרוני של תוכן מקפיא.
3. Cryosectioning וקרינת מכתים לתמונות En פנים של NMJs
- לקלף עובש האלומיניום. בתוך 20 ° C קאמרי cryostat לצרף בלוק הקפוא לצ'אק cryostat כדי לחתוך 20 מיקרומטר cryosections מקביל לציר הארוך של סיבי השריר (איור 1). להרים את הסעיפים על poly-L- ליזין או שקופיות מיקרוסקופ ג'לטין מצופים.
- הערה: השמט שלב זה אם הרקמה קבועה לפני ההקפאה. אחרי 30 דקות המאפשרים לחלקים להתייבש על השקופיות, לתקן אותם על ידי הנחת ירידה של 2% בparaformaldehyde PBS על כל חלק במשך 15 דקות ב RT.
- לשטוף שקופיות 3 x 10 דקות ב PBS בצנצנת Coplin, ולאחר מכן לטבול את השקופיות בPBS המכיל 0.1 M גליצין למשך 30 דקות כדי לחסום קבוצות אלדהיד שייר.
- לשטוף שקופיות למשך 10 דקות ב PBS, ולאחר מכן לטבול במתנול (מקורר ל -20 מעלות צלזיוס) במשך 7 דקות. צעד permeabilization זה חלק משגרה של תיוג כפול עם ניאון BGT ואנטי-synaptophysin אבל זה עלול להשפיע לרעה immunostaining לכמה חלבונים אחרים.
- לשטוף שקופיות 2 x 10 דקות ב PBS ואז למקם את כל שקופית בתא humidified יציב ומפולס. מייד לכסות כל חלק עם 20 μl של פתרון חסימה (0.2% Triton X-100, 2% אלבומין בסרום שור (BSA) בPBS) במשך שעה 1 ב RT. סעיפים אסור להתייבש בכל שלב של תהליך immunostaining.
- לבצע את הדגירה העיקרית: לקיחת שקופית אחת בכל פעם להסיר בזהירות את פתרון החסימה העודף מעל כל סעיף ולהחליף אותו עם 20 μl של אנטי-synaptophysin ארנב (בדילול 1: 200 בפתרון החסימה).
- כולל שקופיות שלילית-שליטה שיהיה הודגרו עם חסימת פתרון היחידה. 'לא-יסודי שליטת נוגדן זה"הוא חיוני בכל ריצת immunostaining.
- טיפול שהנוגדן הראשוני נשאר במקום מעל כל קטע, לסגור את תא humidified ודגירה של 1-2 ימים על 4 מעלות צלזיוס.
- בדוק כל סעיף כדי לוודא שהנוגדן הראשוני נשאר במקום. השתמש פיפטה פסטר לשטוף בעדינות כל שקופית עם PBS ולמקם אותו בצנצנת Coplin. לשטוף את כל השקופיות 3 x 10 דקות ב PBS.
- לבצע דגירה משנית. לוקח שקופית אחת בכל פעם, להסיר בזהירות PBS העודף, ולהניח אותה בתא humidified ולכסות כל חלק עם 20 μl של תערובת המכילה IgG FITC מצומדות- החמור נגד הארנב וBGT המוצמד לtetramethyl rhodamine או אחר fluorophor אדום (TRITC- / RedBGT; 5 גר '/ מיליליטר) בדילול מלא בפתרון חסימה. לדגור על RT עבור שעה 2.
- לשטוף שקופיות 3 x 10 דקות ב PBS בצנצנות Coplin.
- לוקח שקופית אחת בכל פעם, להסיר בזהירות PBS העודף והר עם coverslip באמצעות נפח מינימאלי של, glyceroמבוסס l, הרכבה התנגדות בינונית-לדעוך. לאטום את הקצוות של coverslips עם לכה מסמר ברור. לאפשר לו להתייבש קשה.
- אחסן את השקופיות בחושך ב 4 מעלות צלזיוס עד שבוע אחד, או ב -20 ºC לתקופות ארוכות יותר אחסון (עד מספר חודשים).
4. משוחדת דגימה וEn Face הדמיה של הרכב endplates
- עיוור שקופיות על ידי תיוג כל שקופית עם מספר קוד אקראי שנשאר ידוע רק לחוקר שני (שלא היה מעורב בניתוח). כתוצאה מכך המפעיל נשאר עיוור לקבוצות טיפול עד לכמת את הפרמטרים NMJ הוא מלאה עבור כל הדגימות.
- מניחים את השקף על הבמה מיקרוסקופ ולצפות בו תחת תאורת שדה רחבה עם מערכת סינון TRITC (שמן 1.3 אובייקטיבי NA 63X). העבר בהדרגה (שדה על ידי שדה) משמאל לימין ובחזרה עד endplate מופיעה בשדה (איור 2 א).
קריטריון דגימה:: הערה בכל מבנה הצבעוני AChR שהוא יחסיתשטוח ופונה למטרה (כלומר, משתרע <15 מ 'בz-הממד) נחשב endplate והוא צילם לניתוח (סהרונים של מכתים AChR מייצגים חתכים דרך endplates ולכן לא נכללו). - עם סט חריר confocal 1.0 יחידת Airy וכוח הלייזר נמוך לייעל את הרווח לקזז רמות לTRITC / אדום-BGT (לייזר 532 ננומטר) בendplate שהיא להיות צילמו. FITC לייעל הבא / הקרינה synaptophysin באמצעות לייזר 488 ננומטר. לאסוף Z- מחסנית של endplate עם מרווח של 0.7 מיקרומטר בין כל פרוסה אופטית. שמור את התמונות עם שם קובץ שכולל את התאריך של פגישת ההדמיה, שם הקוד של השקופית ומספר endplate.
הערה: הסריקות באמצעות ננומטר 488 ו 532 ננומטר לייזרים (FITC וTRITC) יש לאסוף ברצף (לא בו זמנית), כדי למנוע זיהום של ערוץ FITC על ידי הקרינה מfluorophore האדום ולהיפך (לדמם דרך). - חזור על הדגימהnd הדמיה של צעדים 4.2-4.3 עד 20 endplates נאספים מהשקופיות / המדגם.
- לשנות לשקופית מקודדת הבאה וחזור 4.2-4.4. חזור על פעולה זו עבור כל אחד מהשקופיות מקודדות.
- לאסוף כמה תמונות של endplates משקופית השליטה (לא-יסודי שליטת נוגדן) באמצעות confocal הגדרות שנמצאו אופטימלי לשקופיות ניסוי (ערוץ הקרינה FITC אמור להופיע כהה).
- בסופו של העברת הפעלת confocal קבצי תמונה למחשב אחר ולגבות את הקבצים המקוריים בכונן או בשרת חיצוני.
5. מדידת השטח של התמחויות Synaptic בתמונות En Face
- השתמש בתוכנה חופשית NIH ImageJ (http://imagej.nih.gov/ij/) להכין תמונות הקרנה מקסימלי (MIP) מכל Z- מחסנית. לשמור אותם כקבצי TIFF (איור 2 א & B). שמות קבצים צריכים לכלול את תאריך תמונת מושב, קוד לדוגמא, מספר endplate וערוץ ניאון (למשל, 060414_5723_7_FITC.tiff).
- פתח את תמונת Z- ההקרנה בImageJ. בחר את ערוץ תמונת קולטן האצטילכולין (איור 3 א) ובחר: תמונה> סוג> 8 סיביות להמיר תמונת RGB 24-bit צבע לשלוש תמונות בגווני אפור 8 סיביות על המסך.
- שימוש בכלי מצולע ImageJ לצייר קווי המתאר גסים סביב endplate עניין בredBGT מוכתמת ערוץ (ACHR) כך שיכלול את כל האזורים לכאורה הצבעוניים של endplate אדם המסוימת, תוך נטרול כל כתמים שאינו נובעים מendplate של עניין ( 3C איור).
- החל סף עוצמה מינימאלי לתמונה על ידי בחירה: תמונה> התאם> סף (איור 3E וצילומי מסך ImageJ קשור).
- התאם את רמת הסף כדי לבודד את החלקים הצבעוניים AChR תוך הדרת אות רקע שמסביב כמו תת-סף (3E איור). פתח סיבוב שניOW עם התמונה המקורית (רציף הטון) מייד ליד החלון להשוואה, כדי להקל על ההחלטה על ערך הסף. רשום את ערך הסף לשימוש מאוחר יותר בcolocalization ניתוחים.
- שמירה על המתווה המצולע סביב endplate לבחור: הניתוח> לנתח חלקיקים. בתפריט המוקפץ לציין את הטווח של גדלים כ: 50 עד אינסוף פיקסלים (זה מבטל חפצים זעירים הנובעים מרעש חשמלי במכפיל).
- לנתח חלקיקי הפקודה יוצרת חלון עם רשימה של אזורים על-סף בדידים וערכי עוצמת הקרינה שלהם ממוספרים כפי שהם מופיעים בתמונה בינארי (איור 3G ומסך ImageJ קשור). העתק את הנתונים לגיליון אלקטרוני שכותרתו.
- למדוד את שטח endplate סה"כ (האזור בתוך המצולע) על ידי בחירה: ניתוח> מדוד. זה מניב הכולל אזור endplate. העתק והדבק את הנתונים לאזורי AChR ועוצמות לגיליון אלקטרוני כדי לוודא לתייג עמודות כראוי, שורות ישמשו לendplates פרט לשקופיות ספציפיות.
- עובר לערוץ הקרינה אנטי-synaptophysin וחזור על צעדים 5.1-5.5, אבל לערוץ FITC (איור 3 ב ', ד' ו-ו '). המטרה היא להתאים את הסף, כך שהוא יוצר תמונה בינארי ש, ככל האפשר, תואם את הגבולות של מכתים כפי שהיא נתפסת על ידי העין. רשום את ערך הסף.
- למדוד את השטח של חפיפה על ידי יישום הצעדים הבאים: פתח את הקובץ המקורי מכיל שתי תמונות הערוץ ולפצל אותה לשתי תמונות נפרדות על ידי בחירה: תמונה> סטאקס> מחסנית לתמונות.
- שימוש בתוסף colocalization (הוריד והתקין מדף אינטרנט ImageJ) בחר: Pluggin> colocalization וקלט ערכי הסף נרשמו בעבר לערוצי AChR ועצב לb שאילתא הערוץ המתאיםשור. זו תניב תמונת חפיפה בפיקסלים לבנים (איור 3H וצילומי מסך ImageJ קשור).
- להמיר את תמונת החפיפה החדשה שנוצרה לפורמט בגווני אפור ולהחיל סף לערך המקסימאלי. הסף המקסימאלי רק יבחר פיקסלים הלבנים, מתאים לאזור החפיפה של שני הערוצים הקודמים. שיא בגיליון האלקטרוני וכתוצאה מכך ערך שטח של 'colocalization', המייצג את אזור חפיפה בפיקסלים.
- הכן גיליון אלקטרוני של אמצעי מדגם נתונים, לחשב ולתכנן סטיות תקן וסטיות התקן כהיסטוגרמות או scatterplots 20,22. שים לב שהערך של n בדרך כלל מייצג את מספר העכברים לכל קבוצת מדגם למטרות סטטיסטיות.
- endplate עלילת אזורי AChR כscatterplots או היסטוגרמות תדירות כדי לקבוע אם הנתונים מתפלגים נורמלי לפני בדיקה סטטיסטית (איור 6).
6. מכתים יחסיתעוצמות לעומת שימוש בסעיפים אופטיים רוחביים
הערה: לתהליך זה פרוטוקול יחד את כל דגימות השריר ותמונה במושב confocal יחיד. בתכנון ניסוי מאפשר עד 30 דקות זמן הדמיה לדגימה שריר.
- לחתוך 15 מיקרומטר cryosections הרוחבי לציר של סיבי השריר הארוך ולאסוף על גבי שקופיות כפי שמתואר בשלב 3.1.
- לבצע צביעת הקרינה כמתואר בשלבים 3.2-3.13.
- קוד שקופיות המוכתמות כך שההדמיה והניתוח מתבצעים עם עיוור מפעיל לקבוצת טיפול, כפי שתוארו בשלב 4.1.
- באמצעות מטרת 40X הקרינה (NA 0.75) בקצרה תסקור חלק מכל שקופית כדי לקבוע רווח בודד וקיזוז הגדרת רמה לAChR שתהיה מתאים לכל endplates בכל שקופיות המדגם. Endplate הבהירה אז צריכה להיות ממש מתחת 256 אפורה בקנה המידה. אופטימיזציה זה צריך להיעשות בנפרד עבור fluorescenc השניערוץ E (שנאסף ברציפות). רשום את הרווח הקבוע ולקזז את הגדרות רמה ואינו משנה אותם לאורך כל פגישת ההדמיה.
- לאסוף תמונות של שקופיות הקרינה סטנדרטית (לדוגמא, חרוזי ניאון הלא הלבנה), תוך שימוש באותם הפרמטרים, בתחילת וסוף פגישת confocal כדי לאתר את כל תנודות אפשריות בעוצמת לייזר.
- השתמש בערוץ AChR כדי לסרוק את השקופיות בהדרגה לאתר endplates.
- להתמקד כדי למצוא את מטוס הסעיף האופטי היחיד בכל תחום מיקרוסקופ המכיל את המספר הגדול ביותר של endplates הצבעוני AChR.
- סריקת סעיף אופטי יחיד זה פעמיים ולשמור את התמונה בממוצע (איור 4G).
- שמירה על אותו מתג מוקדי מטוס לערוץ הקרינה השני (חלבון של עניין) ולאסוף את התמונה כבשלב 6.8. שמור את קובץ התמונה, ובכלל זה בשם הקובץ: מועד פגישת הדמיה, קוד לדוגמא, מספר תמונה וסמל כדי לציין את ערוץ הניאון. איור 4 א - F מציג דוגמאות של הפצת endplate של AChR לעומת rapsyn, מושק או -dystroglycan (-DG).
- הזז את הבמה לשדה הבא שיכלול את endplates אחד או יותר וחזור על שלב 6.8-6.9. חזור על פעולה זו עד סך של 60 endplates הם צילמו.
- בסופו של העברת פגישת הדמיה את כל הקבצים למחשב אחר ולגבות אותם.
- לפתוח כל קובץ תמונה מקורי ותוך כדי צפייה בערוץ AChR, בחר: תמונה> סטאקס> מחסנית לתמונות, לפיצול ערוצים.
- בחר: תמונה> סוג> 8bit להמיר לפורמט בגווני אפור 8 סיביות על המסך. לעשות את זה בשני ערוצי הקרינה.
- בחר: תמונה> תמונות סטאקס> למחסנית. פתח ערימה חדשה משתי תמונות של 8 סיביות הופרדו בעבר. אפשר לאחר מכן לעבור בנוחות בין שני ערוצי הקרינה בתוך החלון אחד.
- השתמש בכלי המצולע לצייר linדואר בחוזקה סביב הגבול של הכתמת AChR (איור 4I).
- בחר: ניתוח> למדוד למדוד את עוצמת פיקסל הממוצעת לAChR בתוך השטח המגודר (שים לב לחשיבותו של ציור הקו בחוזקה). העתק ערך זה לגיליון אלקטרוני שכותרתו.
- שמירה על אותו המתווה המצולע (כדי להגדיר את האזור כדי להימדד), עובר לערוץ השני הניאון (למשל, איור 4 ב ', ד', ו ') ובחר: ניתוח> מדד. זו תניב את עוצמת כתמים הממוצעת לחלבון של עניין בתחום הסינפטי שהוגדר על ידי צביעת AChR.
- בחר אזור מהכתמת endplate גלויה ולאחר מכן בחר: ניתוח> למדוד למדוד את עוצמת הקרינה רקע הממוצעת. חזור על פעולה זו עבור ערוץ הקרינה / s האחרות ולהעתיק את ערכי רקע לגיליון האלקטרוני של ערכי הקרינה.
- תתמערכת ערכי רקע הממוצע מערכי endplate להשיג עוצמות המתוקנות לAChR והחלבון של עניין בכל endplate.
- מחלקים את ערכי עצמת endplate המתוקנות לחלבון של עניין על ידי עוצמת הקרינה BGT תיקנה להניב יחסי עוצמת הקרינה 14,21
7. השוואת צפיפות Postsynaptic ממברנה AChR שימוש סריג
הערה: פרוטוקול זה מעריך בקרום postsynaptic המידה שבה הם ארוזים באופן הדוק AChRs (<10 ננומטר מרווח). שילוב תורם fluorophore acceptor המדויק הוא קריטי לassay סריג זה. מקבלים שמות ופרטים של fluorophores בטבלת חומרים. התכונות ספקטרליות שלהם, ביחס לסריג, הם דנו במאמרים הקודמים שלנו 14,15.
- הכן cryosections הרוחבי קבוע כמפורט בסעיף 6.1. כל קבוצות המדגם חייבים להיות מעובד ביחד ותמונהד באותה ההפעלה confocal.
- לערבב ביסודיות אדום BGT (תורם סריג) 2.5 גר '/ מיליליטר עם 10 גר' / מיליליטר כה אדומה-BGT (סריג acceptor) עם פתרון חסימה בצינור פלסטיק קטן על ידי pipetting למעלה ולמטה 12 פעמים. זה 1: תערובת טוחנת 4 ממקסם את היעילות של 14 סריג.
- מניחים כל שקופית בתא humidified, לכסות בזהירות כל חלק עם ירידה (μl 12) של התערובת מעל ודגירה של 1.5 שעות ב RT.
- סעיפי שליטה: לכסות מספר קטן של חלקים עם 2.5 גר '/ מיליליטר אדום-BGT (תורם בלבד; בקרות C1 שכותרתו), וגם כמה קטעים עם 10 גר' / כה-אדום-BGT מיליליטר (acceptor בלבד; בקרות C2 שכותרתו). דגירה בקרות אלה כבשלב 7.3.
- לשטוף שקופיות 3 x 10 דקות ב PBS ו הר הבמבוסס על גליצרול, הרכבה בינונית (ראה שלב 3.12) העמידה לדהייה.
- לבצע דגימה של endplates כמו בשלב 6.7. הקרינה מתורם acceptor צריכה להיות מושלם שיתוף מקומי-בendplates בשל אקראי המחייב של מולקולות ניאון-BGT.
- תמונות בקרה: שימוש במטרה 40X ורווח redBGT נמוך לייזר לייעל כוח ולקזז את הגדרות רמה לendplates מC1 שקופיות שליטה. לייעל רווח מרחיק redBGT ולקזז רמות לendplates מC2 שקופיות שליטה. לאשר את היעדר לדמם דרך הקרינה.
- מבלי לשנות את כוח הלייזר, להרוויח או הגדרות ברמת קיזוז לעבור לשקופיות הניסיוניות ולאסוף תמונות (לפני photobleach) לשני ערוצי הקרינה.
- סלקטיבי photobleach מרחיק האדומה-BGT על חלק של endplate אחת על ידי התקרבות באזור הסריקה ולאחר מכן סריקת 10 פעמים עם לייזר 633 ננומטר ב 100% כוח. הקרינה באזור שנסרק צריכה להיות עמומה.
- איפוס כוח הלייזר וזום ולאסוף תמונות לאחר אקונומיקה על שני ערוצי הניאון באמצעות הגדרות confocal הוקמו על 7.7.
- לחשב את יעילות סריג (E) מאחוז העלייה בתורם הקרינה (אדום-BGT) הבא photobleach של acceptor (מרחיק האדום-BGT) על פי הנוסחא * הבאה:
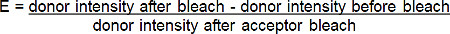
* לכל המצבים שבם הקרינה של התורם מגבירה לאחר photobleaching acceptor.
תוצאות
מדידה של שטח Synaptic בNMJ
כל הערכה של האזור מסתמכת על הציור של גבול כדי להגדיר את היקף התמחויות הסינפטי. בשרירים צעירים מבוגרים בריאים תמונות NMJ צריכים להציג גבולות מוגדרים היטב עבור שני AChR וצביעת synaptophysin (איור 2 א 'וב'...
Discussion
הפרוטוקולים שתוארו כאן, אפשרו לנו למדוד באופן מהימן ולכמת שינויים במאפיינים של NMJ על פני מגוון מצבים, כולל מדינות הזדקנות ומחלות נורמליות. השיטות שתוארו עבור en פנים תמונות NMJ תאפשר לחוקרים להשוות את השטח של התמחויות טרום postsynaptic ואזור חפיפה / יישור הסינפטי. כדי להשוות ?...
Disclosures
The authors declare they have no competing financial interests.
Acknowledgements
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materials
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
References
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved