Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Нервно-мышечном соединении: Synapse размер измерение, фрагментации и изменения в синаптической белка плотности с использованием конфокальной флуоресцентной микроскопии
В этой статье
Резюме
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Аннотация
Нервно-мышечного соединения (НМС) является большой, холинергическая реле синапс, через который млекопитающих моторные нейроны контролировать добровольное сокращение мышц. Структурные изменения в НМС может привести к поломке нервам, в результате слабости, атрофии и даже смерти мышечного волокна. Многие исследования изучали, как генетические изменения или болезнь может привести к изменению структуры НМС мыши. К сожалению, это может быть трудно непосредственно сравнивать результаты этих исследований, так как они часто используют различные параметры и аналитические методы. Три протокола описаны здесь. Первый использует Проекция максимальной интенсивности конфокальных изображений для измерения площади рецептора ацетилхолина (AChR) обогащенный постсинаптической мембраны доменов на концевой шайбы и области синаптической окрашивания пузырьков в вышележащей пресинаптических окончаний нервов. Второй протокол сравнивает относительные интенсивности иммунного окрашивания для синаптических белков в постсинаптической мембране. Третий прotocol использует флуоресцентного резонанса переноса энергии (FRET), чтобы обнаружить изменения в упаковке постсинаптических АХР на торцевой пластины. Протоколы были разработаны и уточнены в течение ряда исследований. Факторы, влияющие на качество и согласованность результатов обсуждаются и нормативные данные предоставляются НМС в здоровых молодых взрослых мышей.
Введение
Нервно-мышечном соединении (НМС) является критическим реле синапсов, что опосредует связь между нервной системы и скелетных мышцах. Это требуется для всех произвольных движений. Флуоресцентная микроскопия уже давно используется для изучения влияния трансгенов на мышь NMJ 1-3 или сравнить эффекты от возраста, диеты, физические упражнения и болезни на грызунов NMJs 4-11. Такие исследования научили нас много о физиологии и патофизиологии НМС, но различные параметры сообщалось (например, AChR площадь, Концевая пластина площадь, длина периметра, индексы фрагментации) часто затрудняют сравнение результатов этих исследований. Существует растущая ожидание доклинические исследователи, чтобы иметь возможность продемонстрировать воспроизводимость, в частности, в исследованиях с грызунами моделей болезни 12. Протоколы, описанные здесь, были уточнены в ходе ряда исследований, которая расследовала развития, физиологических и патофизиологических чАнгелов в НМС. Такие исследования требуют измерения области синаптических специализаций на двигателе мыши концевой пластинки и относительной плотности упаковки синаптических белков в постсинаптической специализаций 13-15.
Полезность этих методов свидетельствуют недавние исследования в мышиной модели анти-мускуса миастения. Ежедневные инъекции IgG из анти-мускусный положительного миастения пациентов в взрослых мышей заставило их стать слабыми в течение 2 недель 16. Конфокальные максимальной проекции изображения мышечных разделов, которые были дважды мечеными для синаптофизина (в нервных терминалов) и постсинаптических АХР показали прогрессирующее снижение в области АХР окрашивания в качестве основного изменений. Важно темпы снижения было достаточно, чтобы объяснить, сопоставимые снижение амплитуды синаптических потенциалов, отказ от синаптической передачи и мышечной слабости 17,18. Качественно аналогичные результаты были получены и другими исследовательскими группами10,19. Те же НМС методы измерения, поскольку были использованы для оценки влияния трех препаратов для лечения анти-мускуса миастения в этой модели мыши 20,21.
Сидячий старение может привести к потере нервно-мышечных соединений. Протоколы, описанные здесь, выявили снижение, связанное с возрастом в области нервных окончаний синаптофизина на двигателе концевых пластинок, как у мышей прогресс в пожилом возрасте. Те же методы показали, что добровольным мероприятием можно в значительной степени предотвратить уменьшение площади 22 терминала пресинаптических нервных, в соответствии с предыдущей работой со стороны других групп 4. Потеря нервно-мышечных соединений также происходит в модели SOD1G93A мыши бокового амиотрофического склероза 9,23.
Исследования, упомянутые выше, показывают, что многие факторы здоровья могут привести к сокращению в области либо до или после синаптических специализаций НМС. Это может привести к нарушению синаптической удовольствияие или может предвещать полную потерю нервно-мышечного соединения. Три протокола описан, что позволит количественно оценивать площади и плотности синаптических специализаций. Цель первого протокола является создание практического и воспроизводимое измерение области до и после синаптических специализации и их выравнивание при НМС млекопитающих, с помощью флуоресцентной микроскопии. Двумерные максимальной проекцией конфокальной изображения и анализа изображений с NIH ImageJ используется для обнаружения изменений в области синаптофизин окрашивания (синаптические пузырьки), постсинаптических АХР и синаптической области перекрытия. Конфокальные параметры визуализации (усиление и смещение уровня) оптимизированы для каждого НМС так, чтобы максимизировать визуальную информацию, используемую для разглядеть площадь синаптической специализации. Нервно ошибка может также возникнуть в результате изменений в плотности постсинаптических AChR и / или других синаптических белков. Второй протокол может быть применен для обнаружения изменений в относительной плотности постсинаптических белков, такихкак мускус, rapsyn, Dystroglycan, фосфорилированного Src киназы и фосфорилирования AChR 18,21.
В миастения, снижение плотности АЧР в постсинаптической мембране Непосредственной причиной синаптической недостаточности и мышечной слабости. Третий протокол описывает метод флуоресцентного резонанса Передача энергии (FRET), чтобы оценить изменения в непосредственной близости от соседних АХР в постсинаптических мембранах 14,15. Этот метод определяет передачу энергии между соседними АХР, меченных флуоресцентной-α-бунгаротоксина (BGT). FRET происходит только тогда, когда флуоресцентные донорные и акцепторные зонды менее 10 нм друг от друга. Это может выявить (субмикроскопические) изменения в герметичности АХР упаковки, которые могут непосредственно связанные с амплитудой синаптических потенциалов.
Эти три протокола, совершенствуется на протяжении последнего десятилетия, обеспечивают дополнительные меры NMJ целостности в последовательной и воспроизводимой образом. Использование стандартных протоколов Ай параметры должны облегчить сравнение эффектов генов и окружающей среды вмешательств на млекопитающих НМС.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Проектирование, проведение и отчетность экспериментов на животных следует учитывать нынешних руководящих принципов 24. Такая работа должна быть заранее одобрены местными властями защиты животных (в нашем случае комитет по этике животных из Университета Сиднея).
1. Эвтаназия животного и мышц Вскрытие
- Передача мышь от удерживающей комнате с отдельной комнате, где он эвтаназии путем внутрибрюшинной инъекции пентобарбитона раствора (30 мг / кг) с использованием метода обработки мыши список по Shimizu 25. Поместите мышь обратно в клетку.
- После того, как дыхание мыши была остановлена на более чем 1 мин, проверить футов снятие рефлекс, осторожно сжимая ноги, и роговицы рефлекс, слегка чистки роговицы. Только тогда, когда рефлекторные реакции отсутствуют можете мышь быть подготовлены для вскрытия.
- Обратитесь атлас грызунов анатомии, таких как Чиассон 26 и / или обратиться за помощью к experienCED анатом, прежде чем пытаться рассечение мышцы интерес. В каждом случае удаления волос из вышележащих кожи с помощью небольшого электробритву, прежде чем открывать кожу, чтобы выставить мышцы.
ПРИМЕЧАНИЕ: рассечение будет отличаться для каждого анатомически отдельной мышцы. - Использование тупых щипцы освободить мышцы от вышележащих оболочек и окружающих тканей. Возьмите и сократить дистального сухожилия, чтобы отделить мышцу от его введения.
- Аккуратно дразнить и отрезать мышцы, свободной от окружающих тканей обратно к своему источнику. Вкратце место недавно расчлененный мышцы в 0,1 М фосфатном растворе буферный солевой раствор (PBS) или раствор Рингера перед дальнейшей обработкой.
2. Подготовка мышц для Cryosectioning
Примечание: Оптимальное структурное сохранение может быть достигнуто за счет целого животного перфузии, как описано ранее 27 или погружением крепление (для небольших мышц), как описано в необязательной стадии 2.1. Тем не менее,4% параформальдегида фиксации может привести к ухудшению последующим окрашиванием со многими антител зондов и с люминесцентными-BGT. Глутаральдегид частности, следует избегать. Если мышцы не должны быть фиксированной, они должны быть немедленно замораживали (перейти к 2,3).
- Дополнительное крепление погружения: Pin мышцы воска в чашку Петри в длину покоя. Накройте мышцы с 2% вес / объем параформальдегида (свеже, растворенного в PBS) в течение 2 ч при комнатной температуре. Промыть 3 с изменениями PBS в течение 30 минут (3 х 10 мин), затем заменить PBS с 30% вес / объем сахарозы в PBS и инкубировали O / N при 4 ° С.
- Сделать формы ('') лодки заранее спинка 2 см х 1,5 см кусочки алюминиевой фольги, как показано на фиг.1. Поместите кусок нитроцеллюлозную мембрану в нижней части шлюпки. Аккуратно влить криостата вложения матрицу (Материалы таблицу) в лодке на глубину 2 мм, заботясь, чтобы избежать воздушных пузырей. Поместите мышцы в лодку, совместив его с шариковой ручкой линий нанитроцеллюлозы. Добавить еще вложение матрицу так, чтобы полностью покрыть мышцы (рисунок 1).
- Pre-этикеток полипропиленовые трубы с несмываемым маркером. Поместите каплю воды в каждую пробирку и охладить трубку в жидком азоте.
ПРИМЕЧАНИЕ: замороженные капли воды поддерживает давление паров и предотвращает высыхание при длительном -80 ° C Температура хранения - Использование маску, толстые защитные перчатки и большой пару тупых щипцы, частично снизить небольшой металлический стакан (диаметр 3 см, 8 см глубиной), содержащий 2 см Глубина изопентана в контейнер с жидким азотом в течение 30 сек. Снимите стакан и поместить его на скамейке наверху. Использование меньшего пару тупых щипцы разместить форму, содержащую мышцы и вложение матрицу в охлажденной изопентана. Будьте осторожны, чтобы избежать смешивания с жидким азотом с изопентана.
- Разрешить 2 мин для блока заморозить перед использованием тупых щипцы, чтобы поднять замороженного блока, и запечатать его в правильном прэлектронной помечены и предварительно охлажденной трубки (этап 2.3).
- Хранить трубы временно в жидком азоте до передачи -80 ° С. Записывать все образцы в таблице содержания морозильную камеру.
3. Cryosectioning и флуоресценции окрашивания для ванной изображений лиц НМС
- Удаляйте алюминиевые пресс-формы. В -20 ° C криостата камеры прикрепить замороженный блок криостата патрона таким образом, чтобы сократить 20 мкм криосрезы параллельно длинной оси мышечных волокон (фиг.1). Возьмите в разделах, посвященных поли-L-лизина или покрытые желатином предметные стекла.
- ПРИМЕЧАНИЕ: Пропустите этот шаг, если ткань фиксируется до замораживания. После того как 30 мин в течение участки высохнуть на слайдах, исправить их, помещая капли 2% параформальдегидом в PBS в течение каждого раздела в течение 15 мин при комнатной температуре.
- Промыть слайды 3 х 10 мин в PBS в банку Коплин, а затем погрузить слайдов в PBS, содержащем 0,1 М глицин в течение 30 мин, чтобы блокировать остаточные альдегидных групп.
- Промыть слайдов в течение 10 мин в PBS, а затем погружают в метаноле (охлажденного до -20 ° С) в течение 7 минут. Этот шаг пермеабилизации является обычной частью двойной маркировки с люминесцентными BGT и анти-синаптофизина но это может отрицательно сказаться на иммуноокрашивания для некоторых других белков.
- Вымойте слайды 2 х 10 мин в PBS затем поместить каждый слайд в стабильной и сравняли влажной камере. Сразу охватывать каждую секцию с 20 мкл блокирующего раствора (0,2% Triton X-100, 2% бычьего сывороточного альбумина (БСА) в PBS) в течение 1 ч при комнатной температуре. Разделы не должно быть позволено высохнуть на любом этапе процесса иммуноокрашивания.
- Провести первичный инкубации: взять один слайд в то время, осторожно удалите излишки раствора блокирующий из более чем каждой секции и заменить его 20 мкл кроличьего анти-синаптофизина (разбавленный 1: 200 в блокирующем растворе).
- Включить негативного контроля слайд, который будет инкубировали с блокирующим только решение. не Это «нет первичной контрольное антитело"Необходимо в каждом Иммуноокрашивание перспективе.
- Забота, что первичное антитело остается на месте в течение каждого раздела, закройте влажной камере и инкубировать в течение 1-2 дней при 4 ° С.
- Проверьте каждый раздел, чтобы подтвердить, что первичное антитело остается на месте. Используйте пипетку Пастера осторожно промыть каждый слайд с PBS и поместить его в банку Коплин. Вымойте все слайды 3 х 10 мин в PBS.
- Провести вторичную инкубацию. Принимая один слайд в то время, осторожно удалите излишки PBS, положите его в увлажненной камере и охватывают каждую секцию с 20 мкл смеси, содержащей FITC-конъюгированного осел анти-кролика IgG и BGT конъюгированный с Тетраметил родамин или еще один красный флуорофор (TRITC- / redBGT; 5 мкг / мл) разводили в блокирующем растворе. Инкубируют при комнатной температуре в течение 2 часов.
- Вымойте слайды 3 х 10 мин в PBS в Коплин банки.
- Принимая один слайд в то время, осторожно удалите излишки PBS и смонтировать с покровным использованием минимального объема, глицерол основе, нарастающий сопротивление монтажа среды. Печать края покровных с четким лака для ногтей. Позвольте ему высохнуть трудно.
- Храните слайды в темноте при 4 ° С на срок до одной недели или при -20 ° С для длительного хранения (до нескольких месяцев).
4. Объективное Отбор проб и анфас Визуализация Motor концевых пластин
- Blind слайды, маркируя каждый слайд со случайным кодовым номером, который остается известным только второй исследователя (которые не участвовали в анализе). В результате оператор остается слепым к группам лечения до количественное определение NMJ параметров не будет завершена для всех образцов.
- Поместите слайд на предметный столик микроскопа и просматривать его под широким освещением поля с множеством TRITC фильтра (63X масло 1,3 NA объективной). Перемещение постепенно (поле за полем) слева направо и обратно, пока не лобовая плита появляется в поле (рис 2а).
ПРИМЕЧАНИЕ: Отбор проб критерий: Каждый AChR окрашенных структура, которая является относительноплоской и сталкивается с целью (то есть, проходит <15 м в Z-измерении) считается концевой шайбы и отображены для анализа (полумесяца окрашивания AChR представляют поперечные сечения через концевых шайб и, следовательно, исключены). - С Регулируемая щель от 1,0 Эри устройства и низкой мощности лазера оптимизации усиления и смещения уровня для TRITC / красный-БГТ (532 нм) лазера на концевой шайбы, которые должны быть отображены. Следующая оптимизировать FITC / синаптофизин флуоресценции с помощью 488 нм лазера на. Сбор Z-стек концевой шайбы с интервалом 0,7 мкм между каждым оптическим среза. Сохранение изображений с именем файла, которое включает в себя дату изображений сессии, кодовое имя слайда и номер концевой шайбы.
ПРИМЕЧАНИЕ: Сканирование с использованием 488 нм и 532 нм лазеров (FITC и TRITC) должны быть собраны последовательно (не одновременно), чтобы избежать загрязнения канала FITC флуоресценции, от красного флюорофора и наоборот (проступание). - Повторите отбора пробй изображений шагов 4,2-4,3 до 20 торцевые пластины собраны из слайд / образец.
- Переход к следующей кодированной слайд и повторите 4,2-4,4. Повторите эту процедуру для каждого из кодируемых слайдов.
- Соберите несколько изображений концевых пластин из управления слайд (без первичной управления антитела), используя настройки конфокальной, которые были найдены оптимальные для экспериментальных слайдов (флуоресценции канал FITC должен появиться темные).
- В конце конфокальной передачи сеанса файлы изображений на другой компьютер и обратно до оригинальных файлов с внешнего жесткого диска или сервера.
5. Измерение площади синаптические специализации в фас изображений
- Используйте NIH ImageJ бесплатно (http://imagej.nih.gov/ij/) подготовить максимальный выступ (MIP) изображения от каждого Z-стека. Сохранить их в качестве TIFF файлов (рис 2А и В). Имена файлов должны содержать дату изображение сеанса, примеры кода, номер концевой шайбы и флуоресцентный канал (например, 060414_5723_7_FITC.tiff).
- Откройте изображение Z-проекции в ImageJ. Выберите изображение канала рецептора ацетилхолина (рис 3а) и выберите: Image> Type> 8-бит, чтобы преобразовать 24-битовый RGB цветного изображения на три 8-битных изображений в градациях серого на экране.
- Использование Polygon Tool ImageJ нарисуйте контур вокруг торцевой пластины интереса к redBGT окрашенных (АЧР) канал так, чтобы включать в себя все видимые окрашенные регионы конкретного индивидуального концевой пластинки, в то время исключая окрашивание, что не происходит из торцевой пластины интереса ( Фигура 3С).
- Применить минимальный порог интенсивности к изображению, выбрав: Изображение> Коррекция> Порог (рис 3E и связанные с ними скриншоты ImageJ).
- Отрегулируйте пороговый уровень так, чтобы изолировать AChR окрашенных частей, исключая окружающий фоновый сигнал, как суб-порог (рис 3Е). Откройте второе дыханиеОй с оригинальным (однотонных) снимка сразу рядом с окном для сравнения, чтобы облегчить решение о пороговом значении. Запишите пороговое значение для дальнейшего использования в колокализации анализа.
- Сохраняя полигон контур вокруг концевой пластинки выберите: Анализ> Анализ частиц. В всплывающем меню укажите диапазон размеров, как: 50 до бесконечности пикселей (это исключает крошечные артефакты, связанные с электрическими помехами в ФЭУ).
- Анализ Частицы команда создает окно со списком дискретных выше пороговых областей и их значения интенсивности флуоресценции пронумерованы, как они появляются в бинарном изображении (рис 3G и связанного с экрана ImageJ). Скопируйте эти данные в меченого таблицы.
- Измерьте Общая площадь концевой шайбы (область внутри полигона), выбрав: Анализ> Измерить. Это дает общую площадь концевой шайбы. Скопируйте и вставьте данные для AChR районов и интенсивности втаблица убедившись, что метка колонки надлежащим образом, строки будут использоваться для отдельных торцевых пластин для конкретных слайдов.
- Переключитесь на анти-синаптофизин канала флуоресценции и повторите шаги 5,1 - 5,5, а для канала FITC (3В, D и F). Цель состоит в том, чтобы настроить порог так, что он создает бинарный образ, который, насколько это возможно, соответствует границам окрашивания, как воспринимается глазом. Запишите пороговое значение.
- Измерьте площадь перекрытия, применяя следующие действия: Откройте исходный файл, содержащий два канала изображения и разделить его на два отдельных изображения, выбрав: Image> Стеки> Стек изображений.
- Используя плагин колокализационные (загрузка и установка с веб-страницы ImageJ) Выберите: Pluggin> колокализационные и входные пороговые значения ранее записанную для каналов AChR и нервных в соответствующем канале запрос Бвол. Это даст перекрытие изображения в белых пикселей (рис 3Н и связанных с ними скриншотов ImageJ).
- Преобразование созданную перекрытия изображения в черно-белом формате и применить порог максимального значения. Максимальный порог будет выбирать только белые пиксели, соответствующие области перекрытия двух предыдущих каналов. Запись в таблице полученное значение площадь "колокализации", которая представляет собой область перекрытия в пикселях.
- Подготовьте таблицу выборки данных с помощью, рассчитать и построить стандартные отклонения и стандартные ошибки, как гистограммы или диаграммы рассеивания 20,22. Следует отметить, что значение N в основном представляет собой количество мышей в группе выборки для статистических целей.
- Участок концевых пластин АЧР областях, как диаграммы рассеивания или частотных гистограмм, чтобы определить, является ли данные нормально распределены до статистических испытаний (рисунок 6).
6. Относительная ОкрашиваниеИнтенсивность сравнивали с помощью поперечных оптических Разделы
ПРИМЕЧАНИЕ: Для этого процесса протокола все образцы мышц вместе, и изображение на одной сессии конфокальной. При планировании эксперимента позволяют до 30 мин времени съемки на пробу мышц.
- Вырезать 15 мкм криосрезы поперек длинной оси мышечных волокон и собирать на слайдах, как описано на шаге 3.1.
- Провести флуоресцентного окрашивающего как описано в шагах 3.2-3.13.
- Код окрашенные слайды, так что изображения и анализы, проведенные с оператором слепых в группу лечения, как описано в шаге 4.1.
- Использование флуоресценции цели 40X (NA 0,75) краткий обзор раздела из каждого слайда, чтобы определить единого усиления и смещения настройки уровня для AChR, что будут пригодны для всех концевых пластин во всех образцов слайдов. Яркая Концевая пластина должна затем быть чуть ниже 256 серый по шкале. Эта оптимизация должно быть сделано отдельно для второго fluorescencе канала (собранные подряд). Запишите фиксированного усиления и смещения настройки уровня и не изменяют их в течение сессии изображений.
- Собирают изображения стандартной слайд флуоресценции (например, не-отбеливающие флуоресцентные шарики), с теми же параметрами, в начале и в конце конфокальной сессии для обнаружения любого возможного колебания интенсивности лазерного.
- Используйте канал AChR для сканирования слайдов постепенно, чтобы найти торцевых пластин.
- Фокус, чтобы найти единый оптической части плоскости в каждом поле микроскопа, который содержит наибольшее количество AChR окрашенных концевых пластинок.
- Сканирование этот единственный оптической части в два раза и сохранить усредненный образ (рис 4G).
- Сохраняя ту же фокальной плоскости переключатель на второй канал флуоресценции (белок интерес) и собрать изображение, как на этапе 6.8. Сохраните файл изображения, в том числе в имени файла: Дата визуализации сессии, примеры кода, номер изображения и символ для обозначения флуоресцентного канала. Рисунок 4A - F приведены примеры распределения концевой пластинки АЧР по сравнению с rapsyn, мускус или -dystroglycan (-dg).
- Перемещение этап к следующему полю, которое содержит один или несколько концевых пластин и повторите шаг 6.8-6.9. Повторите это, пока в общей сложности 60 торцевых пластин изображаются.
- В конце передачи изображений сессии все файлы на другой компьютер и обратно их.
- Откройте каждый исходный файл изображения и при просмотре канала AChR, выберите: Image> Стеки> Стек к изображениям, чтобы разделить каналы.
- Выберите: Image> Type> 8 бит преобразовать в 8-битные оттенки серого формате на экране. Делайте это в течение двух флуоресцентных каналов.
- Выберите: Image> Стеки> Изображения укладывать. Откройте новую пачку из двух ранее разделенных 8-битных изображений. То можно переключить удобно между двумя каналами флуоресценции в одном окне.
- Используйте инструмент многоугольник сделать линэлектронной плотно вокруг границы AChR окрашивания (фиг 4I).
- Выберите: Анализ> Измерение измерить среднюю интенсивность пикселя для AChR в закрытом помещении (обратите внимание на важность рисования линии сильно). Скопируйте это значение в меченого таблицы.
- Сохранение же многоугольника план (определить область, которая будет измерено), переключитесь на второго флуоресцентного канала (например, рис 4В, D, F) и выберите: Анализ> меры. Это даст среднюю интенсивность окрашивания для белка, представляющего интерес в синаптической области, определенной с помощью окрашивания AChR.
- Выберите область от видимого окрашивания концевой пластинки затем выберите: Анализ> Измерение измерить среднюю интенсивность фоновой флуоресценции. Повторите эту процедуру для другой флуоресценции канала / с и скопировать фоновые значения в таблицу значений флуоресценции.
- Subурочищу средних фоновых значений из значений шайбами, чтобы получить исправленные интенсивности для AChR и интерес белок при каждом концевой пластинки.
- Разделить скорректированные значения яркости концевой шайбы для интересующего белка от исправленной интенсивности флуоресценции БГТ с получением соотношения интенсивности флуоресценции 14,21
7. Сравнение плотности постсинаптической мембраны AChR Использование FRET
ПРИМЕЧАНИЕ: Этот протокол оценивает, в какой степени АХР, плотно упакованными (<10 нм пробелами) в постсинаптической мембране. Точный донорных и акцепторных флуорофор комбинации имеет решающее значение для этой FRET анализа. Имена и детали флуорофоров приведены в таблице материалов. Их спектральные свойства по отношению к ладу обсуждаются в наших предыдущих работах 14,15.
- Подготовка фиксированные поперечные криосрезы, как описано в разделе 6.1. Все группы образцов должны быть обработаны вместе и изображенияд в том же конфокальной сессии.
- Тщательно перемешайте 2,5 г / мл красного-BGT (FRET донора) с 10 мкг / мл до красно-BGT (FRET акцептором) с блокировкой решение в небольшой пластиковой трубки с помощью пипетки вверх и вниз 12 раз. Это 1: 4 молярная смесь максимизирует эффективность FRET 14.
- Поместите каждый слайд в увлажненной камере, тщательно покрыть каждую секцию с каплей (12 мкл) полученной выше смеси и инкубировать в течение 1,5 ч при комнатной температуре.
- Контрольных участках: Обложка небольшое число секций с 2,5 г / мл красно-BGT (единственным донором; меченые управления C1), а также некоторые разделы с 10 мкг / мл далеко красно-BGT (только акцептора; меченые управляет С2). Выдержите эти элементы управления, как на этапе 7.3.
- Вымойте слайды 3 х 10 мин в PBS и смонтировать в основе глицерина, нарастающий сопротивление монтажа среды (см шаг 3,12).
- Выполните выборку концевых пластин, как в шаге 6.7. Флуоресценции от донора и акцептора должны быть полностью со-локализованы на концевых пластин из-за случайного связывания молекул флуоресцентного-BGT,
- Контрольные изображения: Использование цели 40X и низкой мощности лазерного излучения оптимизировать прибыль redBGT и смещение настройки уровня для торцевых пластин от управляющего слайд-C1. Оптимизация далеко redBGT усиления и смещения уровней для торцевых пластин из управления слайд-С2. Подтвердите отсутствие каких-либо флуоресценции проступание.
- Не изменяя мощность лазера, получить или настройки смещения уровня перейти на экспериментальных слайдов и собрать снимков (предварительно photobleach) для обоих флуоресценции каналов.
- Избирательно photobleach в пор-красно-BGT над частью одной концевой шайбы за счет увеличения области сканирования, то сканирование в 10 раз с помощью лазера на 633 нм при 100% мощности. Флуоресценции в области сканирования должна стать тусклым.
- Сброс мощности лазера и увеличить и собирать после отбеливателя изображения на обеих люминесцентных каналов с помощью конфокальной настройки, установленные на 7,7.
- Рассчитать эффективность FRET (E) от процентное увеличение донора (красно-BGT) флуоресценции после photobleach акцептора (FAR-красно-BGT) в соответствии со следующей формулой *:
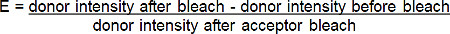
* Для всех ситуаций, в которых флуоресценция донора возрастает после фотообесцвечивания акцептора.
Access restricted. Please log in or start a trial to view this content.
Результаты
Измерение Synaptic Района сразу после NMJ
Любое оценка области опирается на чертеже границы, чтобы определить степень синаптических специализаций. У здоровых молодых взрослых мышц НМС изображения должны отображаться четко определенные границы как для AChR и синапто...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Протоколы, описанные здесь, позволили нам надежно измерять и количественной оценки изменений в свойствах НМС по целому ряду условий, в том числе нормального старения и болезненных состояний. Методы, описанные в фас НМС изображения позволит исследователям сравнить площадь до и постсин...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare they have no competing financial interests.
Благодарности
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Ссылки
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663(2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640(2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970(2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412(2010).
- Shimizu, S. Routes of Administration. The Laboratory Mouse. Hedrich, H. J., Bullock, G. , Elsevier. (2004).
- Chiasson, R. B. Laboratory anatomy of the white rat. , Brown. Dubuque, Iowa. (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564(2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840(2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены