È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La giunzione neuromuscolare: Synapse Misurazione circonferenza, la frammentazione e Variazioni Synaptic Proteine Densità Uso confocale microscopia a fluorescenza
In questo articolo
Riepilogo
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Abstract
La giunzione neuromuscolare (NMJ) è il grande, sinapsi relè colinergici attraverso cui i neuroni motori mammiferi controllano la contrazione muscolare volontaria. I cambiamenti strutturali del NMJ possono causare insufficienza neurotrasmissione, con conseguente debolezza, atrofia e persino la morte della fibra muscolare. Molti studi hanno indagato come modificazioni genetiche o malattie possono alterare la struttura del NMJ mouse. Purtroppo, può essere difficile confrontare direttamente i risultati di questi studi, perché spesso utilizzati diversi parametri e metodi analitici. Tre protocolli sono descritte qui. Il primo utilizza massima intensità di proiezione immagini confocale per misurare l'area di acetilcolina recettore (AChR) ricchi di domini di membrana postsinaptici alla placca e la zona della vescicola sinaptica colorazione nella terminazione nervosa presinaptica sovrastante. Il secondo protocollo confronta le intensità relative di immunocolorazione per proteine sinaptiche nella membrana postsinaptica. Il terzo protocol utilizza Fluorescence Resonance Energy Transfer (FRET) per rilevare i cambiamenti nel confezionamento di AChRs postsinaptici alla placca. Sono stati sviluppati e raffinato in una serie di studi I protocolli. I fattori che influenzano la qualità e la coerenza dei risultati vengono discussi e dati normativi sono previste NMJs in soggetti sani giovani topi adulti.
Introduzione
La giunzione neuromuscolare (NMJ) è la sinapsi relè critico che media la comunicazione tra il sistema nervoso e muscolo scheletrico. E 'richiesto per tutti i movimenti volontari. La microscopia a fluorescenza è stato a lungo utilizzato per studiare gli effetti della transgeni del mouse NMJ 1-3 o per confrontare gli effetti di età, la dieta, esercizio fisico e le malattie sul NMJs roditori 4-11. Tali studi hanno insegnato molto sulla fisiologia e fisiopatologia della NMJ, ma i diversi parametri segnalati (ad esempio, zona AChR, zona endplate, la lunghezza del perimetro, indici di frammentazione) spesso rendono difficile il confronto dei risultati di questi studi. C'è un'aspettativa crescente per i ricercatori pre-clinici per essere in grado di dimostrare la riproducibilità, in particolare in studi con modelli di roditori di malattia 12. I protocolli descritti qui sono state affinate attraverso una serie di studi che ha indagato sviluppo, fisiologico e fisiopatologico changes al NMJ. Tali studi richiedono misurazione della zona di specializzazioni sinaptiche alla placca motore mouse e la densità relativa di imballaggio, di proteine sinaptiche all'interno specializzazioni postsinaptici 13-15.
L'utilità di questi metodi è illustrato da studi recenti in un modello murino di anti-MuSK miastenia gravis. Iniezioni giornaliere di IgG da miastenia anti-MuSK-positivi gravis pazienti in topi adulti hanno causato loro di diventare deboli entro 2 settimane 16. Confocale immagini di massima proiezione di sezioni muscolari che sono stati doppio etichettati per sinaptofisina (in nervosi terminali) e post-sinaptici AChRs rivelato un progressivo declino nella zona del recettore colorazione come il cambiamento primario. È importante sottolineare che il tasso di declino è stato sufficiente a spiegare calo comparabili in ampiezza dei potenziali sinaptici, il fallimento della trasmissione sinaptica e debolezza muscolare 17,18. Qualitativamente Risultati simili sono stati riportati da altri gruppi di ricerca10,19. Gli stessi metodi di misurazione NMJ allora sono stati utilizzati per valutare l'impatto di tre farmaci per il trattamento anti-MuSK miastenia grave in questo modello di topo 20,21.
Invecchiamento sedentario può portare alla perdita di connessioni neuromuscolari. I protocolli descritti hanno rivelato un declino associato all'età in materia di terminazione nervosa synaptophysin a placche motrici come topi progrediscono in età avanzata. Gli stessi metodi hanno rivelato che l'esercizio fisico volontario potrebbe in gran parte prevenire la riduzione della zona terminale nervoso presinaptico 22, in linea con il lavoro precedente di altri gruppi 4. La perdita delle connessioni neuromuscolari si verifica anche nel modello murino SOD1G93A di sclerosi laterale amiotrofica 9,23.
Gli studi di cui sopra dimostrano che una varietà di condizioni di salute può portare a riduzioni in materia di specializzazioni sia pre o post-sinaptici al NMJ. Ciò può comportare divertimento sinaptica alterataction o può preannunciare la perdita completa della connessione neuromuscolare. Tre protocolli sono descritte che permettono quantificazione della superficie e la densità di specializzazioni sinaptici. Lo scopo del primo protocollo è quello di fornire una misura pratica e riproducibile delle aree di pre e post-sinaptici specializzazioni e il loro allineamento a NMJs di mammifero, utilizzando microscopia a fluorescenza. Bidimensionali immagini massimi proiezione confocale e analisi di immagine con NIH ImageJ è utilizzato per rilevare i cambiamenti nel settore della sinaptofisina colorazione (vescicole sinaptiche), AChRs post-sinaptici e area di sovrapposizione sinaptica. Parametri confocale (gain e offset di livello) sono ottimizzati per ogni NMJ in modo da massimizzare le informazioni visive utilizzate per discernere l'area di specializzazione sinaptica. Insufficienza neuromuscolare può anche derivare da variazioni di densità del recettore postsynaptic e / o di altre proteine sinaptiche. Il secondo protocollo può essere applicata per rilevare variazioni nella densità relativa di proteine postsinaptici talicome muschio, rapsyn, distroglicano, fosforilata Src chinasi e fosforilata AChR 18,21.
In miastenia grave, una densità ridotta del recettore nella membrana post-sinaptica è la causa immediata del fallimento sinaptica e debolezza muscolare. Il terzo protocollo descrive un metodo Fluorescence Resonance Energy Transfer (FRET) per valutare i cambiamenti in prossimità di AChRs adiacenti all'interno delle membrane postsinaptiche 14,15. Questo metodo rileva il trasferimento di energia tra AChRs vicini etichettati con fluorescenti-α-bungarotossina (BGT). FRET avviene solo quando le sonde donatore e accettore fluorescenti sono meno di 10 nm a parte. Questo può rivelare (submicroscopiche) delle modifiche, la tenuta di AChR imballaggio che possono riguardare direttamente l'ampiezza dei potenziali sinaptici.
Questi tre protocolli, raffinati negli ultimi dieci anni, prevedono misure complementari di integrità NMJ in modo coerente e riproducibile. L'utilizzo di protocolli standardizzati unParametri nd dovrebbero facilitare il confronto degli effetti di geni e interventi ambientali su mammifero NMJ.
Protocollo
NOTA: Progettazione, gestione e rendicontazione di esperimenti sugli animali dovrebbero tenere conto degli orientamenti attuali 24. Tale lavoro deve essere preventivamente approvato dalle autorità locali il benessere degli animali (nel nostro caso il comitato della University of Sydney Etica Animale).
1. L'eutanasia dell'animale e Muscle Dissection
- Trasferire il mouse dalla camera di conservazione ad una camera separata dove è eutanasia con una iniezione intraperitoneale di soluzione pentobarbitone (30 mg / kg) utilizzando il metodo di movimentazione del mouse dettagliato da Shimizu 25. Posizionare il mouse di nuovo nella sua gabbia.
- Una volta che il respiro del mouse è fermato per più di 1 min, testare il riflesso piede-ritiro pizzicando delicatamente il piede, e il riflesso corneale mediante spazzolatura leggermente la cornea. Solo quando risposte riflesse sono assenti il mouse può essere preparata per la dissezione.
- Consultare un atlante di anatomia roditore quali Chiasson 26 e / o chiedere l'aiuto di un espeanatomista ced prima di tentare dissezione del muscolo di interesse. In ciascun caso rimuovere i peli dalla pelle sovrastante usando un piccolo rasoio elettrico prima di aprire la pelle per esporre il muscolo.
NOTA: La dissezione sarà diverso per ogni muscolo-anatomicamente distinti. - Utilizzando pinze smussato liberare il muscolo dalla sovrastante membrane e dei tessuti circostanti. Afferrare e tagliare il tendine distale per separare il muscolo dalla sua inserzione.
- Stuzzicare delicatamente e tagliare il muscolo privo di tessuto circostante destra torna alla sua origine. Brevemente posizionare il muscolo appena sezionato in soluzione 0,1 M tampone fosfato salino (PBS) o soluzione di Ringer prima dell'ulteriore lavorazione.
2. Preparare il muscolo per criosezionamento
NOTA: conservazione strutturale ottimale può essere ottenuto mediante perfusione intero animale come precedentemente descritto 27, o immersione fissaggio (per piccoli muscoli) come descritto al punto 2.1 opzionale. Tuttavia,4% di fissazione paraformaldeide può compromettere la successiva colorazione con molte sonde anticorpi e fluorescenti-BGT. Glutaraldeide particolare dovrebbe essere evitato. Se muscoli non sono da fissare devono essere immediatamente congelati a scatto (procedere 2.3).
- Fissaggio Opzionale immersion: Pin il muscolo di cera in una capsula di Petri a lungo a riposo. Coprire il muscolo con 2% w / v paraformaldeide (appena sciolto in PBS) per 2 ore a temperatura ambiente. Lavare con 3 cambi di PBS oltre 30 min (3 x 10 min) quindi sostituire il PBS con 30% w / v di saccarosio in PBS e incubare O / N a 4 ° C.
- Rendere stampi ('barche') in anticipo piegando due centimetri x 1,5 cm pezzi di fogli di alluminio come mostrato in figura 1. Posizionare un pezzo di membrana di nitrocellulosa sul fondo della barca. Versare delicatamente criostato incorporamento matrice (tabella materiali) in barca ad una profondità di 2 mm, avendo cura di evitare bolle d'aria. Posizionare il muscolo nella barca, allineandola con la penna linee sfera sula nitrocellulosa. Aggiungere più matrice incorporamento in modo da coprire completamente i muscoli (Figura 1).
- Tubi in polipropilene pre-label con un pennarello indelebile. Inserire una goccia d'acqua in ciascuna provetta e raffreddare il tubo in azoto liquido.
NOTA: La goccia d'acqua congelata mantiene la tensione di vapore ed evita essiccazione durante prolungata -80 ° C di stoccaggio - Utilizzando una visiera, guanti protettivi spessi e un grande paio di pinze smussato, parzialmente abbassare un piccolo bicchiere di metallo (3 cm di diametro, a 8 cm di profondità) contenente 2 cm Profondità di isopentano in un contenitore di azoto liquido per 30 sec. Togliere il bicchiere e posizionarlo sul banco. Utilizzando un paio di pinze piccolo smussato posizionare lo stampo contenente il muscolo e l'incorporamento di matrice in isopentano raffreddato. Fare attenzione ad evitare la miscelazione azoto liquido con l'isopentano.
- Lasciare 2 min per il blocco di congelare completamente prima di usare pinze smussato per sollevare il blocco congelato fuori e sigillarlo nel pr correttoe-etichettati e tubi pre-raffreddata (passo 2,3).
- Conservare le provette temporaneamente nella azoto liquido prima del trasferimento a -80 ° C. Entra tutti i campioni in un foglio di calcolo di contenuti freezer.
3. criosezionamento e fluorescenza colorazione per en face Immagini di NMJs
- Sbucciare via lo stampo in alluminio. All'interno della camera di -20 ° C criostato fissare il blocco congelato al mandrino criostato in modo da tagliare 20 micron criosezioni parallele all'asse lungo delle fibre muscolari (Figura 1). Raccogliete le sezioni su poli-L-lisina o gelatina rivestito vetrini da microscopio.
- NOTA: Omettere questo passo se il tessuto è fissato prima del congelamento. Dopo 30 min per permettere sezioni asciugare sui vetrini, fissarli mettendo una goccia del 2% paraformaldeide in PBS su ciascuna sezione per 15 minuti a RT.
- Lavare i vetrini 3 x 10 min in PBS in una vaschetta Coplin, e poi immergere i vetrini in PBS contenente 0,1 M glicina per 30 minuti per bloccare gruppi aldeide residui.
- Lavare i vetrini per 10 minuti in PBS, poi immergere in metanolo (raffreddata a -20 ° C) per 7 min. Questo passaggio permeabilizzazione è una parte di routine della doppia marcatura con fluorescenti-BGT e anti-sinaptofisina ma può influenzare negativamente immunocolorazione per alcune altre proteine.
- Lavare i vetrini 2 x 10 min in PBS poi posto ogni diapositiva in una camera umidificata stabile e livellato. Coprire immediatamente ogni sezione con 20 ml di soluzione di blocco (0,2% Triton X-100, 2% di siero albumina bovina (BSA) in PBS) per 1 ora a RT. Le sezioni non devono essere lasciati ad asciugare in qualsiasi fase del processo di immunocolorazione.
- Effettuare l'incubazione primaria: Prendere un vetrino alla volta rimuovere con attenzione la soluzione di saturazione in eccesso su ogni sezione e sostituirlo con 20 ml di coniglio anti-sinaptofisina (diluito 1: 200 nella soluzione di blocco).
- Includere un vetrino negativo di controllo che saranno incubate con blocco unica soluzione. Questo 'no-primario controllo dell'anticorpo'È fondamentale in ogni corsa immunocolorazione.
- Facendo attenzione che l'anticorpo primario rimane in vigore su ogni sezione, chiudere la camera umidificata e incubare per 1-2 giorni a 4 ° C.
- Ispezionare ogni sezione per confermare che l'anticorpo primario rimane al suo posto. Utilizzare una pipetta Pasteur per lavare delicatamente ogni diapositiva con PBS e metterlo in una vaschetta Coplin. Lavare tutte le diapositive 3 x 10 min in PBS.
- Effettuare incubazione secondaria. Prendere un vetrino alla volta, rimuovere con attenzione l'eccesso di PBS, si trovava nella camera umidificata e coprire ogni sezione con 20 ml di una miscela contenente IgG FITC-coniugato asino anti-coniglio e BGT coniugato tetrametil rodamina o un'altra fluoroforo rosso (TRITC- / redBGT; 5 g / ml) diluito in soluzione bloccante. Incubare a temperatura ambiente per 2 ore.
- Lavare i vetrini 3 x 10 min in PBS in vaschette Coplin.
- Prendere un vetrino alla volta, rimuovere con attenzione l'eccesso di PBS e montare con un coprioggetto utilizzando un volume minimo di, glycerobasata l-, fade-resistente mezzo di montaggio. Sigillare i bordi dei vetrini con vernice trasparente per unghie. Lasciare asciugare duro.
- Conservare i vetrini al buio a 4 ° C per un massimo di una settimana, oppure a -20 ° C per periodi di conservazione più lunghi (fino a diversi mesi).
4. imparziale Campionamento e En Face Imaging di Motor placche
- Accecare le diapositive etichettando ogni diapositiva con un numero di codice casuale che resta noto solo a un secondo ricercatore (non coinvolta nell'analisi). Come risultato l'operatore rimane ciechi ai gruppi di trattamento fino quantificazione dei parametri NMJ è completa per tutti i campioni.
- Posizionare il vetrino sul palco microscopio e vederlo sotto illuminazione campo largo con il set di filtri TRITC (63X olio 1,3 obiettivo NA). Spostare progressivamente (campo per campo) da sinistra a destra e viceversa fino a quando un endplate appare nel campo (Figura 2A).
Criterio di campionamento:: NOTA Ogni struttura AChR macchiato che è relativamentepiatta e si trova di fronte l'obiettivo (ad esempio, si estende <15 m nel z-dimensione) è considerato un piatto vertebrale ed è ripreso per l'analisi (mezzelune di AChR colorazione rappresentano sezioni tramite piastre laterali e sono quindi esclusi). - Con il set pinhole confocale a 1,0 unità di Airy e potenza laser a bassa ottimizzare il guadagno e offset livelli per TRITC / rosso-BGT (laser 532 nm) al endplate che deve essere ripreso. Avanti ottimizzare FITC / fluorescenza synaptophysin utilizzando il laser 488 nm. Raccogliere un z-stack della placca con un intervallo di 0,7 micron tra ogni fetta ottica. Salvare le immagini con un nome di file che include la data della sessione di imaging, il nome in codice della diapositiva e il numero della placca.
NOTA: Le scansioni utilizzando il 488 nm e 532 nm laser (FITC e TRITC) devono essere raccolti in sequenza (non contemporaneamente) per evitare la contaminazione del canale FITC con la fluorescenza del fluoroforo rosso e viceversa (sanguinare-through). - Ripetere il campionamento di unnd imaging passi 4,2-4,3 fino al 20 piastre laterali sono raccolti dalla diapositiva / campione.
- Passare alla diapositiva successiva codificato e ripetere 4,2-4,4. Ripetere per ciascuno dei vetrini codificati.
- Raccogliere alcune immagini di placche dal vetrino di controllo (no-primario di controllo degli anticorpi) utilizzando le impostazioni confocale che sono stati trovati ottimale per le diapositive sperimentali (il canale di fluorescenza FITC dovrebbe apparire scuro).
- Alla fine della sessione confocale trasferimento i file di immagine in un altro computer e il backup dei file originali su un drive esterno o un server.
5. Misurare l'area di Synaptic Specializzazioni in en face Immagini
- Utilizzare NIH ImageJ freeware (http://imagej.nih.gov/ij/) per preparare la massima proiezione (MIP) immagini da ogni z-stack. Salvarli come file tiff (Figura 2A & B). I nomi dei file dovrebbero includere la data della sessione immagine, codice di esempio, il numero e il canale endplate fluorescenti (ad esempio, 060414_5723_7_FITC.tiff).
- Aprite l'immagine z-proiezioni in ImageJ. Selezionare il canale dell'immagine recettore dell'acetilcolina (figura 3A) e selezionare: Immagine> Tipo> 8-bit per convertire l'immagine di colore RGB a 24 bit in tre immagini in scala di grigi a 8 bit sullo schermo.
- Utilizzando lo strumento poligono ImageJ disegnare un abbozzo intorno alla placca di interesse per il redBGT macchiato (ACHR) del canale in modo da includere tutte le regioni colorate apparenti particolare placca individuo, ignorando qualsiasi colorazione che non provengono dalla placca di interesse ( Figura 3C).
- Applicare una soglia minima di intensità all'immagine selezionando: Immagine> Regola> Soglia (Figura 3E e screenshots ImageJ associati).
- Regolare il livello di soglia in modo da isolare le parti AChR-macchiati escludendo circostante segnale di fondo come sub-soglia (Figura 3E). Aprire un secondo ventoow l'immagine originale (tono continuo) con immediatamente accanto alla finestra per il confronto, per facilitare la decisione circa il valore di soglia. Registrare il valore di soglia per un uso successivo in colocalization analisi.
- Mantenendo il contorno del poligono intorno alla placca selezionare: Analizza> Analizzare particelle. Nel menu a comparsa specificare l'intervallo di formati come: 50 a Infinity pixel (questo elimina piccoli manufatti derivanti da disturbi elettrici nel fotomoltiplicatore).
- Analizza il comando particelle genera una finestra con un elenco di aree sovra-soglia discreti e loro valori di intensità di fluorescenza numerata come appaiono nell'immagine binaria (Figura 3G e associato ImageJ screenshot). Copiare questi dati in un foglio di calcolo con etichetta.
- Misurare l'area placca totale (area all'interno del poligono) selezionando: Analizza> Misura. Questo produce la superficie totale placca. Copiare e incollare i dati per aree AChR e intensità inun foglio di calcolo facendo attenzione a etichettare le colonne in modo appropriato, sarà utilizzato per le righe placche individuali per diapositive specifiche.
- Passare al canale di fluorescenza anti-sinaptofisina e ripetere i passaggi 5,1-5,5, ma per il canale FITC (Figura 3B, D e F). L'obiettivo è quello di regolare la soglia in modo che crea un'immagine binaria che, il più possibile, corrisponde ai confini di colorazione come percepito dall'occhio. Registrare il valore di soglia.
- Misurare l'area di sovrapposizione, applicando le seguenti operazioni: Aprire il file originale contenente le due immagini del canale e dividerlo in due immagini separate selezionando: Immagine> Stack> Stack di immagini.
- Utilizzando il plugin Colocalizzazione (scaricato e installato dal sito ImageJ) Seleziona: Pluggin> Colocalizzazione e immettere i valori di soglia precedentemente registrati per i canali AChR e nervosi nel rispettivo canale di query bbue. Ciò produrrà un'immagine sovrapposizione in pixel bianchi (figura 3H e screenshot ImageJ associati).
- Convertire dell'immagine sovrapposizione appena creata in un formato scala di grigi e applicare una soglia al valore massimo. La soglia massima selezionerà solo i pixel bianchi, corrispondente alla zona di sovrapposizione dei due canali precedenti. Record nel foglio il valore dell'area risultante 'colocalizzazione', che rappresenta l'area di sovrapposizione in pixel.
- Preparare un foglio di calcolo di medie campionarie di dati, calcolare e tracciare le deviazioni standard e gli errori standard come istogrammi o grafici a dispersione 20,22. Si noti che il valore di n rappresenta generalmente il numero di topi per gruppo campione a fini statistici.
- Endplate Plot aree AChR come grafici a dispersione o istogrammi di frequenza per determinare se i dati sono distribuiti normalmente prima del test statistico (Figura 6).
6. colorazione relativaLe intensità rispetto Utilizzando sezioni ottiche trasversali
NOTA: Per questo processo protocollo tutti i campioni muscolari insieme e immagine in una singola sessione confocale. Nel pianificare un esperimento di consentire fino a tempo di imaging 30 min per campione muscolare.
- Tagliare 15 micron criosezioni trasversale all'asse lungo delle fibre muscolari e raccogliere su vetrini come descritto al punto 3.1.
- Effettuare la colorazione in fluorescenza come descritto nei passaggi 3,2-3,13.
- Codice del vetrini colorati in modo che l'imaging e le analisi vengono realizzati con l'operatore cieca gruppo di trattamento, come descritto al punto 4.1.
- Utilizzando un obiettivo di fluorescenza 40X (NA 0.75) brevemente rilevare una sezione ogni diapositiva per determinare un unico guadagno e offset impostazione del livello per il recettore che sarà adatto per tutte le placche terminali attraverso tutte le diapositive di esempio. La placca luminosa dovrebbe poi essere appena sotto 256 grigi sulla scala. Questa ottimizzazione dovrebbe essere fatto separatamente per il secondo fluorescence canale (raccolte successivamente). Registrare il guadagno fisso e offset impostazioni di livello e non li altera in tutta la sessione di imaging.
- Raccogliere immagini di un vetrino standard di fluorescenza (ad esempio, perline fluorescenti non sbiancanti), utilizzando gli stessi parametri, all'inizio e alla fine della sessione confocale per rilevare eventuali fluttuazioni di intensità laser.
- Utilizzare il canale AChR per eseguire la scansione della diapositiva progressivamente per individuare placche.
- Focus di trovare il piano di sezione ottica singolo in ogni campo del microscopio che contiene il maggior numero di piastre laterali AChR-macchiati.
- Scansione questa singola sezione ottica due volte e salvare l'immagine in media (Figura 4G).
- Mantenendo lo stesso interruttore piano focale al secondo canale di fluorescenza (proteina di interesse) e raccogliere l'immagine come al punto 6.8. Salvare il file di immagine, anche nel nome del file: data della sessione di imaging, codice di esempio, il numero di immagini e un simbolo per indicare il canale di fluorescenza. Figura 4A - F mostra esempi della distribuzione placca di AChR rispetto al rapsyn, muschio o -dystroglycan (-DG).
- Spostare il palco per il campo successivo che contiene uno o più piastre laterali e ripetere il punto 6,8-6,9. Ripetere questo fino a un totale di 60 endplates vengono esposte.
- Alla fine del trasferimento sessione di imaging di tutti i file in un altro computer ed eseguirne il backup.
- Aprire ogni file immagine originale e durante la visualizzazione del canale AChR, selezionare: Immagine> Stack> Stack di immagini, di dividere i canali.
- Seleziona: Immagine> Tipo> 8bit da convertire in formato in scala di grigi a 8 bit sullo schermo. Fate questo per entrambi i canali di fluorescenza.
- Seleziona: Immagine> Stacks> Immagini per impilare. Aprire una nuova pila da due immagini precedentemente separate 8 bit. Si può quindi passare tra i due canali di fluorescenza all'interno della finestra singola convenientemente.
- Utilizzare lo strumento Poligono per disegnare un line stretto attorno al perimetro della colorazione AChR (figura 4I).
- Seleziona: Analizza> Misura per misurare l'intensità media dei pixel per AChR all'interno della zona delimitata (notare l'importanza di tracciare la linea ermeticamente). Copiare questo valore in un foglio di calcolo con etichetta.
- Mantenendo lo stesso profilo poligonale (per definire l'area da misurare), passare al secondo canale fluorescenti (ad esempio, la Figura 4B, D, F) e selezionare: Analizza> misura. Ciò produrrà l'intensità media di colorazione per la proteina di interesse nella zona sinaptica definita da AChR colorazione.
- Scegli una zona fuori dal visibile endplate colorazione quindi selezionare: Analizza> Misura per misurare l'intensità media fluorescenza di fondo. Ripetere l'operazione per l'altro canale di fluorescenza / s e copiare i valori di fondo nel foglio di calcolo dei valori di fluorescenza.
- Subtratto i valori medi di fondo dai valori endplate per ottenere le intensità corrette per AChR e la proteina di interesse ad ogni endplate.
- Dividere i valori di intensità endplate corretti per la proteina di interesse per l'intensità di fluorescenza BGT corretta per dare i rapporti di intensità di fluorescenza 14,21
7. Confrontando densità postsinaptica membrana AChR Uso FRET
NOTA: Questo protocollo valuta la misura in cui AChRs sono strettamente imballati (<10 nm spaziatura) nella membrana postsinaptica. La combinazione donatore e accettore fluoroforo preciso è fondamentale per questo test FRET. Nomi e dettagli dei fluorofori sono riportati nella tabella dei materiali. Le loro proprietà spettrali, in relazione FRET, sono discussi nelle nostre precedenti documenti 14,15.
- Preparare criosezioni trasversali fissi come descritto nella sezione 6.1. Tutti i gruppi di campioni devono essere trattati insieme e l'immagined nella stessa sessione confocale.
- Mescolare accuratamente 2,5 g / ml rosso-BGT (FRET donatore) con 10 g / ml lontano rosso-BGT (FRET accettatore) con soluzione bloccante in un piccolo tubo di plastica pipettando su e giù per 12 volte. Questa miscela 1: 4 molare massimizza l'efficienza della FRET 14.
- Mettere ciascun vetrino in una camera umidificata, coprire accuratamente ogni sezione con una goccia (12 ml) della miscela sopra e incubare per 1,5 ore a temperatura ambiente.
- Sezioni di controllo: riguardano un numero limitato di sezioni con 2,5 g / ml rosso-BGT (unico donatore; controlli C1 etichettati), e anche alcune sezioni con 10 g / ml far-red-BGT (solo accettore; controlli C2 etichettati). Incubare questi controlli come al punto 7.3.
- Lavare i vetrini 3 x 10 min in PBS e montare in base glicerolo-, fade-resistente mezzo di montaggio (vedi punto 3.12).
- Eseguire il campionamento delle placche come al punto 6.7. Fluorescenza dal donatore e accettore deve essere perfettamente co-localizzato a piastre laterali a causa del caso di legame delle molecole fluorescenti-BGT.
- Immagini di controllo: Utilizzare l'obiettivo 40X e bassa laser di potenza ottimizzare il guadagno e offset redBGT impostazioni del livello di placche da un C1 cursore. Ottimizzare guadagno lontano redBGT e offset livelli di placche di comando di scorrimento C2. Conferma assenza di fluorescenza a spurgo attraverso.
- Senza cambiare la potenza del laser, guadagnano o impostazioni a livello di compensazione si spostano le diapositive sperimentali e raccogliere immagini (pre-photobleach) per entrambi i canali di fluorescenza.
- Photobleach selettivamente lontano-rosso-BGT su una porzione di un singolo endplate ingrandendo l'area di scansione poi 10 volte la scansione con il laser 633 nm a 100% di potenza. La fluorescenza nell'area scansionata dovrebbe diventare dim.
- Ripristina la potenza del laser e lo zoom e raccogliere le immagini post-candeggina su entrambi i canali fluorescenti utilizzando le impostazioni confocale stabiliti a 7,7.
- Calcolare l'efficienza FRET (E) dal l'aumento percentuale dei donatori (rosso-BGT) di fluorescenza a seguito photobleach del accettore (far-red-BGT) secondo la seguente formula *:
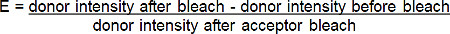
* Per tutte le situazioni in cui la fluorescenza del donatore aumenta dopo photobleaching accettore.
Risultati
Misura di Synaptic Area al NMJ
Qualsiasi stima della zona si basa sul disegno di un contorno per definire l'estensione di specializzazioni sinaptici. Nei giovani adulti sani muscoli immagini NMJ dovrebbero visualizzare i confini ben definiti sia per AChR e synaptophysin colorazione (Figura 2A e B). Intensità di fluorescenza sia per AChR e synaptophysin aumenta sensibilmente al confine tra la porzione peri-sinaptica e sinaptica del endpl...
Discussione
I protocolli descritti qui ci hanno permesso di misurare in modo affidabile e quantificare i cambiamenti nelle proprietà del NMJ tutta una serie di condizioni, tra cui l'invecchiamento e le malattie normali stati. I metodi descritti per en face immagini NMJ consentiranno ai ricercatori di confrontare l'area di specializzazioni pre- e post-sinaptici e la zona di sinaptica sovrapposizione / allineamento. Per confrontare l'intensità relativa di proteine pre- e post-sinaptici il secondo protocollo, che u...
Divulgazioni
The authors declare they have no competing financial interests.
Riconoscimenti
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Materiali
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Riferimenti
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon