Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nöromusküler Kavşak: Ölçme Synapse Boyut, Konfokal Floresan Mikroskobu kullanılarak sinaptik Protein Yoğunluk Parçalanma ve Değişiklikler
Bu Makalede
Özet
The neuromuscular junction (NMJ) is altered in a variety of conditions that can sometimes culminate in synaptic failure. This report describes fluorescence microscope-based methods to quantify such structural changes.
Özet
nöromüsküler bileşke (NMJ) memeli motor nöronların istemli kas kasılması kontrol hangi aracılığıyla, büyük, kolinerjik röle sinaps olduğunu. NMJ yapısal değişiklikler zayıflık, atrofi ve kas lifi hatta ölümle sonuçlanan, nörotransmısyonunun başarısızlıkla sonuçlanabilir. Birçok çalışma, genetik modifikasyon veya hastalık fare NMJ yapısını değiştirebilir nasıl araştırdık. Ne yazık ki, doğrudan genellikle farklı parametreler ve analitik yöntemler istihdam nedeniyle bu çalışmalardan elde edilen bulguları karşılaştırmak zor olabilir. Üç protokolleri burada açıklanmıştır. İlk asetilkolin reseptörü (AChR) alanını ölçmek için maksimum intensite projeksiyon konfokal görüntüleri kullanır son plak ve örten presinaptik sinir terminal sinaptik vezikül boyama alanında bakımından zengin postsinaptik membran alanları. İkinci protokol postsinaptik membranın sinaptik proteinlerin immün için göreli yoğunluklarını karşılaştırır. Üçüncü protocol son plak de postsinaptik AChRs ambalaj değişiklikleri tespit etmek için Floresan Rezonans Enerji Transferi (FRET) kullanır. protokolleri geliştirildi ve çalışmaların bir dizi üzerinde rafine edilmiş. Kalite ve sonuç tutarlılığı etkileyen faktörler tartışılmıştır ve sayısal veriler, sağlıklı, genç, yetişkin farelerde NMJs verilmektedir.
Giriş
nöromüsküler bileşke (NMJ) sinir sistemi ve iskelet kası arasındaki iletişimi aracılık kritik röle sinaps olduğunu. Her gönüllü hareket için gereklidir. Floresan mikroskobu uzun NMJ 1-3 fare transgenlerin etkilerini incelemek veya kemirgen NMJs 4-11 yaş üzerine, diyet, egzersiz ve hastalığın etkilerini karşılaştırmak için kullanılır olmuştur. Bu tür çalışmalar NMJ fizyolojisi ve patofizyolojisi hakkında bize çok şey öğretti, ama farklı parametreler (örneğin, AChR alanı, plak alan, çevre uzunluğu, parçalanma endeksleri) sık sık zor bu çalışmaların bulgularını karşılaştırmak yapmak bildirildi. Klinik öncesi araştırmacılar, özellikle hastalığın 12 kemirgen modellerinde yapılan çalışmalarda, tekrarlanabilir göstermek edebilmek için giderek artan bir beklenti var. Burada anlatılan protokoller, gelişimsel, fizyolojik ve patofizyolojik ch araştırıldı çalışmaların bir dizi rafine edilmişNMJ için anges. Bu tür çalışmalar fare motor son plak sinaptik uzmanlık alanı ve postsinaptik uzmanlık 13-15 içinde sinaptik proteinlerin ambalaj nispi yoğunluk ölçümü gerektirir.
Bu yöntemlerin yarar miyasteni gravis, anti-misk bir fare modelinde, son çalışmalar açıklanmaktadır. Anti-MuSK-pozitif myastenia IgG Günlük enjeksiyonları erişkin farelere hastalar bunları 2 hafta içinde 16 zayıf hale gelmesine gravis. Kas (sinir-terminallerinde) sinaptofizin çift etiketli bölümler ve postsinaptik AChRs Konfokal maksimum projeksiyon görüntüleri birincil değişiklik olarak AChR boyama alanında ilerici bir düşüş gösterdi. Düşüş Önemli oranı sinaptik potansiyellerin, sinaptik iletim ve kas zayıflığı 17,18 başarısızlık amplitüdünde benzer düşüşler açıklamak için yeterliydi. Nitel benzer bulgular diğer araştırma grupları tarafından rapor edilmiştir10,19. Aynı NMJ ölçüm yöntemleri beri bu fare modeli 20,21 olarak gravis, anti-MuSK myastenia tedavisinde üç ilaç etkisini değerlendirmek için kullanılmaktadır.
Hareketsiz yaşlanma kas bağlantılarının kaybına yol açabilir. fareler yaşlılık içine ilerleme olarak burada açıklanan protokoller, motor endplate'lerin sinir terminali sinaptofizin alanında bir yaşa-bağlı düşüş ortaya koymuştur. Aynı yöntemler gönüllü egzersiz büyük ölçüde diğer gruplar 4 önceki çalışma ile uyumlu presinaptik sinir terminal alanında 22 azalma, önleyebilir ortaya koymuştur. Nöromüsküler bağlantı kaybı da amyotrofik lateral skleroz 9,23 arasında SOD1G93A fare modelinde ortaya çıkar.
Yukarıda belirtilen çalışmalar sağlık koşulları çeşitli NMJ öncesi ya da post-sinaptik uzmanlık ya alanında azalmalara neden olabileceğini göstermektedir. Bu bozulmuş sinaptik eğlenceli neden olabilirction nöromüsküler bağlantı tam kaybı habercisi olabilir ya. Üç protokolleri alan ve sinaptik uzmanlık yoğunluğunun nicelendirilmesine izin veren açıklanmaktadır. İlk protokolde amacı floresan mikroskopi kullanılarak, ön ve post-sinaptik uzmanlık ve memeli NMJs bunların uyum alanlarında pratik ve yeniden üretilebilir bir ölçü temin edilmesidir. İki-boyutlu maksimum projeksiyon konfokal görüntüleri ve NIH ImageJ ile görüntü analizi sinaptofizin boyama (sinaptik veziküller), postsinaptik AChRs ve sinaptik çakışma alanının alanında değişiklikleri tespit etmek için kullanılır. Sinaptik uzmanlık alanını ayırt kullanılan görsel bilgiyi maksimize edecek şekilde Konfokal görüntüleme parametreleri (kazanç ve ofset seviyesini) Her NMJ için optimize edilmiştir. Nöromüsküler yetmezliği de postsinaptik ACHR ve / veya diğer sinaptik proteinlerin yoğunluğu değişikliklere neden olabilir. İkinci protokol postsinaptik proteinler gibi göreli yoğunluk değişiklikleri tespit etmek için uygulanabilirmisk, rapsyn, distroglikan, fosforile Src kinaz ve fosforile ACHR 18,21 olarak.
Myastenia gravis olarak, postsinaptik membranın içinde ACHR azaltılmış yoğunluğu sinaptik yetmezliği ve kas güçsüzlüğü hemen nedenidir. Üçüncü protokolde ise postsinaptik membran 14,15 içindeki bitişik AChRs yakınında değişiklikleri değerlendirmek için bir flüoresan rezonans enerji transferi (FRET) yöntemi tarif etmektedir. Bu yöntem, floresan-α-bungarotoxin (bgt) ile etiketlenmiş çevre AChRs arasındaki enerji transferi tespit eder. Floresan, verici ve alıcı problar en az 10 nm ayrı olduğunda, FRET yalnızca oluşur. Bu doğrudan sinaptik potansiyellerin genlik ilgili olabilir AChR ambalaj gerginliği (mikroskopik) değişiklikleri ortaya çıkarabilir.
Geçtiğimiz on yıl içinde rafine Bu üç protokol de, tutarlı ve tekrarlanabilir bir şekilde NMJ bütünlüğü tamamlayıcı ölçümler ortaya koymaktadır. Standart protokoller a Kullanımınd parametreler memeli NMJ üzerine genler ve çevresel müdahalelerin etkileri karşılaştırılmasını kolaylaştırmalıdır.
Protokol
NOT: Hayvan deneylerinde tasarımı, yürütülmesi ve raporlanması güncel kılavuzlarda 24 dikkate almalıdır. Böyle bir çalışma (bizim durumumuzda Sydney Üniversitesi Hayvan Deneyleri Yerel Etik Kurulu olarak) yerel hayvan refahı otorite tarafından önceden onaylanmalıdır.
Hayvan ve kas diseksiyonu 1. Ötenazi
- Bu Shimizu 25 tarafından ayrıntılı fare kontrolü yöntemi kullanılarak pentobarbiton çözeltisinin intraperitonal enjeksiyonu (30mg / kg) ile ötenazi ayrı bir odaya tutma odasından fare aktarın. Onun kafese geri fare yerleştirin.
- Fare nefes fazla 1 dakika durduktan sonra, yavaşça hafifçe kornea fırçalayarak ayak ve kornea refleksi sıkıştırarak ayak çekme refleksi testi. Refleks tepkiler bulunmadığına Sadece fare diseksiyon için hazırlanabilir.
- Chiasson 26 olarak kemirgen anatomisi gibi bir atlas danışın ve / veya experien yardım isteyinilgi kas diseksiyonu başlamadan önce CED anatomist. Her durumda kas maruz cilt açmadan önce küçük bir elektrikli tıraş makinesi kullanarak örten deriden saç kaldırmak.
NOT: Diseksiyon her anatomik-ayrı kas için farklı olacaktır. - Künt forseps kullanarak zarları örten ve çevre dokulardan kas ücretsiz. Kavrayın ve ekleme gelen kas ayırmak için uzak tendon kesti.
- Yavaşça kızdırmak ve sağ arka aslına için çevreleyen dokudan serbest kas snip. Kısaca, daha sonraki işlemlerden önce, 0.1 M fosfat tamponlu tuz (PBS) çözeltisi ya da Ringer çözeltisi içine yeni kaslardan yerleştirin.
2. cryosectioning için Muscle hazırlanması
NOT: İsteğe bağlı aşama 2.1 'de tarif edildiği gibi, daha önce 27 ayrıntılı, ya da (küçük kaslar için) Daldırma tespitin en uygun yapısal koruma bütün hayvan perfüzyon ile elde edilebilir. Bununla birlikte,% 4 paraformaldehid tespit birçok antikor problar ve floresan-BGT ile sonraki boyama bozabilir. Glutaraldehit kaçınılmalıdır. Kaslar hemen donduruldu gereken sabit olması değilseniz (2.3 geçin).
- İsteğe bağlı daldırma sabitleme: Pim dinlenme uzunluğunda bir Petri kabındaki balmumu kas. 2%, oda sıcaklığında 2 saat boyunca (taze PBS) içinde çözülmüş / hac paraformaldehid w kas örtün. Daha sonra PBS içinde 30 ağırlık% / hac sakaroz ile PBS yerine ve 4 ° C 'de O / N inkübe 30 dakika ile (3 x 10 dakika) ile PBS içinde 3 kez değiştirilen ile yıkayın.
- . Şekil 1 'de gösterildiği gibi, alüminyum folyo, 2 cm x 1,5 cm parçalar katlama önceden kalıplar (' tekneler ') Marka teknenin altında, nitroselüloz zarın bir parça yerleştirin. Yavaşça hava kabarcıklarını önlemek için özen, 2 mm derinliğe kadar tekne içine kriyostat gömme matris (Malzeme tablosu) dökün. Üzerindeki tükenmez kalem hatları ile hizalayarak, tekne içine kas yerleştirinnitroselüloz. Tamamen kas (Şekil 1) kapsayacak şekilde daha gömme matrisi ekleyin.
- Silinmez bir işaret ile Ön-etiket polipropilen borular. Her bir tüp içinde bir damla su koyun ve sıvı azot içinde tüp soğuk.
NOT: Donmuş su damlası buharı basıncı korur ve uzun süreli -80 ° C depolama sırasında kuruma önler - Bir yüz kalkanı, kalın bir koruyucu eldiven ve küt forseps büyük çiftlerini kullanarak, kısmen 30 saniye için sıvı azot içeren bir kaba izopentan 2 cm derinliğinde ihtiva eden bir küçük metal beher (8 cm derinliğinde 3 cm çapında), alt. Beher çıkarın ve tezgah üstüne yerleştirin. Künt forseps daha küçük bir çift kullanarak kalıp kas içeren ve soğutulmuş izopentanın içine matris gömme yerleştirin. Izopentanın sıvı azot karışmasını önlemek için dikkat edin.
- Dışarı donmuş blok kaldırın ve doğru pr mühür künt forseps kullanmadan önce tamamen donmasına blok için 2 dakika bekleyinE-etiketli ve önceden soğutulmuş tüp (adım 2.3).
- -80 ° transfer edilmeden önce sıvı azot içinde geçici olarak tüpler saklayın. Dondurucu içeriğinin bir tablodaki tüm örnekleri yapın.
3. Cryosectioning ve Floresan Boyama NMJs En Face Images
- Alüminyum kalıp uzak soyun. 20 mikron cryosections kas liflerinin uzun ekseni (Şekil 1) paralel kesmek üzere -20 ° C kriyostat odasının içinde kriyostat chuck dondurulmuş blok takın. Poli-L-lizin veya jelatin kaplı mikroskop slaytlar üzerinde bölümleri Pick up.
- NOT: Doku dondurma önce sabit ise bu adımı atlayın. Bölümler slaytlar üzerinde kurumaya için 30 dakika beklendikten sonra, oda sıcaklığında 15 dakika için her bir bölümü üzerinde PBS içinde% 2 paraformaldehit bir damlasının yerleştirilmesiyle sabitleyin.
- Yıkama Coplin kavanoz PBS içinde 3 x 10 dakika slaytlar, 30 dakika, artık aldehid grupları bloke etmek için daha sonra 0.1 M glisin ihtiva eden PBS içinde slaytlar bırakın.
- 7 dakika boyunca (-20 ° C soğutulmuş), metanol sokmak, daha sonra, PBS içinde 10 dakika boyunca slaytlar yıkayın. Bu permeabilizasyon adım floresan-BGT ile çift etiketleme ve anti-sinaptofizin rutin bir parçası ama olumsuz bazı diğer proteinler için immün etkileyebilir.
- Yıkama daha sonra bir sabit ve tesviye nemli bir bölmede, her bir slayt yer PBS içinde 2 x 10 dakika boyunca kayar. Hemen bloke çözeltisinin 20 ul her bir bölümü kapsayan (% 0.2 Triton X-100,% 2 sığır serum albümini PBS (BSA)), oda sıcaklığında 1 saat karıştırıldı. Bölümler immun sürecinin herhangi bir aşamasında kurumasına izin verilmemelidir.
- Birincil inkübasyon gerçekleştirin: Bir defada bir slayt alarak dikkatle her bölüm üzerinde aşırı engelleme çözüm kaldırmak ve tavşan anti-sinaptofizin 20 ul ile değiştirin (: 200 engelleme çözümü 1 seyreltilmiş).
- Tek çözüm engelleme inkübe edilecek bir negatif kontrol slayt ekleyin. Bu 'hayır birincil antikor kontrolü'Her immün vadede esastır.
- Birincil antikor, her bir bölümü üzerinde yerinde kalır bakımı, nemlendirilmiş odasına yakın ve 4 ° C'de 1-2 gün süreyle inkübe edilir.
- Primer antikor yerinde kalmasını onaylamak için her bölüm inceleyin. PBS ile her slayt durulayın ve bir Coplin kavanoza yerleştirin Pasteur pipet kullanın. Tüm slaytları PBS içinde 3 x 10 dk yıkayınız.
- İkincil inkübasyon yürütmek. Her seferinde bir slayt alarak, dikkatli bir şekilde, fazla PBS kaldırmak nemlendirilmiş bir haznede lekelenmiştir dönük olarak ve FITC-konjügeli eşek anti-tavşan IgG ve bgt rodamin tetrametil konjüge ya da başka bir kırmızı florofor içeren bir karışımın 20 ul her bir bölümü (TRITC- kapağı / redBGT, 5 ug / ml) çözeltisi içinde bloke seyreltilmiştir. 2 saat oda sıcaklığında inkübe edin.
- Yıkama Coplin kavanoz içinde PBS içinde 3 x 10 dakika kayar.
- Bir seferde bir slayt alarak, dikkatle aşırı PBS kaldırmak ve glisero minimal hacmi kullanarak bir lamel ile montel-tabanlı, solmaya dayanıklı montaj orta. Şeffaf tırnak cilası ile lamelleri kenarları mühür. Zor kurumasını bekleyin.
- Uzun depolama süreleri (birkaç ay kadar) için bir haftaya kadar, ya da -20 ºC de 4 ºC karanlıkta slaytlar saklayın.
4. Unbiased Örnekleme ve Motor endplate'lerin En Face Görüntüleme
- (Değil analize dahil) ikinci bir araştırmacı bilinen tek kalır rastgele bir kod numarası ile her slayt etiketleme slaytlar kör. NMJ parametrelerin kantitasyonu, tüm örnekler için tamamlanana kadar bir sonucu olarak operatör tedavi gruplarına kör kalır.
- Mikroskop sahnede slayt yerleştirin ve TRITC filtre seti (63X yağı 1.3 NA objektif) ile geniş alan aydınlatma altında görüntülemek. Sağa ve geri bir plak alan (Şekil 2A) görünene kadar sol (alana göre alan) giderek taşıyın.
NOT: Örnekleme kriteri: nispeten Her AChR-lekeli yapıDüz ve objektif bakan bir uç plakası olarak kabul edilir ve (AChR boyama hilal endplate'lerin aracılığıyla enine-kesitini göstermektedir; ve bu nedenle hariç) analiz için görüntülendi (yani, - 1.0 Havadar ünitesi ve düşük lazer gücü konfokal iğne deliği set ile görüntülü edilecek son plak de TRITC / kırmızı-BGT (532 nm lazer) için seviyeleri kazanç optimize ve ofset. Sonraki optimize FITC / 488 nm lazer kullanarak sinaptofizin floresan. Her optik dilim arasında 0.7 mikron aralığı ile son plağın z-yığını toplayın. Görüntüleme oturumun tarihini, slayt kod adını ve son plağın numarasını içeren bir dosya adı ile kaydedin.
NOT: 488 nm kullanarak tarar ve 532 nm lazerler (FITC ve TRITC) kırmızı florofora ve tersi (sızdırma-through) dan floresan FITC kanalının kirlenmesini önlemek için sıralı (aynı anda değil) toplanması gerekir. - Örnekleme a tekrarlayınnd adımların görüntüleme 4,2-4,3 20 kadar omurun slayt / numune toplanmıştır.
- Bir sonraki kodlu slayta değiştirin ve 4,2-4,4 tekrarlayın. Kodlu slaytlar her biri için bu işlemi tekrarlayın.
- Deneysel slaytlar (FITC floresan kanal karanlık görünmelidir) için en uygun bulundu konfokal ayarlarını kullanarak kontrol slayt (no-primer antikor kontrol) den endplate'lerin birkaç görüntüleri toplayın.
- Görüntü dosyaları başka bir bilgisayara ve geri bir harici sürücü veya sunucudaki dosyaların orijinal kadar konfokal oturum transferi sonunda.
5. En Face Görüntüler sinaptik Uzmanlıklar Alan Ölçme
- Her z-yığını maksimum projeksiyon (MIP) görüntüleri hazırlamak için NIH ImageJ freeware (http://imagej.nih.gov/ij/) kullanın. Tiff dosyalarını (Şekil 2A ve B) olarak kaydedebilirsiniz. Dosya adları görüntü oturumu tarihi, örnek kod, plak numarası ve floresan kanalı (örneğin, 060414_57 içermelidir23_7_FITC.tiff).
- ImageJ z-projeksiyon görüntüsünü açın. Asetilkolin reseptör görüntü kanalı (Şekil 3A) seçin ve seçin: Görüntü> ekranda üç 8-bit gri tonlama görüntü içine 24-bit RGB renkli görüntüyü dönüştürmek için> 8-bit yazınız.
- Ilgi son plak kaynaklı olmayan herhangi bir boyama hariç ederken, özellikle bireysel son plağın tüm belirgin lekeli bölgeleri, içerecek şekilde ImageJ poligon aracını kullanarak ((ACHR) kanal lekeli redBGT ilgi son plak etrafında kaba bir taslağını çizmek Şekil 3C).
- Seçerek görüntü asgari yoğunluk eşiği uygulayın: Görüntü> Ayarlama> Eşiği (Şekil 3E ve ilgili ImageJ ekran).
- Eşikaltı (Şekil 3E) olarak çevredeki arka plan sinyali hariç ederken AChR-lekeli bölümleri izole şekilde eşik seviyesini ayarlayın. Ikinci bir rüzgar açıneşik değeri hakkında karar kolaylaştırmak için, karşılaştırma için pencerenin yanında hemen orijinal (sürekli-ton) görüntü ile ow. Ko sonraki kullanım analizleri için eşik değerini kaydedin.
- Seçmek son plak çevresinde çokgen anahat İstinat:> Parçacıklar Analiz Analyze. (Bu fotomultiplier elektrik gürültü kaynaklanan küçük eserler ortadan kaldırır) sonsuz piksel 50: açılır menüsünde gibi boyutları aralığını belirtin.
- Analiz Parçacıklar komutu ayrık üstü eşik alanlarının bir listesini içeren bir pencere oluşturur ve bunlar ikili görüntü (Şekil 3G ve ilgili ImageJ ekran) göründükleri gibi kendi floresan yoğunluğu değerleri sayılı. Bir etiketli elektronik tabloya bu verileri kopyalayın.
- Seçerek Toplam plak alanı (poligon içindeki alan) ölçün: Analiz> Ölçü. Bu, toplam plak alanını verir. AChR alanlara ve şiddetleri içine yönelik kopyalama ve yapıştırma verileriuygun sütunları etiketlemek için emin bir elektronik tablo, satır belirli slaytlar için bireysel endplate'lerin için kullanılacaktır.
- Anti-sinaptofizin floresan kanalına geçin ve tekrar 5.1 adımları - 5.5, ancak FITC kanal için (Şekil 3B, D ve F). Amaç, göz tarafından algılandığı gibi, mümkün olduğu kadar yakın, boyama sınırlarını eşleşen bir ikili görüntü oluşturur, böylece eşiği ayarlamaktır. Eşik değerini kaydedin.
- Görüntüler Stack> Görüntü> Yığınlar: Aşağıdaki adımları uygulayarak örtüşme alanını ölçün: İki kanal görüntüler içeren orijinal dosyayı açın ve seçerek iki ayrı görüntü bölmek.
- Pluggin> ko ve giriş eşik değerleri, daha önce ilgili kanal sorgu b içine AChR ve sinir kanalları için kaydedilen: (ImageJ web sayfasından indirilebilir ve yüklü) ko eklentisi seçiniz kullanmaÖküz. Bu beyaz piksel (Şekil 3H ve ilgili ImageJ ekran) bir örtüşme görüntü verecektir.
- Gri tonlamalı biçime yeni oluşturulan örtüşme görüntü dönüştürme ve maksimum değere bir eşik uygulayın. Maksimum eşik sadece iki önceki kanalların örtüşme alanına gelen, beyaz pikseller seçecektir. E-tabloya rekor piksel örtüşme alanı temsil 'ko' ortaya çıkan alanı değeri.
- Veri örnek araçlarının bir elektronik tablo hazırlayın hesaplamak ve histogramlar veya scatterplots 20,22 gibi standart sapmalar ve standart hataları arsa. N değeri genel olarak istatistiksel amacıyla örnek grup başına farelerin sayısı temsil ettiğini unutmayın.
- Scatterplots veya frekans histogramlarına olarak arsa plak AChR alanları veri normal istatistik testi (Şekil 6) önce dağıtılan olup olmadığını belirlemek için.
6. Bağıl BoyamaYoğunlukları Enine Optik Bölümler kullanma Karşılaştırıldı
NOT: Tek bir konfokal oturumda bu protokol tüm kas numuneleri bir araya süreç ve görüntü için. Bir deney planlama kas numune başına 30 dk görüntüleme süresi kadar izin verir.
- Kas liflerinin uzun eksenine enine 15 mikron cryosections kesin ve adım 3.1 açıklandığı gibi slaytlar üzerine toplamak.
- Adımlarda 3,2-3,13 açıklandığı gibi floresan boyama yürütmek.
- Kod adım 4.1 açıklandığı gibi bu görüntüleme ve analizler, tedavi grubuna operatör kör üstlendiği böylece lekeli slaytlar.
- Kısaca her slayt bir bölüm anket 40X floresan objektif (NA 0.75) kullanarak tek bir kazanç belirlemek ve tüm örnek slaytlar arasında tüm endplate'lerin için uygun olacaktır ACHR için seviye ayarı ofset. parlak plak sonra ölçekte hemen altında 256 gri olmalıdır. Bu optimizasyon, ikinci fluorescenc için ayrı ayrı yapılmalıdıre kanalı (arka arkaya toplanan). Sabit kazanç kaydedin ve seviye ayarlarını ofset ve görüntüleme oturum boyunca onları değiştirmez.
- Lazer yoğunluğu olası dalgalanmaları tespit başından ve konfokal oturumun sonunda, aynı parametreler kullanılarak, bir floresan standart slayt (örneğin, ağartıcı olmayan floresan boncuk) görüntülerini toplayın.
- Uç plaka bulmak için giderek slayt taramak için AChR kanalı kullanın.
- AChR-lekeli endplate'lerin en sayısını içeren her mikroskop alanında tek optik düzlemini bulmak için odaklanın.
- İki kez bu tek optik bölümü tarayın ve ortalama görüntüyü (Şekil 4G) kaydedin.
- İkinci floresan kanalı aynı odak düzlemi anahtarı (faiz protein) tutulması ve adım 6.8 itibariyle görüntü toplamak. Görüntüleme oturumun tarih, örnek kod, resim numarası ve floresan kanal belirtmek için bir sembol: dosya adı dahil, görüntü dosyasını kaydedin. Şekil 4A - F rapsyn, misk veya -dystroglycan (-DG) göre ACHR olan plak dağılımı örneklerini gösterir.
- Bir veya daha fazla uç plaka içeren bir sonraki alana taşıyın ve sahne adımı 6,8-6,9 tekrarlayın. 60 endplate'lerin toplam görüntülü kadar bu işlemi tekrarlayın.
- Görüntüleme oturumu transferi sonunda tüm başka bir bilgisayara dosya ve onları yedeklemek.
- Her orijinal görüntü dosyasını açın ve AChR kanalı izlerken, seçin: Görüntü> Yığınlar> kanalları bölmek, Görüntüler Stack.
- Seçin: Görüntü> Yazım> 8bit ekranda 8-bit gri tonlama biçimine dönüştürmek için. Her iki floresan kanalları için bunu yapın.
- Seçin: Görüntü> Yığınları> Görüntüler Stack. İki önceden ayrılmış 8-bitlik görüntüleri yeni bir yığın açın. Bir sonra tek pencere içinde iki floresan kanalları arasında rahatlıkla geçiş yapabilirsiniz.
- Bir lin çizmek için poligon aracını kullanıne sıkıca AChR boyama (Şekil 4I) sınırları etrafında.
- Seçin: kapalı alan içinde ACHR için ortalama piksel yoğunluğunu ölçmek için ölçün> Analiz (sıkıca çizgi çizerek önemini unutmayın). Bir etiketli elektronik tabloya bu değeri kopyalayın.
- Aynı poligon anahat (bölgeyi tanımlamak için ölçülecek) İstinat, (örneğin, Şekil 4B, D, F) ikinci floresan kanala geçmek ve seçin: Analiz> ölçü. Bu AChR boyama ile tanımlanan sinaptik alanda ilgili protein için ortalama lekeleme yoğunluğu sağlayacaktır.
- Ortalama plan floresan yoğunluğunu ölçmek için Tedbir> Analiz: seçin uzak görünen plak boyama bir alan seçin. Diğer floresan kanal / s için bu işlemi tekrarlayın ve floresan değerleri elektronik tabloya arkaplan değerleri kopyalamak.
- AltACHR için düzeltilmiş yoğunluklarını ve her son plağın bir ilgi protein elde etmek için son plak değerlerinden ortalama arka plan değerlerini cezbet.
- Floresan yoğunluğu oranı 14,21 vermek üzere düzeltilmiş bgt floresan yoğunluğu ile, ilgilenilen protein için düzeltilmiş plak yoğunluk değerlerini bölün
7. FRET kullanarak postsinaptik Membran AChR Yoğunluk karşılaştırılması
NOT: Bu protokol postsinaptik membranda AChRs yakından paketlenmiş ölçüde (<10 nm aralığı) değerlendirir. tam verici ve alıcı florofor kombinasyon bu FRET deneyinde için çok önemlidir. İsimler ve fluorophores detayları malzemeler tabloda verilmiştir. Onların spektral özellikleri, FRET ilgili, önceki gazetelerde 14,15 tartışılmıştır.
- Bölüm 6.1 de tarif edildiği gibi sabit bir enine cryosections hazırlayın. Tüm örnek grupları birlikte ve görüntü işleme gerekirAynı konfokal seansta d.
- İyice g 10 ile 2.5 g / ml kırmızı-BGT (FRET donör) mix / ml kadar kırmızı-BGT (alıcısını FRET) 12 kez yukarı ve aşağı pipetleme küçük bir plastik tüp içinde çözüm engelleme ile. Bu 1: 4 molar karışımı FRET 14 verimliliğini maksimuma çıkarır.
- Dikkatli bir şekilde, yukarıdaki karışım bir damla (12 ul) ile her bir bölümü kapsar ve oda sıcaklığında 1.5 saat süreyle inkübe, nemli bir bölmede, her slayt yerleştirin.
- Kontrol bölümler:; ve ayrıca 10 ng / ml kadar, kızıl bgt bazı bölümleri / ml kırmızı bgt (etiketli C1 kontrol verici) g 2,5 bölümlerde az sayıda kapak (sadece alıcı etiketli C2 kontrolleri). Adım 7.3 itibariyle bu kontrolleri inkübe.
- Yıkama PBS içinde 3 x 10 dakika slaytlar ve monte gliserol-tabanlı, solmaya dayanıklı montaj orta (adım 3.12 bakınız).
- Adım 6.7 gibi endplate'lerin örnekleme gerçekleştirin. Verici ile kabul floresan bağlı floresan bgt moleküllerin rastgele bağlanma mükemmel endplate'lerin ko-lokalize olmalıdır.
- Kontrol görüntüleri: 40X objektif ve düşük lazer güç optimize redBGT kazancını kullanma ve kontrol slayt C1 endplate'lerin için seviye ayarlarını ofset. Uzak-redBGT kazanç Optimize ve kontrol slayt C2 endplate'lerin için seviyeleri ofset. Herhangi bir floresan boşaltma-through yokluğunu onaylayın.
- Lazer gücünü değiştirmeden kazanç veya ofset düzey ayarları deneysel slaytlar taşımak ve hem de floresan kanalları görüntüleri (ön-photobleach) toplamak.
- Seçmeli olarak, sonra% 100 güçte 633 nm lazer ile 10 kez tarama tarama alanının yaklaştırarak tek uç plakanın bir kısmı boyunca uzak-kırmızı bgt photobleach. Taranan alanın floresan loş hale gelmelidir.
- Lazer gücü sıfırlamak ve zoom ve 7.7 kurulan konfokal ayarları kullanarak hem floresan kanallarda sonrası ağartma görüntüleri toplamak.
- Alıcı (uzak-kırmızı-B photobleach aşağıdaki donör yüzde artış (kırmızı-BGT) floresan FRET verimliliği (E) hesaplayınAşağıdaki formüle * e göre GT):
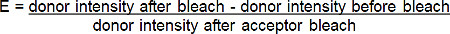
* Donör floresan akseptorü photobleaching sonra artar tüm durumlar için.
Sonuçlar
NMJ sinaptik Alanı Ölçümü
Alan herhangi bir tahmin sinaptik uzmanlık derecesini tanımlamak için bir sınır çizim dayanır. Sağlıklı genç erişkin kaslarda NMJ görüntüleri ACHR ve sinaptofizin boyama (Şekil 2A ve B) hem de iyi tanımlanmış sınırlar göstermelidir. ACHR ve sinaptofizin hem Floresan yoğunluğu, motor son plağın (Şekil 5A 've B')-peri sinaptik ve sinaptik kısm?...
Tartışmalar
Burada anlatılan protokoller güvenilir ölçmek ve normal yaşlanma ve hastalık halleri dahil olmak üzere koşulları bir dizi, karşısında NMJ özelliklerinde değişiklikler ölçmek için bize sağlamıştır. tr için açıklanan yöntemler NMJ görüntüleri araştırmacılar öncesi ve postsinaptik uzmanlık alanı ve sinaptik örtüşme / uyum alanı karşılaştırmak sağlayacak karşıya. Pre-ve postsinaptik proteinler enine optik bölümleri kullanan ikinci protokol, nispi yoğunluğu karşılaştırmak...
Açıklamalar
The authors declare they have no competing financial interests.
Teşekkürler
This work was supported by the National Health and Medical Research Council [570930]. Imaging was carried out at the Bosch Institute Advanced Microscopy Facility. Former members of the lab, whose work is cited, are thanked for their contributions to developing these methods.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Scanning confocal microscope | Leica | DM 2000 with TCS SP2 system | Most scanning confocal microscopes should be suitable. |
| Zeiss | LSM 510 Meta | ||
| Leica | SPE-II | ||
| Alexa555-a-bungarotoxin (red-BGT) | Life technologies | B35451 | Used for labelling AChRs |
| Alexa647-α-bungarotoxin (far-red-BGT) | Life technologies | B35450 | Far red fluorescence: barely visible through the eyepiece |
| rabbit anti-synaptophysin | Life technologies | 18-0130 | Different batches of primary antibody differ in effective working dilution |
| FITC-anti-rapsyn mab1234 | Milipore | FCMAB134F | Monoclonal antibody conjugated to FITC |
| FITC-donkey anti-rabbit IgG | Jackson | 711-095-152 | Polyclonal secondary antibodies can vary in quality according to source and batch |
| Optimal Cutting Temperature compound (O.T.C.) | ProSciTech | IA018 | Cryostat embedding matrix for freezing muscles |
| DABCO | Sigma | 10981 | Mounting medium that slows photobleaching of fluorophores |
Referanslar
- Schmidt, N., et al. Neuregulin/ErbB regulate neuromuscular junction development by phosphorylation of α-dystrobrevin. J Cell Biol. 195, 1171-1184 (2011).
- Amenta, A. R., et al. Biglycan is an extracellular MuSK binding protein important for synapse stability. J Neurosci. 32, 2324-2334 (2012).
- Samuel, M. A., Valdez, G., Tapia, J. C., Lichtman, J. W., Sanes, J. R. Agrin and Synaptic Laminin Are Required to Maintain Adult Neuromuscular Junctions. PLOS ONE. 7, e46663 (2012).
- Valdez, G., et al. Attenuation of age-related changes in mouse neuromuscular synapses by caloric restriction and exercise. Proc Natl Acad Sci (USA). 107, 14863-14868 (2010).
- Yampolsky, P., Pacifici, P. G., Witzemann, V. Differential muscle-driven synaptic remodeling in the neuromuscular junction after denervation). Eur J Neurosci. 31, 646-658 (2010).
- Li, Y., Lee, Y., Thompson, W. J. Changes in Aging Mouse Neuromuscular Junctions Are Explained by Degeneration and Regeneration of Muscle Fiber Segments at the Synapse. J Neurosci. 31, 14910-14919 (2011).
- Zhu, H., Bhattacharyya, B. J., Lin, H., Gomez, C. M. Skeletal muscle IP3R1 receptors amplify physiological and pathological synaptic calcium signals. J Neurosci. 31, 15269-15283 (2011).
- Valdez, G., Tapia, J. C., Lichtman, J. W., Fox, M. A., Sanes, J. R. Shared resistance to aging and ALS in neuromuscular junctions of specific muscles. PLoS ONE. 7, e34640 (2012).
- Perez-Garcia, M. J., Burden, S. J. Increasing MuSK Activity Delays Denervation and Improves Motor Function in ALS Mice. Cell reports. 2, 1-6 (2012).
- Klooster, R., et al. Muscle-specific kinase myasthenia gravis IgG4 autoantibodies cause severe neuromuscular junction dysfunction in mice. Brain. 135, 1081-1101 (2012).
- Pratt, S. J., Shah, S. B., Ward, C. W., Inacio, M. P., Stains, J. P., Lovering, R. M. Effects of in vivo injury on the neuromuscular junction in healthy and dystrophic muscles. J Physiol. 591, 559-570 (2013).
- Landis, S. C., et al. A call for transparent reporting to optimize the predictive value of preclinical research. Nature. 490, 187-191 (2012).
- Gervásio, O. L., Phillips, W. D. Increased ratio of rapsyn to ACh receptor stabilizes postsynaptic receptors at the mouse neuromuscular synapse. J Physiol. 562, 673-685 (2005).
- Gervásio, O. L., Armson, P. F., Phillips, W. D. Developmental increase in the amount of rapsyn per acetylcholine receptor promotes postsynaptic receptor packing and stability. Dev Biol. 305, 262-275 (2007).
- Brockhausen, J., Cole, R. N., Gervásio, O. L., Ngo, S. T., Noakes, P. G., Phillips, W. D. Neural agrin increases postsynaptic ACh receptor packing by elevating rapsyn protein at the mouse neuromuscular synapse. Dev Neurobiol. 68, 1153-1169 (2008).
- Cole, R. N., Reddel, S. W., Gervásio, O. L., Phillips, W. D. Anti-MuSK patient antibodies disrupt the mouse neuromuscular junction. Ann Neurol. 63, 782-789 (2008).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Muscle Specific Kinase autoantibodies cause synaptic failure through progressive wastage of postsynaptic acetylcholine receptors. Exp Neurol. 237, 237-286 (2012).
- Cole, R. N., Ghazanfari, N., Ngo, S. T., Gervasio, O. L., Reddel, S. W., Phillips, W. D. Patient autoantibodies deplete postsynaptic Muscle Specific Kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol. 588, 3217-3229 (2010).
- Viegas, S., et al. Passive and active immunization models of MuSK-Ab positive myasthenia: Electrophysiological evidence for pre and postsynaptic defects. Exp Neurol. 234, 506-512 (2012).
- Morsch, M., Reddel, S. W., Ghazanfari, N., Toyka, K. V., Phillips, W. D. Pyridostigmine but not 3,4-diaminopyridine exacerbates ACh receptor loss and myasthenia induced in mice by Muscle Specific Kinase autoantibody. J Physiol. 591, 2747-2762 (2013).
- Ghazanfari, N., Morsch, M., Reddel, S. W., Liang, S. X., Phillips, W. D. Muscle Specific Kinase autoantibodies suppress the MuSK pathway and ACh receptor retention at the mouse neuromuscular junction. J Physiol. 592, 2881-2897 (2014).
- Cheng, A., Morsch, M., Murata, Y., Ghazanfari, N., Reddel, S. W., Phillips, W. D. Sequence of age-associated changes to the mouse neuromuscular junction and the protective effects of voluntary exercise. PLoS One. 8, e67970 (2013).
- Schaefer, A. M., Sanes, J. R., Lichtman, J. W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis. J Comp Neurol. 490, 209-219 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLos Biol. 8, e1000412 (2010).
- Shimizu, S., Hedrich, H. J., Bullock, G. Routes of Administration. The Laboratory Mouse. , (2004).
- Chiasson, R. B. . Laboratory anatomy of the white rat. , (1988).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Mitra, A. K., Stroud McCarthy, M. P., M, R. Three-dimensional structure of the nicotinic acetylcholine receptor and location of the major associated 43-kD cytoskeletal protein, determined at 22A by low dose electron microscopy and x-ray diffraction to 12.5A. J Cell Biol. 109, 755-774 (1989).
- Paas, Y., et al. Electron microscopic evidence for nucleation and growth of 3D acetylcholine receptor microcrystals in structured lipid-detergent matrices. Proc. Natl Acad. Sci. (USA). 100, 11309-11314 (2003).
- Samson, A. O., Scherf, T., Eisenstein, M., Chill, J. H., Anglister, J. The mechanism for acetylhcoline receptor inhibition by α-neurotoxins and species-specific resistance to α-bungarotoxin revealed by NMR). Neuron. 35, 319-332 (2002).
- Ghazanfari, N., et al. Muscle Specific Kinase: Organiser of synaptic membrane domains. Int J Biochem Cell Biol. 43, 295-298 (2011).
- Ghazanfari, N., Morsch, M., Tse, N., Reddel, S. W., Phillips, W. D. Effects of the β2-adrenoceptor agonist, albuterol, in a mouse model of anti-MuSK myasthenia gravis. PLoS ONE. 9, e87840 (2014).
- Prakash, Y. S., Miller, S. M., Huang, M., Sieck, G. C. Morphology of diaphragm neuromuscular junctions on different fibre types. J Neurocytol. 25, 88-100 (1996).
- Salpeter, M. M., Harris, R. Distribution and turnover rate of acetylcholine receptors throughout the junction folds at a vertebrate neuromuscular junction. J Cell Biol. 96, 1781-1785 (1983).
- Soper, S. A., Nutter, H. L., Keller, R. A., Davis, L. M., Shera, E. B. The photophysical constants of several fluorescent dyes pertaining to ultrasensitive fluorescence spectroscopy. Photochem Photobiol. 57, 972-977 (1993).
- Panchuk-Voloshina, N., et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates. J Histochem Cytochem. 47, 1179-1188 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır