Method Article
التحقق من Nanobody والجسم المضاد القائم
* These authors contributed equally
In This Article
Summary
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Abstract
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introduction
في هذا التقرير، وصفنا تنفيذ الأشعة تحت الحمراء القريبة fluorophore المسمى تحقيقات للتأكد من صحة في الجسم الحي تجارب التصوير طعم أجنبي باستخدام المجراة سابقا التدفق الخلوي ومضان المجهري للأورام طعم أجنبي تشريح. نحن مقارنة nanobody واحد نطاق (ق + 16A، 17 كيلو دالتون) (1) والأجسام المضادة وحيدة النسيلة (Nika102، 150 كيلو دالتون) 2،3 موجهة لنفس المستضد الهدف لمحددة في الجسم الحي القريب من الأشعة تحت الحمراء التصوير مضان في نموذج سرطان الغدد الليمفاوية طعم أجنبي. يتم التعبير عن مستضد المستهدفة ADP ribosyltransferase ARTC2.2 باعتباره GPI الراسية-سطح الخلية ecto انزيم من قبل خلايا سرطان الغدد الليمفاوية 4-9.
Nanobodies المستمدة من الكامليد السلسلة الثقيلة فقط الأجسام المضادة هي أصغر المتاحة ملزم مستضد شظايا 10،11. مع فقط ~ 15 كيلو دالتون، هذه الشظايا الأجسام المضادة صغيرة قابلة للذوبان، ومستقرة جدا وبرأت renally من التداول 8،10. تيخصائص ذات المناظر جعلها مناسبة بشكل خاص لاستهداف محددة وفعالة من مستضدات الأورام في الجسم الحي 12-20. أهداف مستضد المشتركة للnanobodies المتاحة هي عامل نمو البشرة مستقبلات (EGFR1 أو HER-1)، الإنسان عامل نمو البشرة من النوع 2 (HER-2 أو CD340)، مستضد سرطاني مضغي (CEA)، والتصاق الخلايا الوعائية جزيء-1 (VCAM-1 ) 21. تقارن Nanobody هي أدوات واعدة لعلاج مناعي السرطان وعلاج الأمراض الالتهابية 22.
وقد أظهرت الدراسات الحديثة أن nanobodies تسمح أعلى -ratios للورم إلى الخلفية (T / B) من الأجسام المضادة في الجسم الحي التقليدية في تطبيقات التصوير الجزيئي 8،17،19. ويفسر ذلك بشكل رئيسي عن طريق اختراق الأنسجة فقيرة نسبيا وبطيئة من الأجسام المضادة التقليدية، وإزالة بطيئة من التداول، والاحتفاظ طويلة في أنسجة غير المستهدفة 23. وعلاوة على ذلك، يزيد من الأجسام المضادة التقليدية يؤدي إلى i تراكم غير محددالأورام مستضد سلبي ن الهدف الناجمة عن نفاذية تعزيز والاستبقاء (EPR) تأثير 24،25. وهذا يعني أن تناول جرعات أعلى من الأجسام المضادة التقليدية قد تزيد ليس فقط إشارات محددة ولكن أيضا إشارات غير محددة، وبالتالي تقليل الحد الأقصى لنسبة قابلة للتحقيق الورم إلى الخلفية. في المقابل، زيادة جرعة nanobodies يزيد من إشارات الأورام مستضد إيجابي ولكن ليس من الأنسجة الطبيعية أو الأورام مستضد سلبي (بيانات غير منشورة).
ما وراء المقارنة بين nanobodies والأجسام المضادة التقليدية، ونحن الخطوط العريضة تقييما داخل الفرد من xenografts مستضد الإيجابية و-negative في نفس الفئران للمقارنة المباشرة لإشارات محددة وغير محددة بسبب تأثير EPR. سمحت تحقيقات مترافق fluorophore القريب من الأشعة تحت الحمراء لنا لاستغلال التحقيق واحد في الجسم الحي وخارج الحي باستخدام التصوير مضان الأشعة تحت الحمراء القريبة، التدفق الخلوي، ومضان المجهري. تطبيق بروتوكولات لدينا يسمح لغيرالمشع، حساسة للغاية، وغير مكلفة تعظيم الاستفادة من التجارب المجراة في التصوير الجزيئي مثل تقييم يبني الأجسام المضادة الجديدة لاستهداف الورم محدد.
والهدف من هذه الدراسة هو البرنامج التعليمي لتسليط الضوء على استخدام NIRF التصوير لتقييم يبني الأجسام المضادة الجديدة في مجال التصوير الجزيئي قبل السريرية.
في هذا البروتوكول، تم تنفيذ جميع التجارب مع نظام NIRF-التصوير الحيوانات الصغيرة، ومضان تنشيط خلية فارز (FACS) تدفق عداد الكريات، والمجهر متحد البؤر.
Protocol
وقد أجريت تجارب وفقا للمبادئ التوجيهية الدولية بشأن استخدام الأخلاقي للحيوانات وتمت الموافقة من قبل لجنة الرفق بالحيوان المحلية من المركز الطبي لجامعة، هامبورغ: ملاحظة.
1. إعداد الخلايا السرطانية، الفئران، والأجسام المضادة التركيبات
- إعداد خلايا الغدد اللمفاوية وAliquoting من مصفوفة الطابق السفلي (Matrigel).
- قبل يوم واحد من حقن الخلايا السرطانية وضع مربع تعقيمها طرف (1،000 نصائح ميكرولتر) وماصة مناسبة في الثلاجة -20 درجة مئوية.
- ذوبان الجليد في زجاجة مع مصفوفة الطابق السفلي على الجليد في 4 ° C الثلاجة O / N.
- في يوم حقن ملء دلو الجليد ووضع مصفوفة الطابق السفلي مع ماصة، نصائح، و1 مل المحاقن مع الإبر 30 G على الجليد.
- خلايا سرطان الغدد الليمفاوية قسامة في حجم 100 ميكرولتر من RPMI المتوسطة في 1.5 مل أنابيب microcentrifuge وتخلط بعناية مع 100 ميكرولتر من المصفوفة الطابق السفلي. وضع إلى ما قبل تبريدهالمحاقن وضعت على الجليد حتى الحقن.
ملاحظة: استخدام تقنية معقمة جيدة والعمل على الجليد طوال الوقت لمنع انسداد المصفوفة الطابق السفلي.
- الفئران إعداد
- استخدام 8-10 اسبوع الفئران عارية athymic (NMRI- Foxn1 ن ش).
- للحد من تألق ذاتي من الأمعاء حفاظ على الفئران على نظام غذائي خال من البرسيم لمدة 1 أسبوع قبل التصوير في الجسم الحي.
- لحقن خلايا سرطان الغدد الليمفاوية تخدير الفئران لإحداث مع 2٪ الأيزوفلورين في غرفة الاستقراء. الحفاظ على 1-2٪ الأيزوفلورين لمدة الإجراء باستخدام متعددة isofluorane.
- حقن خلايا سرطان الغدد الليمفاوية تحت الجلد في جنباته الكتف. وعلى سبيل المقارنة البينية الفردية المباشرة حقن الخلايا مستضد إيجابي ومستضد سلبي على اليمين واليسار الجانب، على التوالي.
- استخدام الإبهام والسبابة لقرصة الجلد من الفأرة وتسحبه بعيدا عن الجسم من الفأرة. حقن ببطء وبشكل متساو إلىالحقيبة التي تم إنشاؤها بواسطة الأصابع، وخلق مجموعة واحدة من الخلايا تحت الجلد. مصفوفة الطابق السفلي تساعد حفظ حقن الخلايا في المكان.
- إعداد الأجسام المضادة التركيبات
- تسمية الاجسام المضادة وnanobodies مجال واحد مع عدة متاحة تجاريا وضع العلامات البروتين لصبغة الفلورسنت AlexaFluor-680 (AF680) (الطول الموجي الإثارة = 679 نانومتر، والانبعاثات الطول الموجي = 702 نانومتر) وفقا لتعليمات الشركة الصانعة. حساب عدد من الأصباغ في nanobody والأجسام المضادة التقليدي باستخدام معاملات الانقراض المولي من 15720 مول -1 سم -1 و 203،000 مول -1 سم -1، على التوالي. تقييم نقاء يبني الأجسام المضادة التي كتبها SDS-PAGE حجم تجزئة وCoomassie وصمة عار الزرقاء الرائعة.
- ضمان خصوصية تقارن المسمى من خلال إجراء سلسلة من التجارب في المختبر قبل دراسات التصوير الفعلية. اختبار خصوصية وصفتtibody يبني في المختبر من خلال دراسات الحجب ونمط إسوي غير محدد يتحكم 8،20.
ملاحظة: في خطوة قد تضطر إلى أن تتكيف وفقا لمعدلات النمو المختلفة 1.2.4 أعداد الخلايا لخلايا مستضد سلبي ومستضد إيجابي (أو خطوط خلايا مختلفة). لهذه التجارب، واستخدمت خلايا إيجابية 0.5x10 6 DC27.10 ARTC2 السلبية و1.5x10 6 DC27.10 ARTC2 للحصول أورام مشابهة من حيث الحجم. في الخطوة 1.3.1 عملية وضع العلامات ووضع العلامات فعالية الأجسام المضادة تحقيقات مع fluorophores قد تختلف من عدة العلامات المستخدمة.
2. في فيفو التصوير
- بعد 7-9 أيام، عندما تصل الأورام ~ 8 ملم في القطر، وحقن 50 ميكروغرام من AlexaFluor680 المسمى يبني الأجسام المضادة في حجم 200 ميكرولتر المالحة عن طريق الوريد إلى الوريد ذيل الماوس (MAB-AF680: 50 ميكروغرام مع 2 الأصباغ / جزيء ≈ ~ 4 ^ 14 fluorochromes ≈ ~ 0.8 ميكروغرام fluorochromes، Nanobody-AF680: 50 μز مع 0.3 الأصباغ / جزيء ≈ ~ 5.6 ^ 14 fluorochromes ≈ ~ 1.1 ميكروغرام fluorochromes).
- تهيئة نظام التصوير وتخدير الفئران لإحداث مع 3٪ الأيزوفلورين باستخدام نظام التخدير XGI-8 في غرفة الاستقراء قبل التصوير. الحفاظ على 1-2٪ الأيزوفلورين لمدة الإجراء التصوير باستخدام متعددة الأيزوفلورين يضم في غرفة التصوير.
- الفئران موقف على خشبة المسرح التصوير ساخنة مع الأورام الموجهة نحو الكاميرا. مراقبة التخدير السليم عن طريق معسر إصبع القدم أو ذيل الحيوان؛ أي رد فعل من الحيوان إلى أن التخدير خفيفة جدا.
- رصد معدل التنفس. التخدير خفيفة جدا إذا زاد معدل التنفس وعميق جدا إذا انخفض معدل التنفس، العميق أو غير منتظمة. حماية القرنيات الحيوان مع مرهم العين لمنع جفاف بينما تحت التخدير.
- اختيار مجموعات مرشح الفلورسنت من 615-665 نانومتر لالإثارة، 695-770 نانومتر لemissioن، و580-610 نانومتر الإثارة لالطرح الخلفية مع 51 2X 512 بكسل حجم المصفوفة. تعيين وقت التعرض لصناعة السيارات، بكسل binning إلى متوسطة وF / وقف إلى 2.
ملاحظة: مرات التعرض أقصر تمكن أسرع معدلات الإطار. مرات التعرض أطول توفير قدر أكبر من الحساسية. Binning يتحكم في حجم بكسل على كاميرا CCD. زيادة binning يزيد من حجم بكسل، حساسية، ومعدل الإطار، ولكن يقلل من القرار المكانية. F / إيقاف يحدد حجم فتحة عدسة الكاميرا. حجم الفتحة يتحكم في كمية الضوء الكشف عن وعمق field.Note أن إعدادات يمكن أن تختلف من تصوير الجهاز ومجموعة تجريبية تصل. راجع دليل الشركة المصنعة لأفضل النتائج.- في برامج التصوير زمن التعرض الأمثل، F / إيقاف وبكسل binning استنادا إلى مستوى التعبير عن خط الخلية. تغيير هذه الإعدادات في أي وقت خلال تجربة دون التأثير على نتيجة الكمية. بدلا من ذلك، والسماح للبرنامج معالج التصوير تحدد تلقائياالمعلمات.
- الفئران الصورة قبل الحقن و6 ساعات بعد الحقن من يبني الأجسام المضادة.
ملاحظة: إن فعالية وضع العلامات قد تؤثر على الجرعة المطلوبة اللازمة لنتائج التصوير المثلى. وبالتالي فإن كمية من الأجسام المضادة المطلوبة لبناء نتائج التصوير المثلى لابد من تحديد تجريبيا. قد تختلف اعتمادا على فعالية وضع العلامات وحجم بناء فضلا عن نموذج الورم والتعبير عن الهدف مستضد.
3. الحصاد وإعداد الأورام
- ملء دلو الجليد ووضع 4٪، بارافورمالدهيد (PFA) الفوسفات مخزنة المالحة (PBS) / مثبط البروتياز (AEBSF) وPBS / 0.2٪ ألبومين المصل البقري (BSA) على الجليد.
- وبمجرد الانتهاء من الدورة والتصوير، وزيادة تركيز الأيزوفلورين إلى 4٪. بعد توقف التنفس الحيوان، إزالته من مرحلة التصوير وأداء خلع عنق الرحم.
- جبل الماوس على كتلة الستايروفوم ورذاذ مع الايثانول 70٪.
- استخدام مقصالصورة وملقط لقطع الجلد الخارجي وتسحبه إلى الوراء بعناية لفضح الأورام. إزالة الأورام مع مشرط لضمان بقاء أنسجة الورم سليمة.
- الأورام قطع في نصف باستخدام مشرط. ضع نصف واحد في أنبوب جمع مع PBS / AEBSF لFACS التحليلات والنصف الآخر في أنبوب 50 مل مع 4٪ PFA لالمناعية.
- استعدادا لالمناعية
- الحفاظ الأورام في 4٪ PFA في الثلاجة عند 4 درجة مئوية لمدة 24 ساعة. نقل الأورام إلى أنبوب مع PBS / 30٪ سكروز والاحتفاظ بها في الثلاجة على 4 درجات مئوية حتى المصارف الورم إلى أسفل الأنبوب.
- قطع الأورام في القطع المناسبة لcryomolds. وضع الأورام في cryomolds وملء مع أكتوبر مركب بحيث تتم تغطية الأورام.
- وضع قوالب على الثلج الجاف وانتظر حتى المجمع هو المجمدة تماما. نقل الأورام المجمدة إلى -80 ° C الثلاجة وتخزين لالمناعية.
- قطع تجميد الأورام في أجزاء من 8 ميكرون مع مشراح. استخدام immunohisto القياسيةبروتوكول الكيمياء إلى وصمة عار مع الأجسام المضادة ضد CD31-AF488 لتصور الأوعية الدموية وdiamidino-phenylindole (دابي) لتصور النوى.
ملاحظة: أقسام الأورام حساسة جدا للضوء لأنها تحتوي بالفعل الأجسام المضادة fluorescently المسمى. تقليل التعرض للضوء قدر الإمكان.
- استعدادا لتحليل FACS
- وضع طبق بتري على الجليد وإزالة المكبس من حقنة 2.0 مل. وضع الورم في مصفاة الخلية وقطع عليه بلطف إلى 3-4 قطع باستخدام مشرط. صب PBS الأولي في طبق بتري واستخدام نهاية شقة من المكبس لالهريس الورم داخل مصفاة الخلية.
- تدفق مصفاة الخلية مع PBS الأولي لتغسل جميع الخلايا مع ماصة 10 مل. نقل تعليق الخلية في أنبوب جديد وتدور في 500 x ج لمدة 5 دقائق. تجاهل طاف و resuspend الخلايا في 10 مل PBS / 0.2٪ BSA. عدد الخلايا.
- قسامة 1-5 × 10 6 خلايا سرطان الغدد الليمفاوية في 5 مل FACS الأنبوب. خلايا تدور مرة أخرى (500x ج)، ونبذ طاف و resuspend في 100 ميكرولتر PBS / 0.2٪ BSA.
- اختياريا، كتلة FCR باستخدام معاداة CD16 / CD32-ماب (FcgR3 / 2) التي تربط لFcγR على الجليد لمدة 10 دقيقة. غسل خلايا مرة واحدة مع PBS / 0.2٪ BSA.
- إضافة مكافحة CD45-ماب للتمييز كريات الدم البيضاء من الخلايا الأخرى. احتضان لمدة 20 دقيقة على الجليد في الظلام، تليها اثنين من يغسل مع PBS / 0.2٪ BSA.
- الحق قبل FACS تحليل وصمة عار مع يوديد propidium لمدة 15 دقيقة على الجليد لتمييز الخلايا الميتة، تليها اثنين من يغسل مع برنامج تلفزيوني عادي. resuspend في 150 ميكرولتر لتحليل FACS.
ملاحظة: في الخطوة 3.7.4 وخطوة 3.7.5 الأجسام المضادة أخرى يمكن أن تستخدم تبعا لكيان الورم.
4. تحليل FACS
- استخدام مجموعة من الأدوات النابضة لبوابة سكان الفائدة في شكل مبعثر كبير والتمييز صدرة، واستبعاد الخلايا الميتة، النابضة للخلايا إيجابية CD45، والنابضة للخلايا مستضد إيجابي.
- في البداية، وبوابة الخروج خليةالحطام في مبعثر إلى الأمام (FSC-A) مقابل الجانب مبعثر (SSC-A) باستخدام مؤامرة المعلمة اثنين. الحلل خلية تجاهل المقبل. وأخيرا، بوابة من غير CD45-مستضد إيجابي (CD45) وميت / يحتضر الخلايا (LD - الحية / الميت وصمة عار).
- عينات قياسية باستخدام نفس القالب لجميع التجارب.
ملاحظة: يرجى الرجوع إلى بروتوكول الشركة المصنعة للحصول على المشورة الفنية بشأن استخدام الأجهزة والبرامج التحليلية.
5. تحليل المجهري
- تحليل cryosections الورم الملون باستخدام المجهر متحد البؤر مع عدسة الغمر النفط (الهدف 40X). استخدام والنيون 633 نانومتر الإثارة ليزر من AF680، ليزر الأرجون لAF488، وعلى بعد 405 ديود لدابي.
- معالجة بيانات الصور الخام باستخدام برنامج متوافق مع المجهر. أداء خلفية تصحيح والضوضاء تصفية إذا لزم الأمر. أداء التعديلات صورة إضافية مثل باجتزاء، وزراعة المحاصيل وكذلك السطوع والتباين التعديلات.
- وأخيرا شركة جنرال الكتريكnerate صورة تراكب مركبة واحدة من جميع القنوات الكشف. ضبط السطوع والتباين في الطبقات الفردية. والصور المركبة تظهر توطين الخلايا (دابي وصمة عار والأزرق)، وتوزيع يبني المسمى الأجسام المضادة (AF680 وصمة عار، الحمراء) والأوعية الدموية (AF488 وصمة عار، الخضراء).
6. في تحليل فيفو التصوير
- ملفات الصور المفتوحة في برامج التصوير، وخلق صورة تراكب من خلال الجمع بين بيانات الصورة صورة مع بيانات الصورة مضان. تحسين عرض الصور عن طريق إزالة تألق ذاتي الأنسجة إشارة الخلفية من إشارة الفلورسنت محددة. ويمكن القيام بذلك عن طريق طرح صورة المكتسبة مع فلتر خلفية تعيين من الصورة المكتسبة مع فلتر مجموعة محددة من أجل التتبع.
- رسم المناطق قياس دائرية مماثلة من الفائدة (ROI) حول الورم مستضد إيجابي والورم مستضد سلبي. لتحديد خلفية كثافة إشارة، ضع ROI دائريفي منطقة من الحيوان حيث من المتوقع أن تكون منخفضة إشارة مضان (على سبيل المثال، هند الساق).
- استخدام نفس رويس لجميع الحيوانات في جميع نقاط الوقت. لتحديد المواقع، واستخدام الصور بالأسود والأبيض الفوتوغرافية لتحديد هوامش الورم.
- عرض البيانات ROI في جدول القياس. استخدام متوسط البيانات كفاءة مشع، والتي تمكن المقارنة أكثر كمية من الإشارات الفلورسنت لإجراء المزيد من التحليلات الإحصائية.
- عرض ومقارنة البيانات وشدة إشارة المطلقة أو حساب نسبة الإشارة إلى الخلفية باستخدام بيانات قياس العائد على الاستثمار من الأنسجة المستهدفة والأنسجة الخلفية. حساب نسبة الورم إلى خلفية بقسمة قيمة امتصاص الورم عن طريق قيمة خلفية تحديد من أطرافه الخلفية.
- والضوابط، وأيضا تحليل الأورام مستضد السلبية ومستضد إيجابي في نفس الحيوانات وكذلك الحيوانات المحقونة مع الضوابط نمط إسوي المسمى لتقييم خصوصية إشارات في الجسم الحي.
النتائج
تحقيقات fluorescently المسمى تسمح لمزيج من تقنيات مختلفة NIRF التصوير (الشكل 1A). نحن تهدف لأداء في الجسم الحي NIRF التصوير، التدفق الخلوي، ومضان المجهر بالتتابع من أجل مقارنة nanobodies fluorescently المسمى والاجسام المضادة لمحددة في الجسم الحي التصوير (الشكل 1B).
تم حقن الفئران مع 50 ميكروغرام من nanobody والأجسام المضادة وحيدة النسيلة لتقييم خصوصية يبني fluorescently المسمى للتصوير في الجسم الحي. أظهرت النتائج العلامات معين من الأورام مستضد إيجابي مع كل nanobody والأجسام المضادة وحيدة النسيلة في 6 ساعات بعد الحقن (الشكل 2). ROI يحلل الأورام مستضد إيجابي أظهرت نسبة أعلى بكثير T / B من ~ 12 لnanobody مقارنة ~ 6 لالأجسام المضادة وحيدة النسيلة. وعلاوة على ذلك، أظهر nanobody أي إشارة غير محددة في الأورام مستضد سلبي، في حين أنأظهر الأجسام المضادة وحيدة النسيلة إشارات التباس غير محددة في الأورام مستضد سلبي.
إلى جانب إشارة غير محددة من الأورام السلبية، والأجسام المضادة وحيدة النسيلة أيضا يسببها الإشارات الخلفية غير محددة في الحيوان بأكمله. هذا هو الأرجح بسبب الإفراط في الأضداد الجائلة الحرة، والتي هي كبيرة جدا أن تفرز renally. بالعكس، الحيوانات المحقونة مع nanobodies أظهرت إشارات غير محددة فقط في الكلى بسبب القضاء الكلوي من nanobodies الصغيرة.
التدفق الخلوي التحليلات من تعليق خلية الورم أظهر وسم معين من الخلايا السرطانية مستضد إيجابي مع كل AF680-تقارن 6 ساعات بعد الحقن. إشارة مضان أقوى من الخلايا nanobody المسمى بالمقارنة مع خلايا الأجسام المضادة وحيدة النسيلة المسمى تعكس في الجسم الحي النتائج NIRF التصوير. الأهم من ذلك، تكشف التحليلات تدفق cytometric أنه لا يوجد وضع العلامات غير محدد من الخلايا مستضد السلبي مع أي من اثنينيبني (الشكل 3).
أظهر مضان المجهر من cryosections الورم وضع العلامات قوية ومتجانسة تقريبا من الخلايا مستضد إيجابي مع nanobody 6 ساعات بعد الحقن. النقيض من ذلك، أظهر الأجسام المضادة وحيدة النسيلة لتلطيخ أضعف بكثير وغير متجانسة إلى حد ما (الشكل 4A). تظهر أورام مستضد سلبي أي تلطيخ 6 ساعات بعد الحقن من nanobody، في حين أن الأورام مستضد سلبي حقن مع التقليدية تظهر الأجسام المضادة غير محدد تلطيخ المنتشرة في الفضاء الخلالي (الشكل 4B).
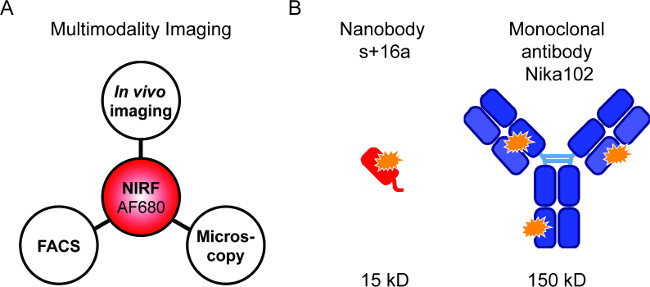
الشكل 1: التصوير Flourescence ويبني الأجسام المضادة. (A) الإعداد التصوير لتقييم AF680-تقارن: في الجسم الحي NIRF التصوير تليها التدفق الخلوي ومضان المجهري. (B ) رسم تخطيطي للAlexaFluor680 المسمى nanobody الصورة + 16A (الحمراء)، والأجسام المضادة وحيدة النسيلة Nika102 (الأزرق). البرتقال تشير النجوم إلى fluorochromes AlexaFluor680.
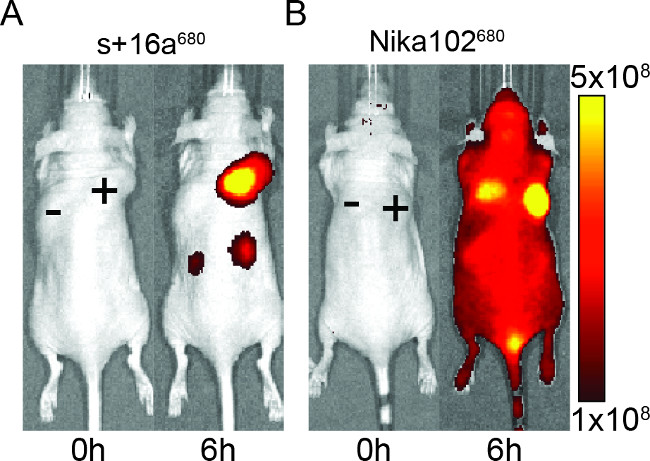
الشكل 2: في الجسم الحي NIRF التصوير صور من إشارة مضان من مستضد الموجب (+) ومستضد سلبي (-) الأورام في الفئران التي تم حقنها مع nanobody الصورة + 16A (A) والأجسام المضادة وحيدة النسيلة Nika102 (B). . وقد أجريت في الجسم الحي التصوير من قبل (0 ح) و 6 ساعات بعد الحقن. يتم عرض شدة إشارة عن الكفاءة مشع (ص / ثانية / سم 2 / SR) / (μW / سم 2).
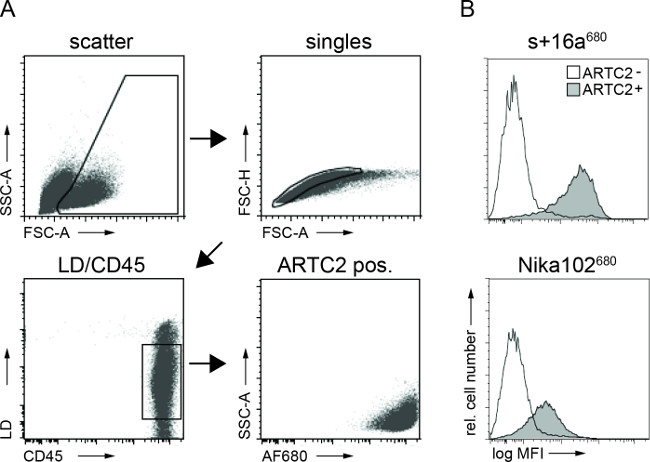
الشكل (3):فيفو السابقين FACS تحليلات خلية ملزمة يبني الأجسام المضادة من تعليق خلية الورم. (A) استراتيجية المحاصرة لFACS تحلل الخلايا السرطانية. (B) المدرج الإحصائي عرض مبلغ حقن عن طريق الوريد nanobody AF680 مترافق الصورة + 16A والأجسام المضادة Nika102 ملزمة على وجه التحديد إلى الخلايا السرطانية في الجسم الحي. يتم عرض أورام مستضد سلبية لأنه رسوم بيانية شاغرة والأورام مستضد إيجابي كما يتم عرض رسوم بيانية شغلها.
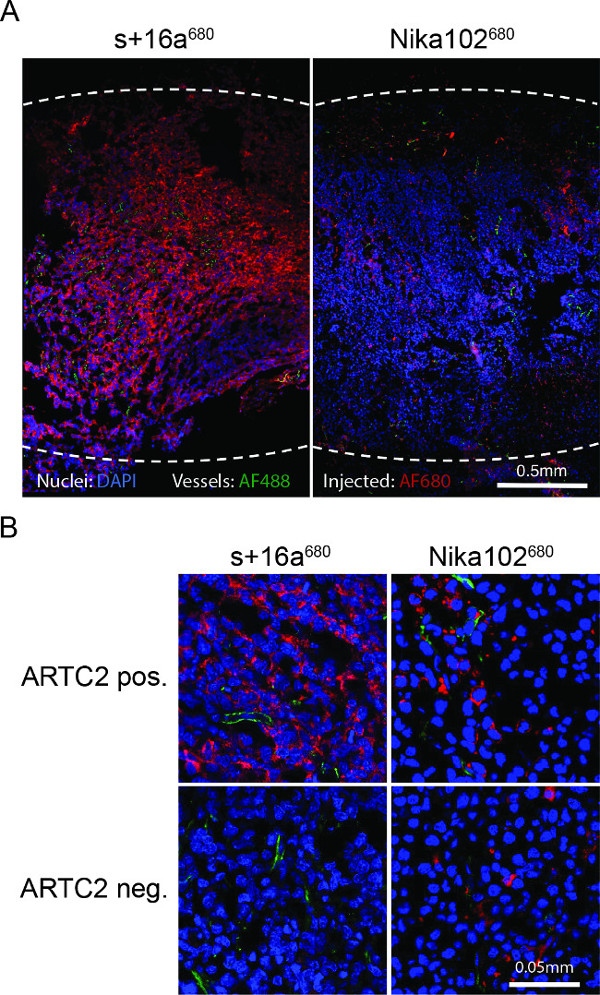
الرقم 4: خارج الحي مضان المجهر (A) نظرة عامة المجهري مضان من كامل cryosections الورم مستضد إيجابي 6 ساعات بعد الحقن من ليالي + 16A 680 أو 680 Nika102. شدة إشارة للفي الجسم الحي عن طريق الوريد فييتم عرض jected AF680-تقارن دون وسيط وضع العلامات الثانوي باللون الأحمر. يتم عرض خارج الحي نوى counterstained في الزرقاء والأوعية باللون الأخضر. الخطوط المنقطة تشير الهوامش الخارجية للأورام بأكملها. (B) عن قرب المجهر مضان من الأورام مستضد إيجابي وسلبي مستضد.
Discussion
استخدمنا الأشعة تحت الحمراء القريبة fluorophore nanobodies وصفت والأجسام المضادة وحيدة النسيلة التقليدية الموجهة ضد نفس الهدف على خلايا سرطان الغدد الليمفاوية للمقارنة المتعدد الوسائط للفي الجسم الحي وخارج الحي التحليلات. أظهرنا أن nanobodies هي مناسبة كذلك أدوات التشخيص للكشف السريع ومحددة في الجسم الحي من الأورام اللمفاوية.
في الجسم الحي، ق + 16A 680 يسمح للكشف سريع وأكثر تحديدا من xenografts-ARTC2 إيجابية. وبصرف النظر عن حركية مختلفة للحصول على أفضل التصور الورم في الجسم الحي، وكان العيب الرئيسي لNika102 680 إشارة غير محددة عالية من الأورام ARTC2 سلبية وإشارات الخلفية غير محددة.
يحلل خارج الحي تدفق cytometric من الخلايا المتفرقة من الأورام تشريح لم تظهر أي ملزمة لانوعي إلى خلايا سرطان الغدد الليمفاوية-ARTC2 سلبية من حقن AF680-تقارن. خارج الحي مضان كشفت قوي وhomogen تقريباتلطيخ الأوس من الخلايا في أقسام ورم ART2C إيجابية في حالة nanobody الصورة + 16A، مؤكدا أن nanobody كان قادرا على الوصول إلى المناطق النائية حتى داخل الورم بعد 6 ساعات. في المقابل، أظهر الأجسام المضادة وحيدة النسيلة تلطيخ أضعف وغير متجانسة من الخلايا في الأورام ARTC2 إيجابية بعد 6 ساعات. نتائج التصوير أفضل مع الأجسام المضادة التقليدي لا يمكن أن يتحقق بعد 24 ساعة أو 48 ساعة (لا تظهر البيانات). من أجل إجراء مقارنة شاملة اثنين من بنيات الحجم بشكل مختلف، والتصوير في نقاط زمنية مختلفة (المسلسل التصوير) لابد من القيام بها لتحديد أفضل نقطة زمنية التصوير لكل بناء.
مثل دراسات سابقة أخرى، فإن النتائج المعلنة هنا تؤكد أن في الجسم الحي التصوير الجزيئي مع nanobodies المسمى يسمح في نفس اليوم التصوير ورم سريع ومحدد مع ارتفاع الورم إلى خلفية نسب 12-15،17-19. بالعكس، والأجسام المضادة التقليدية تؤدي إلى انخفاض الورم إلى الخلفية النسب وإشارات غير محددة من مكافحةالأورام جنرال السلبية في وقت مبكر بعد الحقن بسبب إزالتها بطيء من الجسم. من أجل الحصول على نتائج التصوير الأمثل مع الأجسام المضادة التقليدية، وقت التصوير ويشير 24 ساعة أو حتى 48 ساعة بعد وهناك حاجة إلى حقن عادة. هذه النتائج هي في اتفاق مع الدراسات السابقة التي اقترحت أن الأجسام المضادة التقليدية مع فوائد علاجية ثبت أن فائدة محدودة في مجال التصوير الجزيئي 17،19،26. لذلك الأجسام المضادة التقليدية قد تكون مناسبة بدلا لأغراض علاجية بسبب الطويلة البلازما نصف الحياة، بينما nanobodies هي مناسبة بدلا لأغراض التصوير بسبب التخليص السريع الخاصة بهم من الدورة الدموية. ويرجع ذلك إلى حقيقة أن أي فائض من nanobodies أصغر (15-17 كيلو دالتون) يتم مسح بسرعة عبر القضاء الكلوي في حين يتم الاحتفاظ الزائد من الأجسام المضادة التقليدية الكبيرة (150 كيلو دالتون) في تداول هذه الاختلافات. وبالتالي فإن الميزة الرئيسية لnanobodies للتصوير الجزيئي هو إشارة خلفية منخفضة في نقاط وقت التصوير في وقت مبكر regardlوفاق سطيف من الجرعة حقن. وهذا يسمح التصوير نفس اليوم ويمكن أن يكون للترجمة إلى السريري الإعداد. النقيض من ذلك، الأجسام المضادة التقليدية يجب أن تكون معاير بالضبط لتقليل إشارات خلفية غير محددة، مع الحفاظ على ما يكفي من إشارة محددة من الأنسجة المستهدفة (بيانات غير منشورة).
واحدة من قيود في الجسم الحي تقنية NIRF التصوير هو عمق الاختراق المنخفض الذي يسمح عموما التصوير الوحيد من تحت الجلد ولكن ليس من النماذج الورم مثلي. ومع ذلك، يمكن التغلب على هذا القيد في بيئة تجريبية قبل تقنيات الصورة الصوتية للتصوير الشعاعي الطبقي وضعت مؤخرا التي تسمح التصوير كامل الجسم من الفئران 27 الذين يعيشون. الحد آخر من تقنية NIRF التصوير هو تقييم الجرعة الأنسجة بالمقارنة مع التصوير بوساطة النويدات المشعة. ومع ذلك، قد يكون radiolabelled في nanobodies عن التصوير المقطعي بالإصدار البوزيتروني (PET) التصوير من النماذج طعم أجنبي والتقييم الكمي الدقيق للالتتبع biodistribution. في الواقع، ونتائج NIRF التصوير لدينا هي وفقا لدراسة حديثة أنه بالمقارنة nanobodies والأجسام المضادة التقليدية للتصوير PET. وجاء في الكتاب أيضا إلى استنتاج مفاده أن nanobodies تسمح التصوير في نفس اليوم مع ارتفاع الورم إلى خلفية نسب 15.
ومع ذلك، فقط وضع العلامات من يبني الأجسام المضادة مع الأشعة تحت الحمراء القريبة الفلورسنت صبغة AF680 يسمح لنا شاملة في المختبر، في الجسم الحي وخارج الحي مقارنة بالقرب من الأشعة تحت الحمراء التصوير مضان باستخدام التدفق الخلوي، مضان المجهر، وNIRF التصوير. لهذا السبب، ولأنه غير مشع، حساسة للغاية، وغير مكلفة، ويستخدم سهلة لإنتاج نسبيا تحقيقات المستهدفة، ندعو إلى استخدام تقنية NIRF التصوير لتقييم يبني الأجسام المضادة الجديدة في مجال التصوير الجزيئي قبل السريرية.
Disclosures
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Acknowledgements
وأيد هذا العمل من قبل كلية الدراسات العليا "التهاب والتجديد" من مركز البحوث التعاونية 841 من الألمانية للبحوث (الكسندر لينز، فالنتين Kunick، وليام Fumey)، عن طريق مركز البحوث التعاونية 877 من الألمانية للبحوث (فريدريش كوخ نولتي) ، من قبل مؤسسة فيرنر أوتو (بيتر Bannas)، من قبل مؤسسة فيلهلم ساندر (بيتر Bannas، فريدريك كوخ نولتي)، وجمعية الألمانية للبحوث (مارتن Trepel، فريدريك هاج وفريدريك كوخ نولتي). نشكر جامعة سرطان مركز هامبورغ (UCCH) في مرفق فيفو البصرية التصوير الأساسية والموظفين في UKE للتشاور وخدمات عالية الجودة العالية. وأيد مرفق الأساسية في جزء من المنح المقدمة من دويتشه Krebshilfe (السرطان الألمانية المعونة).
Materials
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
References
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved