Method Article
Проверка нано- и антител Based
* Эти авторы внесли равный вклад
В этой статье
Резюме
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Аннотация
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Введение
В настоящем докладе мы описываем реализацию ближней инфракрасной флуорофорных меченых зондов для проверки в естественных условиях экспериментов изображений ксенотрансплантат с помощью экс естественных условиях проточной цитометрии и флуоресцентной микроскопии рассеченных ксенотрансплантатных опухолей. Мы сравниваем одну нано- доменов (+ 16а, 17 кДа) 1 и моноклональные антитела (Nika102, 150 кДа) 2,3 направленными в ту же антигена-мишени для конкретных в естественных условиях ближней инфракрасной флуоресценции изображений в модели лимфома ксенотрансплантатной. Целевой антиген АДФ-рибозилтрансферазной ARTC2.2 выражается как якорь GPI-клеточной поверхности экто- фермента клеток лимфомы 4-9.
Нанотел, полученные от верблюда тяжелой цепи только антитела представляют собой наименьшие доступные антиген-связывающие фрагменты 10,11. Только с ~ 15 кДа, эти небольшие фрагменты антител являются растворимыми, очень устойчивы и почками выводится из обращения 8,10. THESE свойства делают их особенно пригодными для конкретного и эффективного таргетинга опухолевых антигенов в естественных условиях 12-20. Общие цели антигена доступных нанотел являются рецептор эпидермального фактора роста (EGFR1 или HER-1), человеческого эпидермального роста типа фактором 2 (HER-2 или CD340), карциноэмбриональный антиген (СЕА) и адгезии сосудистых клеток молекулы-1 (VCAM-1 ) 21. Нанотела конъюгаты перспективные средства для иммунотерапии рака и лечении воспалительных заболеваний 22.
Недавние исследования показали, что нанотела позволяют более опухоли к фону (T / B) -ratios, чем обычные антител в в естественных условиях применения молекулярной визуализации 8,17,19. Это объясняется, главным образом, относительно бедных и медленно проникновения в ткани обычного антител, медленным выведением из обращения, и долго удержания в нецелевых тканях 23. Кроме того, избыток обычных антител приводит к неспецифической накопления Iп-мишени антиген-отрицательных опухолей, вызванных повышенной проницаемости и удержания (ЭПР) Эффект 24,25. Это означает, что более высокие дозы обычных антител может увеличить не только конкретные сигналы, но также и неспецифические сигналы, тем самым уменьшая максимальный достижимый коэффициент опухоли к фону. В отличие от этого, увеличение дозы увеличивает нанотел сигналы антиген-положительных опухолей, но не нормальной ткани или антиген-негативных опухолей (неопубликованные данные).
Помимо сравнения нанотел и обычных антител, мы очертить intraindividual оценку антиген-положительных и негативных, HBeAg ксенотрансплантатах в тех же мышей для прямого сравнения специфических и неспецифических сигналов из-за эффекта ЭПР. В ближней ИК-области флуорофорные сопряженные зонды позволили нам использовать единый зонд в естественных условиях и экс естественных условиях с использованием изображений ближней инфракрасной флуоресценции, проточной цитометрии и флуоресцентной микроскопии. Применение наших протоколов позволяет нерадиоактивные, очень чувствительна и недорого оптимизация в естественных условиях экспериментов молекулярной визуализации, таких как оценка новых антител конструкций, нацеленные на конкретные опухоли.
Цель этого урока исследования, чтобы выделить использование NIRF-визуализации для оценки новых антител конструкций в доклинической молекулярной визуализации.
В этом протоколе, все эксперименты проводились с малого животного системы NIRF-изображений, флуоресценции активирован сортировки клеток (FACS) проточной цитометрии и конфокальной микроскопии.
протокол
ПРИМЕЧАНИЕ: Эксперименты были проведены в соответствии с международными стандартами по этическим использования животных и были одобрены местной комиссии защиты животных Медицинского центра университета, Гамбург.
1. Подготовка опухолевых клеток, мышей и антител конструктов
- Подготовка клеток лимфомы и аликвоты из подвала Matrix (Matrigel).
- День до инъекции опухолевых клеток поставить стерилизовать наконечник окно (1000 советы мкл) и пипетку в -20 ° C морозильнике.
- Оттепель бутылку с базальной матрицы на льду в 4 ° C холодильником O / N.
- В день инъекции заполнить ведро льда и поместите в подвал матрицу вместе с пипеткой, советы и 1 мл шприцы с 30 г хвои на льду.
- Аликвоты клеток лимфомы в объеме 100 мкл RPMI среде в 1,5 мл микроцентрифужных пробирках и тщательно перемешать со 100 мкл базальной матрицы. Составьте в предварительно охлажденныйшприцы и не поставить на лед до инъекции.
ПРИМЕЧАНИЕ: Используйте хорошую стерильную технику и работать на льду все время, чтобы предотвратить засорение подвале матрицы.
- Мыши Подготовка
- Используйте 8-10-недельных бестимусных голых мышей (NMRI- Foxn1 N U).
- Чтобы уменьшить автофлуоресценции кишечника держать мышей на люцерны свободной диете в течение 1 недели до визуализации в естественных условиях.
- Для введения клеток лимфомы анестезию мыши, чтобы осуществить с 2% изофлуран в индукционной камере. Поддержание 1-2% изофлуран для длительности процедуры с использованием изофлуораном коллектор.
- Вводите клетки лимфомы подкожно в плечо флангах. Для прямого внутри индивидуального сравнения вводят антиген-положительных и антиген-негативных клеток на правой и левой стороне, соответственно.
- Используйте большой и указательный палец ущипнуть кожу мыши и потяните ее от тела мыши. Вводите медленно и равномерно вЧехол создан пальцев, создавая один кластер клеток под кожей. Подвал матрица помогает держать вводили клетки на месте.
- Подготовка антител конструктов
- Этикетка моноклональных антител и отдельные нанотела области с коммерчески доступной мечения белков комплекта к флуоресцентным красителем AlexaFluor-680 (AF680) (Длина волны возбуждения = 679 нм, длина волны излучения = 702 нм) в соответствии с инструкциями изготовителя. Подсчитать количество красителей в нано- и обычных антител с использованием молярных коэффициентов экстинкции 15720 моль -1 см -1 и 203 000 моль -1 см -1, соответственно. Оценить чистоту антител конструкций по SDS-PAGE фракционированием и Кумасси пятно.
- Убедитесь, что специфичность конъюгаты путем проведения серии экспериментов в пробирке до фактического визуальных исследований. Проверьте специфику пометкаtibody строит в пробирке через блокирующие исследований и неспецифические изотипу контролирует 8,20.
Примечание: На этапе 1.2.4 число клеток на антиген-отрицательных и антиген-положительных клеток (или различных клеточных линий) может должны быть адаптированы в соответствии с различными темпами роста. Для этих экспериментов 0.5x10 6 DC27.10 ARTC2 отрицательным и 1.5x10 6 DC27.10 ARTC2 позитивные клетки были использованы для получения опухоли такого же размера. На этапе 1.3.1 Процесс маркировки и этикетирования эффективности антител зондов с флуорофорами могут отличаться от набора маркировки используется.
2. В естественных изображений
- После 7-9 дней, когда опухоли достигают ~ 8 мм в диаметре, инъекции 50 мкг AlexaFluor680 помечены конструкции антител в объеме 200 мкл физиологического раствора внутривенно в хвостовую вену мыши (MAB-AF680: 50 мкг с 2 красители / молекул ≈ ~ 4 ^ 14 флуорохромы ≈ ~ 0,8 мкг флуорохромии; нанотело-AF680: 50 μг с 0,3 красителей / молекула ≈ ~ 5,6 ^ 14 флуорохромы ≈ ~ 1,1 мкг флуорохромы).
- Инициализация системы визуализации и обезболить мышей, чтобы осуществить с 3% изофлуран использованием XGI-8 анестезии системы в индукции камеры до визуализации. Поддержание 1-2% изофлуран для продолжительности процедуры визуализации с использованием изофлуран коллектор размещены в камере формирования изображения.
- Мышей позиция по нагретой этапе визуализации с опухолями, направленных на камеру. Контролировать правильность обезболивания, зажимая палец или хвост животного; любая реакция животного показывает, что анестезия слишком светлый.
- Мониторинг частоты дыхания; анестезия слишком светлое, если частота дыхания увеличивается, и слишком глубоко, если частота дыхания уменьшается, глубоко или нерегулярно. Защита роговицы животного с глазной мази, чтобы предотвратить сухость в то время как под наркозом.
- Выберите флуоресцентные наборы фильтрующих 615-665 нм для возбуждения, 695-770 нм для emissioп, и 580-610 нм возбуждения вычитание фона с размером пикселя матрицы 51 2x 512. Установить время экспозиции Авто, пикселей биннинга до среднего и F / Stop, чтобы 2.
ПРИМЕЧАНИЕ: Более короткое время экспозиции позволяют более быструю смену кадров; более длительное время экспозиции обеспечивают более высокую чувствительность. Биннинг контролирует размер пикселя на ПЗС-камеры. Увеличение биннинга увеличивает размер пикселя, чувствительность и частоту кадров, но снижает пространственное разрешение. F / Stop устанавливает размер камеры диафрагмы объектива. Размер отверстия определяет количество света, обнаруженного и глубину field.Note, что конфигурация может отличаться в зависимости от Imaging Device и экспериментальной установки. Обратитесь к руководству производителя для получения оптимальных результатов.- В программное обеспечение визуализации времени экспозиции оптимизации, F / стоп и пикселя на основе отбора по уровню экспрессии в клеточной линии. Измените эти настройки в любое время во время эксперимента, не влияя на количественный результат. Кроме того, чтобы программа Wizard изображений автоматически определитьпараметры.
- Мыши изображение перед инъекцией и 6 ч после инъекции антител конструкций.
ПРИМЕЧАНИЕ: маркировка эффективность может повлиять на требуемую дозу, необходимую для достижения оптимальных результатов визуализации. Поэтому количество требуемого антитела-конструкции для получения оптимальных результатов обработки изображений должно быть определено эмпирически. Это может варьироваться в зависимости от эффективности и маркировки размера конструкции, а также в модели опухоли и экспрессии целевого антигена.
3. Уборка урожая и подготовка опухолей
- Заполните ведро льда и поместите 4% параформальдегид (PFA) забуференный фосфатом физиологический раствор (PBS) / ингибитор протеазы (AEBSF) и PBS / 0,2% бычьего сывороточного альбумина (БСА) на льду.
- После того, как сеанс закончен изображений, увеличение концентрации изофлуран до 4%. После животное перестает дышать, удалить его из стадии визуализации и выполнять шейки дислокации.
- Гора мыши на пенопластовый блок и спрей с 70% этанола.
- Использование ножницс и щипцы, чтобы сократить внешнюю оболочку и вытащить его обратно осторожно, чтобы выставить опухоли. Удалить опухоли скальпелем, чтобы обеспечить опухолевой ткани остается неизменным.
- Cut опухоли в половине скальпелем. Поместите половину в пробирку с PBS / AEBSF для FACS анализ и другой половины в 50 мл пробирку с 4% PFA для иммуногистохимии.
- Подготовка для иммуногистохимии
- Хранить опухоли в 4% PFA в холодильнике при 4 ° С в течение 24 ч. Передача опухоли в пробирку с PBS / 30% сахарозы и держать в холодильнике при 4 ° С до тех пор, опухолевых опускается на дно пробирки.
- Вырезать опухоли в соответствующих заготовок для cryomolds. Положите опухоли в cryomolds и залейте октября соединения так, что опухоли покрыты.
- Положите формы на сухом льду и подождать, пока соединение не будет полностью заморожены. Трансфер замороженные опухоли до -80 ° C морозильник и хранить для иммуногистохимии.
- Резать замороженные опухоли в разделах 8 мкм с помощью микротома. Используйте стандартный immunohistoПротокол химия для окрашивания с антителами против CD31-AF488 визуализировать кровеносные сосуды и диамидино-фенилиндол (DAPI) для визуализации ядер.
Примечание: Опухолевые участки очень чувствительны к свету, как они уже содержат флуоресцентно меченые антитела. Сведите к минимуму воздействие на свет как можно больше.
- Подготовка к анализу FACS
- Поместите чашку Петри на льду и удалить поршень из 2,0 мл шприца. Поставьте опухоль в ячейки фильтра и сократить его нежно в 3-4 части, используя скальпель. Налейте начальное PBS в чашке Петри и использовать плоский конец плунжера пюре опухоли в клеточный фильтр.
- Промойте ячейки фильтра с начальным PBS промыть все клетки с 10 мл пипетки. Передача клеточной суспензии в новую пробирку и спина при 500 х г в течение 5 мин. Жидкость над осадком сливают и клетки вновь суспендируют в 10 мл PBS / 0,2% BSA. Граф клеток.
- Кратные 1-5 × 10 6 клеток лимфомы в 5 мл FACS трубы. Побочные клетки снова (500XG), отбросить супернатант и ресуспендируют в 100 мкл PBS / 0,2% BSA.
- Дополнительно, блок FcR с помощью анти-CD16 / CD32-мАт (FcgR3 / 2), который связывается с FcγR на льду в течение 10 мин. Промыть клетки один раз PBS / 0,2% BSA.
- Добавить анти-CD45-МАБ дискриминации лейкоцитов из других ячеек. Инкубировать в течение 20 мин на льду в темноте, с последующими двумя промывками ФБР / 0,2% БСА.
- Непосредственно перед FACS анализа пятна с пропидийиодидом в течение 15 мин на льду различить мертвые клетки, с последующими двумя промывками с обычной PBS. Ресуспендируют в 150 мкл для анализа FACS.
Примечание: На этапе 3.7.4 и 3.7.5 шаг других антител могут быть использованы в зависимости от субъекта опухоли.
4. FACS анализ
- Используйте серию шлюзами инструментов для ворот населения интерес в виде большого разброса, двойной дискриминации, исключения мертвых клеток, стробирования для CD45-положительных клеток, и стробирования для антиген-позитивных клеток.
- Во-первых, ворота из клетокмусор в прямом рассеяния (FSC-A) по сравнению с боковой разброс (SSC-А), используя участок двухпараметрическое. Дублеты Следующая Отбросить клеток. Наконец, ворота из не CD45-антиген-позитивными (CD45) и мертвых / умирая клетки (LD - Live / Dead-пятно).
- Образцы записей, используя тот же шаблон для всех экспериментов.
ПРИМЕЧАНИЕ: Обратитесь к протоколу производителя для технической консультации по применению оборудования и аналитической программного обеспечения.
5. микроскопического анализа
- Анализ окрашенных криосрезы опухоли с помощью конфокальной микроскопии с иммерсионным объектива (40X объективной). Используйте Он-Neon 633 нм лазерного возбуждения AF680, аргоновый лазер для AF488, и 405-диод DAPI.
- Процесс исходные данные изображения, используя программное обеспечение, совместимое с микроскопом. Выполните фона коррекцию и фильтрацию шумов, если это необходимо. Выполните дополнительные настройки изображения, такие как секционирования, обрезки, а также настройки яркости и контрастности.
- Наконец GEnerate одну составную накладываемого изображения со всех каналов обнаружения. Отрегулируйте яркость и контрастность отдельных слоев. Композитные изображения покажет локализации клеток (DAPI-пятно, синий), распределения меченых антител конструкций (AF680-пятно, красный) и кровеносных сосудов (AF488-пятно, зеленый).
6. При анализе естественных изображений
- Открытые файлы изображения в ПО для обработки изображений и создания наложенного изображения путем комбинирования данных изображение фотография с данными флуоресценции изображения. Оптимизация отображения изображения путем удаления ткани автофлуоресценции фоновый сигнал от конкретного флуоресцентного сигнала. Это может быть сделано путем вычитания изображения, полученного с фонового фильтра, установленного из изображения, полученного с помощью фильтра, установленного для конкретной метки.
- Нарисуйте одинаковой циркулярной регионов измерения интереса (ROI) вокруг антиген-положительный опухоли и антиген-отрицательной опухоли. Для определения интенсивности сигнала фон, место круглое ROIв области животного, где сигнал флуоресценции как ожидается, будет низкой (например, задняя нога).
- Используйте те же трансформирования для всех животных во всех временных точках. Для позиционирования используйте фотографические черно-белые изображения, чтобы определить краев опухоли.
- Отображение данных ROI в таблице измерений. Используйте средний радиант данные эффективности, что позволяет более количественное сравнение флуоресцентных сигналов для дальнейших статистических анализов.
- Дисплей и сравнивать данные как абсолютных интенсивностей сигналов или рассчитать соотношение сигнал-фон с использованием измеренных данных ROI от целенаправленных ткани и фоновой ткани. Рассчитать отношение опухоли к фону путем деления стоимости поглощения опухоли, фоновое значение определяется из задней конечности.
- В качестве контроля, анализа и антиген-негативных и антиген-положительных опухолей у тех же животных, а также животных, которым вводили меченых управления изотипа, чтобы оценить специфичность сигналов в живом организме.
Результаты
Флуоресцентно меченных зондов позволяют комбинации различных методов NIRF-томография (рис 1А). Мы стремились выполнять в естественных условиях NIRF-Imaging, проточной цитометрии и флуоресцентной микроскопии последовательно, чтобы сравнить флуоресцентно меченных нанотела и моноклональные антитела для конкретных в естественных изображений (рис 1б).
Мышам вводили 50 мкг нанотела и моноклонального антитела, чтобы оценить специфичность флуоресцентно меченных конструкций для визуализации в естественных условиях. Результаты показали специфическую маркировку антиген-положительных опухолей как с нанотела и моноклонального антитела через 6 ч после инъекции (рисунок 2). ROI анализ антиген-позитивных опухолей показали гораздо более высокий коэффициент T / В ~ 12 для нанотелу по сравнению с ~ 6 для моноклональных антител. Кроме того, нанотела не показали неспецифический сигнал в антиген-негативных опухолей, в то время какмоноклональное антитело показало неспецифические смешанные сигналы в антиген-негативных опухолей.
Кроме того, неспецифического сигнала отрицательных опухолей, моноклональное антитело также индуцирует неспецифические фоновые сигналы во всей животного. Это, вероятно, из-за чрезмерного бесплатно циркулирующих антител, которые слишком велики, чтобы быть почками. Напротив, животные, которым вводили нанотел показали неспецифические сигналы только в почках из-за почечной ликвидации малых нанотел.
Проточная цитометрия анализ опухолевых клеточных суспензий показали специфическую маркировку антиген-положительных опухолевых клеток как с AF680-конъюгаты 6 ч после инъекции. Чем сильнее сигнал флуоресценции нанотела меченых клеток по сравнению с моноклональное антитело меченых клеток отражает в естественных условиях результаты NIRF-изображений. Важно отметить, что анализ проточной цитометрии показали, что нет неспецифическое мечение антиген-негативных клетках с любой из двухконструкции (рис 3).
Люминесцентной микроскопии опухолевых криосрезах показали сильную и почти однородную маркировку антиген-положительных клеток с нанотела 6 ч после инъекции. Наоборот, моноклональное антитело показали гораздо слабее и довольно неоднородное окрашивание (фиг.4а). Антиген-отрицательные опухоли не показывают окрашивание 6 ч после инъекции нанотела, тогда как антиген-отрицательной опухоли вводили с обычной неспецифической антитела показывают, рассеянного окрашивания в интерстициальное пространство (фиг.4В).
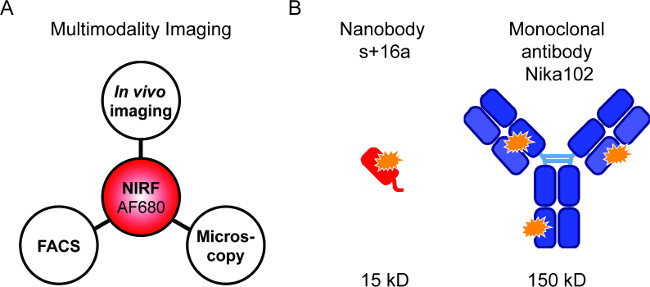
Рисунок 1: визуализация Flourescence и антител конструкции. () Настройки изображений для оценки AF680-конъюгатов: IN VIVO NIRF-изображений с последующим проточной цитометрии и флуоресцентной микроскопии. (В ) Схема AlexaFluor680 помечены + 16a нано- сек (красный) и моноклональные антитела Nika102 (синий). Оранжевые звезды указывают на флуорохромии AlexaFluor680.
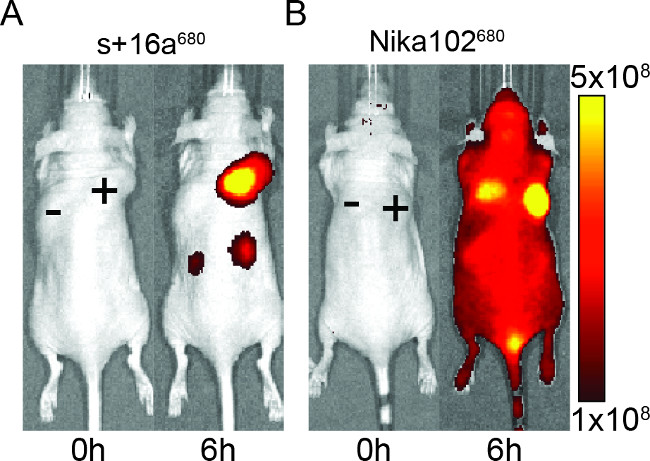
На рисунке 2: В естественных NIRF-изображений Изображения флуоресценции сигнала антиген-положительной (+) и антиген-отрицательной (-) опухоли у мышей, которые были введены с + 16а нанотела S (A) и моноклонального антитела Nika102 (B). . В естественных изображений была выполнена до (0 ч) и 6 ч после инъекции. Интенсивности сигналов отображаются в виде лучистой эффективности (P / сек / см 2 / Sr) / (мкВт / см 2).
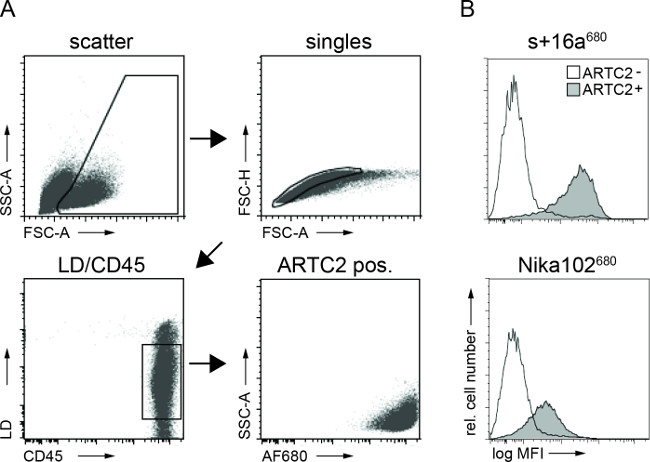
Рисунок 3:Экс естественных FACS-анализ клеточных связанное антитело конструкций из опухолевых клеток суспензии. (A) Память стратегия FACS анализ опухолевых клеток. (B) Гистограммы отображения суммы внутривенно AF680-сопряженных нано- S + 16a и антител Nika102 специфически связывается с опухолевыми клетками в естественных условиях. Антиген-отрицательные опухоли отображаются в виде гистограмм и незаполненных антиген-положительных опухолей показаны в заполненных гистограмм.
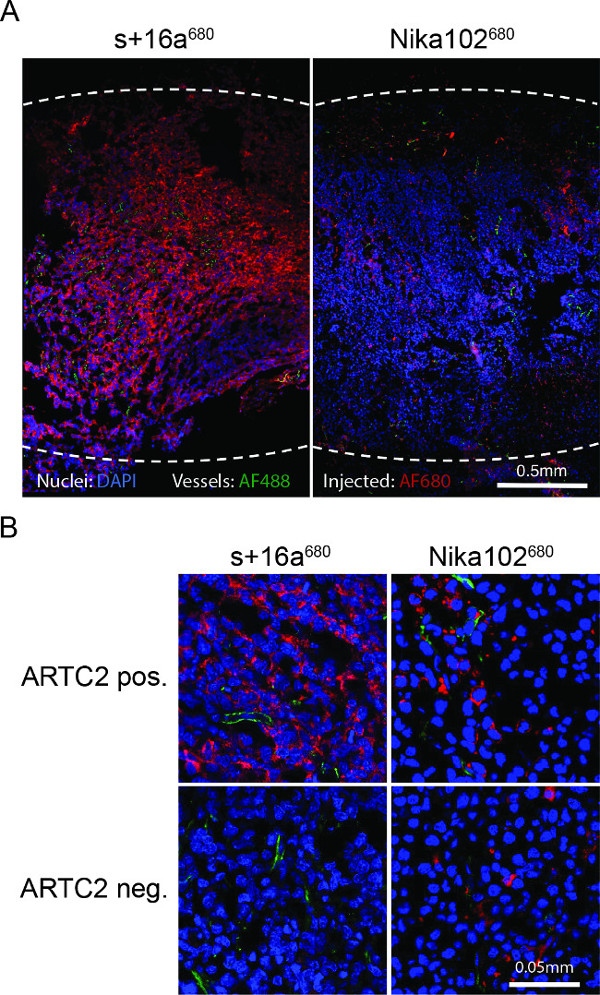
Рисунок 4:. Экс естественных флуоресцентной микроскопии () Обзор флуоресцентной микроскопии целых антиген-положительных опухолевых криосрезов 6 ч после инъекции с + 16a 680 или Nika102 680. Сигнальные интенсивности в естественных условиях внутривенно вподверженном AF680-конъюгаты без каких-либо вторичной маркировки агентов отображаются красным цветом. Экс Vivo контрастно ядра отображаются синим цветом, а судов в зеленый цвет. Пунктирные линии показывают по внешним границам целых опухолей. (B) Крупный план флуоресцентной микроскопии антиген-положительных и антиген-негативных опухолей.
Обсуждение
Мы использовали в ближнем инфракрасном диапазоне меченный флюорофором нанотела и обычные моноклональные антитела, направленные против той же цели на клетках лимфомы для смешанных сравнения в естественных условиях, и экс виво анализ. Мы показали, что нанотела хорошо подходят в качестве диагностических средств для оперативного и конкретного обнаружения в естественных условиях лимфом.
В естественных условиях, S + 16a 680 позволило быстро и более конкретную обнаружение ARTC2-положительных ксенотрансплантатах. Помимо различной кинетикой для лучшей визуализации опухоли в живом организме, основным недостатком Nika102 680 был высокий сигнал от неспецифического ARTC2-отрицательных опухолей и неспецифических фоновых сигналов.
Экс естественных проточной цитометрии анализа дисперсных клеток из отсеченных опухолей не показали неспецифическое связывание с ARTC2-отрицательных клетках лимфомы инъекционных AF680-конъюгатов. Экс естественных флуоресценции показал, сильным и почти homogenПодразделения окрашивание клеток в ART2C-положительных опухолевых срезах в случае + 16a нано- сек, подтверждая, что нанотело удалось достичь даже отдаленные районы внутри опухоли после 6 ч. В отличие от этого, моноклональное антитело показали слабую и неоднородную окрашивание клеток в ARTC2-положительных опухолей после 6 ч. Лучшие результаты визуализации с обычным антителом может быть достигнуто после 24 ч или 48 ч (данные не показаны). Для того чтобы выполнить тщательное сравнение двух различных размеров конструкций, изображения в различные моменты времени (последовательно-томография) должна быть выполнена, чтобы определить оптимальный момент времени формирования изображения для каждой конструкции.
Как и в других предыдущих исследованиях, результаты, представленные здесь подчеркнуть, что в естественных условиях молекулярной визуализации с мечеными нанотел позволяет быстро и специфическую тот же день Опухоль изображений с высоким опухоли к фону отношений 12-15,17-19. Напротив, обычные антитела привести к снижению опухоли к фону отношений и неспецифических сигналов от противопехотныхGen-негативные опухоли в ранние сроки после инъекции из-за их медленным выведением из организма. Для того, чтобы получить оптимальные результаты работы с изображениями обычных антител, время визуализации указывает 24 ч или даже 48 ч после инъекции, как правило, необходимо. Эти данные согласуются с предыдущими исследованиями, которые показали, что обычные антитела с доказанным терапевтическим эффектом обладают ограниченными применение в молекулярной визуализации 17,19,26. Поэтому обычные антитела могут быть весьма подходит для использования в терапевтических целях в связи с их долгой полувыведения из плазмы, а нанотела довольно пригодны для целей визуализации из-за их быстрого выведения из обращения. Эти различия в связи с тем, что любой избыток небольших нанотел (15-17 кДа) быстро выводится через почки ликвидации, а избыток больших обычных антител (150 кДа) удерживается в обращении. Таким образом, основным преимуществом нанотел для молекулярной визуализации является низкая фоновый сигнал на ранних временных точек изображения regardlESS от введенной дозы. Это дает возможность получить изображение в тот же день и может быть переводимым в клинических условиях. Напротив, обычные антитела должны быть точно титровать, чтобы минимизировать неспецифические фоновые сигналы, при сохранении достаточно специфический сигнал от ткани-мишени (неопубликованные данные).
Одним из ограничений в естественных техники NIRF-изображений является низкая глубина проникновения, которые, как правило допускает только визуализацию подкожного, но не ортотопической модели опухоли. Однако это ограничение можно преодолеть в экспериментальных условиях на недавно разработанных томографических фотоакустическая методов, которые позволяют всего тела визуализации живых мышей 27. Другим ограничением методики NIRF-изображений является оценка дозы ткани по сравнению с радионуклидов-опосредованной визуализации. Тем не менее, нанотела может быть радиоактивным изотопом для позитронно-эмиссионной томографии (ПЭТ) моделей ксенотрансплантатов и точной количественной оценкиTracer биораспределение. В самом деле, наши результаты NIRF-изображений в соответствии с недавнего исследования, что по сравнению нанотела и обычные антитела для ПЭТ. Авторы также пришли к выводу, что нанотела позволит в тот же день изображений с высоким опухоли к фону отношений 15.
Тем не менее, только маркировка конструкций антител с AF680 флуоресцентным красителем ближней инфракрасной области позволили нам всеобъемлющий в пробирке, в естественных условиях и экс естественных условиях ближней ИК-области сравнение изображений флуоресценции с помощью проточной цитометрии, флуоресцентная микроскопия, и NIRF-изображений. По этой причине, а потому, что это нерадиоактивное, очень чувствительна, недорогой, и использует сравнительно простой в производить целевые зонды, мы выступаем за использование метода NIRF-изображения для оценки новых антител конструкций в доклинической молекулярной визуализации.
Раскрытие информации
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Благодарности
Эта работа была поддержана аспирантуру 'воспаление и регенерации "Совместного исследовательского центра 841 Немецкого исследовательского общества (Александр Ленц, Валентин Kunick, Уильям Fumey), Совместным научно-исследовательским центром 877 Немецкого исследовательского общества (Friedrich Koch-Nolte) , по Вернером Отто Фонда (Peter Bannas), по В. Сандер фонда (Питер Bannas Фридрих Кох-Nolte), а также Немецкого исследовательского (Martin TREPEL, Фридрих Haag и Фридриха Koch-Nolte). Мы благодарим университет онкологический центр Гамбург (UCCH) В Vivo оптических изображений основной комплекс и сотрудников в УКЭ для консультаций и их высокое качество обслуживания. Основной комплекс частично поддержана грантами от Deutsche Krebshilfe (немецкий помощи Рак).
Материалы
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Ссылки
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены