Method Article
Validazione di Nanobody e anticorpi Based
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Abstract
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introduzione
Nella presente relazione, si descrive l'implementazione del vicino infrarosso fluoroforo sonde marcate per la convalida di vivo esperimenti di imaging xenotrapianto in utilizzando ex vivo citometria a flusso e la microscopia a fluorescenza dei tumori xenotrapianto sezionati. Confrontiamo un singolo nanobody domini (s + 16a, 17 kDa) 1 ed un anticorpo monoclonale (Nika102, 150 kDa) 2,3 indirizzate allo stesso antigene bersaglio per specifici in vivo vicino infrarosso fluorescenza in un modello linfoma xenotrapianto. L'antigene bersaglio ADP-ribosyltransferase ARTC2.2 è espresso come GPI-ancorata superficie cellulare ecto-enzima dalle cellule del linfoma 4-9.
Nanobodies derivati da camelid heavy-catena-only anticorpi sono le più piccole antigene vincolante frammenti disponibili 10,11. Con soli ~ 15 kDa, questi piccoli frammenti di anticorpi sono solubili, molto stabile e sono per via renale cancellati dalla circolazione 8,10. Tueste proprietà li rendono particolarmente adatti per specifica e efficacemente mirati antigeni tumorali in vivo 12-20. Obiettivi comuni di antigene nanobodies disponibili sono il recettore del fattore di crescita epidermico (EGFR1 o HER-1), fattore di crescita epidermico umano di tipo 2 (HER-2 o CD340), l'antigene carcinoembrionario (CEA) e l'adesione delle cellule vascolari molecola-1 (VCAM-1 ) 21. Coniugati nanobody sono strumenti promettenti per l'immunoterapia del cancro e il trattamento delle malattie infiammatorie 22.
Recenti studi hanno dimostrato che nanobodies consentono maggiore tumorale-a-background (T / B) -ratios di anticorpi convenzionali nelle applicazioni di imaging molecolare in vivo 8,17,19. Questo si spiega principalmente con la penetrazione relativamente povero e lento del tessuto di anticorpi convenzionali, lenta clearance dalla circolazione, e la conservazione a lungo nei tessuti non mirati 23. Inoltre, l'eccesso di anticorpi convenzionali porta a non specifico i accumulon bersaglio tumori antigene-negativi causati dalla permeabilità potenziata e ritenzione (EPR) Effetto 24,25. Ciò significa che dosi elevate di anticorpi convenzionali possono aumentare non solo segnali specifici, ma anche segnali aspecifici, riducendo così il rapporto massimo ottenibile tumorale-a-background. Al contrario, aumentando la dose di nanobodies aumenta i segnali di tumori antigene-positiva, ma non di tessuto normale o tumori antigene-negativi (dati non pubblicati).
Oltre il confronto delle nanobodies e anticorpi convenzionali, descriviamo una valutazione intraindividuale di xenotrapianti antigene-positivi che quelli negativi nella stessa topi per confronto diretto dei segnali specifici e non specifici per effetto EPR. Le sonde coniugati fluoroforo vicino infrarosso ci hanno permesso di sfruttare una singola sonda in vivo e ex vivo con vicino infrarosso imaging di fluorescenza, citometria a flusso, e microscopia a fluorescenza. Applicando i nostri protocolli permette di nonottimizzazione radioattive, altamente sensibile, e poco costoso di vivo esperimenti di imaging molecolare in come la valutazione di nuovi costrutti anticorpali per tumore specifico di targeting.
Lo scopo di questo studio esercitazione è quello di evidenziare l'uso di NIRF imaging per la valutazione di nuovi costrutti anticorpali in imaging molecolare preclinico.
In questo protocollo, tutti gli esperimenti sono stati effettuati con un sistema NIRF-Imaging piccoli animali, una fluorescenza attivato cell sorter (FACS) citofluorimetro, e un microscopio confocale.
Protocollo
NOTA: Gli esperimenti sono stati eseguiti in conformità con le linee guida internazionali per l'uso etico degli animali e sono stati approvati dalla commissione benessere degli animali locale della University Medical Center, Amburgo.
1. Preparazione delle cellule tumorali, topi e anticorpi costrutti
- Preparazione di cellule di linfoma e la suddivisione in aliquote di Basement Matrix (Matrigel).
- Il giorno prima iniezione di cellule tumorali ha messo una scatola sterilizzato punta (1.000 suggerimenti microlitri) e la pipetta appropriata -20 ° C freezer.
- Scongelare il flacone con la matrice interrato sul ghiaccio nel 4 ° C frigo O / N.
- Il giorno di iniezione riempire un secchio di ghiaccio e posizionare la matrice seminterrato con pipetta, punte, e 1 ml siringhe con 30 aghi G su ghiaccio.
- Cellule di linfoma Aliquota in un volume di 100 ml di RPMI medie provette da 1,5 ml microcentrifuga e mescolare accuratamente con 100 ml di matrice seminterrato. Elaborare in pre-raffreddamentosiringhe e mettere in ghiaccio fino iniezione.
NOTA: Utilizzare buona tecnica sterile e per lavorare sul ghiaccio tutto il tempo per evitare l'intasamento della matrice seminterrato.
- Mice Preparazione
- Utilizzare 8-10 settimana vecchio atimici topi nudi (NMRI- Foxn1 n u).
- Per ridurre autofluorescenza dell'intestino mantenere topi su una dieta priva di erba medica per 1 settimana prima di imaging in vivo.
- Per l'iniezione di linfoma cellule anestetizzare topi di effettuare con il 2% isoflurano in una camera di induzione. Mantenere 1-2% isoflurano per la durata della procedura usando un collettore di isofluorano.
- Iniettare cellule di linfoma per via sottocutanea nei fianchi spalla. Per confronto diretto intraindividuale iniettare cellule antigene-positivi e antigene-negativi sul lato destro e sinistro, rispettivamente.
- Utilizzare il pollice e l'indice per pizzicare la pelle del mouse e staccarlo dal corpo del mouse. Iniettare lentamente e in modo uniforme inil sacchetto creato dalle dita, creando un singolo gruppo di cellule sotto la pelle. La matrice seminterrato aiuta a mantenere le cellule iniettate in luogo.
- Preparazione di anticorpi costrutti
- Etichetta anticorpi monoclonali e nanobodies dominio singolo con un kit di etichettatura proteine disponibili in commercio per il colorante fluorescente AlexaFluor-680 (AF680) (lunghezza d'onda di eccitazione = 679 nm, emissione d'onda = 702 nm), secondo le istruzioni del produttore. Calcolare il numero di coloranti per nanobody e anticorpi convenzionali che utilizzano coefficienti di estinzione molare di 15.720 mol -1 cm -1 e 203.000 mol -1 cm -1, rispettivamente. Valutare la purezza di costrutti anticorpali mediante SDS-PAGE dimensioni frazionamento e Coomassie brillante macchia blu.
- Assicurare la specificità dei coniugati marcati conducendo una serie di esperimenti in vitro prima degli studi reali di imaging. Testare la specificità di un marcatotibody costruisce in vitro attraverso studi di blocco e isotipo aspecifica controlla 8,20.
NOTA: In fase 1.2.4 il numero di cellule di cellule antigene-negativi e antigene-positivi (o di diverse linee di cellule) può essere adattato in base alle dinamiche di crescita. Per questi esperimenti, cellule positive 0,5x10 6 DC27.10 ARTC2 negativo e 1,5x10 6 DC27.10 ARTC2 sono stati utilizzati per ottenere i tumori di dimensioni simili. In fase 1.3.1 il processo di etichettatura e di etichettatura efficacia di sonde di anticorpi con fluorofori può differire dal kit etichettatura utilizzata.
2. In Vivo Imaging
- Dopo 7-9 giorni, quando i tumori raggiungono ~ 8 mm di diametro, iniettare 50 mg di AlexaFluor680 etichettati costrutti anticorpali in un volume di 200 microlitri di soluzione salina per via endovenosa nella vena della coda del topo (mAb-AF680: 50 mg con 2 coloranti / molecola ≈ ~ 4 ^ 14 fluorocromi ≈ ~ 0,8 mcg fluorocromi; Nanobody-AF680: 50 μg con 0,3 coloranti / molecola ≈ ~ 5.6 ^ 14 fluorocromi ≈ ~ 1.1 mg fluorocromi).
- Inizializzare il sistema di imaging e anestetizzare topi di effettuare con 3% isoflurano utilizzando un sistema di anestesia XGI-8 nella camera di induzione prima imaging. Mantenere 1-2% isoflurano per la durata della procedura di imaging utilizzando il collettore isoflurano alloggiata nella camera di imaging.
- Posizione topi sul palco di imaging riscaldata con tumori diretti verso la macchina fotografica. Monitorare la corretta anestesia pizzicando la punta o la coda dell'animale; qualsiasi reazione dell'animale indica che l'anestesia è troppo leggero.
- Monitorare il tasso di respirazione; l'anestesia è troppo chiara, se il tasso di respirazione aumenta e troppo in profondità, se il tasso di respirazione è diminuita, profonda o irregolare. Proteggere cornee di animali con un unguento occhio per prevenire la secchezza mentre sotto anestesia.
- Scegli set di filtri fluorescenti di 615-665 nm per l'eccitazione, 695-770 nm per emission, e 580-610 nm di eccitazione per sottrazione dello sfondo, con una dimensione di 51 2x 512 matrice di pixel. Impostare il tempo di esposizione per l'auto, pixel binning medio e F / Stop per 2.
NOTA: i tempi di esposizione più brevi consentono frame rate più veloci; tempi di esposizione più lunghi garantiscono una maggiore sensibilità. Binning controlla la dimensione dei pixel della fotocamera CCD. Aumentando il binning aumenta la dimensione dei pixel, la sensibilità, e frame rate, ma riduce la risoluzione spaziale. F / Stop imposta la dimensione dell'apertura della lente della fotocamera. La dimensione di apertura controlla la quantità di luce rilevata e la profondità di field.Note che le impostazioni possono differire a seconda del dispositivo e sperimentale set up di imaging. Consultare il manuale del produttore per ottenere risultati ottimali.- Nel software di imaging tempo di esposizione ottimizzare, F / arresto e pixel binning basano sul livello di espressione della linea cellulare. Modificare queste impostazioni in qualsiasi momento durante un esperimento senza impattare il risultato quantitativo. In alternativa, lasciare che il software di imaging Wizard determinare automaticamentei parametri.
- Topi immagine prima iniezione e 6 ore dopo l'iniezione di costrutti anticorpali.
NOTA: L'efficacia etichettatura può influenzare la dose richiesta necessaria per ottenere risultati ottimali di imaging. Pertanto, la quantità di richieste anticorpi costrutto per ottenere risultati ottimali di imaging deve essere determinato empiricamente. Essa può variare a seconda efficacia etichettatura e dimensioni del costrutto nonché il modello di tumore e l'espressione target-antigene.
3. Raccolta e preparazione dei Tumori
- Riempire un secchio di ghiaccio e mettere 4%, paraformaldeide (PFA) tampone fosfato salino (PBS) / inibitore della proteasi (AEBSF) e PBS / 0,2% di albumina sierica bovina (BSA) sul ghiaccio.
- Una volta che la sessione di imaging è terminata, aumentare la concentrazione di isoflurano al 4%. Dopo animale cessa la respirazione, rimuoverlo dalla fase di imaging ed eseguire dislocazione cervicale.
- Montare il mouse su un blocco di polistirolo e spruzzare con il 70% di etanolo.
- Usa forbices e pinze per tagliare la pelle esterna e tirare di nuovo con attenzione per esporre i tumori. Rimuovere i tumori con bisturi per garantire tessuto tumorale rimane intatto.
- Tumori tagliato a metà con un bisturi. Inserire una metà in un tubo di raccolta con PBS / AEBSF per FACS analisi e l'altra metà in un tubo da 50 ml con 4% PFA per immunoistochimica.
- Preparazione per immunoistochimica
- Mantenere tumori in 4% PFA in frigorifero a 4 ° C per 24 ore. Trasferire tumori ad un tubo con PBS / 30% di saccarosio e conservare in frigorifero a 4 ° C fino a quando i lavelli tumorali al fondo della provetta.
- Tagliare i tumori in pezzi adeguati per le cryomolds. Mettete i tumori in cryomolds e riempire con il composto ottobre in modo che i tumori sono coperti.
- Mettere gli stampi in ghiaccio secco e attendere fino a quando il composto è completamente ghiacciato. Trasferimento tumori congelati a -80 ° C freezer e conservare per immunoistochimica.
- Cut tumori congelato in sezioni di 8 micron con un microtomo. Utilizzare standard di immunoistochimicaprotocollo chimica alla macchia con l'anticorpo contro CD31-AF488 di visualizzare i vasi sanguigni e diamidino-fenilindolo (DAPI) per visualizzare nuclei.
NOTA: le sezioni tumorali sono molto sensibili alla luce in quanto già contengono anticorpi fluorescente. Minimizzare l'esposizione alla luce il più possibile.
- Preparazione per l'analisi FACS
- Inserire capsula di Petri su ghiaccio e rimuovere lo stantuffo di una siringa da 2,0 ml. Mettere il tumore del filtro cellulare e tagliata delicatamente in 3-4 pezzi con un bisturi. Versare l'iniziale PBS nella capsula di Petri e utilizzare l'estremità piatta del pistone per schiacciare il tumore all'interno del filtro delle cellule.
- Lavare il filtro cella con l'iniziale PBS a lavare tutte le cellule con una pipetta 10 ml. Trasferimento sospensione cellulare in una nuova provetta e centrifugare a 500 xg per 5 min. Eliminare il surnatante e risospendere le cellule in 10 ml di PBS / 0,2% di BSA. Contare le celle.
- Aliquota 1-5 x 10 6 cellule di linfoma in una provetta 5 ml FACS. Di nuovo le cellule Spin (500xg), scartare il surnatante e risospendere in 100 l PBS / 0,2% BSA.
- Facoltativamente, blocco FcR usando un anti-CD16 / CD32-mAb (FcgR3 / 2) che si lega al FcγR in ghiaccio per 10 min. Lavare le cellule una volta con PBS / 0,2% BSA.
- Aggiungi anti-CD45-mAb a discriminare i leucociti da altre cellule. Incubare per 20 min in ghiaccio al buio, seguito da due lavaggi con PBS / BSA 0,2%.
- Poco prima macchia analisi FACS con ioduro di propidio per 15 min in ghiaccio per discernere le cellule morte, seguito da due lavaggi con PBS pianura. Risospendere in 150 ml per l'analisi FACS.
NOTA: In fase 3.7.4 e 3.7.5 passo altri anticorpi possono essere utilizzati a seconda dell'entità del tumore.
4. Analisi FACS
- Utilizzare una serie di strumenti di gating per porta la popolazione di interesse in forma di grande dispersione, la discriminazione doppietto, l'esclusione di cellule morte, gating per le cellule CD45 positive, e gating per le cellule antigene positive.
- Dapprima, porta fuori celluledetriti in un forward scatter (FSC-A) rispetto side scatter (SSC-A) con una trama a due parametri. Doppiette cella successiva scartare. Infine, porta fuori non CD45-antigene-positivi (CD45) e morti / morire le cellule (LD - live / dead-macchia).
- Campioni registrare usando lo stesso modello per tutti gli esperimenti.
NOTA: fare riferimento al protocollo del produttore per un parere tecnico per quanto riguarda l'uso di hardware e software analitico.
5. Analisi microscopica
- Analizzare criosezioni tumorali colorate utilizzando un microscopio confocale con una lente immersione in olio (obiettivo 40X). Utilizzare un He-Neon 633 nm laser eccitazione AF680, un laser ad argon per AF488, e un 405-diodo per DAPI.
- Elaborare i dati di immagine raw tramite un software compatibile con il microscopio. Eseguire background-correzione e filtrare, se necessario, il rumore. Eseguire regolazioni dell'immagine aggiuntivi come sezionamento, ritaglio e di luminosità e contrasto adeguamenti.
- Infine generate un'unica immagine composita sovrapposizione da tutti i canali di rilevamento. Regolare la luminosità e il contrasto dei singoli strati. Le immagini composite mostreranno localizzazione delle cellule (DAPI-macchia, blu), la distribuzione di costrutti anticorpo marcato (AF680-macchia, rosso) e vasi sanguigni (AF488-macchia, verde).
6. In Analysis Vivo Imaging
- Aprire i file di immagine nel software di imaging e creano un'immagine sovrapposizione combinando dati di immagine fotografia con dati di immagine di fluorescenza. Ottimizzare la visualizzazione delle immagini, eliminando segnale di fondo autofluorescenza tessuto dal segnale fluorescente specifico. Questo può essere fatto sottraendo l'immagine acquisita con un filtro sfondo impostato dal immagine acquisita con il filtro specifico per impostare il tracciante.
- Disegnare identici regioni misurazione circolari di interesse (ROI) attorno al tumore antigene positivo e il tumore antigene-negativi. Per determinare sfondo intensità del segnale, posizionare una ROI circolarein un'area dell'animale dove dovrebbe essere bassa segnale di fluorescenza (ad esempio, hind gamba).
- Utilizzare gli stessi ROI per tutti gli animali in tutti i tempi. Per il posizionamento, utilizzare le immagini in bianco e nero fotografico per identificare margini del tumore.
- Visualizzare dati ROI in una tabella di misura. Utilizzare i dati media efficienza radiante, che permette un confronto più quantitativa di segnali fluorescenti per ulteriori analisi statistiche.
- Display e confrontare i dati, come intensità di segnale assoluti o calcolare il rapporto segnale-background utilizzando i dati ROI misurati dal tessuto mirato e il tessuto di fondo. Calcolare il rapporto tumorale-a-background dividendo il valore di assorbimento del tumore dal valore di fondo determinata dal dell'arto posteriore.
- Come controllo, analizzare anche i tumori antigene-negativi e antigene-positivi negli stessi animali e gli animali iniettati con controlli isotipici etichettati per valutare la specificità dei segnali in vivo.
Risultati
Sonde fluorescente consentono la combinazione di diverse tecniche NIRF-imaging (Figura 1A). Abbiamo puntato a fare in vivo NIRF imaging, citometria a flusso, e microscopia a fluorescenza in sequenza in modo da confrontare nanobodies fluorescente e anticorpi monoclonali per specifici imaging in vivo (Figura 1B).
I topi sono stati iniettati con 50 mg di nanobody e anticorpo monoclonale per valutare la specificità dei costrutti fluorescente per l'imaging in vivo. I risultati hanno mostrato etichettatura specifica dei tumori antigene-positivi sia con nanobody e anticorpo monoclonale a 6 ore dopo l'iniezione (Figura 2). ROI analisi dei tumori antigene-positiva ha mostrato una molto più alto rapporto T / B di ~ 12 per l'nanobody rispetto a ~ 6 per l'anticorpo monoclonale. Inoltre, il nanobody mostrato alcun segnale aspecifico nei tumori antigene-negativi, mentre laanticorpo monoclonale ha mostrato segnali confondenti non specifici nei tumori antigene-negativi.
Oltre al segnale aspecifico dei tumori negativi, l'anticorpo monoclonale indotto anche segnali di fondo non specifici nell'intera animali. Ciò è probabilmente dovuto ad eccessivi anticorpi liberi circolanti, che sono troppo grandi per essere escreto per via renale. Al contrario, gli animali iniettati con nanobodies hanno mostrato segnali non specifici solo nei reni a causa della eliminazione renale dei piccoli nanobodies.
Citometria a flusso analisi di sospensioni cellulari tumorali ha mostrato etichettatura specifica delle cellule tumorali antigene-positivi sia con AF680-coniugati 6 ore dopo l'iniezione. Il segnale di fluorescenza più forte delle cellule nanobody marcato rispetto alle cellule anticorpo marcato monoclonali riflette i risultati NIRF imaging in vivo. È importante sottolineare che le analisi di citometria a flusso rivelano che non c'è etichettatura non specifica delle cellule antigene-negativa con uno dei duecostrutti (Figura 3).
Microscopia a fluorescenza di criosezioni tumorali ha mostrato una etichettatura forte e quasi omogeneo di cellule antigene-positivi con il nanobody 6 ore dopo l'iniezione. Al contrario, l'anticorpo monoclonale ha mostrato una colorazione molto più debole e piuttosto disomogeneo (Figura 4A). Tumori antigene-negativi non mostrano colorazione 6 ore dopo l'iniezione del nanobody, mentre i tumori antigene-negativi iniettato convenzionale anticorpo mostra aspecifica dispersi nello spazio interstiziale (Figura 4B).
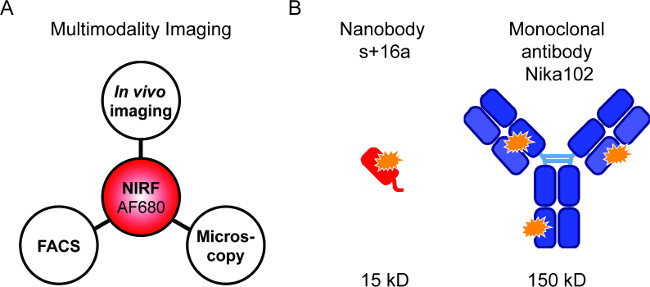
Figura 1: immagini Flourescence e costrutti anticorpali. (A) installazione Imaging per la valutazione di AF680-coniugati: In vivo NIRF imaging seguita mediante citometria di flusso e microscopia a fluorescenza. (B ) Schema di AlexaFluor680 etichettato nanobody s + 16 bis (rosso) e anticorpo monoclonale Nika102 (blu). Arancione stelle indicano i fluorocromi AlexaFluor680.
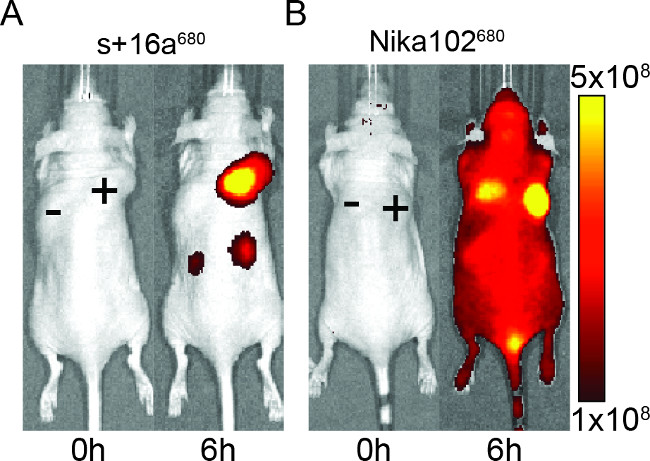
Figura 2: In vivo NIRF imaging Immagini del segnale di fluorescenza di antigene-positiva (+) e l'antigene-negativa (-) tumori nei topi che sono stati iniettati con nanobody s + 16a (A) e l'anticorpo monoclonale Nika102 (B). . Imaging in vivo è stata eseguita prima (0 h) e 6 ore dopo l'iniezione. Intensità di segnale sono visualizzati come efficienza radiante (p / sec / cm 2 / sr) / (W / cm 2).
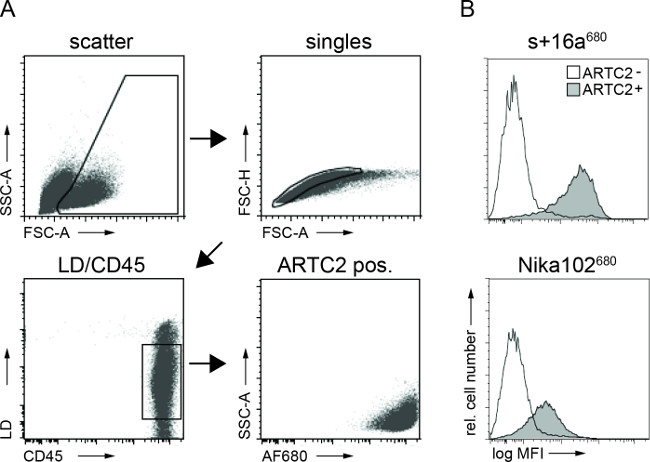
Figura 3:Ex vivo FACS analisi di cellula legata costrutti anticorpali da sospensioni di cellule tumorali. (A) strategia di gating per FACS analisi delle cellule tumorali. (B) istogrammi mostrano la quantità della nanobody AF680 coniugato iniettata per via endovenosa s + 16a e anticorpo Nika102 specificamente legata alle cellule tumorali in vivo. Tumori antigene-negativi vengono visualizzati come istogrammi vacanti e tumori antigene-positivi sono visualizzati come istogrammi pieni.
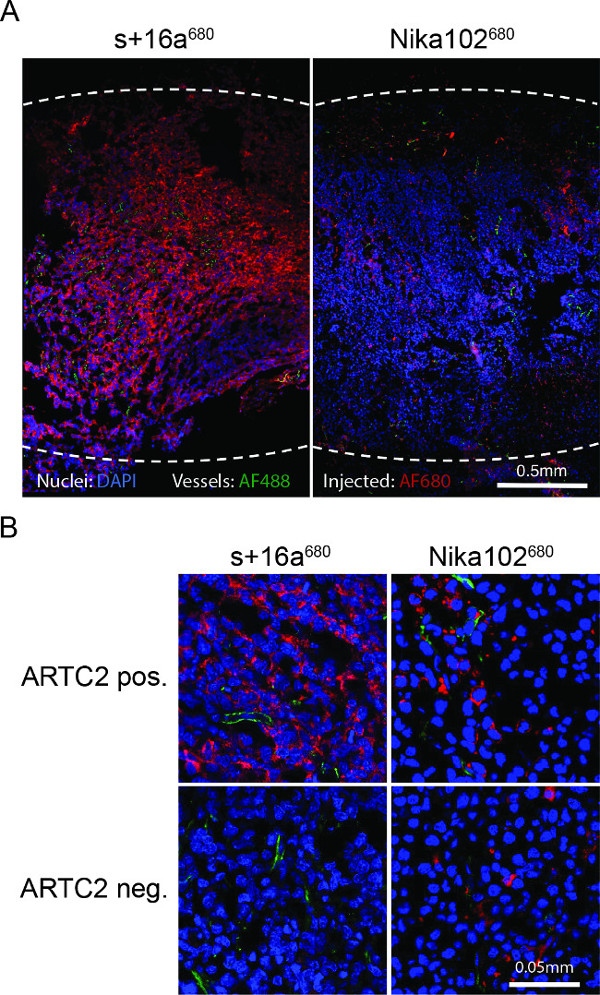
Figura 4:. Ex vivo microscopia a fluorescenza (A) Panoramica microscopia a fluorescenza di intere criosezioni tumore antigene-positivi 6 ore dopo l'iniezione di s + 16a 680 o Nika102 680. Intensità di segnale del in vivo per via endovenosa inproiettata AF680-coniugati senza agenti secondario etichettatura sono visualizzate in rosso. Ex vivo nuclei controcolorate vengono visualizzati in blu e vasi in verde. Le linee tratteggiate indicano margini esterni di tutto il tumore. (B) Primo piano microscopia a fluorescenza di tumori antigene-positivi e antigene-negativi.
Discussione
Abbiamo usato vicino infrarosso fluoroforo nanobodies etichettati e anticorpi monoclonali convenzionali diretti contro lo stesso bersaglio in cellule di linfoma per un confronto multimodale di in vivo e ex vivo analisi. Abbiamo dimostrato che nanobodies sono adatti come strumenti diagnostici per un rapido e specifico il rilevamento in vivo di linfomi.
In vivo, s + 16a 680 ammessi un rilevamento veloce e più preciso di xenotrapianti ARTC2-positivo. Oltre alle diverse cinetiche per un'ottima visualizzazione del tumore in vivo, il grave inconveniente di Nika102 680 è stato il segnale alto aspecifico da tumori ARTC2-negativi e segnali di fondo non specifici.
Ex vivo citometria a flusso analisi di cellule disperse da tumori sezionati non hanno mostrato il legame non specifico di cellule del linfoma ARTC2 negativi di iniettate AF680-coniugati. Ex vivo fluorescenza rivelato forte e quasi homogencolorazione UO di cellule nelle sezioni tumorali ART2C-positivo in caso di nanobody s + 16a, confermando che il nanobody era in grado di raggiungere le zone ancora isolate all'interno del tumore dopo 6 h. Al contrario, l'anticorpo monoclonale mostrava colorazione debole e disomogenea delle cellule nei tumori ARTC2-positive dopo 6 ore. Risultati di imaging migliori con l'anticorpo convenzionale può essere raggiunto dopo 24 ore o 48 ore (dati non riportati). Per eseguire un confronto approfondito di due costrutti di dimensioni diverse, imaging a tempi diversi (seriale-Imaging) deve essere eseguita per identificare il punto di tempo di imaging ottimale per ciascun costrutto.
Come altri studi precedenti, i risultati qui riportati sottolineano che in vivo imaging molecolare con nanobodies etichettati consente un rapido e specifico in giornata immagine del tumore con rapporti 12-15,17-19 alta tumore-to-sfondo. Al contrario, gli anticorpi convenzionali producono bassi rapporti tumore-to-sfondo e segnali non specifici di lottatumori gen-negativi precoce dopo l'iniezione a causa della loro liquidazione lenta dal corpo. Per ottenere risultati di imaging ottimali con anticorpi convenzionali, tempo di imaging fa 24 ore o anche 48 ore dopo l'iniezione sono comunemente necessari. Questi risultati sono in accordo con precedenti studi che hanno suggerito che gli anticorpi convenzionali con comprovata beneficio terapeutico hanno un'utilità limitata in imaging molecolare 17,19,26. Pertanto anticorpi convenzionali potrebbero essere piuttosto adatto per scopi terapeutici a causa della loro lunga emivita plasmatica mentre nanobodies sono piuttosto adatti per scopi di imaging a causa della loro rapida eliminazione dalla circolazione. Tali differenze sono dovute al fatto che una eventuale eccedenza dei nanobodies piccoli (15-17 kDa) viene eliminato rapidamente tramite eliminazione renale, mentre l'eccesso di anticorpi convenzionali grandi (150 kDa) viene mantenuta in circolazione. Così il grande vantaggio di nanobodies per l'imaging molecolare è il segnale di fondo basso alle brevi intervalli di tempo di imaging regardless della dose iniettata. Questo permette di imaging stesso giorno e potrebbe essere traslabile alla clinica impostazione. Al contrario, gli anticorpi convenzionali devono essere titolato esattamente per minimizzare segnali di fondo non specifici, pur mantenendo abbastanza segnale specifico dal tessuto bersaglio (dati non pubblicati).
Uno dei limiti della tecnica NIRF imaging in vivo è la profondità di penetrazione bassa che consente generalmente soltanto imaging sottocutanea, ma non di modelli tumorali ortotopiche. Tuttavia, questa limitazione potrebbe essere superata in un ambiente sperimentale dalle tecniche foto-acustica tomografiche sviluppati di recente che permettono al corpo intero per immagini di topi 27 vivente. Un'altra limitazione della tecnica NIRF imaging è la valutazione della dose tessuti rispetto all'imaging radionuclide mediata. Tuttavia, le nanobodies possono essere radiomarcato per la tomografia ad emissione di positroni (PET) di modelli di xenotrapianto e la valutazione quantitativa precisa ditracciante biodistribuzione. Infatti, i nostri risultati NIRF imaging sono secondo un recente studio che ha confrontato nanobodies e anticorpi convenzionali per l'imaging PET. Gli autori hanno anche giunti alla conclusione che nanobodies permettono di imaging in giornata con rapporti di 15 high tumore-to-sfondo.
Tuttavia, solo l'etichettatura dei costrutti anticorpali con il colorante fluorescente vicino infrarosso AF680 ci ha permesso il completo in vitro, in vivo e ex vivo il confronto del vicino infrarosso imaging di fluorescenza mediante citometria a flusso, microscopia a fluorescenza, e NIRF-imaging. Per questo motivo, e perché è nonradioactive, altamente sensibile, poco costoso, e utilizza relativamente facile da produrre sonde mirate, sosteniamo l'uso della tecnica NIRF imaging per la valutazione di nuovi costrutti anticorpali in imaging molecolare preclinico.
Divulgazioni
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Riconoscimenti
Questo lavoro è stato sostenuto dalla scuola di specializzazione 'infiammazione e rigenerazione' del Centro di Ricerca in collaborazione 841 della Deutsche Forschungsgemeinschaft (Alexander Lenz, Valentin Kunick, William Fumey), dal Centro di Ricerca in collaborazione 877 della Deutsche Forschungsgemeinschaft (Friedrich Koch-Nolte) , dalla Fondazione Otto Werner (Peter Bannas), dalla Fondazione Wilhelm Sander (Peter Bannas, Friedrich Koch-Nolte), e dalla Deutsche Forschungsgemeinschaft (Martin TREPEL, Friedrich Haag e Friedrich Koch-Nolte). Ringraziamo l'Università Cancer Center Hamburg (UCCH) In Vivo Optical Imaging Nucleo Struttura e personale a UKE per la consultazione e il loro servizio di alta qualità. Il Fondo Nucleo è stato sostenuto in parte da sovvenzioni dal Deutsche Krebshilfe (German Cancer Aid).
Materiali
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Riferimenti
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon