Method Article
ナノボディ及び抗体ベースの検証
* これらの著者は同等に貢献しました
要約
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
要約
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
概要
本報告では、ex vivoで解剖異種移植腫瘍のフローサイトメトリーおよび蛍光顕微鏡使用して、インビボで異種移植イメージング実験の検証のための近赤外フルオロフォア標識プローブの実装について述べる。我々は、単一ドメインのナノボディ(単数+ 16aは、17 kDa)の1およびインビボで特定の同じ標的抗原に対するモノクローナル抗体(Nika102、150 kDa)の2,3を比較する近赤外線リンパ腫異種移植片モデルにおける蛍光イメージング。標的抗原のADPリボシルトランスフェラーゼARTC2.2はリンパ腫細胞4-9によるGPIアンカー型細胞表面エクト酵素として発現される。
ラクダ科動物重鎖のみ抗体に由来するナノボディは、最小の利用可能な抗原結合断片10,11です。唯一の〜15kDaのによると、これらの小さな抗体フラグメントは、可溶性の非常に安定しており、腎循環8,10から消去されます。 THESEプロパティは、生体 12-20 における腫瘍抗原の特異的かつ効率的な標的化のために特に適したものにする。利用可能なナノボディの共通の抗原標的は、上皮成長因子受容体(EGFR1またはHER-1)、ヒト上皮成長因子2型(HER-2またはCD340)、癌胎児性抗原(CEA)および血管細胞接着分子-1(VCAM-1である)21。ナノボディの結合体は、炎症性疾患22の癌免疫療法と治療のための有望なツールです。
最近の研究では、高い腫瘍対バックグラウンド(T / B)は、 インビボでの分子イメージングアプリケーション8,17,19、従来の抗体より-ratiosナノボディが許可されていることを示している。これは、非標的組織23に、従来の抗体、循環からの遅いクリアランス、および長い保持の比較的乏しいと遅い組織浸透によって主に説明されている。さらに、従来の抗体の過剰非特異的蓄積をiに導く強化された透過性および保持(EPR)によって引き起こされるn個の標的抗原陰性腫瘍は24,25をもたらす。これは、従来の抗体の高い用量は、このように最大の達成可能な腫瘍対バックグラウンド比を減少させる、特定の信号だけでなく、非特異的なシグナルだけでなく、増加させることができることを意味する。対照的に、ナノボディの用量を増加させることなく、正常組織または抗原陰性腫瘍(未発表データ)の抗原陽性腫瘍のシグナルを増加させる。
ナノボディと、従来の抗体の比較を超えて、我々が原因EPR効果に特定し、非特異的なシグナルの直接比較のために同じマウスにおける抗原陽性と陰性異種移植片の個人内評価の概要を説明します。近赤外蛍光団結合プローブは、私たちは、近赤外蛍光イメージングを用いたin vivoおよびex vivoで単一のプローブを利用するフローサイトメトリー、および蛍光顕微鏡することができました。我々のプロトコルを適用することを可能にする非そのような特定の腫瘍が標的とするための新たな抗体構築物の評価などの生体内分子イメージング実験の、放射性、高感度、かつ安価な最適化。
このチュートリアル研究の目的は、前臨床分子イメージングの新抗体構築物の評価のためのNIRFイメージングの使用を強調することです。
このプロトコルでは、すべての実験小動物NIRF·イメージングシステムを用いて実施した、蛍光活性化セルソーター(FACS)は、フローサイトメーターおよび共焦点顕微鏡。
プロトコル
注:実験動物の倫理的な使用に関する国際的なガイドラインに従って実施し、大学医療センター、ハンブルクの地元の動物福祉委員会によって承認された。
腫瘍細胞、マウス、および抗体構築物の作製
- リンパ腫細胞の調製と地下行列の分注(マトリゲル)。
- 腫瘍細胞の注射の前日には、滅菌チップボックス(1,000μlのヒント)し、-20℃の冷凍庫内の適切なピペットを置く。
- 4℃の冷蔵庫のO / Nで氷上の地下マトリックスとボトルを解凍する。
- 注射の日にアイスバケットを充填し、ピペットチップと共に基底行列を配置し、そして氷上で30 G針で1mlシリンジ。
- 1.5ミリリットルマイクロ遠心チューブ中でRPMI培地100μlの容量でアリコートリンパ腫細胞および基底行列100μlで丁寧に混ぜる。予め冷却しに作成する注射器と注射まで氷上に置く。
注:良い無菌テクニックを使用し、氷上で地下行列の目詰まりを防止するために、全体の時間を仕事に。
- マウスの準備
- 8-10週齢の無胸腺ヌードマウス(NMRI- Foxn1 N U)を使用してください。
- 腸の自己蛍光を減少させるためにin vivoイメージングに先立って1週間アルファルファを含まない食事にマウスを保つ。
- リンパ腫細胞の注射のために誘導室中の2%イソフルランで行うためにマウスを麻酔。イソフルランマニホールドを使用してプロシージャの間、1〜2%イソフルランを維持します。
- 肩の脇腹に皮下リンパ腫細胞を注入。直接個人内比較のために、それぞれ、右側及び左側の抗原陽性および抗原陰性細胞を注入する。
- マウスの皮膚をつまんで、マウスの体からそれを引き離すために親指と人差し指を使用してください。ゆっくりと均等にに注入ポーチは、皮膚の下の細胞の単一クラスタを作成、指で作成しました。地下行列は所定の位置に注入した細胞を維持するのに役立ちます。
- 抗体構築物の調製
- 製造元の指示に従って、蛍光染料のAlexaFluor-680(AF680)(励起波長= 679 nmの発光波長= 702 nm)の市販のタンパク質標識キットでモノクローナル抗体および単一ドメインのナノボディにラベルを付けます。 15720モル-1 cm -1でと203000モル-1 cm -1で、それぞれのモル吸光係数を用いてナノボディ、従来の抗体当たりの色素の数を計算します。 SDS-PAGEのサイズ分画とクマシーブリリアントブルー染色により抗体構築物の純度を評価。
- 実際のイメージング研究の前にin vitroでの一連の実験を実施することにより標識複合体の特異性を確認してください。ラベルANの特異性を試験tibodyブロッキング研究によって、in vitroで構築し、非特異的なアイソタイプは8,20を制御します。
注:ステップでは、抗原陰性および抗原陽性細胞(または異なる細胞株)1.2.4細胞数は、異なる成長速度に応じて適合されなければならない。これらの実験では、0.5×10 6 DC27.10 ARTC2陰性および1.5×10 6 DC27.10 ARTC2陽性細胞は、同様のサイズの腫瘍を得るために使用した。ステップ1.3.1で蛍光団との抗体プローブの標識化およびラベリング効果のプロセスが使用される標識キットによって異なる場合があります。
2. in vivoイメージング
- 50μgの2染料/分子:腫瘍が直径1~8ミリメートルに達したとき7-9日後、AlexaFluor68050μgの静脈内、マウスの尾静脈(mAbを、AF680に200μlの生理食塩水の体積で抗体構築物を標識注入≈〜4 ^ 14の蛍光色素≈〜0.8μgの蛍光色素、ナノボディ-AF680:50μ0.3色素とG /分子≈〜5.6 ^ 14の蛍光色素≈〜1.1μgの蛍光色素)。
- イメージング·システムを初期化し、画像化前に誘導チャンバ内のXGI-8麻酔システムを使用して、3%イソフルランで達成するために、マウスを麻酔。撮像チャンバ内に収容イソフルランマニホールドを用いて撮像手順の期間中1~2%のイソフルランを維持する。
- カメラ向けの腫瘍を有する加熱された撮像段階上の位置マウス。つま先や動物の尾をつまんで適切な麻酔を監視。動物の任意の反応は、麻酔が軽すぎることを示しています。
- 呼吸速度を監視する。麻酔は、呼吸速度を増加させると軽すぎるとあまりに深く呼吸速度が低下すると、深いまたは不規則である。麻酔下ながら乾燥を防ぐために、眼軟膏剤で、動物の角膜を保護します。
- 励起用の615から665ナノメートル、emissioための695から770ナノメートルの蛍光フィルタセットを選択してくださいnは、51倍512画素マトリクスサイズのバックグラウンド減算のための580から610 nmの励起。 2にオート、媒体へのピクセルビニングとF /停止するように露光時間を設定します。
注:より短い露光時間を高速フレームレートを可能にする。長い露光時間は、より高い感度を提供する。ビニングは、CCDカメラの画素サイズを制御する。ビニングを大きくすると、画素サイズ、感度、及びフレームレートを増加させるが、空間分解能を低下させる。 F /ストップは、カメラレンズの絞りの大きさを設定する。開口部の大きさは、検出された光の量との設定が、デバイスおよび実験セットアップを撮像して異なることがfield.Noteの深さを制御する。最適な結果については、製造元のマニュアルを参照してください。- イメージングソフトウェア最適露光時間では、F /ストップ及びピクセルビニングは、細胞株の発現レベルに基づく。定量的な結果に影響を与えることなく、実験中いつでもこれらの設定を変更してください。また、イメージ作成ウィザードソフトウェアは自動的に決定させるパラメータ。
- 注射と抗体構築物の注射後6時間前の画像マウス。
NOTE:ラベリング効率は最適な撮像結果を得るために必要とされる必要な用量に影響を及ぼし得る。したがって、最適な撮像結果を得るために必要な抗体構築物の量は、経験的に決定されなければならない。それは、標識有効性およびサイズの構築物ならびに腫瘍モデルおよび標的抗原の発現に依存して変化し得る。
3.収穫および腫瘍の準備
- アイスバケットを充填し、4%パラホルムアルデヒド(PFA)リン酸緩衝生理食塩水(PBS)/プロテアーゼ阻害剤(AEBSF)、氷上でPBS / 0.2%ウシ血清アルブミン(BSA)を置く。
- 撮像セッションが終了すると、4%イソフルランの濃度を増加させる。動物が呼吸を停止した後、撮像段階からそれを削除し、頸椎脱臼を行う。
- 70%エタノール発泡スチロールブロックスプレーのマウントマウス。
- はさみを使用してくださいSと鉗子外皮をカットし、腫瘍を露出させ、慎重にそれを引き戻すために。腫瘍組織は無傷のまま確実にするためにメスで腫瘍を除去します。
- メスを用いて半分に切った腫瘍。 PBS / FACS用AEBSF分析し、免疫組織化学のために、4%PFAで50ミリリットルチューブ内の他の半分とコレクションチューブに半分を置きます。
- 免疫組織化学のための準備
- 24時間4℃で冷蔵庫で4%PFA中で腫瘍を保管してください。 PBS / 30%スクロースとの管に腫瘍を移し、チューブの底に腫瘍シンクまで4℃で冷蔵庫に保管してください。
- cryomoldsのための適切なピースで腫瘍を切り取ります。 cryomoldsに腫瘍を入れて、腫瘍が覆われるようにOCT化合物で満たされる。
- ドライアイス上で金型を入れて、化合物が完全に凍結されるまで待ちます。凍結された腫瘍は-80℃の冷凍庫に移し、免疫組織化学のために保管してください。
- ミクロトームで8μmのセクションで凍結された腫瘍をカット。標準の免疫組織を使用してください化学プロトコルは、核を可視化するために血管およびジアミジノフェニルインドール(DAPI)を可視化するためにCD31-AF488に対する抗体で染色した。
注:彼らはすでに蛍光標識した抗体を含有するように腫瘍切片を光に非常に敏感である。可能な限り光への曝露を最小限に抑えます。
- FACS分析のために準備
- 氷上のペトリ皿を置き、2.0ミリリットル注射器からプランジャーを取り外します。セルストレーナーに腫瘍を入れ、メスを用いて3-4個にそっとそれをカット。ペトリ皿に最初のPBSを注ぎ、セルストレーナー内の腫瘍をマッシュアップするために、プランジャーの平坦な端を使用しています。
- 10ミリリットルピペットですべてのセルを洗い流すために、最初のPBSで細胞ストレーナーをフラッシュします。 5分間500×gで新しいチューブとスピンに細胞懸濁液を転送します。上清を捨て、10mlのPBS / 0.2%BSAで細胞を懸濁します。細胞を数える。
- 5ミリリットルFACSチューブ中のアリコートを1~5×10 6個のリンパ腫細胞。再びスピン細胞(500XG)、100μlのPBS / 0.2%BSA中で上清と再懸濁を捨てる。
- 必要に応じて、抗CD16 / CD32-mAbの(FcgR3 / 2)を使用してブロックFcRは、10分間、氷上でのFcγRに結合する。 PBS / 0.2%BSAで細胞を1回洗浄する。
- 他のセルからの白血球を区別するために抗CD45-mAbを追加します。 PBS / 0.2%BSAで2回洗浄し、続いて暗所で氷上で20分間、インキュベートする。
- 右無地PBSで2回洗浄し、死細胞を識別するために、氷上で15分間ヨウ化プロピジウムFACS分析染色前。 FACS分析のために150μlの中で再懸濁します。
注:ステップ3.7.4および3.7.5のステップでは、他の抗体は、腫瘍の実体に応じて使用することができる。
4. FACS分析
- ゲートに大型散布、ダブレット差別、死細胞の排除、CD45陽性細胞のためのゲーティング、および抗原陽性細胞のためのゲーティングの形で関心の人口をゲーティング一連のツールを使用してください。
- まず、ゲート外セル2パラメータプロットを使用して側方散乱(SSC-A)対前方散乱(FSC-A)で破片。次のセルダブレットを破棄。最後に、ゲート外非CD45抗原陽性(CD45)および死んだ/死細胞(LD - ライブ/デッド染色)。
- すべての実験のために同じテンプレートを使用して、レコードのサンプル。
注:ハードウェアおよび分析ソフトウェアの使用に関する技術的な助言のために、製造業者のプロトコルを参照してください。
5.顕微鏡分析
- 油浸レンズ(対物レンズ40倍)と共焦点顕微鏡を用いて染色し、腫瘍の凍結切片を分析します。 AF680の彼-ネオン633 nmのレーザー励起、AF488用アルゴンレーザー、およびDAPI用の405-ダイオードを使用してください。
- 顕微鏡と互換性のあるソフトウェアを使用して、生の画像データを処理します。必要に応じて、バックグラウンド補正とノイズフィルタリングを実行します。そのような、切片トリミングだけでなく、明るさやコントラストの調整などの追加の画像調整を行います。
- 最後にGE全ての検出チャネルから単一の複合オーバーレイイメージをnerate。個々の層の明るさとコントラストを調整します。合成画像は、細胞の局在(DAPI染色、青)標識抗体の構造(AF680-ステイン、赤)と血管の、分布(AF488-ステイン、緑)が表示されます。
in vivoイメージング解析6.
- イメージングソフトウェアで開いている画像ファイルと蛍光画像データと写真画像データを合成してオーバーレイイメージを作成する。特定の蛍光信号からの組織自己蛍光のバックグラウンド信号を除去することにより画像表示を最適化する。これはトレーサーのための特定の設定されたフィルタで取得した画像からセットバックグラウンドフィルタで取得した画像を減算することによって行うことができる。
- 抗原陽性腫瘍および抗原陰性の腫瘍の周りの関心領域(ROI)の同一の円形測定領域を描画します。バックグラウンド信号強度を決定するには、円形のROIを配置蛍光シグナルが低いと予想される動物( 例えば 、後肢)の領域である。
- 全ての時点ですべての動物のために同じROIを使用してください。位置決めのために、腫瘍のマージンを識別するために、写真の白黒画像を使用する。
- 測定テーブルで表示しROIデータ。さらに統計分析のための蛍光シグナルのより定量的な比較を可能にする、平均放射効率データを使用してください。
- ディスプレイ絶対信号強度などのデータを比較したり、標的組織および背景組織から測定されたROIのデータを使用して、シグナル対バックグラウンド比を計算する。後肢から求めたバックグラウンド値によって腫瘍の取り込み値を除算することにより、腫瘍対バックグラウンド比を計算する。
- 対照として、また、抗原陰性および抗原陽性同じ動物の腫瘍、ならびにインビボでのシグナルの特異性を評価するために標識されたアイソタイプ対照を注射した動物の分析。
結果
蛍光標識プローブは、異なるNIRFイメージング技術( 図1A)との組み合わせを可能にする。我々は、in vivoイメージング ( 図1B) 内の特定のために、蛍光標識されたナノボディおよびモノクローナル抗体を比較するために、in vivoでの NIRFイメージングを実行するフローサイトメトリー、および蛍光顕微鏡を順次ことを目的とした。
マウスは、in vivoイメージングのための蛍光標識された構築物の特異性を評価するために、ナノボディ及びモノクローナル抗体の50μgを注射した。結果は、注射後6時間( 図2)でナノボディおよびモノクローナル抗体の両方と抗原陽性腫瘍の特異的標識を示した。 ROIは、モノクローナル抗体〜6と比較して、ナノボディのためのはるかに高いT / B比が〜12を示し、抗原陽性腫瘍の分析。さらに、ナノボディは、一方、抗原陰性腫瘍における非特異的シグナルを示さなかったモノクローナル抗体は、抗原陰性腫瘍における非特異的な交絡シグナルを示した。
陰性腫瘍の非特異的な信号に加えて、モノクローナル抗体はまた、動物全体に非特異的バックグラウンドシグナルを誘導した。これは、腎臓で排泄されるには大きすぎる過剰な自由循環抗体に思われる。逆に、ナノボディを注射した動物は、わずかなナノボディの腎排泄のために腎臓で非特異的なシグナルを示した。
フローサイトメトリー腫瘍細胞懸濁液の分析は、6時間注入後にAF680結合体の両方で抗原陽性腫瘍細胞の特異的標識を示した。モノクローナル抗体標識された細胞と比較して、ナノボディ標識細胞のより強い蛍光シグナルは、in vivo NIRFイメージングの結果を反映している。重要なことには、フローサイトメトリー分析は、2つのいずれかで、抗原陰性細胞の非特異的標識がないことを明らかにし構造物( 図3)。
腫瘍の凍結切片の蛍光顕微鏡は、注射後のナノボディ6時間で、抗原陽性細胞の強力かつほぼ均一な標識を示した。逆に、モノクローナル抗体は非常に弱く、かなり不均一な染色( 図4A)を示した。抗原陰性腫瘍は、間質空間での従来の抗体ショー非特異的散乱染色( 図4B)を注射した抗原陰性腫瘍のに対し、ナノボディーの注入後には染色6時間を示していない。
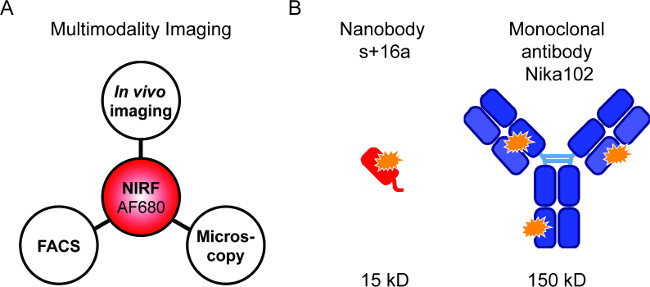
図1:Flourescenceイメージングおよび抗体構築。 (A)AF680結合体を評価するためのイメージングセットアップ:フローサイトメトリーおよび蛍光顕微鏡に続くインビボ NIRFイメージング。 (B )はAlexaFluor680の概略は、ナノボディS + 16aは(赤)およびモノクローナル抗体Nika102(青)のラベル。オレンジの星はAlexaFluor680の蛍光色素を示している。
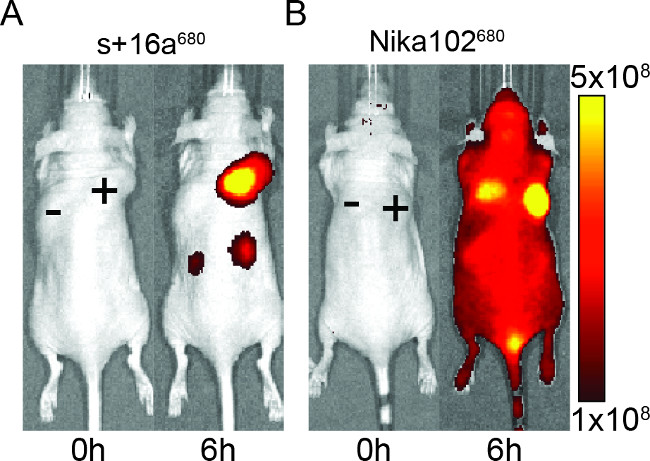
図2: インビボ NIRFイメージングの蛍光シグナルの画像抗原陽性(+)及び抗原陰性( - )ナノボディの+ 16aの(A)およびモノクローナル抗体Nika102(B)を注射されたマウスの腫瘍。 。in vivoイメージングは(0時間)と注射後の6時間前に実施された。シグナル強度は、放射効率た(p /秒/ cm 2の/ srで)/(μW/ cm 2)のように表示されている。
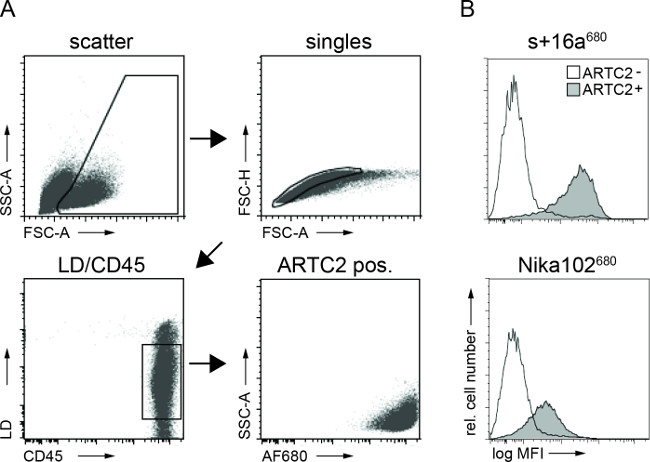
図3:FACSのためにex vivoで FACS分析腫瘍細胞懸濁液からの細胞に結合した抗体構築物。(A)ゲーティング戦略は、腫瘍細胞の分析。 (B)ヒストグラムは、具体的には、インビボで腫瘍細胞に結合した静脈内注射AF680共役ナノボディの+ 16aおよび抗体Nika102の量を表示する。抗原陰性腫瘍は未充填ヒストグラムおよび抗原陽性腫瘍として表示されている充填ヒストグラムとして表示される。
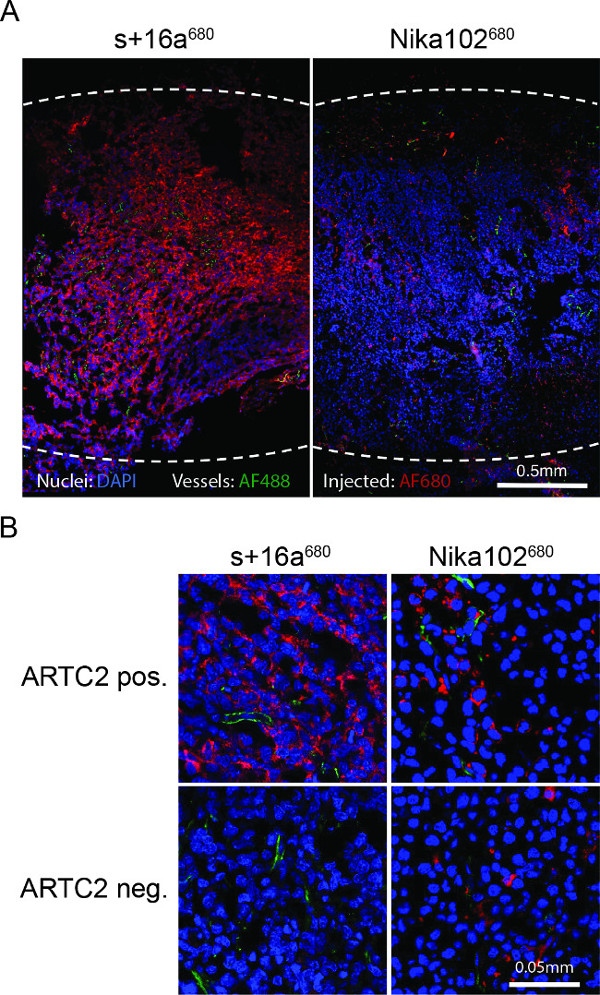
図4:6時間S + 16aは680またはNika102 680の注入後の全体抗原陽性腫瘍凍結切片の ex vivo蛍光顕微鏡(A) 概要蛍光顕微鏡。 in vivoでの静脈内での信号強度すべての二次標識剤なしjected AF680-結合体は赤色で表示されます。 エクスビボで対比核は緑で青や船舶で表示されます。点線は、全体の腫瘍の外側の余白を示している。 (B)抗原陽性および抗原陰性腫瘍のクローズアップ蛍光顕微鏡。
ディスカッション
我々 は、in vivo及びex vivoでの分析のマルチモーダル比較のために、リンパ腫細胞上で同じターゲットに対して向けられた近赤外蛍光団ラベルナノボディ、従来のモノクローナル抗体を使用していました。我々は、ナノボディはよくリンパ腫の迅速かつ特異的インビボ検出のための診断ツールとして適していることを示した。
生体内では 、+ 16(a)680は ARTC2陽性異種移植片の迅速かつより具体的な検出を可能にしたのです。別に、in vivoでの最高の腫瘍の可視化のための異なる反応速度論から、Nika102 680の主な欠点は、ARTC2陰性腫瘍と、非特異的バックグラウンドシグナルより高い非特異的なシグナルであった。
解剖腫瘍が注入されたAF680-結合体のARTC2陰性リンパ腫細胞への非特異的な結合を示さなかったからex vivoでのフローサイトメトリーは、分散した細胞の解析。 エクスビボ蛍光はほとんどhomogen強く明らかにし、ナノボディーS + 16aの場合のART2C陽性腫瘍切片内の細胞のOUの染色、ナノボディーは6時間後に腫瘍内のさえ遠隔地に到達することができたことが確認された。対照的に、モノクローナル抗体は、6時間後ARTC2陽性腫瘍における細胞の弱く不均一な染色を示した。従来の抗体との良好な撮像結果は、24時間または48時間後に達成することができる(データは示さず)。異なる2つのサイズの構築物の完全な比較を行うために、異なる時点(シリアルイメージング)での撮像は、各構築物のための最適な撮像時点を特定するために実行されなければならない。
他の先行研究と同様に、ここに報告された結果は、in vivoでラベルナノボディーとの分子イメージングは高い腫瘍対バックグラウンド比12-15,17-19と迅速かつ特異的に同じ日の腫瘍イメージングを可能にすることを強調。逆に、従来の抗体は、低腫瘍対バックグラウンド比と抗からの非特異的なシグナルになる初期の身体からの遅いクリアランスのために注射後GEN陰性腫瘍。従来の抗体との最適な撮像結果を得るためには、撮像時間が24時間を指し、または注射後にも48時間は、一般的に必要とされる。これらの知見は、実績のある治療上の有益性と、従来の抗体は、分子イメージング17,19,26において有用性が限られていることが示唆されている以前の研究と一致している。ナノボディは、循環からの彼らの急速なクリアランスのために画像化目的のためにむしろ適していながら、そのため、従来の抗体は、その長い血漿半減期に治療目的ではなく、適しているかもしれません。これらの差は大きく、従来の抗体(150 kDa)の過剰の循環に保持されている間に小さいナノボディ(15-17 kDa)のいずれかの過剰が急速に腎排泄を介してクリアされるという事実に起因する。そのように、分子イメージングのためのナノボディの主な利点は、初期の撮像時点での低いバックグラウンドシグナルであるregardl注射量のESS。これは、同じ日のイメージングを可能にし、臨床の設定に変換可能である可能性があります。これに反して、従来の抗体は、標的組織(未発表データ)から十分な特定の信号を維持しながら、正確に、非特異的なバックグラウンド信号を最小化するために滴定する必要があります。
インビボでの NIRFイメージング技術の限界の一つは、一般的ではなく同所腫瘍モデルの皮下のみの画像化を可能にする低浸透深さである。しかし、この制限は、マウス27を生きた全身イメージングを可能最近開発された断層光音響技術により実験的設定で克服されることがあります。 NIRFイメージング技術の他の制限は、放射性核種媒介イメージングと比較して組織量の評価である。しかし、ナノボディは、異種移植モデルとの正確な定量的評価の陽電子放出断層撮影(PET)イメージングのために放射性標識することができるトレーサー生体内分布。確かに、私たちのNIRFイメージングの結果は、PETイメージングのためのナノボディと、従来の抗体を比較した最近の研究に基づいている。著者はまた、ナノボディーが高い腫瘍対バックグラウンド比15と同じ日のイメージングを可能という結論に達しました。
しかしながら、近赤外蛍光色素AF680との抗体構築物の唯一の標識化は、 インビボで 、私たちのin vitroでの総合的な許可及びex vivo近赤外蛍光イメージング比較フローサイトメトリー、蛍光顕微鏡、およびNIRFイメージング使用。このため、それは、非放射性高感度、安価で、比較的簡単に製造するターゲットプローブを使用しているため、我々は、前臨床分子イメージングの新しい抗体構築物の評価のためのNIRFイメージング技術の使用を提唱する。
開示事項
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
謝辞
この作品は、ドイツ学術振興(フリードリヒコッホ-·ノルティ)の共同研究センター877によって、ドイツ学術振興(アレクサンダーレンツ、バレンティンKunick、ウィリアムFumey)の共同研究センター841の大学院「炎症と再生」によってサポートされていました、ヴェルナー·オットー財団(ピーターBannas)によって、ヴィルヘルムサンダー財団(ピーターBannas、フリードリッヒコッホ-·ノルティ)によると、ドイツ学術振興(マーティン·トレペル、フリードリヒハーグとフリードリッヒコッホ·ノルティ)による。私たちは、 インビボ光学イメージングコア施設とスタッフUKEで相談し、その高品質のサービスでは大学がんセンターハンブルク(UCCHを)感謝。コア施設はドイツKrebshilfe(ドイツ癌エイド)からの助成金によって部分的にサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | n/a | Other cells with different surface targets can be used |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1ml | Braun | 916 1406 V | Alternative product can be used |
参考文献
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved