Method Article
Validación de nanocuerpo y basados en anticuerpos
* Estos autores han contribuido por igual
En este artículo
Resumen
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Resumen
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introducción
En el presente informe se describe la implementación de fluoróforo sondas marcadas en el infrarrojo cercano para la validación de los experimentos in vivo de imágenes de xenoinjertos utilizando ex vivo citometría de flujo y microscopía de fluorescencia de los xenoinjertos de tumores disecados. Comparamos una sola nanocuerpos dominio (s + 16a, 17 kDa) 1 y un anticuerpo monoclonal (Nika102, 150 kDa) 2,3 dirigida al mismo antígeno diana para específico in vivo de infrarrojo cercano de imágenes de fluorescencia en un modelo de xenoinjerto de linfoma. El ADP-ribosiltransferasa ARTC2.2 antígeno diana se expresa como una superficie celular ecto-enzima anclado a GPI por las células de linfoma de 4-9.
Nanobodies derivados de camélidos de sólo-cadena pesada de anticuerpos son los fragmentos de unión al antígeno disponibles pequeños 10,11. Con sólo ~ 15 kDa, estos pequeños fragmentos de anticuerpos son solubles, muy estable y se elimina de la circulación por vía renal 8,10. Tstos propiedades los hacen particularmente adecuado para la orientación específica y eficiente de antígenos tumorales in vivo 12-20. Objetivos antígeno común de nanocuerpos disponibles son el receptor del factor de crecimiento epidérmico (EGFR1 o HER-1), factor de crecimiento epidérmico humano tipo 2 (HER-2 o CD340), antígeno carcinoembrionario (CEA) y la adhesión celular vascular molécula-1 (VCAM-1 ) 21. Nanocuerpos conjugados son herramientas prometedoras para la inmunoterapia del cáncer y el tratamiento de enfermedades inflamatorias 22.
Estudios recientes han demostrado que nanocuerpos permiten mayor -ratios tumor-a fondo (T / B) que los anticuerpos convencionales en aplicaciones in vivo de imágenes moleculares 8,17,19. Esto se explica principalmente por el relativamente pobre y lenta penetración en los tejidos de los anticuerpos convencionales, la remoción de la circulación lenta y larga permanencia en los tejidos no diana 23. Por otra parte, el exceso de anticuerpos convencionales conduce a i acumulación no específican diana tumores antígeno negativo causado por la permeabilidad mejorada y retención (EPR) Efecto 24,25. Esto significa que dosis más altas de anticuerpos convencionales pueden aumentar no sólo señales específicas, sino también señales no específicas, reduciendo así la relación máxima alcanzable tumor a fondo. Por el contrario, el aumento de la dosis de nanocuerpos aumenta las señales de tumores antígeno-positivas, pero no de tejido normal o tumores antígeno-negativos (datos no publicados).
Más allá de la comparación de nanocuerpos y anticuerpos convencionales, se describe una evaluación intraindividual de xenoinjertos de antígeno-positivos y negativos en los mismos ratones para la comparación directa de las señales específicas y no específicas debido al efecto EPR. Las sondas de conjugados de fluoróforo infrarrojo cercano nos permitieron explotar una sola sonda in vivo y ex vivo usando imágenes de fluorescencia en el infrarrojo cercano, citometría de flujo y microscopía de fluorescencia. Aplicando nuestros protocolos permite nooptimización radiactivo, altamente sensible y de bajo costo de experimentos in vivo de imágenes moleculares, tales como la evaluación de las nuevas construcciones de anticuerpos de tumor específico de orientación.
El objetivo de este estudio tutorial es poner de relieve el uso de NIRF de imágenes para la evaluación de las nuevas construcciones de anticuerpos en la imagen molecular preclínica.
En este protocolo, todos los experimentos se realizaron con un sistema de NIRF-Imaging pequeña animal, un clasificador de células activadas por fluorescencia (FACS) citómetro de flujo, y un microscopio confocal.
Protocolo
NOTA: Los experimentos se realizaron de conformidad con las directrices internacionales sobre el uso ético de los animales y fueron aprobadas por la comisión de bienestar animal local del Centro Médico de la Universidad de Hamburgo.
1. Preparación de las células tumorales, los ratones y los anticuerpos constructos
- Preparación de las células del linfoma y alicuotear de Matrix Sótano (Matrigel).
- El día antes de la inyección de las células tumorales puso una caja esterilizada punta (1000 consejos l) y la pipeta apropiada en -20 ° C congelador.
- Descongelar la botella con la matriz sótano en hielo en la nevera 4 ° C O / N.
- En el día de la inyección de llenar un cubo de hielo y colocar la matriz sótano junto con pipeta, consejos, y 1 ml jeringas con agujas de 30 G en el hielo.
- Células de linfoma alícuota en un volumen de 100 l de medio RPMI en 1,5 ml tubos de microcentrífuga y se mezcla cuidadosamente con 100 l de la matriz de sótano. Elaborar en pre-enfriadojeringas y poner en hielo hasta su inyección.
NOTA: Utilice buena técnica estéril y trabajar en hielo todo el tiempo para evitar la obstrucción de la matriz sótano.
- Ratones Preparación
- Utilice 8-10 semanas de edad ratones desnudos atímicos (NMRI- Foxn1 n u).
- Para reducir la autofluorescencia del intestino mantener los ratones con una dieta alfalfa libre durante 1 semana antes de la formación de imágenes in vivo.
- Para la inyección de células de linfoma anestesian los ratones para efectuar con 2% de isoflurano en una cámara de inducción. Mantener 1-2% de isoflurano durante la duración del procedimiento utilizando un colector de isofluorano.
- Inyectar células de linfoma por vía subcutánea en los flancos de los hombros. Para la comparación intra-individual directa inyectar células antígeno-positivas y negativas al antígeno en el lado derecho e izquierdo, respectivamente.
- Use un dedo pulgar y el índice para pellizcar la piel del ratón y tire de ella fuera del cuerpo del ratón. Inyectar lentamente y uniformemente enla bolsa creada por los dedos, creando un único grupo de células debajo de la piel. La matriz sótano ayuda a mantener las células inyectadas en su lugar.
- Preparación del anticuerpo Constructos
- Marcar anticuerpos monoclonales y nanocuerpos de dominio único con un kit de marcaje de proteínas disponible comercialmente para el colorante fluorescente AlexaFluor-680 (AF680) (longitud de onda de excitación = 679 nm, longitud de onda de emisión = 702 nm) según las instrucciones del fabricante. Calcular el número de colorantes por nanocuerpos y anticuerpo convencional utilizando coeficientes de extinción molar de 15.720 mol -1 cm -1 y 203 000 mol -1 cm -1, respectivamente. Evaluar la pureza de construcciones de anticuerpos por el tamaño de SDS-PAGE fraccionamiento y Coomassie brillante mancha azul.
- Asegúrese de que la especificidad de los conjugados marcados mediante la realización de una serie de experimentos in vitro antes de los estudios de imagen reales. Pon a prueba la especificidad de un etiquetadotibody construye in vitro a través de estudios de bloqueo y isotipo inespecífica controla 8,20.
NOTA: En el paso 1.2.4 número de células para las células antígeno-negativas y positivas para el antígeno (o diferentes líneas de células) puede tener que ser adaptada de acuerdo a diferentes tasas de crecimiento. Para estos experimentos, se utilizaron células positivas 0,5x10 6 DC27.10 ARTC2 negativo y 1.5x10 6 DC27.10 ARTC2 para obtener los tumores de tamaño similar. En el paso 1.3.1 el proceso de etiquetado y etiquetado eficacia de sondas de anticuerpos con fluoróforos puede diferir por el kit de marcaje utilizado.
2. En Vivo Imaging
- Después de 7-9 días, cuando los tumores alcanzan ~ 8 mm de diámetro, se inyectan 50 g de AlexaFluor680 etiquetados construcciones de anticuerpo en un volumen de 200 l de solución salina por vía intravenosa en la vena de la cola del ratón (mAb-AF680: 50 g con 2 colorantes / molécula ≈ ~ 4 ^ 14 fluorocromos ≈ ~ 0,8 g fluorocromos; nanocuerpo-AF680: 50 μg con 0,3 colorantes / molécula ≈ ~ 5,6 ^ 14 fluorocromos ≈ ~ 1,1 g fluorocromos).
- Inicializar el sistema de formación de imágenes y anestesiar a los ratones para llevar a cabo con 3% de isoflurano usando un sistema de anestesia XGI-8 en la cámara de inducción antes de la imagen. Mantener 1-2% de isoflurano durante la duración del procedimiento de formación de imágenes utilizando el colector de isoflurano alojado en la cámara de formación de imágenes.
- Ratones de posición en el escenario de imágenes climatizada con tumores dirigidos hacia la cámara. Monitorear la anestesia adecuada pellizcando la punta o la cola del animal; cualquier reacción del animal indica que la anestesia es demasiado clara.
- Vigilar la tasa de respiración; la anestesia es demasiado clara si se aumenta la tasa de respiración y demasiado profunda si se disminuye la tasa de respiración, profunda o irregular. Proteja las córneas de animales con una pomada para los ojos para evitar la sequedad mientras que bajo anestesia.
- Escoja juegos de filtros de fluorescencia de 615 a 665 nm para la excitación, 695-770 nm para EMISIOn, y 580 a 610 nm de excitación para la sustracción de fondo con un tamaño de matriz de píxeles 51 2x 512. Establecer el tiempo de exposición al auto, binning píxel a medio y F / Stop para 2.
NOTA: Los tiempos de exposición más cortos permiten mayores velocidades de fotogramas; tiempos de exposición más largos proporcionan una mayor sensibilidad. Binning controla el tamaño de píxel de la cámara CCD. El aumento de la binning aumenta el tamaño de píxel, la sensibilidad y velocidad de fotogramas, pero reduce la resolución espacial. F / Stop establece el tamaño de la apertura de la lente de la cámara. El tamaño de la apertura controla la cantidad de luz detectada y la profundidad de field.Note que los ajustes pueden diferir según el dispositivo y experimental hasta la formación de imágenes. Consulte el manual del fabricante para obtener resultados óptimos.- En el software de imágenes de optimizar el tiempo de exposición, F / parada y pixel binning basan en el nivel de expresión de la línea celular. Cambie estos ajustes en cualquier momento durante un experimento sin afectar el resultado cuantitativo. Por otra parte, dejar que el software Imaging Wizard determine automáticamentelos parámetros.
- Ratones de la imagen antes de la inyección y 6 horas después de la inyección de construcciones de anticuerpos.
NOTA: La eficacia de etiquetado puede afectar la dosis requerida necesaria para obtener resultados óptimos de imagen. Por lo tanto la cantidad de anticuerpo requerida-constructo para obtener resultados óptimos de imagen tiene que ser determinado empíricamente. Puede variar dependiendo de la eficacia de etiquetado y el tamaño de la construcción, así como el modelo de tumor y la expresión de antígeno diana.
3. Recolección y Preparación de Tumores
- Llenar un cubo de hielo y colocar 4%, paraformaldehído (PFA) salina tamponada con fosfato (PBS) / inhibidor de la proteasa (AEBSF) y PBS / 0,2% de albúmina de suero bovino (BSA) en hielo.
- Una vez que la sesión de imágenes ha terminado, aumentar la concentración de isoflurano al 4%. Después de animales cesa la respiración, retírelo de la etapa de formación de imágenes y realizar dislocación cervical.
- Ratón Montar en un bloque de espuma de poliestireno y rociar con etanol al 70%.
- Uso de tijeras y pinzas para cortar la piel exterior y tire de él con cuidado para exponer los tumores. Eliminar los tumores con el escalpelo para asegurar el tejido tumoral se mantiene intacta.
- Tumores reducido a la mitad utilizando un bisturí. Coloque un medio en un tubo de recogida con PBS / AEBSF para análisis FACS y la otra mitad en un tubo de 50 ml con 4% PFA para inmunohistoquímica.
- Preparación para inmunohistoquímica
- Mantenga los tumores en el 4% PFA en la nevera a 4 ° C durante 24 horas. Transferencia de tumores a un tubo con PBS / 30% de sacarosa y mantener en la nevera a 4 ° C hasta que los sumideros tumorales a la parte inferior del tubo.
- Cortar los tumores en piezas adecuadas para los criomoldes. Ponga los tumores en criomoldes y rellenar con un compuesto OCT para que los tumores están cubiertos.
- Colocar los moldes en hielo seco y esperar hasta que el compuesto está completamente congelado. Traslado tumores congelados a -80 ° C congelador y almacenar para inmunohistoquímica.
- Corte congela los tumores en las secciones de 8 micras con un microtomo. Utilice inmunohistoquímica estándarprotocolo de la química a la mancha con un anticuerpo contra CD31-AF488 para visualizar los vasos sanguíneos y diamidino-fenilindol (DAPI) para visualizar los núcleos.
NOTA: Las secciones de tumor son muy sensibles a la luz, ya que ya contienen anticuerpos marcados con fluorescencia. Minimizar la exposición a la luz tanto como sea posible.
- Preparación para el análisis FACS
- Coloque placa de Petri en hielo y retirar el émbolo de una jeringa de 2,0 ml. Ponga el tumor en el filtro de células y cortar con suavidad dentro de 3-4 piezas utilizando un bisturí. Verter la PBS inicial en la placa de Petri y utilizar el extremo plano del émbolo para triturar el tumor dentro del filtro de células.
- Lave el filtro de células con el PBS inicial para lavar todas las células con una pipeta de 10 ml. Transferir la suspensión celular en un tubo nuevo y centrifugado a 500 xg durante 5 min. Desechar el sobrenadante y resuspender las células en 10 ml de PBS / 0,2% BSA. Contar las células.
- Alícuotas 5.1 x 10 6 células de linfoma en un tubo de FACS 5 ml. Células girar de nuevo (500xg), desechar el sobrenadante y resuspender en 100 l de PBS / BSA al 0,2%.
- Opcionalmente, el bloque de FcR usando un anticuerpo anti-CD16 / CD32-mAb (FcgR3 / 2) que se une a FcyR en hielo durante 10 min. Lavar las células una vez con PBS / 0,2% BSA.
- Añadir anti-CD45-mAb para discriminar los leucocitos a partir de otras células. Incubar durante 20 min en hielo en la oscuridad, seguido de dos lavados con PBS / 0,2% BSA.
- Justo antes del análisis FACS tinción con yoduro de propidio durante 15 min en hielo para discernir las células muertas, seguido de dos lavados con PBS sin formato. Resuspender en 150 l para el análisis FACS.
NOTA: En el paso 3.7.4 y 3.7.5 paso otros anticuerpos se puede utilizar dependiendo de la entidad tumoral.
Análisis 4. FACS
- Utilice una serie de herramientas de compuerta a la puerta la población de interés en forma de gran dispersión, la discriminación doblete, la exclusión de las células muertas, gating de células CD45 positivas, y gating de células positivas para el antígeno.
- En un primer momento, la puerta hacia fuera celularescombros en una dispersión frontal (FSC-A) frente a dispersión lateral (SSC-A) con una parcela de dos parámetros. Dobletes de células Siguiente descarte. Por último, la puerta hacia fuera no antígeno CD45-positivo (CD45) y muerto / células morir (LD - / dead-mancha en vivo).
- Muestras graba con la misma plantilla para todos los experimentos.
NOTA: Consulte con el protocolo del fabricante para obtener asesoramiento técnico sobre el uso de hardware y software analítico.
5. Análisis microscópico
- Analizar criosecciones tumorales teñidas utilizando un microscopio confocal con una lente de inmersión en aceite (objetivo 40X). Use un Él-Neon 633 nm láser de excitación de AF680, un láser de argón para AF488, y un 405-Diodo para DAPI.
- Procesar los datos de imágenes en bruto utilizando un software compatible con el microscopio. Realizar fondo-corrección y filtrado de ruido en caso necesario. Realice los ajustes de imagen adicionales, como el corte, recorte, así como los ajustes de brillo y contraste.
- Finalmente geNerate una única imagen de superposición compuesto a partir de todos los canales de detección. Ajuste el brillo y el contraste de las capas individuales. Las imágenes compuestas mostrarán localización de las células (DAPI-manchas, azul), de distribución de construcciones de anticuerpo marcado (AF680-manchas, rojo) y los vasos sanguíneos (AF488-manchas, verde).
6. Análisis in vivo Imaging
- Abrir archivos de imagen en el software de imagen y crear una imagen de superposición mediante la combinación de los datos de imagen de la fotografía con datos de imagen de fluorescencia. Optimizar la visualización de imágenes mediante la eliminación de autofluorescencia tejido señal de fondo de la señal fluorescente específica. Esto se puede hacer restando la imagen adquirida con un filtro de fondo fijar de la imagen adquirida con el conjunto de filtros específico para el trazador.
- Dibujar regiones de medición circulares idénticas de interés (ROI) alrededor del tumor antígeno-positivo y el tumor antígeno-negativo. Para determinar la intensidad de la señal de fondo, colocar un ROI circularen un área del animal donde se espera que la señal de fluorescencia a ser baja (por ejemplo, las patas traseras).
- Utilice las mismas regiones de interés para todos los animales en todos los puntos. Para el posicionamiento, utilizar las imágenes en blanco y negro y fotográficos para identificar los márgenes del tumor.
- Visualización de datos de ROI en una tabla de la medida. Utilizar los datos de eficiencia radiante media, lo que permite una comparación más cuantitativa de señales fluorescentes para análisis estadísticos adicionales.
- Pantalla y comparar datos como la intensidad de señal absolutos o calcular la relación señal-fondo a partir de datos medidos ROI de tejido diana y el tejido de fondo. Calcular la relación tumor a fondo dividiendo el valor de captación tumor por el valor de fondo determinado a partir de la extremidad posterior.
- Como controles, también analizar tumores antígeno-negativas y positivas para el antígeno en los mismos animales, así como los animales inyectados con controles de isotipo marcados para evaluar la especificidad de las señales en vivo.
Resultados
Sondas marcadas fluorescentemente permiten la combinación de diferentes técnicas NIRF-de formación de imágenes (Figura 1A). El objetivo de realizar in vivo NIRF de imágenes, citometría de flujo, microscopía de fluorescencia y de forma secuencial con el fin de comparar los nanocuerpos marcados con fluorescencia y anticuerpos monoclonales específicos para la formación de imágenes en vivo (Figura 1B).
Los ratones fueron inyectados con 50 g de nanocuerpos y el anticuerpo monoclonal para evaluar la especificidad de los constructos marcados con fluorescencia para formación de imágenes in vivo. Los resultados mostraron un etiquetado específico de tumores antígeno-positivas con ambos nanocuerpos y el anticuerpo monoclonal a las 6 h después de la inyección (Figura 2). ROI análisis de los tumores positivas para el antígeno mostró una relación mucho más alta T / B de ~ 12 para la nanocuerpos en comparación con ~ 6 para el anticuerpo monoclonal. Además, la nanocuerpos mostró ninguna señal no específica en los tumores antígeno-negativo, mientras que elanticuerpo monoclonal mostró señales de confusión no específicos en los tumores de antígeno negativo.
Además de la señal no específica de los tumores negativos, el anticuerpo monoclonal también indujo señales de fondo no específicas en todo el animal. Esto es probablemente debido a un exceso de anticuerpos libres circulantes, que son demasiado grandes para ser excretada por vía renal. Por el contrario, los animales inyectados con nanocuerpos mostraron señales no específicas sólo en los riñones debido a la eliminación renal de los pequeños nanocuerpos.
La citometría de flujo análisis de las suspensiones de células tumorales mostró un etiquetado específico de las células tumorales positivas para el antígeno con tanto AF680 conjugados 6 horas después de la inyección. La señal de fluorescencia más fuerte de las células nanocuerpo marcado en comparación con células de anticuerpo monoclonal marcado refleja los resultados in vivo NIRF-de formación de imágenes. Es importante destacar que los análisis de citometría de flujo revelan que no hay etiquetado no específica de las células negativas al antígeno con cualquiera de los dosconstrucciones (Figura 3).
La microscopía de fluorescencia de cryosections tumorales mostró un fuerte marcaje y casi homogénea de células positivas para el antígeno con el nanocuerpos 6 horas después de la inyección. Por el contrario, el anticuerpo monoclonal mostró una tinción mucho más débil y más bien no homogénea (Figura 4A). Tumores antígeno-negativo no muestran tinción 6 hr después de la inyección de la nanocuerpos, mientras que los tumores antígeno-negativo inyectados con el espectáculo anticuerpos inespecíficos tinción convencional dispersa en el espacio intersticial (Figura 4B).
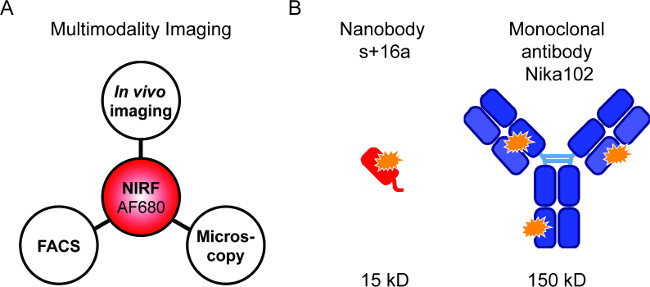
Figura 1: Imágenes de fluorescencia y construcciones de anticuerpos. (A) Configuración de imagen para la evaluación del AF680 conjugados: En vivo NIRF de imágenes seguido por citometría de flujo y microscopía de fluorescencia. (B ) Esquema de AlexaFluor680 etiquetado + 16a nanocuerpos s (rojo) y el anticuerpo monoclonal Nika102 (azul). Estrellas de color naranja indican los fluorocromos AlexaFluor680.
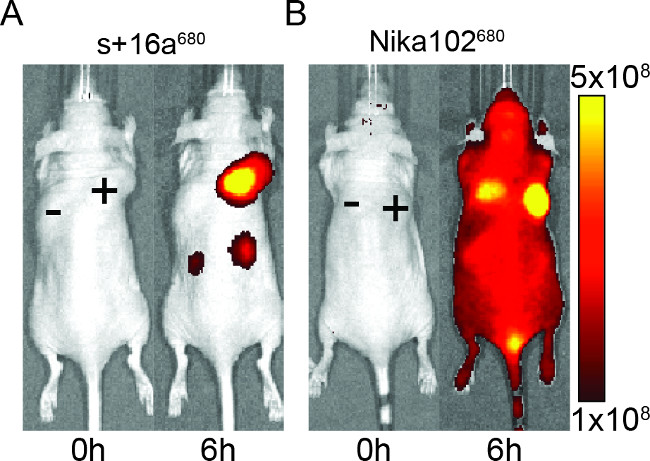
Figura 2: In vivo NIRF de imágenes Imágenes de la señal de fluorescencia de antígeno-positivo (+) y antígeno-negativo (-) tumores en ratones que han sido inyectados con + 16a nanocuerpos s (A) y el anticuerpo monoclonal Nika102 (B). . En vivo de imágenes se realizó antes (0 h) y 6 h después de la inyección. Intensidades de señal se muestran como la eficiencia radiante (p / seg / cm 2 / sr) / (mW / cm 2).
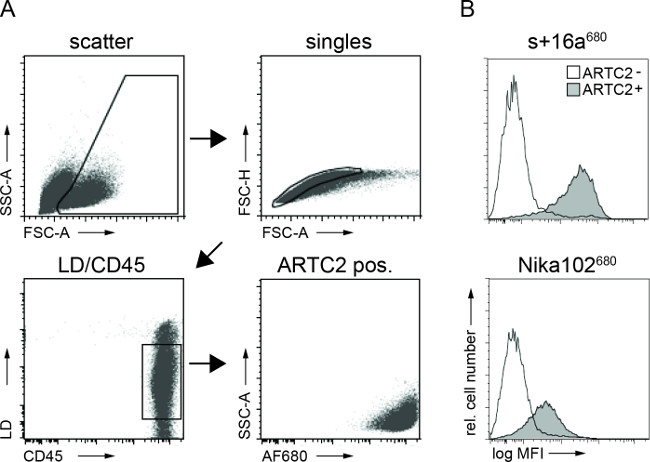
Figura 3:Ex vivo FACS análisis de construcciones de anticuerpos unidos a células a partir de suspensiones de células tumorales. (A) estrategia de apertura de puerta para análisis FACS de las células tumorales. (B) Histogramas de mostrar la cantidad de la nanocuerpos AF680-conjugado inyectado por vía intravenosa s + 16a y anticuerpo Nika102 unido específicamente a las células tumorales in vivo. Tumores antígeno negativo se muestran como histogramas sin relleno y tumores positivas para el antígeno se muestran como histogramas rellenos.
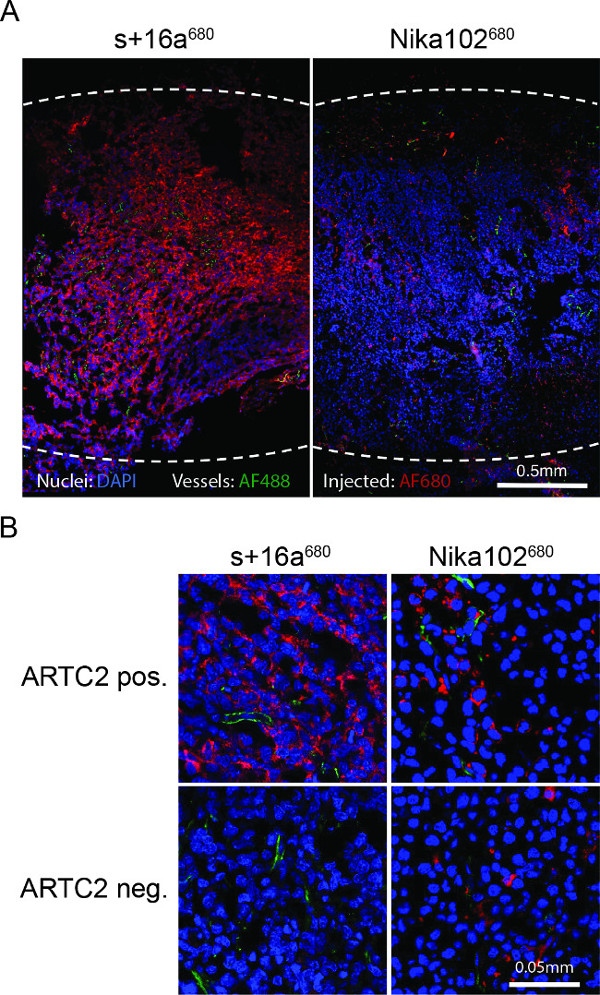
Figura 4:. Ex vivo microscopía de fluorescencia (A) Descripción general microscopía de fluorescencia de todo cryosections tumorales positivas para el antígeno 6 h después de la inyección de s + 16a 680 o Nika102 680. Intensidades de señal de la in vivo por vía intravenosa enproyectados AF680 conjugados sin ningún agente de etiquetado secundaria se muestran en rojo. Ex vivo núcleos counterstained se muestran en azul y los vasos en verde. Las líneas de puntos indican los márgenes exteriores de los tumores enteros. (B) Primer plano de microscopía de fluorescencia de los tumores antígeno-positivas y negativas al antígeno.
Discusión
Se utilizó fluoróforo nanocuerpos infrarrojo cercano marcados y anticuerpos monoclonales convencionales dirigidos contra el mismo objetivo en células de linfoma para una comparación multimodal de in vivo y ex vivo análisis. Demostramos que nanocuerpos son muy adecuadas como herramientas de diagnóstico para la detección rápida y específica in vivo de los linfomas.
In vivo, s + 16a 680 permitió una detección rápida y más específica de xenoinjertos ARTC2-positivo. Aparte de las diferentes cinéticas para mejor visualización del tumor in vivo, el principal inconveniente de Nika102 680 fue la señal no específica alta de tumores de ARTC2 negativo y las señales de fondo no específicas.
Análisis ex vivo de citometría de flujo de células dispersas de tumores diseccionados no mostraron la unión no específica a las células de linfoma de ARTC2 negativo de inyectados AF680 conjugados. Ex vivo de fluorescencia reveló fuerte y casi homogentinción ous de células en las secciones del tumor ART2C-positivo en el caso de + 16a nanocuerpos s, confirmando que el nanocuerpos fue capaz de llegar a las zonas remotas, incluso dentro del tumor después de 6 h. En contraste, el anticuerpo monoclonal mostró tinción más débil y no homogénea de células en tumores ARTC2-positiva después de 6 h. Mejores resultados de imagen con el anticuerpo convencional se puede lograr después de 24 horas o 48 horas (datos no mostrados). Con el fin de realizar una comparación exhaustiva de dos construcciones de diferente tamaño, de formación de imágenes en diferentes puntos temporales (serial-Imaging) tiene que ser realizado para identificar el punto de tiempo de formación de imágenes óptima para cada constructo.
Al igual que otros estudios anteriores, los resultados presentados aquí destacan que en vivo imágenes moleculares con nanocuerpos etiquetados permite imágenes de tumores en el mismo día rápida y específica con alto tumor a fondo las relaciones 12-15,17-19. Por el contrario, los anticuerpos convencionales resultan en bajas relaciones tumor a fondo y las señales no específicas de lucha contratumores gen-negativos temprana después de la inyección debido a su lenta eliminación del cuerpo. Con el fin de obtener resultados óptimos de imágenes con anticuerpos convencionales, el tiempo de imagen señala las 24 horas o incluso 48 horas después de la inyección suelen ser necesarios. Estos resultados concuerdan con estudios previos que han sugerido que los anticuerpos convencionales con beneficio terapéutico probado tienen una utilidad limitada en la imagen molecular 17,19,26. Por lo tanto los anticuerpos convencionales pueden ser bastante adecuado para fines terapéuticos debido a su larga vida media plasmática mientras nanocuerpos son bastante adecuado para los propósitos de formación de imágenes debido a su rápido aclaramiento de la circulación. Estas diferencias se deben al hecho de que cualquier exceso de los nanocuerpos más pequeños (15-17 kDa) se elimina rápidamente a través de la eliminación renal mientras que el exceso de anticuerpos convencionales más grandes (150 kDa) se retiene en la circulación. Así que la principal ventaja de nanocuerpos para formación de imágenes molecular es la baja señal de fondo en puntos de tiempo tempranos de formación de imágenes regardless de la dosis inyectada. Esto permite misma imagen día y podría ser traducible a la clínica ajuste. Por el contrario, los anticuerpos convencionales tienen que ser valorada exactamente para minimizar las señales de fondo no específicas, manteniendo suficiente señal específica del tejido diana (datos no publicados).
Una de las limitaciones de la técnica NIRF de imágenes in vivo es la profundidad baja penetración que generalmente permite que sólo las imágenes de la administración subcutánea, pero no de modelos de tumores ortotópicos. Sin embargo, esta limitación podría superarse en un entorno experimental por las técnicas foto-acústico tomográficas recientemente desarrollados que permiten imágenes de todo el cuerpo de los ratones 27 viviente. Otra limitación de la técnica de NIRF de imágenes es la evaluación de la dosis en comparación con el tejido cintigrafía mediada. Sin embargo, los nanocuerpos pueden estar radiomarcados para la tomografía por emisión de positrones (PET) de formación de imágenes de modelos de xenoinjerto y evaluación cuantitativa exacta debiodistribución trazador. De hecho, nuestros resultados NIRF-imágenes están de acuerdo con un estudio reciente que comparó nanocuerpos y anticuerpos convencionales para la PET. Los autores también llegaron a la conclusión de que nanocuerpos permiten imágenes en el mismo día con un alto índice de tumor a fondo 15.
Sin embargo, sólo el etiquetado de los constructos de anticuerpos con el infrarrojo cercano AF680 colorante fluorescente nos permitió la completa in vitro, in vivo y la comparación de imágenes de fluorescencia ex vivo en el infrarrojo cercano usando citometría de flujo, microscopía de fluorescencia, y NIRF de imágenes. Por esta razón, y debido a que es no radiactivo, muy sensible, de bajo costo, y utiliza comparativamente fáciles de producir sondas específicas, abogamos el uso de la técnica de NIRF-de formación de imágenes para la evaluación de nuevas construcciones de anticuerpos en la imagen molecular preclínica.
Divulgaciones
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Agradecimientos
Este trabajo fue apoyado por la escuela de posgrado "La inflamación y la regeneración" del Centro de Investigación Cooperativa 841 de la Deutsche Forschungsgemeinschaft (Alexander Lenz, Valentin Kunick, William Fumey), por el Centro de Investigación Cooperativa 877 de la Deutsche Forschungsgemeinschaft (Friedrich Koch-Nolte) , por la Fundación Otto Werner (Peter Banna), por la Fundación Wilhelm Sander (Peter Banna, Friedrich Koch-Nolte), y por la Deutsche Forschungsgemeinschaft (Martin TREPEL, Friedrich Haag y Friedrich Koch-Nolte). Damos las gracias a la Universidad del Centro del Cáncer de Hamburgo (UCCH) En Vivo Optical Imaging Core Fondo y el personal de UKE para su consulta y su servicio de alta calidad. El Fondo para el Core fue apoyado en parte por subvenciones de Deutsche Krebshilfe (Ayuda Cáncer alemán).
Materiales
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
Referencias
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados