Method Article
אימות של Nanobody ונוגדנים מבוסס
* These authors contributed equally
In This Article
Summary
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
Abstract
This protocol outlines the steps required to perform ex vivo validation of in vivo near-infrared fluorescence (NIRF) xenograft imaging experiments in mice using fluorophore labelled nanobodies and conventional antibodies.
First we describe how to generate subcutaneous tumors in mice, using antigen-negative cell lines as negative controls and antigen-positive cells as positive controls in the same mice for intraindividual comparison. We outline how to administer intravenously near-infrared fluorophore labelled (AlexaFluor680) antigen-specific nanobodies and conventional antibodies. In vivo imaging was performed with a small-animal NIRF-Imaging system. After the in vivo imaging experiments the mice were sacrificed. We then describe how to prepare the tumors for parallel ex vivo analyses by flow cytometry and fluorescence microscopy to validate in vivo imaging results.
The use of the near-infrared fluorophore labelled nanobodies allows for non-invasive same day imaging in vivo. Our protocols describe the ex vivo quantification of the specific labeling efficiency of tumor cells by flow cytometry and analysis of the distribution of the antibody constructs within the tumors by fluorescence microscopy. Using near-infrared fluorophore labelled probes allows for non-invasive, economical in vivo imaging with the unique ability to exploit the same probe without further secondary labelling for ex vivo validation experiments using flow cytometry and fluorescence microscopy.
Introduction
בדו"ח הנוכחי, אנו מתארים את היישום של בדיקות fluorophore קרוב אינפרא אדום שכותרתו עבור אימות של in vivo ניסויי ההדמיה xenograft באמצעות זרימת vivo לשעבר cytometry ומיקרוסקופ פלואורסצנטי של גידולי xenograft גזורים. אנו משווים nanobody יחיד תחום (ים + 16 א, 17 KDA) 1 ונוגדנים חד שבטיים (Nika102, 150 KDA) 2,3 מופנים לאותו אנטיגן ספציפי ליעד in vivo קרוב אינפרא אדום דימות פלואורסצנטי במודל xenograft לימפומה. ARTC2.2 ADP-ribosyltransferase אנטיגן היעד מתבטא כecto-אנזים פני התא מעוגן-GPI על ידי תאים לימפומה 4-9.
Nanobodies נגזר מגמליים כבד שרשרת רק נוגדנים הם שברים מחייב אנטיגן הכי הקטנים 10,11. עם רק ~ 15 kDa, ברי נוגדן הקטנים אלה מסיסים, יציבים מאוד והם מופרשים באמצעות כליה פינו מהמחזור 8,10. Tמאפייני hese לגרום להם מתאימים במיוחד למיקוד ספציפי ויעיל של אנטיגנים סרטניים in vivo 12-20. מטרות משותפות של אנטיגן nanobodies זמין הן הקולטן לגורם הגדילה באפידרמיס (EGFR1 או-1 שלה), גורם אנושי סוג צמיחת אפידרמיס 2 (HER-2 או CD340), אנטיגן carcinoembryonic (CEA) והידבקות תא כלי דם מולקולה-1 (VCAM-1 ) 21. conjugates Nanobody הם כלים מבטיחים לטיפול חיסוני סרטן וטיפול במחלות דלקתיות 22.
מחקרים שנעשה לאחרונה הראו כי nanobodies לאפשר גבוה -ratios גידול לרקע (T / B) מאשר נוגדנים קונבנציונליים ביישומי הדמיה מולקולריים in vivo 8,17,19. זה מוסבר בעיקר על ידי החדירה לרקמות עניה ואיטית יחסית של נוגדנים קונבנציונליים, פינוי איטי ממחזור, ושימור ארוך ברקמות ממוקדות שאינם 23. יתר על כן, עודף של נוגדנים קונבנציונליים מוביל להצטברות אני לא ספציפיגידולי אנטיגן-שלילי יעד n שנגרמו על ידי החדירות המשופרות והשימור (EPR) ישפיעו 24,25. משמעות הדבר היא כי מינונים גבוהים יותר של נוגדנים קונבנציונליים עשויים להגדיל לא רק אותות ספציפיים אלא גם אותות ספציפיים, ובכך להקטין את יחס גידול לרקע המרבי השגה. בניגוד לכך, הגדלת המינון של nanobodies מגבירה את האותות של גידולי אנטיגן חיובי, אך לא של רקמה נורמלית או גידולי אנטיגן-שלילי (נתונים שלא פורסמו).
מעבר להשוואה של nanobodies ונוגדנים קונבנציונליים, אנו מתארים הערכת intraindividual של xenografts אנטיגן החיובי ו-שלילי באותו העכברים להשוואה ישירה של אותות ספציפיים ולא ספציפיים בשל השפעת EPR. הבדיקות מצומדות fluorophore קרוב אינפרא אדום אפשרו לנו לנצל את בדיקה יחידה in vivo לשעבר vivo באמצעות הדמיה הקרינה האינפרה-אדום קרוב, cytometry זרימה, ומיקרוסקופ פלואורסצנטי. יישום הפרוטוקולים שלנו מאפשר לאיאופטימיזציה רדיואקטיביים, רגישה מאוד, ולא יקרה של in vivo ניסויי הדמיה מולקולריים כגון הערכה של מבני נוגדן חדשים לגידול ספציפי מיקוד.
מטרת מחקר הדרכה זו היא כדי להדגיש את השימוש בNIRF הדמיה להערכת מבני נוגדן חדשים בהדמיה מולקולרית פרה-קלינית.
בפרוטוקול זה, כל הניסויים בוצעו עם מערכת NIRF-הדמיה קטן של בעלי חיים, סדרן תא הקרינה הופעלה (FACS) לזרום cytometer, ומיקרוסקופ confocal.
Protocol
הערה: ניסויים בוצעו בהתאם להנחיות בינלאומיות על השימוש האתי בבעלי חיים ואושרו על ידי הוועדה המקומית לרווחת בעלי החיים של המרכז הרפואי של האוניברסיטה, המבורג.
1. הכנה של תאים סרטניים, עכברים, ובונה הנוגדן
- הכנת התאים לימפומה וaliquoting של מטריקס מרתף (Matrigel).
- היום לפני ההזרקה של תאים סרטניים לשים תיבה מעוקרת קצה (1,000 טיפים μl) ופיפטה המתאימה במקפיא C -20 °.
- להפשיר את הבקבוק עם מטריצת המרתף על קרח במקרר O 4 ° C / N.
- ביום ההזרקה למלא דלי קרח ומניח את מטריצת המרתף יחד עם פיפטה, טיפים, ו1 מיליליטר מזרקים עם 30 מחטי G על קרח.
- תאים לימפומה Aliquot בהיקף של של מדיום RPMI בצינורות 1.5 מיליליטר microcentrifuge 100 μl ומערבבים בזהירות עם של מטריצת המרתף 100 μl. צייר את למראש מקורר-מזרקים ולשים על קרח עד הזרקה.
הערה: השתמש בטכניקה סטרילית טובה ולעבוד על קרח כל הזמן כדי למנוע סתימה של מטריצת המרתף.
- עכברי הכנה
- השתמש 8-10 עכברים בשבוע ישן athymic בעירום (NMRI- Foxn1 n u).
- כדי להפחית autofluorescence של המעי לשמור על עכברי דיאטה נטולת אספסת לשבוע 1 לפני ההדמיה in vivo.
- להזרקה של תאים לימפומה להרדים עכברים לבצע עם 2% isoflurane בתא אינדוקציה. לשמור isoflurane 1-2% עבור משך ההליך באמצעות סעפת isofluorane.
- להזריק תאים לימפומה מתחת לעור לתוך חביות הכתף. לשם השוואה פנים-אישית ישירה להזריק תאי אנטיגן חיובי ושלילי אנטיגן בצד ימין ושמאל, בהתאמה.
- השתמש באגודל ואצבע מורה לצבוט את העור של העכבר ולמשוך אותו מהגוף של העכבר. הזרק לאט ובאופן שווה להנרתיק נוצר על ידי האצבעות, יצירת קבוצה אחת של תאים שמתחת לעור. מטריצת המרתף עוזרת לשמור על תאים מוזרקים במקום.
- הכנת בונת הנוגדן
- לייבל נוגדנים חד-שבטיים וnanobodies תחום אחד עם ערכת תיוג חלבון זמינה מסחרית לצבע ניאון AlexaFluor-680 (AF680) (אורך הגל = 679 nm העירור, גל = 702 nm הפליטה) על פי הוראות היצרן. לחשב את מספר הצבעים לnanobody ונוגדן קונבנציונלי באמצעות מקדמי הכחדה טוחנות של 15720 mol -1 -1 סנטימטר ו203.000 mol -1 סנטימטר -1, בהתאמה. להעריך את טוהר של מבני נוגדנים על ידי חלוקה גודל SDS-PAGE וכתם כחול מבריק Coomassie.
- להבטיח את הספציפיות של conjugates שכותרתו על ידי ביצוע סדרה של ניסויים במבחנה לפני בדיקות ההדמיה בפועל. בחן את הספציפיות של הכותרתtibody בונה במבחנה באמצעות מחקרי חסימה ואלוטיפ נוקב שולט 8,20.
הערה: בשלב 1.2.4 מספרים סלולריים לתאי אנטיגן-שלילי ואנטיגן החיובי (או קווי תאים שונים) עשויות להיות מותאמת על פי שיעורי צמיחה שונים. בניסויים אלה, תאים חיוביים 0.5x10 6 DC27.10 ARTC2 השלילי ו1.5x10 ARTC2 6 DC27.10 שמשו להשיג גידולים בגודל דומה. בשלב 1.3.1 התהליך של יעילות תיוג וסימון של בדיקות נוגדן עם fluorophores יכול להיות שונה בערכת התיוג השתמשה.
2. בVivo Imaging
- לאחר 7-9 ימים, כאשר גידולים להגיע ~ 8 מ"מ קוטר, להזריק 50 מיקרוגרם של AlexaFluor680 שכותרתו בונה נוגדן בהיקף של 200 מלוח μl לוריד לוריד הזנב של העכבר (מב-AF680: 50 מיקרוגרם עם 2 צבעים / מולקולה ≈ ~ 4 ^ 14 fluorochromes ≈ ~ 0.8 מיקרוגרם fluorochromes; Nanobody-AF680: 50 μg עם 0.3 צבעים / מולקולה ≈ ~ 5.6 ^ 14 fluorochromes ≈ ~ 1.1 מיקרוגרם fluorochromes).
- לאתחל את מערכת ההדמיה ולהרדים עכברים לבצע עם 3% isoflurane באמצעות מערכת הרדמה XGI-8 בחדר האינדוקציה לפני ההדמיה. לשמור isoflurane 1-2% עבור משך הליך ההדמיה באמצעות סעפת isoflurane שוכנו בחדר ההדמיה.
- עכברי עמדה על במה הדמיה מחוממת עם גידולים מופנים לכיוון המצלמה. צג הרדמה הראויה על ידי צובט את הבוהן או זנב של החיה; כל תגובה של בעלי החיים מצביעה על כך שההרדמה היא קלה מדי.
- לפקח על קצב הנשימה; ההרדמה היא קלה מדי אם קצב הנשימה מוגבר ועמוקה מדי אם קצב הנשימה יורד, עמוקה או לא סדירה. להגן על הקרניות של החיה עם משחה העין כדי למנוע יובש ואילו בהרדמה.
- בחר מערכות סינון ניאון של 615-665 nm לעירור, 695-770 ננומטר עבור emission, ועירור nm 580-610 לחיסור רקע עם גודל מטריצת פיקסל 51 2x 512. הגדרת זמן חשיפה לאוטומטית, binning פיקסל עד בינוני וF / תפסיק עד 2.
הערה: זמני חשיפה קצרים יותר לאפשר מסגרת חליפין מהר יותר; זמני חשיפה ארוכים יותר מספקים רגישות רבה יותר. Binning שולטת בגודל פיקסל במצלמה CCD. הגדלת binning מגדילה את גודל פיקסל, רגישות, וקצב פריימים, אך מפחית את הרזולוציה מרחבית. F / Stop מגדיר את גודל צמצם עדשת מצלמה. גודל הצמצם שולט בכמות האור זוהה ועומק של field.Note שהגדרות יכולות להיות שונות על ידי ההדמיה מכשיר ולהגדיר ניסיוניים. עיין במדריך של היצרן לקבלת תוצאות אופטימליות.- בזמן החשיפה לייעל תוכנת הדמיה, F / תחנה וbinning פיקסל מבוססים על רמת הביטוי של הקו הסלולרי. לשנות הגדרות אלה בכל עת במהלך ניסוי מבלי להשפיע על התוצאה כמותית. לחלופין, לתת לתוכנת ההדמיה האשף לקבוע באופן אוטומטיהפרמטרים.
- עכברי תמונה לפני ההזרקה ו -6 שעות לאחר ההזרקה של מבני נוגדן.
הערה: יעילות התיוג עשויה להשפיע על המינון הנדרש דרוש לתוצאות הדמיה אופטימליות. לכן כמות נוגדנים-מבנה הנדרש לקבלת תוצאות הדמיה אופטימליות יש לקבוע באופן אמפירי. זה עשוי להשתנות בהתאם ליעילות תיוג וגודל של המבנה, כמו גם את מודל הגידול וביטוי יעד אנטיגן.
3. קציר והכנת הגידולים
- מלא דלי קרח ומניח את 4%, מלוח paraformaldehyde (PFA) פוספט (PBS) / מעכב פרוטאז (AEBSF) ו / 0.2% אלבומין PBS בסרום שור (BSA) על קרח.
- לאחר פגישת ההדמיה נגמרה, להגדיל את הריכוז של isoflurane עד 4%. אחרי בעלי החיים מפסיק לנשום, להסיר אותו מהבמה ולבצע ההדמיה נקע בצוואר הרחם.
- עכבר הר על גוש קלקר ולרסס עם אתנול 70%.
- מספריים שימושים ומלקחיים כדי לחתוך את העור החיצוני ולמשוך בחזרה את זה בזהירות כדי לחשוף גידולים. הסרת גידולים עם אזמל כדי להבטיח רקמת גידול נותרה בשלמותה.
- גידולים בחצי באמצעות אזמל. מניחים מחצית בצינור איסוף עם PBS / AEBSF לFACS ניתוח ואת החצי השני בצינור 50 מיליליטר עם 4% PFA אימונוהיסטוכימיה.
- הכנה לאימונוהיסטוכימיה
- שמור גידולי PFA 4% במקרר ב 4 מעלות צלזיוס במשך 24 שעות. העבר את הגידולים לצינור עם סוכרוז / 30% PBS ולשמור במקרר ב 4 מעלות צלזיוס עד כיורים גידול לחלק התחתון של הצינור.
- חותך את הגידולים בחתיכות מתאימות לcryomolds. שים את הגידולים בcryomolds ולמלא עם מתחם אוקטובר, כך שהגידולים מכוסים.
- שים תבניות על קרח יבש ולהמתין עד למתחם הוא קפוא לחלוטין. העבר את הגידולים קפואים ל-80 ° C במקפיא ולאחסן אימונוהיסטוכימיה.
- Cut קפוא גידולים בסעיפים של 8 מיקרומטר עם microtome. השתמש immunohisto הסטנדרטיפרוטוקול כימיה להכתים עם נוגדן נגד CD31-AF488 לדמיין כלי דם וdiamidino-phenylindole (DAPI) כדי להמחיש גרעינים.
הערה: סעיפי גידול רגישים מאוד לאור כפי שהם כבר מכילים נוגדנים שכותרתו fluorescently. למזער את החשיפה לאור ככל האפשר.
- הכנה לניתוח FACS
- מניחים צלחת פטרי על קרח ולהסיר את הבוכנה של מזרק 2.0 מיליליטר. שים את הגידול במסננת התא ולחתוך אותו בעדינות לתוך 3-4 חתיכות באמצעות אזמל. יוצקים את PBS הראשוני בצלחת פטרי ולהשתמש בקצו השטוח של הבוכנה לכתוש את הגידול בתוך מסננת התא.
- לשטוף את מסננת התא עם PBS הראשוני כדי לשטוף את כל התאים עם טפטפת 10 מיליליטר. העבר את ההשעיה תא בצינור וספין חדש ב XG 500 במשך 5 דקות. בטל supernatant ו resuspend התאים ב 10 מיליליטר PBS / BSA 0.2%. ספירת תאים.
- 1-5 x 10 6 תאים לימפומה Aliquot בצינור FACS 5 מיליליטר. תאים שוב ספין (500XG), להשליך supernatant וגלול ב100 μl BSA / 0.2% PBS.
- לחלופין, בלוק FCR באמצעות אנטי-CD16 / CD32-מב (FcgR3 / 2) שנקשר לFcγR על קרח למשך 10 דקות. שטוף תאים פעם עם PBS / 0.2 BSA%.
- להוסיף אנטי CD45-מב להפלות leucocytes מהתאים אחרים. דגירה של 20 דקות על קרח בחושך, ואחריו שני שוטף עם BSA / 0.2% PBS.
- ממש לפני כתם ניתוח FACS עם יודיד propidium במשך 15 דקות על קרח כדי להבחין תאים מתים, ואחריו שני שוטף עם PBS רגיל. Resuspend ב -150 μl לניתוח FACS.
הערה: בשלב 3.7.4 וצעד 3.7.5 נוגדנים אחרים, ניתן להשתמש בהתאם לישות סרטנית.
ניתוח 4. FACS
- השתמש בסדרה של כלים gating לשער האוכלוסייה של עניין בצורה של פיזור גדול, אפליית כפיל, הרחקה של תאים מתים, gating לתאים חיוביים CD45, וgating לתאי אנטיגן חיובי.
- בהתחלה, תא שער החוצהפסולת בפיזור קדימה (FSC-A) לעומת פיזור הצד (SSC-A) באמצעות עלילת שני פרמטרים. כפילויות תא נזרק הבא. לבסוף, שער החוצה ללא CD45 אנטיגן-חיובי (CD45) ומת למות תאים (LD - מת-כתם / חי) /.
- דגימות שיא תוך שימוש באותה התבנית לכל הניסויים.
הערה: עיין בפרוטוקול של היצרן לקבלת ייעוץ טכני בנוגע לשימוש בחומרה ותוכנה אנליטית.
5. ניתוח מיקרוסקופי
- לנתח cryosections גידול צבעוני באמצעות מיקרוסקופ confocal עם עדשת טבילת שמן (אובייקטיבי 40X). השתמש עירור הוא ניאון 633 nm לייזר של AF680, לייזר ארגון לAF488, ו- 405 Diode לDAPI.
- לעבד את נתוני תמונת גלם באמצעות תוכנה תואמת עם מיקרוסקופ. בצע רקע תיקון ורעש סינון במידת צורך. לבצע התאמות תמונה נוספות, כגון חתך, חיתוך, וכן התאמות בהירות והניגודיות.
- לבסוף generate תמונת שכבת מרוכבים יחידה מכל ערוצי הגילוי. התאם את הבהירות והניגודיות של השכבות בודדות. התמונות המשולבות תציג לוקליזציה של תאים (DAPI-כתם, כחול), הפצה של מבנים שכותרתו נוגדן (AF680-כתם, אדום) וכלי דם (AF488-כתם, ירוק).
6. בניתוח Vivo Imaging
- קבצי תמונה פתוחים בתוכנת הדמיה וליצור תמונת שכבה על ידי שילוב של נתוני תמונת תמונה עם נתוני תמונת הקרינה. לייעל תצוגת תמונה על ידי הסרת אות רקע autofluorescence רקמות מאות הניאון הספציפית. ניתן לעשות זאת על ידי הפחתת התמונה שנרכשה עם מסנן רקע להגדיר מהתמונה שנרכשה עם המסנן המוגדר ספציפיים לנותב.
- לצייר אזורי מדידה מעגליים זהים של עניין (ROI) סביב גידול אנטיגן חיובי והגידול אנטיגן-שלילי. כדי לקבוע עוצמת אות רקע, למקם את ההחזר על ההשקעה חוזרבשטח של בעלי החיים שבו אות הקרינה צפויה להיות נמוך (למשל, אחורי רגל).
- השתמש באותו ROIs לכל בעלי החיים בכל נקודות הזמן. למיצוב, להשתמש בתמונות בשחורות-לבנה הצילום לזהות שוליים גידול.
- נתוני ROI התצוגה בטבלת מדידה. השתמש בנתונים ממוצע קורנים יעילות, המאפשר השוואת כמותית נוספת של אותות ניאון עבור ניתוחים סטטיסטיים נוספים.
- תצוגה ולהשוות את הנתונים כעוצמות אות מוחלטות או לחשב את יחס אות לרקע באמצעות נתוני ROI נמדדו מרקמת מטרה ורקמת רקע. לחשב את יחס גידול לרקע על ידי חלוקת שווי ספיגת גידול על ידי ערך הרקע נקבע מהגפיים האחוריות.
- כפקדים, גם לנתח גידולי אנטיגן-שליליים ואנטיגן החיובי באותן חיות כמו גם בעלי חיים שהוזרקו עם פקדי isotype שכותרתו להעריך את הספציפיות של אותות in vivo.
תוצאות
בדיקות שכותרתו fluorescently מאפשרות שילוב של טכניקות שונות NIRF-הדמיה (איור 1 א). אנחנו מכוונים לביצוע in vivo NIRF-הדמיה, cytometry זרימה, ורצף מיקרוסקופ פלואורסצנטי כדי להשוות nanobodies שכותרתו fluorescently ונוגדנים חד שבטיים לספציפי בתחום ההדמיה vivo (איור 1).
עכברים הוזרקו 50 מיקרוגרם של nanobody ונוגדן חד שבטי כדי להעריך את הספציפיות של המבנים שכותרתו fluorescently הדמיה in vivo. התוצאות הראו תיוג ספציפי של גידולי אנטיגן חיובי עם שני nanobody ונוגדן חד-שבט בשעה 6 שעות לאחר ההזרקה (איור 2). ROI ניתוחים של גידולי אנטיגן החיובי הראה / B יחס גבוה בהרבה של T ~ 12 לnanobody לעומת ~ 6 לנוגדנים חד שבטיים. יתר על כן, nanobody לא הראה אות ספציפיות בגידולי אנטיגן-שלילי, ואילונוגדן חד-שבט הראה אותות בלבול ספציפיים בגידולי אנטיגן-שלילי.
מלבד האות ספציפי של הגידולים השליליים, הנוגדן חד שבטי גם מושרה אותות רקע ספציפיים בכל בעלי החיים. זה כנראה עקב נוגדנים במחזור חופשי מוגזמים, שהם גדולים מדי כדי להיות מופרשים מופרשים באמצעות כליה. Contrariwise, בעלי חיים שהוזרקו עם nanobodies הראו אותות ספציפיים רק בכליות בשל חיסול הכליות של nanobodies הקטן.
Cytometry זרימת ניתוח של מתלי תאים סרטניים הראתה תיוג ספציפי של תאים סרטניים אנטיגן החיובי עם שני AF680-conjugates 6 שעות לאחר הזרקה. אות הקרינה חזקה של תאי nanobody שכותרתו בהשוואה לתאי נוגדן חד שבטיים שכותרת משקפת את תוצאות NIRF ההדמיה in vivo. חשוב לציין, ניתוחי התזרים cytometric מגלים כי אין תיוג ספציפי של תאי אנטיגן-שלילי עם אחד משנימבנים (איור 3).
מיקרוסקופ פלואורסצנטי של cryosections הגידול הראה תיוג חזק וכמעט אחיד של תאי אנטיגן חיובי עם nanobody שעה 6 לאחר הזרקה. Contrariwise, הנוגדן חד שבטי הראה כתמים חלשים מדי ולא הומוגניות (איור 4 א). גידולי Antigen שלילי לא מראים מכתים שעה 6 לאחר ההזרקה של nanobody, ואילו גידולי אנטיגן-שלילי מוזרקים עם הצביעה הקונבנציונלית תכנית הנוגדן ספציפי הפזורות במרחב הבין (איור 4).
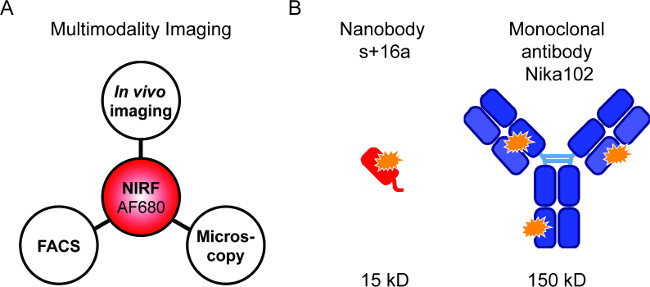
איור 1: הדמיה Flourescence ובונת נוגדן. (א) התקנת הדמיה להערכת AF680-conjugates: בvivo NIRF הדמיה ואחריו cytometry זרימה ומיקרוסקופ פלואורסצנטי. (B ) סכמטי של AlexaFluor680 כותרת 16a של nanobody + (אדום) ונוגדנים חד שבטיים Nika102 (כחול). כוכבים כתומים מעידים על fluorochromes AlexaFluor680.
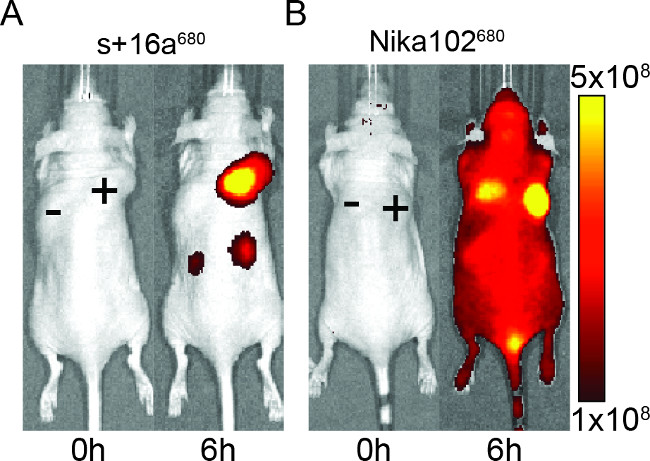
איור 2: בvivo NIRF הדמיה תמונות של אות הקרינה של אנטיגן-חיובי (+) ואנטיגן-שלילי (-) גידולים בעכברים שהוזרקו עם 16a של nanobody + () ונוגדנים חד שבטיים Nika102 (B). . ההדמיה בvivo בוצעה לפני (0 h) ו -6 שעות לאחר הזרקה. עוצמות אות מוצגות כיעילות קורנת (p / sec / 2 סנטימטר / SR) / (μW / 2 סנטימטר).
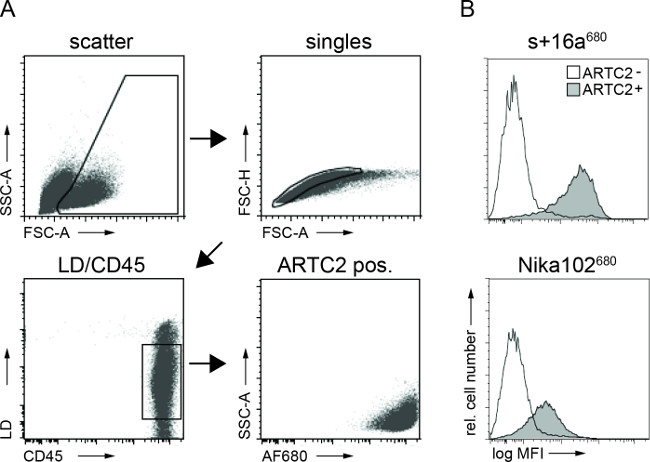
איור 3:Vivo לשעבר FACS ניתוחים של מבני נוגדן תא מחויב מהשעיות תאים סרטניים. () אסטרטגית gating לFACS מנתח של תאים סרטניים. (ב) Histograms להציג את הסכום של 16 א + ונוגדן Nika102 של nanobody AF680 מצומדות- המוזרק לוריד במיוחד קשור לתאים הסרטניים בגוף חי. גידולי Antigen שלילי מוצגים כהיסטוגרמות ללא מילוי וגידולי אנטיגן החיובי מוצגים כהיסטוגרמות מלאה.
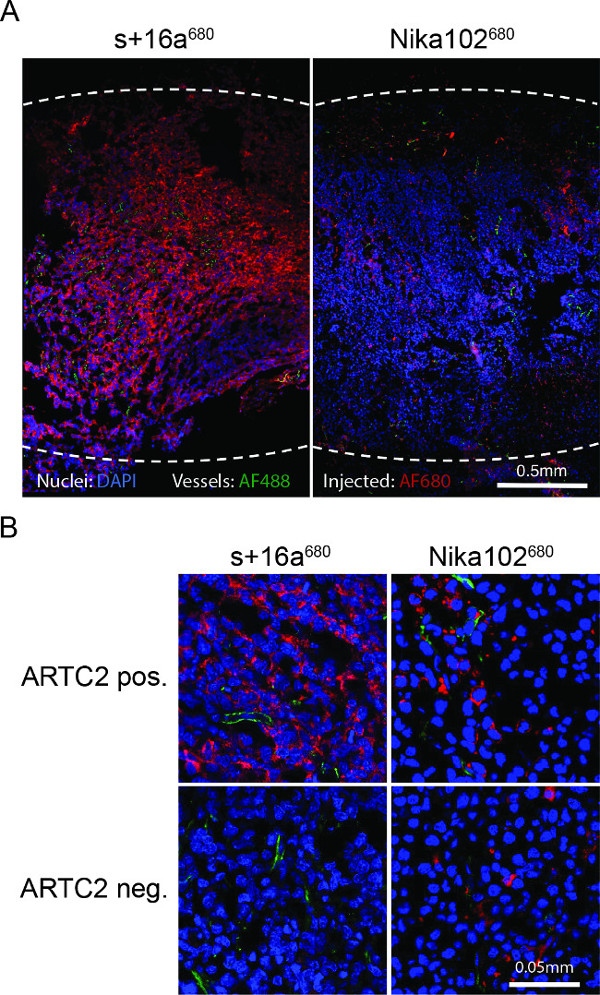
מיקרוסקופ מיקרוסקופ פלואורסצנטי Ex vivo (א) סקירת הקרינה של cryosections גידול אנטיגן חיובי כל 6 שעות לאחר ההזרקה של s + 16 א או 680 Nika102 680: איור 4.. עוצמות אות של in vivo לוריד בהדחוי AF680-conjugates ללא כל סוכנים משניים תיוג מוצגים באדום. Ex vivo גרעיני counterstained מוצגים בכחול וכלי בירוק. קווים מקווקווים מצביעים על שוליים חיצוניים של כל הגידולים. מיקרוסקופ פלואורסצנטי תקריב של גידולי אנטיגן חיובי ושלילי אנטיגן (B).
Discussion
אנחנו השתמשנו nanobodies האינפרה-אדום הקרוב fluorophore שכותרתו ונוגדנים חד-שבטיים קונבנציונליים מכוונות נגד אותו היעד על תאי הלימפומה להשוואת multimodal של in vivo לשעבר vivo ניתוחים. הראינו כי nanobodies מתאים גם כלי אבחון לגילוי מהיר וספציפי in vivo של לימפומות.
In vivo, S + 16 א 680 אפשרו זיהוי מהיר ומדויק יותר של xenografts ARTC2-חיובי. מלבד קינטיקה השונות להדמיה גידול הטובה ביותר in vivo, החסרון העיקרי של Nika102 680 הייתה האות ספציפי הגבוהה מגידולי ARTC2-שלילי ואותות רקע ספציפיים.
Vivo לשעבר זרימת cytometric ניתוחים של תאים מפוזרים מגידולים גזורים לא הראו ספציפיים מחייב לתאים לימפומה ARTC2-השלילי של AF680-conjugates המוזרק. Ex vivo הקרינה חשף חזק וכמעט homogenצביעת יחידות ארגונית של תאי גידול בסעיפי ART2C חיובי במקרה של 16a של nanobody +, המאשר כי nanobody היה מסוגל להגיע לאזורים מרוחקים אפילו בתוך הגידול לאחר 6 שעות. בניגוד לכך, הנוגדן חד שבטי הראה כתמים חלשים והומוגניות של תאים בגידולי ARTC2 החיובי לאחר 6 שעות. תוצאות הדמיה טובות יותר עם הנוגדן הקונבנציונלי יכולות להיות מושגת לאחר 24 שעות או 48 שעות (מידע לא מוצג). על מנת לבצע השוואה מעמיקה של שני מבנים בגודל שונה, הדמיה בנקודות זמן שונה (סידורי הדמיה) יש לבצע על מנת לזהות את נקודת זמן הדמיה האופטימלית עבור כל מבנה.
כמו מחקרים קודמים אחרים, על התוצאות המדווחות כאן להדגיש כי in vivo הדמיה מולקולרית עם nanobodies שכותרתו מאפשרת הדמיה גידול באותו יום מהירה וספציפית עם יחס גבוה של גידול לרקע 12-15,17-19. Contrariwise, נוגדנים קונבנציונליים לגרום ליחסים נמוכים גידול לרקע ואותות ספציפיים מאנטיגידולי gen-שליליים הראשונה לאחר הזרקה עקב הפינוי האיטי שלהם מהגוף. על מנת לקבל תוצאות אופטימליות הדמיה עם נוגדנים קונבנציונליים, זמן הדמיה מציין 24 שעות או אפילו 48 שעות לאחר ההזרקה יש צורך בדרך כלל. ממצאים אלה עולים בקנה אחד עם מחקרים קודמים שהראו כי נוגדנים קונבנציונליים עם תועלת טיפולית מוכחת בעלת תועלת מוגבלות בהדמיה מולקולרית 17,19,26. לכן נוגדנים קונבנציונליים עשויים להיות לא מתאימים למטרות טיפוליות בשל הפלזמה מחצית החיים הארוכים שלהם בזמן nanobodies למדי מתאים למטרות הדמיה בשל הפינוי המהיר שלהם מהמחזור. הבדלים אלה נובעים מכך שכל עודף של nanobodies הקטן יותר (15-17 KDA) מנוקה במהירות באמצעות חיסול כליות בעוד עודף של נוגדנים גדולים יותר קונבנציונליים (150 KDA) נשמרים במחזור הדם. אז היתרון העיקרי של nanobodies להדמיה מולקולרית היא אות הרקע הנמוכה בנקודות זמן מוקדמות הדמיה regardlESS מהחומר המוזרק. זה מאפשר הדמיה אותו יום ויכול להיות לתרגום להגדרה. Contrariwise הקליני, נוגדנים קונבנציונליים צריכים להיות טיטרציה בדיוק כדי למזער אותות רקע ספציפיים, תוך שמירה על אות מסוימת מספיק מרקמת המטרה (נתונים שלא פורסמו).
אחת המגבלות של טכניקת NIRF ההדמיה in vivo הוא עומק החדירה הנמוך אשר בדרך כלל מאפשר הדמיה של תת-עורי רק, אבל לא של מודלים גידול orthotopic. עם זאת, מגבלה זו עשויה להיות להתגבר בהגדרה ניסיונית על ידי טכניקות צילום אקוסטית טומוגרפית שפותחו לאחרונה, המאפשרות הדמיה של הגוף כולו של חיים עכברים 27. מגבלה נוספת של טכניקת NIRF ההדמיה היא ההערכה של מינון הרקמה בהשוואה להדמיה בתיווך רדיונוקלידים. עם זאת, nanobodies ניתן radiolabelled לטומוגרפיה פליטת פוזיטרונים הדמיה (PET) של מודלים xenograft והערכה כמותית מדויקת שלbiodistribution נותב. ואכן, תוצאות NIRF ההדמיה שלנו הן בהתאם למחקר שנערך לאחרונה כי בהשוואה nanobodies ונוגדנים קונבנציונליים הדמיה PET. המחברים גם הגיעו למסקנה שnanobodies לאפשר הדמיה באותו יום עם יחס גבוה של גידול לרקע 15.
עם זאת, רק התיוג של מבני נוגדן עם AF680 צבע פלואורסצנטי קרוב אינפרא אדום אפשר לנו מקיף במבחנה, in vivo והשוואה הדמיה הקרינה האינפרה-אדום קרוב vivo לשעבר באמצעות cytometry זרימה, מיקרוסקופ פלואורסצנטי, וNIRF הדמיה. מסיבה זו, ובגלל זה הוא nonradioactive, רגיש מאוד, זול, ומשתמש קל ללייצר יחסית בדיקות ממוקדות, אנו ממליצים על השימוש בטכניקת NIRF ההדמיה להערכת מבני נוגדן חדשים בהדמיה מולקולרית פרה-קלינית.
Disclosures
Friedrich Koch-Nolte and Friedrich Haag receive a share of antibody and protein sales via MediGate GmbH, a wholly owned subsidiary of the University Medical Center Hamburg-Eppendorf.
Acknowledgements
עבודה זו נתמכה על ידי בוגר בית הספר 'דלקת והתחדשות "המרכז לחקר שיתופי 841 של Forschungsgemeinschaft דויטשה (אלכסנדר לנץ, ולנטין Kunick, ויליאם Fumey), על ידי מרכז המחקר המשותף של 877 Forschungsgemeinschaft דויטשה (פרידריך קוך-נולטה) , על ידי הקרן ורנר אוטו (פיטר Bannas), על ידי וילהלם סנדר הקרן (פיטר Bannas, פרידריך קוך-נולטה), ועל ידי Deutsche Forschungsgemeinschaft (מרטין Trepel, פרידריך Haag ופרידריך קוך-נולטה). אנו מודים לאוניברסיטת מרכז הסרטן המבורג (UCCH) במתקן Vivo האופטי ההדמיה Core וצוות בUKE להתייעצות והשירות באיכות הגבוהה שלהם. מתקן Core נתמך בחלקו על ידי מענקים מדויטשה Krebshilfe (גרמני למלחמה בסרטן סיוע).
Materials
| Name | Company | Catalog Number | Comments |
| AF680 protein labelling kit | Invitrogen | A20172 | |
| Anti-CD16/CD32-antibody | BioXCell | BE0008 | |
| Anti-CD31-antibody | Santa Cruz | sc-1506 | labeled with secondary antibody with AF488 |
| Anti-CD45-antibody V450 | BD Biosciences | 560501 | |
| AxioVision LE software | Zeiss | www.zeiss.com | |
| Basement membrane matrix | BD Biosciences | 354234 | Alternative product can be used |
| Cell strainer 70 µm | Corning | 431751 | Alternative product can be used |
| Confocal microscope | Leica | www.leica-microsystems.com | Leica SP5 with the following lasers: He-Neon for AF680, Argon Laser for AF488, and a 405-Diode for DAPI |
| DAPI | Molcular Probes | D1306 | |
| DC27.10 cells | laboratory specific | Other cells with different surface targets can be used | |
| DPBS | Sigma Aldrich | D8662 | |
| FACS Canto II | BD Biosciences | www.bdbiosciences.com | |
| Flourescence mircoscope | Zeiss | www.zeiss.com | Zeiss Axiovert 200 with Filter Set #32 for AF680: 000000-1031-354 |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| IVIS 200 | Perkin Elmer | www.perkinelmer.com | Alternative in vivo imaging system can be used |
| Leica LAS software | Leica | www.leica-microsystems.com | Software specific to microscope used |
| Living Image software | Perkin Elmer | www.perkinelmer.com | Software specific to imaging system used |
| Needles 30 G | BD Biosciences | 305128 | Alternative product can be used |
| Nika102-antibody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Paraformaldehyde | Sigma Aldrich | P6148 | Potential hazards: carcinogenic, can irritate the eyes and skin, contact may cause drying of the skin and/or allergic dermatitis |
| s+16a-nanobody AF680 | laboratory specific | Other antibodies against different surface targets can be used | |
| Syringes 1 ml | Braun | 916 1406 V | Alternative product can be used |
References
- Koch-Nolte, F., et al. Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21, 3490-3498 (2007).
- Koch-Nolte, F., et al. A new monoclonal antibody detects a developmentally regulated mouse ecto-ADP-ribosyltransferase on T cells: subset distribution, inbred strain variation, and modulation upon T cell activation. J Immunol. 163, 6014-6022 (1999).
- Koch-Nolte, F., et al. Use of genetic immunization to raise antibodies recognizing toxin-related cell surface ADP-ribosyltransferases in native conformation. Cell Immunol. 236, 66-71 (2005).
- Bannas, P., et al. Activity and specificity of toxin-related mouse T cell ecto-ADP-ribosyltransferase ART2.2 depends on its association with lipid rafts. Blood. 105, 3663-3670 (2005).
- Bannas, P., et al. Quantitative magnetic resonance imaging of enzyme activity on the cell surface: in vitro and in vivo monitoring of ADP-ribosyltransferase 2 on T cells. Mol Imaging. 9, 211-222 (2010).
- Bannas, P., et al. Transgenic overexpression of toxin-related ecto-ADP-ribosyltransferase ART2.2 sensitizes T cells but not B cells to NAD-induced cell death. Mol Immunol. 48, 1762-1770 (2011).
- Hottiger, M. O., Hassa, P. O., Luscher, B., Schuler, H., Koch-Nolte, F. Toward a unified nomenclature for mammalian ADP-ribosyltransferases. Trends Biochem Sci. 35, 208-219 (2010).
- Bannas, P., et al. In vivo near-infrared fluorescence targeting of T cells: comparison of nanobodies and conventional monoclonal antibodies. Contrast Media Mol Imaging. 9, 135-142 (2014).
- Scheuplein, F., et al. NAD+ and ATP released from injured cells induce P2X7-dependent shedding of CD62L and externalization of phosphatidylserine by murine T cells. J Immunol. 182, 2898-2908 (2009).
- Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448 (1993).
- Wesolowski, J., et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174 (2009).
- Vaneycken, I., et al. Preclinical screening of anti-HER2 nanobodies for molecular imaging of breast cancer. FASEB J. 25, 2433-2446 (2011).
- Xavier, C., et al. Synthesis, preclinical validation, dosimetry, and toxicity of 68Ga-NOTA-anti-HER2 Nanobodies for iPET imaging of HER2 receptor expression in cancer. J Nucl Med. 54, 776-784 (2013).
- Tchouate Gainkam, L. O., et al. Correlation Between Epidermal Growth Factor Receptor-Specific Nanobody Uptake and Tumor Burden: A Tool for Noninvasive Monitoring of Tumor Response to Therapy. Mol Imaging Biol. 13 (5), 940-948 (2011).
- Vosjan, M. J., et al. Facile labelling of an anti-epidermal growth factor receptor Nanobody with 68Ga via a novel bifunctional desferal chelate for immuno-PET. Eur J Nucl Med Mol Imaging. 38, 753-763 (2011).
- Oliveira, S., Heukers, R., Sornkom, J., Kok, R. J., van Bergen En Henegouwen, P. M. Targeting tumors with nanobodies for cancer imaging and therapy. Journal Of Controlled Release. 172 (3), 607-617 (2013).
- Kijanka, M., et al. Rapid optical imaging of human breast tumour xenografts using anti-HER2 VHHs site-directly conjugated to IRDye 800CW for image-guided surgery. Eur J Nucl Med Mol Imaging. 40, 1718-1729 (2013).
- Zaman, M. B., et al. Single-domain antibody bioconjugated near-IR quantum dots for targeted cellular imaging of pancreatic cancer. J Nanosci Nanotechnol. 11, 3757-3763 (2011).
- Oliveira, S., et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody. Mol Imaging. 11, 33-46 (2012).
- Gainkam, L. O., et al. Comparison of the biodistribution and tumor targeting of two 99mTc-labeled anti-EGFR nanobodies in mice, using pinhole SPECT/micro-CT. J Nucl Med. 49, 788-795 (2008).
- Chakravarty, R., Goel, S., Cai, W. Nanobody: the 'magic bullet' for molecular imaging. Theranostics. 4, 386-398 (2014).
- Siontorou, C. G. Nanobodies as novel agents for disease diagnosis and therapy. International journal of nanomedicine. 8, 4215-4227 (2013).
- Kaur, S., et al. Recent trends in antibody-based oncologic imaging. Cancer Lett. 315, 97-111 (2012).
- Lammers, T., Kiessling, F., Hennink, W. E., Storm, G. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress. Journal Of Controlled Release. 161, 175-187 (2012).
- Jain, R. K., Stylianopoulos, T. Delivering nanomedicine to solid tumors. Nature reviews. Clinical Oncology. 7, 653-664 (2010).
- Lisy, M. R., et al. In vivo near-infrared fluorescence imaging of carcinoembryonic antigen-expressing tumor cells in mice. Radiology. 247, 779-787 (2008).
- Herzog, E., et al. Optical imaging of cancer heterogeneity with multispectral optoacoustic tomography. Radiology. 263, 461-468 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved